Aktin birleşimini indükleyen protein - Actin assembly-inducing protein - Wikipedia
| Aktin birleşimini indükleyen protein | |||||||
|---|---|---|---|---|---|---|---|
 EVH1 alan-ActA peptid kompleksi | |||||||
| Tanımlayıcılar | |||||||
| Sembol | ActA | ||||||
| NCBI geni | 2798121 | ||||||
| UniProt | P33379 | ||||||
| |||||||
Aktin birleşimini indükleyen protein (ActA) bir protein tarafından kodlandı ve kullanıldı Listeria monocytogenes kendini bir memeli konak hücresi boyunca ilerletmek için. ActA, membranı kapsayan bir bölge içeren bir bakteriyel yüzey proteinidir.[1] Bir memeli hücresinde bakteriyel ActA, Arp2 / 3 kompleksi ve aktin monomerler bakteri yüzeyinde aktin polimerizasyonunu indükleyerek bir aktin kuyruklu yıldız kuyruğu oluşturur. ActA'yı kodlayan gen adlandırılır actA veya prtB.[2]
Giriş
En kısa sürede L. monocytogenes bakteriler insanlar tarafından sindirilir, içselleştirilirler bağırsak epitel hücreler ve hızla içselleştirme boşluklarından kaçmaya çalışırlar.[3][4] Sitozolde, ActA proteini yardımıyla yüzeylerinde aktin polimerize etmeye başlarlar. ActA'nın sadece gerekli değil, aynı zamanda diğer bakteriyel faktörlerin yokluğunda bakterilerin hareketliliğini indüklemek için yeterli olduğu da gösterilmiştir.[5]
Keşif
ActA analiz edilerek keşfedildi lesitinaz -negatif Tn917-lac Listeria mutantları, hücreden hücreye yayılamadıkları fenotip nedeniyle. Bu mutant bakteriler, fagozomlardan vahşi tip bakteriler kadar verimli bir şekilde kaçtılar ve enfekte olmuş hücreler içinde çoğaldılar, ancak vahşi tip bakteriler gibi aktin ile çevrili değillerdi. Daha fazla analiz gösterdi ki, Tn917-lac içine eklendi actA, bir operonun ikinci geni. Bu operonun üçüncü geni, plcB, kodlar L. monocytogenes lesitinaz. Olup olmadığını belirlemek için actA kendisi plcB veya diğer birlikte transkripte edilmiş aşağı akış bölgeleri, aktin birleşiminde yer alır, uygun genlerdeki mutasyonlar üretilir. Hariç tüm mutantlar actA mutantlar, F-aktin ve hücre-hücre yayılımı ile ilgili doğal tipe benzerdi. İle tamamlama actA geri yüklenen vahşi tip fenotip actA mutantlar.[1]
Fonksiyon

ActA, bir taklit görevi gören bir proteindir. Wiskott-Aldrich sendromu proteini (WASP), konakçı hücrelerde bulunan bir çekirdeklenme teşvik edici faktör (NPF). Memeli hücresindeki NPF'ler, halihazırda mevcut olanları işe alır ve bağlar. aktin ile ilgili protein 2 ve 3 kompleksi (Arp2 / 3 kompleksi) ve Arp2 / 3 kompleksinin aktive edici bir konformasyonel değişimini indükleyin.[6] Bu konformasyonel değişiklik nedeniyle, NPF'ler, hareketli hücrelerin ön ucunda karakteristik Y-dallı aktin yapılarına yol açan yeni bir aktin filamentinin 70 ° 'lik bir açıyla polimerizasyonunu başlatır. ActA, bakterinin eski kutbuna yerleşir ve hem bakteri hücre zarını hem de hücre duvarını kapsar, yanal difüzyon engellenir; bu nedenle ActA, bakteri yüzeyinde polarize ve bağlantılı bir şekilde lokalize olur. Sonuç olarak aktin polimerizasyonu ancak bakteri yüzeyinde bu bölgede başlar.[7] ActA'nın ekspresyonu, yalnızca bir memeli konakçı hücreye girdikten sonra indüklenir.[8]
Aktin filaman düzeneği, memeli konakçı sitoplazmasındaki bakteriyi ileriye doğru iten kuvveti üretir. Sürekli aktin polimerizasyonu, sitoplazmada hareketlilik için ve hatta bitişik hücrelerin enfeksiyonu için yeterlidir.[9]
Araştırma
Yeni veriler, ActA'nın vakuolar bozulmada da rol oynadığını göstermektedir. ActA'nın bir silme mutantı, vakuolün geçirgen hale getirilmesinde kusurludur. Asidik bölgenin (32-42) N-terminalinin 11 amino asitlik bir uzantısının, bölgenin bozulması için önemli olduğu gösterilmiştir. fagozom.[10]
Yapısı
Ana proteinli ürün actA gen 639 amino asitten oluşur ve sinyal peptidi (ilk N-terminal 29 amino asit) ve ActA zincirini (C-terminal 610 amino asit) içerir. Bu nedenle, olgun ActA proteininin dizisi 610 amino asitten oluşur. ActA'nın moleküler ağırlığı 70,349 Da'dır ve bir yüzey proteinidir.[1][2]
ActA, üç fonksiyonel alana bölünebilen doğal olarak katlanmamış bir proteindir (Şekil 2):[1][11][12]
- Yüksek yüklü N-terminal alanı: 1-234 amino asit kalıntıları
- prolin açısından zengin tekrarlara sahip merkezi alan: amino asit kalıntıları 235-394
- Bir transmembran alanı olan C-terminal alanı: amino asit kalıntıları 395-610
N-terminal alanı
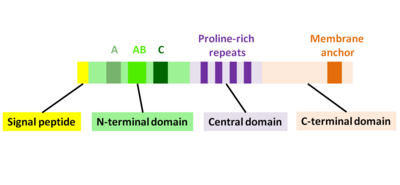
N-terminal alanının ilk 156 amino asidi üç bölgeden oluşur[10][13] (İncir. 2):
- Asidik kalıntılara sahip A bölgesi: 32-45
- AB bölgesi, bir aktin monomer bağlanma bölgesi: 59-102
- C-bölgesi, bir cofilin homoloji dizisi: 145-156
ActA'nın N-terminal kısmı aktin polimerizasyonunda önemli bir rol oynar.[14] Alan, bir aktin monomer bağlama bölgesinin yanı sıra bir Arp2 / 3 bağlama C (merkezi veya kofilin homolojisi) ve A (asidik) bölgesini içeren ökaryotik WASP ailesi NPF'lerinde bulunan konsensüs elemanlarını gösterir.[7] ActA'nın aktin monomer bağlanma bölgesi, WASP-Homology-2 (WH2) veya V alanı gibi fonksiyonel özelliklere sahiptir, ancak dizide farklılık gösterir.[15] Bu nedenle, WASP ailesi NPF'lerinde alanların sırası WH2, ardından C ve ardından A'dır, bu da ActA'da durum böyle değildir.
Merkezi alan
ActA'nın prolin bakımından zengin merkezi bölgesi, verimli bakteriyel hareketliliği sağlamak için çok önemlidir. FPPPP veya FPPIP motiflerini içeren dört prolin açısından zengin tekrar vardır. Bu bölgeler, konak hücre sitoskeletal proteininkileri taklit eder. zyxin, vinculin ve Palladin ile ilişkilendirildiği bilinen fokal yapışıklıklar veya stres lifleri.[16] Vazodilatör ile uyarılan fosfoprotein (VASP ) Ena / VASP homology 1 etki alanı (EVH1 alanı ) merkezi prolin açısından zengin bölgeye ve acemilere profil kendisi aktin filamentlerinin dikenli uçlarında polimerizasyonu teşvik eden bir aktin monomer bağlayıcı protein. Ayrıca, VASP, F-aktin bakterinin kuyruğa bir bağlantısını sağlayan karboksi-terminal EVH2 alanı aracılığıyla.[17] Bu ifade, ActA'nın birden çok Ena / VASP proteinini aynı anda bağlayabilmesi ve ActA ile Ena / VASP arasında yüksek bir afiniteye sahip olması gerçeğiyle desteklenmektedir. VASP'nin in vitro olarak aktin-Y dallarının frekansını azalttığı ve böylece kuyruklu yıldız kuyruklarında paralel bir hizalamada organize olan filamanların oranını arttırdığı gösterilmiştir.[18][19]
C-terminal alanı
ActA'nın C-terminal alanı, proteini bakteriyel membranda tutturan bir hidrofobik bölgeye sahiptir.[20][21][22]
Özetle, ayrıca
- aktin bağlama bölgesinde dizi homolojisinin olmaması ve
- WASP-ailesi NPF'ler (V (WH2) -C-A) için tipik olan ARP2 / 3 aktive edici etki alanlarının dizisinde bir değişiklik,
- ActA ve konakçı NPF'ler arasındaki önemli bir fark, ActA'nın Rho ailesi GTPazlar gibi düzenleyici proteinlere bağlanan elementlere sahip olmamasıdır. ActA ve ana NPF'ler arasındaki bu yapısal fark, aşağıdakiler için avantajlı olabilir: L. monocytogenes ve patogenezi, çünkü aktin çekirdeklenme aktivitesi L. monocytogenes ana bilgisayar düzenlemesinden bağımsızdır.[7]
Analogları
ActA tarafından işlevsel olarak taklit edilen WASP / N-WASP, ökaryotlarda yüksek oranda korunur. Önemli bir aktin-hücre iskeleti düzenleyicisidir ve endositoz ve hücre hareketliliği gibi işlemler için kritik öneme sahiptir. Etkinleştiren Cdc42 Rho ailesi küçük bir GTPase olan WASP / N-WASP, hızlı aktin polimerizasyonuna yol açan Arp2 / 3 kompleksini aktive eder.[23]
Diğer patojenlerin aktin bazlı hareketliliği
İçinde Shigella IcsA proteini aktive eder N-WASP, enfekte olmayan memeli hücrelerinde GTPase Cdc42 tarafından aktive edilir. Aktif N-WASP / WASP, Arp2 / 3 kompleksini aktive ederek aktin polimerizasyonuna yol açar. Aksine, Listeria ActA proteini, Arp2 / 3 kompleksi ile etkileşime girer ve doğrudan aktive eder.[7]
Rickettsia RickA proteini ayrıca Arp2 / 3 kompleksini WASP benzeri bir şekilde aktive edebilir. Kıyasla Listeriaaktin filamentleri uzun, dalsız paralel demetler halinde düzenlenir. Arp2 / 3 kompleksi yalnızca bakteri yüzeyinin yakınında lokalizedir ve bu nedenle daha sık Arp2 / 3 kompleksinden bağımsız uzamanın meydana geldiği varsayılır.[16]
İçinde Burkholderia Pseudomallei BimA, in vitro aktin polimerizasyonunu başlatır. Bu bakterinin hücre içi göçünün Arp2 / 3 kompleksinden bağımsız olarak işlev gördüğü varsayılmaktadır.[16]
Ayrıca bakınız
Referanslar
- ^ a b c d Kocks C, Gouin E, Tabouret M, Berche P, Ohayon H, Cossart P (Şubat 1992). "L. monocytogenes kaynaklı aktin topluluğu, bir yüzey proteini olan actA gen ürününü gerektirir". Hücre. 68 (3): 521–31. doi:10.1016 / 0092-8674 (92) 90188-I. PMID 1739966.
- ^ a b Uniprot P33379
- ^ Cossart P, Sansonetti PJ (Nisan 2004). "Bakteriyel istila: enteroinvaziv patojenlerin paradigmaları". Bilim. 304 (5668): 242–8. doi:10.1126 / science.1090124. PMID 15073367.
- ^ Cossart P, Pizarro-Cerdá J, Lecuit M (Ocak 2003). "Memeli hücrelerinin Listeria monocytogenes tarafından istilası: hücresel işlevleri yıkmak için işlevsel taklitçilik". Hücre Biyolojisindeki Eğilimler. 13 (1): 23–31. doi:10.1016 / S0962-8924 (02) 00006-5. PMID 12480337.
- ^ Zigmond SH (Şubat 2004). "Aktin filamentlerinin formin kaynaklı çekirdeklenmesi". Hücre Biyolojisinde Güncel Görüş. 16 (1): 99–105. doi:10.1016 / j.ceb.2003.10.019. PMID 15037312.
- ^ Goley ED, Rodenbusch SE, Martin AC, Welch MD (Ekim 2004). "Arp2 / 3 kompleksindeki kritik konformasyonel değişiklikler, nükleotid ve nükleasyon teşvik edici faktör tarafından indüklenir". Moleküler Hücre. 16 (2): 269–79. doi:10.1016 / j.molcel.2004.09.018. PMID 15494313.
- ^ a b c d Gouin E, Welch MD, Cossart P (Şubat 2005). "Hücre içi patojenlerin aktin bazlı hareketliliği". Mikrobiyolojide Güncel Görüş. 8 (1): 35–45. doi:10.1016 / j.mib.2004.12.013. PMID 15694855.
- ^ Rafelski SM, Theriot JA (Şubat 2006). "Listeria monocytogenes yüzey proteini ActA'nın polarizasyon mekanizması". Moleküler Mikrobiyoloji. 59 (4): 1262–79. doi:10.1111 / j.1365-2958.2006.05025.x. PMC 1413586. PMID 16430699.
- ^ Goldberg MB (Aralık 2001). "Hücre İçi Mikrobiyal Patojenlerin Aktin Bazlı Motilitesi". Mikrobiyoloji ve Moleküler Biyoloji İncelemeleri. 65 (4): 595–626. doi:10.1128 / MMBR.65.4.595-626.2001. PMC 99042. PMID 11729265.
- ^ a b Poussin MA, Goldfine H (Ocak 2010). "Listeria monocytogenes fagozomunun olgunlaşmasında ActA'nın rol oynadığına dair kanıt". Hücre Araştırması. 20 (1): 109–12. doi:10.1038 / cr.2009.142. PMC 2802179. PMID 20029388.
- ^ Ireton K, Cossart P (1997). "Listeria monocytogenes'in girişi ve aktin bazlı hareketi sırasında konakçı-patojen etkileşimleri". Genetik Yıllık İnceleme. 31: 113–38. doi:10.1146 / annurev.genet.31.1.113. PMID 9442892.
- ^ Altbilgi, Matthew J .; Lyo, John K .; Theriot Julie A. (2008-08-29). "Doğal olarak katlanmamış bir protein olan Listeria monocytogenes ActA'nın yakın paketlenmesi, dimerizasyon olmadan F-aktin birleşimini geliştirir". Biyolojik Kimya Dergisi. 283 (35): 23852–23862. doi:10.1074 / jbc.M803448200. ISSN 0021-9258. PMC 2527104. PMID 18577520.
- ^ Welch Matthew D. (2007). "Listeria monocytogenes'in aktin bazlı hareketliliği ve hücreden hücreye yayılması". Goldfine'da Howard; Shen, Hao (editörler). Listeria monocytogenes: Patogenez ve konakçı yanıtı. New York: Springer. s. 197–223. doi:10.1007/978-0-387-49376-3_10. ISBN 978-0-387-49373-2.
- ^ Welch MD, Rosenblatt J, Skoble J, Portnoy DA, Mitchison TJ (Temmuz 1998). "İnsan Arp2 / 3 kompleksi ile Listeria monocytogenes ActA proteininin aktin filaman çekirdeklenmesinde etkileşimi". Bilim. 281 (5373): 105–8. doi:10.1126 / science.281.5373.105. PMID 9651243.
- ^ Zalevsky J, Grigorova I, Mullins RD (Şubat 2001). "Arp2 / 3 kompleksinin Listeria acta proteini tarafından aktivasyonu. Açta, iki aktin monomerini ve Arp2 / 3 kompleksinin üç alt birimini bağlar". Biyolojik Kimya Dergisi. 276 (5): 3468–75. doi:10.1074 / jbc.M006407200. PMID 11029465.
- ^ a b c Lambrechts A, Gevaert K, Cossart P, Vandekerckhove J, Van Troys M (Mayıs 2008). "Listeria kuyruklu yıldız kuyrukları: iş başında aktin bazlı hareketlilik makinesi". Hücre Biyolojisindeki Eğilimler. 18 (5): 220–7. doi:10.1016 / j.tcb.2008.03.001. PMID 18396046.
- ^ Laurent V, Loisel TP, Harbeck B, vd. (Mart 1999). "Listeria monocytogenes Aktin Bazlı Motilitesinde Ena / VASP Ailesinin Proteinlerinin Rolü". Hücre Biyolojisi Dergisi. 144 (6): 1245–58. doi:10.1083 / jcb.144.6.1245. PMC 2150578. PMID 10087267.
- ^ Skoble J, Auerbuch V, Goley ED, Welch MD, Portnoy DA (Ekim 2001). "Arp2 / 3 kompleksi aracılı aktin nükleasyonunda, aktin dal oluşumunda ve Listeria monocytogenes hareketliliğinde VASP'nin temel rolü". Hücre Biyolojisi Dergisi. 155 (1): 89–100. doi:10.1083 / jcb.200106061. PMC 2150787. PMID 11581288.
- ^ Bear JE, Svitkina TM, Krause M, vd. (Mayıs 2002). "Ena / VASP proteinleri ile aktin filaman kaplaması arasındaki antagonizm fibroblast hareketliliğini düzenler". Hücre. 109 (4): 509–21. doi:10.1016 / S0092-8674 (02) 00731-6. hdl:1721.1/83477. PMID 12086607.
- ^ Vazquez-Boland JA, Kocks C, Dramsi S, vd. (Ocak 1992). "Listeria monocytogenes'in lesitinaz operonunun nükleotid dizisi ve lesitinazın hücreden hücreye yayılmadaki olası rolü". Enfeksiyon ve Bağışıklık. 60 (1): 219–30. PMC 257526. PMID 1309513.
- ^ Domann E, Wehland J, Rohde M, vd. (Mayıs 1992). "Listeria monocytogenes'te vincülinin prolin açısından zengin bölgesi ile homoloji ile konak hücre mikrofilaman etkileşimi için gerekli olan yeni bir bakteriyel virülans geni". EMBO Dergisi. 11 (5): 1981–90. doi:10.1002 / j.1460-2075.1992.tb05252.x. PMC 556658. PMID 1582425.
- ^ Kocks C, Hellio R, Gounon P, Ohayon H, Cossart P (Temmuz 1993). "Yönlü aktin düzeneği bölgesinde Listeria monocytogenes yüzey proteini ActA'nın polarize dağılımı". Hücre Bilimi Dergisi. 105 (3): 699–710. PMID 8408297.
- ^ Kurisu S, Takenawa T (2009). "WASP ve WAVE ailesi proteinleri". Genom Biyolojisi. 10 (6): 226. doi:10.1186 / gb-2009-10-6-226. PMC 2718491. PMID 19589182.
Dış bağlantılar
- Youtube videosu itibaren Doğa, Listeria monocytogenes [2:00–4:12]
