Amin oksit - Amine oxide

Bir amin oksit, Ayrıca şöyle bilinir amin-N-oksit ve N-oksit, bir kimyasal bileşik içeren fonksiyonel grup R3N+−O−, bir N − O koordinat kovalent bağ N'ye bağlı üç ek hidrojen ve / veya hidrokarbon yan zinciri ile. Bazen R olarak yazılır3N → O veya yanlış olarak R3N = O.
Tam anlamıyla terim amin oksit sadece üçüncül oksitler için geçerlidir aminler. Bazen aynı zamanda birincil ve ikincil aminlerin analog türevleri için de kullanılır.
Amin oksitlerin örnekleri şunları içerir: piridinN-oksit suda çözünür kristal bir katı ile erime noktası 62–67 ° C ve N-metilmorfolin N-oksit, bir oksidan olan.
Başvurular
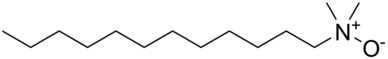
Amin oksitler, şampuanlar, saç kremleri, deterjanlar ve sert yüzey temizleyicileri gibi tüketici ürünlerinde yaygın olarak kullanılan yüzey aktif maddelerdir.[1] Alkil dimetil amin oksit (zincir uzunlukları C10 – C16), ticari olarak en çok kullanılan amin oksittir.[2] Birden fazla üye ülkede yüksek üretim hacimli bileşikler sınıfı olarak kabul edilirler. Ekonomik İşbirliği ve Kalkınma Teşkilatı (OECD); ABD, Avrupa ve Japonya'da sırasıyla 26.000, 16.000 ve 6.800 mt'un üzerinde yıllık üretim ile.[1] Kuzey Amerika'da ev temizlik ürünlerinde amin oksitlerin% 95'inden fazlası kullanılmaktadır.[3] Aktif konsantrasyonları% 0.1–10 aralığında olan stabilizatörler, kıvam arttırıcılar, yumuşatıcılar, emülgatörler ve yumuşatıcılar olarak hizmet ederler.[1] Kalan kısım (<% 5) kişisel bakım, kurumsal, ticari ürünlerde kullanılmaktadır.[4] ve fotoğrafçılık gibi benzersiz patentli kullanımlar için.[1]
Özellikleri
Amin oksitler şu şekilde kullanılır: koruma grubu aminler için ve kimyasal ara maddeler. Uzun zincir alkil amin oksitler olarak kullanılır amfoterik yüzey aktif maddeler ve köpük stabilizatörler.
Amin oksitler oldukça polar moleküller ve bir polarite ona yakın kuaterner amonyum tuzları. Küçük amin oksitler çok hidrofilik ve mükemmel Su çözünürlük ve çoğu organik üründe çok zayıf bir çözünürlük çözücüler.
Amin oksitler zayıftır üsler Birlikte pKb yaklaşık 4,5 oranında R3N+−OH, katyonik hidroksilaminler, üzerine protonasyon bir pH p'nin altındaKb.
Sentez
Hemen hemen tüm amin oksitler, oksidasyon ya üçüncül alifatik aminler ya da aromatik N-heterosikller. Hidrojen peroksit hem endüstriyel hem de akademide en yaygın reaktiftir, ancak perasitler ayrıca önemlidir.[5] Daha özel oksitleyici maddeler, örneğin niş kullanımı görebilir Caro asidi veya mCPBA. Moleküler oksijen kullanılarak kendiliğinden veya katalize edilmiş reaksiyonlar nadirdir. Bazı diğer reaksiyonlar da amin oksitler üretecektir. retro-Cope eleme ancak nadiren kullanılırlar.
Tepkiler
Amin oksitler, birçok türde reaksiyon sergiler.[6]
- Pirolitik eliminasyon. Amin oksitler, 150–200 ° C'ye ısıtıldığında bir hidroksilamini ortadan kaldırır ve sonuçta alken. Bu pirolitik syn-eliminasyon reaksiyonu adı altında bilinir Başa çıkma reaksiyonu. Mekanizma, Hofmann eleme.
- Aminlere indirgeme. Amin oksitler, ortak amine kolayca ana amine dönüştürülür. indirgeme reaktifler dahil olmak üzere lityum alüminyum hidrit, sodyum borohidrid, katalitik indirgeme, çinko / asetik asit ve demir / asetik asit. Piridin N-oksitler şu şekilde oksijenden arındırılabilir: fosfor oksiklorür
- Kurban katalizi. Oksidanlar indirgenerek yeniden üretilebilir N- yenilenme durumunda olduğu gibi oksitler osmiyum tetroksit tarafından N-metilmorfolin N-oksit.
- Ö-alkilasyon. Piridin N-oksitler ile reaksiyona girer Alkil halojenürler için Öalkillenmiş ürün
- Gümüş yüzeylere adsorbe edilen bis-ter-piridin türevleri, oksijen ile bis-ter-piridin-N-oksit. Bu reaksiyonu video izleyebilir.taramalı tünelleme mikroskobu alt moleküler çözünürlük ile.[7]
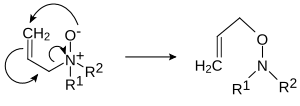
- İçinde Meisenheimer yeniden düzenleme (sonra Jakob Meisenheimer ) belirli N-oksitler R1R2R3N+Ö− yeniden düzenlemek -e hidroksilaminler R2R3N − O − R1[8][9]
- 1,2 yeniden düzenlemede:

- veya 2,3-yeniden düzenleme:
- İçinde Polonovski reaksiyonu üçüncül N-oksit, asetik asit anhidrit karşılık gelen asetamit ve aldehit:[10][11][12]
Metabolitler
Amin oksitler yaygındır metabolitler ilaç ve psikoaktif ilaçlar. Örnekler şunları içerir: nikotin, Zolmitriptan, ve morfin.
Amin oksitleri anti-kanser ilaçları olarak geliştirilmiştir ön ilaçlar içinde metabolize olan oksijen yetersiz kanser doku aktif ilaca.
İnsan güvenliği
Amin oksitlerin (AO) kanserojen, dermal duyarlılaştırıcı olduğu veya üreme toksisitesine neden olduğu bilinmemektedir. Kolayca metabolize olurlar ve yutulurlarsa atılırlar. Tavşanlar tarafından kronik yutmada, 87-150 mg AO / kw bw / gün aralığında gözlenen en düşük yan etki seviyelerinde (LOAEL) daha düşük vücut ağırlığı, ishal ve lentiküler opasiteler bulundu. İnsan cildine maruz kalma testleri, 8 saat sonra% 1'den daha azının vücuda emildiğini bulmuştur. Amin oksitler ve diğer yüzey aktif maddelerden kaynaklanan göz tahrişi orta derecede ve geçicidir, kalıcı etkileri yoktur.[1]
Çevre güvenliği
Ortalama zincir uzunluğu 12.6 olan amin oksitlerin ~ 410 g L'de suda çözünür olduğu ölçülmüştür.−1. Düşük olduğu kabul edilir biyoakümülasyon su türlerinde potansiyel, C14'ten daha kısa zincir uzunluklarından alınan log Kow verilerine dayanmaktadır (biyokonsantrasyon faktörü <% 87).[1] Tedavi edilmeyen girişteki AO seviyeleri 2,3-27,8 ug L olarak bulundu−1atık su içindeyken 0.4-2.91 ug L arasında bulundu−1. En yüksek atık konsantrasyonları oksidasyon hendekleri ve damlatmalı filtre arıtma tesislerinde bulunmuştur. Ortalama olarak, ikincil aktif çamur arıtımı ile% 96'nın üzerinde temizleme bulunmuştur.[2] Balıklarda akut toksisite, 96 saatlik LC50 testleriyle gösterildiği gibi, 1.000-3.000 ug L aralığındadır.−1 karbon zinciri uzunlukları C14'ten az. C14'ten büyük zincir uzunlukları için LC50 değerleri 600 ila 1400 ug L arasındadır−1. Balıklar için kronik toksisite verileri 420 ug / L'dir. C12.9'a normalize edildiğinde NOEC 310 ug L'dir−1 büyüme ve kuluçka için.[2]
Ayrıca bakınız
- Fonksiyonel grup
- Amin, NR3
- Hidroksilamin, NR2OH
- Fosfin oksit, PR3= O
- Sülfoksit, R2S = O
- Azoxy, RN = N+(Ö−) R RN = N+RO−
- Aminoksil grubu Genel yapısı R olan radikaller2HAYIR•
- Kategori: Amin oksitler, belirli amin oksit bileşikleri hakkındaki tüm makaleleri içerir
Referanslar
- ^ a b c d e f Ekonomik İşbirliği ve Kalkınma Teşkilatı (OECD) (2006). "Amin Oksitler". OECD Mevcut Kimyasallar Veritabanı. Arşivlenen orijinal 22 Şubat 2014.
- ^ a b c Sanderson, H; C Tibazarwa; W Greggs; DJ Versteeg (2009). "Yüksek Üretim Hacimli Kimyasal Amin Oksitler [C8–C20]". Risk analizi. 29 (6): 857–867. doi:10.1111 / j.1539-6924.2009.01208.x.
- ^ Modler, RF; Inoguchi Y (2004). "CEH Pazarlama Araştırma Raporu: Yüzey Aktif Maddeler, Ev Tipi Deterjanlar ve Hammaddeleri". Kimya Ekonomisi El Kitabı. Menlo Park, CA: SRI Danışmanlığı.
- ^ Sanderson, H; JL'yi sayar; Stanton K; Sedlak R (2006). "Maruz Kalma ve Önceliklendirme — Tüketici Ürünlerinde Yüksek Üretim Hacimli Kimyasallar için İnsan Tarama Verileri ve Yöntemleri: Amin Oksitler Bir Örnek Çalışma". Risk analizi. 26 (6): 1637–1657. doi:10.1111 / j.1539-6924.2006.00829.x.
- ^ Smith, Michael B .; Mart, Jerry (2007), İleri Organik Kimya: Reaksiyonlar, Mekanizmalar ve Yapı (6. baskı), New York: Wiley-Interscience, s. 1779, ISBN 978-0-471-72091-1
- ^ Albini Angelo (1993). "Amin'in sentetik faydası N-oksitler ". Sentez: 263–77. doi:10.1055 / s-1993-25843.
- ^ Waldmann, T .; et al. (2012). "Organik Bir Reklamcının Oksidasyonu: Kuş Bakışı". Amerikan Kimya Derneği Dergisi. 134: 8817. doi:10.1021 / ja302593v. PMID 22571820.
- ^ J. Meisenheimer, Ber. 52. 1667 (1919)
- ^ Mart'ın Gelişmiş Organik Kimya: Reaksiyonlar, Mekanizmalar ve Yapı Michael B. Smith, Jerry March Wiley-Interscience, 5. baskı, 2001, ISBN 0-471-58589-0
- ^ Grierson, D (1990). "Polonovski Tepkisi". Org. Tepki. 39: 85. doi:10.1002 / 0471264180.or039.02.
- ^ M. Polonovski, M. Polonovski, Bull. Soc. Chim. Fransa 41, 1190 (1927).
- ^ Organik Sentezde İsimli Reaksiyonların Stratejik Uygulamaları (Ciltsiz Kitap) Yazan: Laszlo Kürti, Barbara Czako ISBN 0-12-429785-4.



