Bjerrum arsa - Bjerrum plot - Wikipedia
- Bazen şu şekilde de bilinir Sillén diyagramı veya Hägg diyagramı.

Bir Bjerrum arsa (adını Niels Bjerrum ) bir grafik of konsantrasyonlar farklı türlerin poliprotik asit içinde çözüm, bir fonksiyonu olarak pH,[1] çözüm ne zaman denge. Birçok nedeniyle büyüklük dereceleri Konsantrasyonlar tarafından kapsanan, genellikle bir logaritmik ölçek. Bazen konsantrasyonların oranları gerçek konsantrasyonlardan ziyade grafiğe dökülür. Bazen H+ ve OH− ayrıca çizilmiştir.
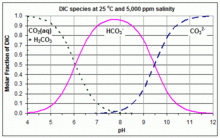
Çoğu zaman, karbonat sistemi poliprotik asidin olduğu yerde çizilir. karbonik asit (bir diprotik asit ) ve farklı türler çözülür karbon dioksit, karbonik asit, bikarbonat, ve karbonat. Asidik koşullarda, baskın biçim CO
2; içinde temel (alkali) koşullar, baskın biçim CO32−; ve arada, baskın biçim HCO3−. Her pH'ta, karbonik asit konsantrasyonunun, çözünmüş CO konsantrasyonuna kıyasla ihmal edilebilir olduğu varsayılır.2ve bu yüzden Bjerrum planlarından genellikle çıkarılır. Bu grafikler çözelti kimyası ve doğal su kimyasında çok yararlıdır. Burada verilen örnekte, insan yapımı girdilere bağlı olarak deniz suyu pH'ı ve karbonat türleşmesinin tepkisini göstermektedir. CO
2 fosil yakıtın yanmasıyla ortaya çıkan emisyon.[2]
Bjerrum, diğer poliprotik asitler için grafikler silisik, borik, sülfürik ve fosforik asitler, yaygın olarak kullanılan diğer örneklerdir.[1]
Bjerrum karbonat sistemi için grafik denklemleri
Eğer karbon dioksit, karbonik asit, hidrojen iyonları, bikarbonat ve karbonat hepsi çözüldü Su ve kimyasal Denge dengeleri konsantrasyonlar genellikle aşağıdakiler tarafından verildiği varsayılır:
alt simge 'eq' bunların denge konsantrasyonları olduğunu belirtir, K1 ... denge sabiti reaksiyon için CO
2 + H
2Ö ⇌ H+ + HCO3− (yani ilk asit ayrışma sabiti karbonik asit için), K2 ... denge sabiti HCO reaksiyonu için3− ⇌ H+ + CO32− (yani ikinci asit ayrışma sabiti karbonik asit için) ve DIC (değişmeyen) toplam konsantrasyon nın-nin çözünmüş inorganik karbon sistemde, yani [CO
2] + [HCO3−] + [CO32−]. K1, K2 ve DIC'nin her biri bir konsantrasyon, Örneğin. mol /litre.
Bjerrum arsa, bu üç denklemi kullanarak bu üç türü karşılaştırarak elde edilir. pH = −log10[H+]eqverilen için K1, K2 ve DIC. Bu denklemlerdeki kesirler, üç türün nispi oranlarını verir ve bu nedenle DIC bilinmiyorsa veya gerçek konsantrasyonlar önemsizse, bunun yerine bu oranlar çizilebilir.
Bu üç denklem, eğrilerin CO
2 ve HCO3− kesişmek [H+]eq = K1ve HCO için eğriler3− ve CO32− kesişmek [H+]eq = K2. Bu nedenle, değerleri K1 ve K2 Belirli bir Bjerrum grafiğini oluşturmak için kullanılanlar, bu kesişme noktalarındaki konsantrasyonları okuyarak bu arsadan kolayca bulunabilir. Ekteki grafikte doğrusal Y eksenli bir örnek gösterilmektedir. K değerleri1 ve K2ve bu nedenle Bjerrum grafiğindeki eğriler, sıcaklık ve tuzlulukla büyük ölçüde değişir.[3]
Karbonat sistemi için Bjerrum grafik denklemlerinin kimyasal ve matematiksel türetilmesi
Farz edin ki arasındaki reaksiyonlar karbon dioksit, hidrojen iyonları, bikarbonat ve karbonat iyonlar, hepsi çözüldü Su, aşağıdaki gibidir:
- CO
2 + H
2Ö ⇌ H+ + HCO3− (1) - HCO3− ⇌ H+ + CO32−. (2)
Reaksiyonun (1) aslında ikisinin kombinasyonu olduğunu unutmayın. temel reaksiyonlar:
- CO
2 + H
2Ö ⇌ H
2CO
3 ⇌ H+ + HCO3−.
Varsayarsak kitle eylem yasası bu iki reaksiyon için geçerlidir, su bol ve farklı kimyasal türlerin her zaman iyi karıştırıldığını, oran denklemleri vardır
nerede [ ] belirtir konsantrasyon, t zamandır ve k1 ve k−1 uygun orantılılık sırasıyla ileri ve geri olarak adlandırılan reaksiyon (1) için sabitler hız sabitleri bu reaksiyon için. (Benzer şekilde k2 ve k−2 reaksiyon için (2).)
Herhangi bir dengede, konsantrasyonlar değişmez, bu nedenle bu denklemlerin sol tarafları sıfırdır. Daha sonra, bu dört denklemden ilkinden, reaksiyonun (1) hız sabitlerinin oranı, denge konsantrasyonlarının oranına eşittir ve bu oran, K1, denir denge sabiti reaksiyon (1) için, yani
- (3)
burada 'eq' alt simgesi, bunların denge konsantrasyonları olduğunu belirtir.
Benzer şekilde, dördüncü denklemden denge sabiti K2 reaksiyon için (2),
- (4)
Yeniden düzenleme (3) verir
- (5)
ve (4) 'ü yeniden düzenlemek, sonra (5)' te değiştirmek,
- (6)
Toplam konsantrasyon nın-nin çözünmüş inorganik karbon sistemde verilir
- (5) ve (6) 'da ikame
Bunu yeniden düzenlemek için denklemi verir CO
2:
HCO için denklemler3− ve CO32− (5) ve (6) 'ya ikame edilerek elde edilir.
Ayrıca bakınız
- Charlot denklemi
- Gran arsa (Gran titrasyonu veya Gran yöntemi olarak da bilinir)
- Henderson – Hasselbalch denklemi
- Hill denklemi (biyokimya)
- İyon türleşmesi
- temiz su
- Deniz suyu
- Termohalin dolaşımı
Referanslar
- ^ a b Andersen, C.B. (2002). "Deneysel ve doğal sistemlerde alkaliniteyi ölçerek karbonat dengesini anlamak". Jeoloji Eğitimi Dergisi. 50 (4): 389–403. Bibcode:2002JGeEd..50..389A. doi:10.5408/1089-9995-50.4.389.
- ^ D.A. Kurt-Gladrow (2007). "Toplam alkalilik: açık konservatif ifade ve biyojeokimyasal işlemlere uygulanması" (PDF). Deniz Kimyası. 106 (1): 287–300. doi:10.1016 / j.marchem.2007.01.006.
- ^ Mook W (2000) Sudaki karbonik asit kimyası. Hidrolojik Döngüde Çevresel İzotoplar: İlkeler ve Uygulamalar 's. 143-165. (INEA / UNESCO: Paris). [1] Erişim tarihi: 30NOV2013.

![{ displaystyle { begin {align} [] left [{ textrm {CO}} _ {2} right] _ { text {eq}} & = { frac { left [{ textrm {H }} ^ {+} right] _ { text {eq}} ^ {2}} { left [{ textrm {H}} ^ {+} right] _ { text {eq}} ^ { 2} + K_ {1} left [{ textrm {H}} ^ {+} right] _ { text {eq}} + K_ {1} K_ {2}}} times { textrm {DIC }}, [3pt] sol [{ textrm {HCO}} _ {3} ^ {-} sağ] _ { text {eq}} & = { frac {K_ {1} sol [ { textrm {H}} ^ {+} right] _ { text {eq}}} { left [{ textrm {H}} ^ {+} right] _ { text {eq}} ^ {2} + K_ {1} left [{ textrm {H}} ^ {+} right] _ { text {eq}} + K_ {1} K_ {2}}} times { textrm { DIC}}, [3pt] sol [{ textrm {CO}} _ {3} ^ {2 -} sağ] _ { text {eq}} & = { frac {K_ {1} K_ {2}} { left [{ textrm {H}} ^ {+} right] _ { text {eq}} ^ {2} + K_ {1} left [{ textrm {H}} ^ {+} right] _ { text {eq}} + K_ {1} K_ {2}}} times { textrm {DIC}}, end {hizalı}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5add9ed036f12c906f0c0d313c8891e0db78d00b)
![{ displaystyle { begin {align} { frac {{ textrm {d}} left [{ textrm {CO}} _ {2} right]} {{ textrm {d}} t}} ve = -k_ {1} sol [{ textrm {CO}} _ {2} sağ] + k _ {- 1} sol [{ textrm {H}} ^ {+} sağ] sol [{ textrm {HCO}} _ {3} ^ {-} right], { frac {{ textrm {d}} left [{ textrm {H}} ^ {+} right]} { { textrm {d}} t}} & = k_ {1} left [{ textrm {CO}} _ {2} right] -k _ {- 1} left [{ textrm {H}} ^ {+} sağ] sol [{ textrm {HCO}} _ {3} ^ {-} sağ] + k_ {2} sol [{ textrm {HCO}} _ {3} ^ {-} sağ] -k _ {- 2} sol [{ textrm {H}} ^ {+} sağ] sol [{ textrm {CO}} _ {3} ^ {2 -} sağ], { frac {{ textrm {d}} left [{ textrm {HCO}} _ {3} ^ {-} right]} {{ textrm {d}} t}} & = k_ {1 } sol [{ textrm {CO}} _ {2} sağ] -k _ {- 1} sol [{ textrm {H}} ^ {+} sağ] sol [{ textrm {HCO} } _ {3} ^ {-} sağ] -k_ {2} sol [{ textrm {HCO}} _ {3} ^ {-} sağ] + k _ {- 2} sol [{ textrm {H}} ^ {+} sağ] sol [{ textrm {CO}} _ {3} ^ {2 -} sağ], { frac {{ textrm {d}} sol [ { textrm {CO}} _ {3} ^ {2 -} right]} {{ textrm {d}} t}} & = k_ {2} left [{ textrm {HCO}} _ {3 } ^ {-} sağ] -k _ {- 2} sol [{ textrm {H}} ^ {+} sağ] sol [{ textrm {CO}} _ {3} ^ {2 -} sağ], end {hizalı}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f7ad5a1abecdd206f676e9f1e3b3502377c4d5a)
![{ displaystyle K_ {1} = { frac {k_ {1}} {k _ {- 1}}} = { frac {[{ textrm {H}} ^ {+}] _ { text {eq} } [{ textrm {HCO}} _ {3} ^ {-}] _ { text {eq}}} {[{ textrm {CO}} _ {2}] _ { text {eq}}} },}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1a76081526d8da277c41a2eb2eb512e581d369e8)
![{ displaystyle K_ {2} = { frac {k_ {2}} {k _ {- 2}}} = { frac { sol [{ textrm {H}} ^ {+} sağ] _ { metin {eq}} left [{ textrm {CO}} _ {3} ^ {2 -} right] _ { text {eq}}} { left [{ textrm {HCO}} _ {3 } ^ {-} sağ] _ { metin {eq}}}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e4b5b28b83c692cbe388781f1ae2e5b1fd9fcbb3)
![{ displaystyle sol [{ textrm {HCO}} _ {3} ^ {-} sağ] _ { text {eq}} = { frac {K_ {1} sol [{ textrm {CO} } _ {2} right] _ { text {eq}}} { left [{ textrm {H}} ^ {+} right] _ { text {eq}}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2eb5a81cacc1c4700d3aa0eb3f4c6a838dedf6de)
![{ displaystyle sol [{ textrm {CO}} _ {3} ^ {2 -} sağ] _ { text {eq}} = { frac {K_ {2} sol [{ textrm {HCO }} _ {3} ^ {-} right] _ { text {eq}}} { left [{ textrm {H}} ^ {+} right] _ { text {eq}}}} = { frac {K_ {1} K_ {2} left [{ textrm {CO}} _ {2} right] _ { text {eq}}} { left [{ textrm {H}} ^ {+} sağ] _ { text {eq}} ^ {2}}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/02e67a83e27f189c49157245a51ddc64eea21098)
![{ displaystyle { begin {align} { textrm {DIC}} & = left [{ textrm {CO}} _ {2} sağ] + sol [{ textrm {HCO}} _ {3} ^ {-} sağ] + sol [{ textrm {CO}} _ {3} ^ {2 -} sağ] & = sol [{ textrm {CO}} _ {2} sağ ] _ { text {eq}} left (1 + { frac {K_ {1}} { left [{ textrm {H}} ^ {+} right] _ { text {eq}}} } + { frac {K_ {1} K_ {2}} { sol [{ textrm {H}} ^ {+} sağ] _ { text {eq}} ^ {2}}} sağ) & = left [{ textrm {CO}} _ {2} right] _ { text {eq}} left ({ frac { left [{ textrm {H}} ^ {+} right] _ { text {eq}} ^ {2} + K_ {1} left [{ textrm {H}} ^ {+} sağ] _ { text {eq}} + K_ {1} K_ {2}} { sol [{ textrm {H}} ^ {+} sağ] _ { text {eq}} ^ {2}}} sağ). End {hizalı}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f37ee267eae1aeeaadb46e98fdf4c3dce8ebc694)
![{ displaystyle sol [{ textrm {CO}} _ {2} sağ] _ { text {eq}} = { frac { sol [{ textrm {H}} ^ {+} sağ] _ { text {eq}} ^ {2}} { left [{ textrm {H}} ^ {+} right] _ { text {eq}} ^ {2} + K_ {1} left [{ textrm {H}} ^ {+} right] _ { text {eq}} + K_ {1} K_ {2}}} times { textrm {DIC}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fac1506f4aa57f82abfb39b65e962a834fd02d75)