Buchwald-Hartwig aminasyonu - Buchwald–Hartwig amination
Bu makale çok güveniyor Referanslar -e birincil kaynaklar. (Ağustos 2016) (Bu şablon mesajını nasıl ve ne zaman kaldıracağınızı öğrenin) |
| Buchwald-Hartwig aminasyonu | |
|---|---|
| Adını | Stephen L. Buchwald John F. Hartwig |
| Reaksiyon türü | Birleştirme reaksiyonu |
| Tanımlayıcılar | |
| Organik Kimya Portalı | buchwald-hartwig-reaksiyonu |
| RSC ontoloji kimliği | RXNO: 0000192 |
Buchwald-Hartwig aminasyonu bir Kimyasal reaksiyon kullanılan organik Kimya sentezi için karbon-nitrojen bağları aracılığıyla paladyumla katalize edilen birleştirme reaksiyonları ile aminlerin aril halojenürler.[1] Pd katalizli C-N bağlaşımlarının 1983 gibi erken bir tarihte bildirilmesine rağmen, Stephen L. Buchwald ve John F. Hartwig 1994 ile 2000'lerin sonları arasındaki yayınları dönüşümün kapsamını belirleyen kredilendirildi. Reaksiyonun sentetik faydası, öncelikle tipik yöntemlerin eksikliklerinden kaynaklanır (nükleofilik ikame, indirgeyici aminasyon, vb.) aromatik C-N bağlarının sentezi için, çoğu yöntem sınırlı substrat kapsamı ve fonksiyonel grup toleransından muzdariptir.[2] Buchwald-Hartwig reaksiyonunun gelişimi, aril aminlerin kolay sentezine izin vererek, bir dereceye kadar daha sert yöntemlerin ( Goldberg reaksiyonu, nükleofilik aromatik ikame, vb.) olası C – N bağ oluşumunun repertuarını önemli ölçüde genişletirken.[kaynak belirtilmeli ]

(Denklem.1)
Gelişimi boyunca, her bir sistem, bağlama ortakları ve daha yumuşak koşullar açısından daha geniş kapsam sağlayan ve hemen hemen her aminin çok çeşitli aril birleştirme ortaklarıyla birleştirilmesine izin veren birkaç "nesil" katalizör sistemi geliştirildi.[kaynak belirtilmeli ] Farmasötiklerde aril C-N bağlarının her yerde bulunmasından dolayı ve doğal ürünler Reaksiyon, sentetik organik kimyada geniş bir kullanım kazanmıştır ve birçok toplam sentezler ve çok sayıda ilacın endüstriyel olarak hazırlanması.
Tarih
Paladyum katalizli C – N çapraz birleştirme reaksiyonunun ilk örneği 1983 yılında Migita ve arkadaşları tarafından yayınlandı ve birkaç aril bromid ile N, N-dietilamino-tributil arasındaki bir reaksiyonu açıkladıteneke % 1 mol PdCl kullanarak2[P (o-tolil)3]2. Birkaç aril bromür test edilmiş olmasına rağmen, yalnızca elektronik olarak nötr, sterik ipoteksiz substratlar, iyi ila mükemmel verimler verdi.[3]

(Denklem.2)
1984 yılında Dale L. Boger ve James S. Panek stoikiometrik kullanan lavendamisin sentezi üzerindeki çalışmaları bağlamında Pd (0) aracılı C-N bağ oluşumunun bir örneğini bildirdi. Pd (PPh3)4. Reaksiyon katalitik hale getirme girişimleri başarısız oldu.[4]

(Denklem 3)
Bu raporlar neredeyse on yıl boyunca alıntılandı. Şubat 1994'te Hartwig, orijinal Migita makalesinde yer alan paladyum bileşiklerinin sistematik bir çalışmasını bildirdi ve şu sonuca varıldı: d10 karmaşık Pd [P (o-Tolyl)3]2 aktif katalizördü. Aşağıdakileri içeren bir katalitik döngü önerildi oksidatif ekleme aril bromür.[5]
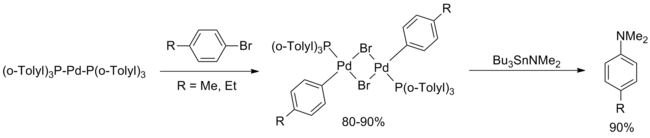
(Denklem.4)
Mayıs 1994'te Buchwald, Migita makalesinin orijinal makaleye göre iki büyük gelişme sunan bir uzantısını yayınladı. İlk, transaminasyon Bu3SnNEt2 bunu takiben argon uçucu maddeyi çıkarmak için temizleyin dietilamin metodolojinin çeşitli şekillerde genişletilmesine izin verildi ikincil aminler (hem döngüsel hem de döngüsel olmayan) ve birincil anilinler. İkinci olarak, elektron açısından zengin ve elektron açısından fakir alanlar için verim, reaksiyon prosedüründe küçük değişikliklerle (daha yüksek katalizör yüklemesi, daha yüksek sıcaklık, daha uzun reaksiyon süresi) geliştirildi, ancak orto ikame edilmiş aril grupları bu yayına dahil edildi.[6]

(Denklem.5)
1995 yılında, her laboratuvardan arka arkaya araştırmalar, kuplajların hacimli bir ortam varlığında serbest aminlerle yapılabileceğini gösterdi. temel (NaOtBu Buchwald yayınında, LiHMDS Hartwig yayınında), organotin -ücretsiz bağlantı. Bu iyileştirilmiş koşullar daha hızlı ilerlemesine rağmen, substrat kapsamı, rekabet gücü nedeniyle neredeyse tamamen ikincil aminlerle sınırlıydı. hidrodehalojenasyon bromoarenes.[7][8] (Görmek Mekanizma altında)

(Denklem.6)
Bu sonuçlar, Buchwald-Hartwig katalizör sistemlerinin sözde "ilk neslini" oluşturdu. Sonraki yıllarda, daha sofistike fosfin ligandlar bu, daha geniş bir amin ve aril gruplarına genişlemeye izin verdi. Aril iyodürler, klorürler, ve triflakalar sonunda uygun substratlar haline geldi ve oda sıcaklığında daha zayıf bazlarla yürütülen reaksiyonlar geliştirildi. Bu ilerlemeler, Dürbün aşağıdaki bölüm ve daha karmaşık sistemlerin genişletilmesi aktif bir araştırma alanı olmaya devam etmektedir.
Mekanizma
reaksiyon mekanizması çünkü bu reaksiyonun, paladyum katalizli C-C birleştirme reaksiyonları için bilinenlere benzer aşamalardan geçtiği gösterilmiştir. Adımlar, aril halojenürün bir Pd (0) türüne oksidatif ilavesini, oksidatif ekleme kompleksine aminin ilavesini, protonsuzlaştırmayı ve ardından indirgeyici eliminasyon. Verimsiz bir yan reaksiyon, indirgeyici eliminasyonla rekabet edebilir, burada amid, hidrodehalojenlenmiş areni vermek için beta hidrit eliminasyonuna maruz kalır ve bir imine etmek ürün.[9]
Reaksiyonun gelişimi boyunca grup, temel mekanik çalışmalar yoluyla reaksiyon ara maddelerini tanımlamaya çalıştı. Bu çalışmalar, mevcut olup olmadığına bağlı olarak farklı bir reaksiyon yolu ortaya çıkarmıştır. tek dişli veya şelatlama Reaksiyonda fosfin ligandları kullanılır ve bir takım nüanslı etkiler ortaya çıkarılmıştır (özellikle dialkilbiaril fosfin ligandları Buchwald tarafından geliştirilmiştir).
Katalitik döngü şu şekilde ilerler:[10][11][12][13]
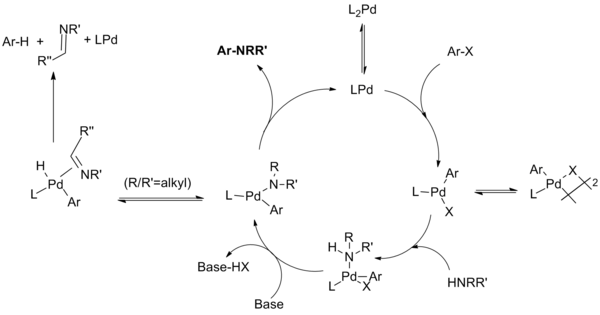
(Denklem.7)
Monodentat ligand sistemleri için, monofosfin palladyum (0) türlerinin, palladyum (II) türlerini oluşturduğuna inanılmaktadır. denge μ-halojen dimer ile. Bu dimerin stabilitesi X = I> Br> Cl mertebesinde azalır ve aril iyodürlerin birinci nesil katalizör sistemiyle yavaş reaksiyonundan sorumlu olduğu düşünülmektedir. Amin ligasyonu ve ardından baz ile deprotonasyon, paladyum amidi üretir. (Şelatlama sistemlerinin, amid oluşumundan önce gelen baz kompleksleşmesi ile ters sırada bu iki aşamadan geçtiği gösterilmiştir.) Bu anahtar ara ürün, ürünü üretmek ve katalizörü yeniden oluşturmak için indirgeyici olarak elimine eder. Bununla birlikte, p-hidrit eliminasyonunun ardından indirgeyici eliminasyonun hidrodehalojenlenmiş areni ve karşılık gelen imini ürettiği bir yan reaksiyon meydana gelebilir. Katalitik döngünün çeşitli aşamalarında çeşitli ara ürünlerin ek fosfin ligandlarına koordine olduğu ek dengeler gösterilmemiştir.
Şelatlama ligandları için monofosfin paladyum türleri oluşmaz; oksidatif ekleme, amid oluşumu ve indirgeyici eliminasyon L'den oluşur2PD kompleksleri. Hartwig grubu, "indirgeyici eliminasyonun ya dört koordinatlı bir bifosfin ya da üç koordinatlı monofosfin arilpalladyum amido kompleksinden meydana gelebileceğini buldu. Üç koordinatlı bileşiklerden eliminasyonlar daha hızlıdır. İkincisi, β-hidrojen eliminasyonu üç koordinatlı bir ara maddeden gerçekleşir. Bu nedenle,-hidrojen eliminasyonu, kenetleyici fosfinler içeren arilpalladyum komplekslerinden yavaşça meydana gelirken, indirgeyici eliminasyon bu dört koordinatlı türlerden hala gerçekleşebilir. "[14]
Uygulama
Farmasötiklerde aril C-N bağlarının her yerde bulunmasından dolayı ve doğal ürünler Reaksiyon, sentetik organik kimyada geniş bir kullanım kazanmıştır ve birçok toplam sentezler ve çok sayıda ilacın endüstriyel olarak hazırlanması.[22]Endüstriyel uygulamalar, karbonil bileşiklerinin (ketonlar, esterler, amidler, aldehitler gibi) ve nitrillerin a-arilasyonunu içerir.[23]
Dürbün
Buchwald-Hartwig aminasyonunun kapsamı çok çeşitli aril ve amin birleştirme partnerlerini içerecek şekilde genişletilmesine rağmen, herhangi bir özel reaktan için gerekli koşullar hala büyük ölçüde substrata bağlıdır. Her biri farklı yeteneklere ve sınırlamalara sahip çeşitli ligand sistemleri geliştirilmiştir ve koşulların seçimi, her iki ortağın sterik ve elektronik özelliklerinin dikkate alınmasını gerektirir. Aşağıda ayrıntılı ligand sistemleri için substratlar ve koşullar verilmiştir. (Burada yer almayanlar N-heterosiklik karben geniş ligandlar ve ligandlar ısırık açıları gibi Xantphos ve Spanphos aynı zamanda önemli ölçüde geliştirilmiştir.)[9]
Birinci nesil katalizör sistemi
İlk nesil (Pd [P (o-Tolyl)3]2) katalizör sisteminin, hem alkil hem de aril işlevselliği (diarilaminler olmasa da) taşıyan hem siklik hem de asiklik ikincil aminlerin çeşitli aril bromürler ile birleştirilmesi için etkili olduğu bulunmuştur. Genel olarak, bu koşullar, arenin rekabetçi hidrodehalojenasyonuna bağlı olarak birincil aminleri birleştiremedi.[7][8]
Aril iyodürlerin aşağıdakiler için uygun substratlar olduğu bulunmuştur. moleküliçi bu reaksiyonun varyantı,[8] ve daha da önemlisi, birleştirilebilir moleküller arası sadece çözücü olarak toluen yerine dioksan kullanılmışsa, mütevazı verimle de olsa.[24]

Bidentat fosfin ligandları
Geliştirilmesi difenilfosfinobinaftil (BINAP) ve difenilfosfinoferosen Buchwald-Hartwig aminasyonu için ligand olarak (DPPF), birincil aminlere ilk güvenilir uzantıyı sağladı ve aril iyodürlerin ve triflatların verimli bir şekilde bağlanmasına izin verdi. (İki dişli ligandların, oksidatif eklemeden sonra paladyum iyodür dimerinin oluşumunu önlediğine ve reaksiyonu hızlandırdığına inanılmaktadır.) Bu ligandlar tipik olarak birleştirilmiş ürünleri daha yüksek oranlarda ve birinci nesil katalizörlerden daha iyi verimlerde üretir. Bu ligandların katalizörler olarak ilk raporları, birinci nesil sistemde aktif katalizörler olarak görev yapan monolige kompleksler için mekanik kanıtlar göz önüne alındığında biraz beklenmedikti. Aslında, her iki laboratuvardan ilk örnekler aynı sayıda yayınlanmıştır. JACS.[25][26][27]

(Denklem.8)
şelasyon Bu ligandların açık bir koordinasyon bölgesini önleyerek p-hidrit eliminasyonunu baskıladığı düşünülmektedir. Aslında, birinci nesil katalizör sisteminin aksine, şelatlama ligandları kullanıldığında a-kiral aminlerin rasemize olmadığı bulunmuştur.[28]

(Denklem.9)
Sterik olarak engellenmiş ligandlar
Hacimli tri- ve di-alkil fosfin ligandlarının, geniş bir amin yelpazesinin (birincil, ikincil, elektron geri çekilmiş, heterosiklik, vb.) Aril klorürler, bromürler, iyodürler ve triflatlar ile bağlanmasına izin veren dikkat çekici derecede aktif katalizörler olduğu gösterilmiştir. . Ek olarak, kullanan reaksiyonlar hidroksit, karbonat, ve fosfat geleneksel alkoksit ve sililamid bazlarının yerine bazlar geliştirilmiştir. Buchwald grubu geniş bir yelpazede dialkilbiaril fosfin ligandları Hartwig grubu, ferrosen türetilmiş ve trialkil fosfin ligandları.[29][30][31][32][33][34]

(Denklem 10)
Bu ligandlarla görülen etkinlikte görülen dramatik artış, katalitik döngünün tüm aşamalarında monolige edilmiş paladyum türlerini sterik olarak tercih etme eğilimlerine atfedilir, oksidatif ekleme, amid oluşumu ve indirgeyici eliminasyon oranını dramatik bir şekilde arttırır. Bu ligandların birçoğunun, elektron veren aren-paladyum etkileşimi yoluyla β-hidrit eliminasyonuna göre indirgeyici eliminasyon oranını da arttırdığı görülmektedir.[19][20]
Paladyum katalizörünü deaktive etme eğilimlerine rağmen, elektron geri çekilmiş aminler ve heterosiklik substratlar bile bu koşullar altında birleştirilebilir.[35][36]

(Denklem.11)
Amonyak eşdeğerleri
Amonyak Palladyum kompleksleri ile sıkı bağlanmasına atfedilen bir problem olan Buchwald-Hartwig aminasyon reaksiyonları için en zorlu eşleşme ortaklarından biri olmaya devam etmektedir. Bunun üstesinden gelmek için amonyak eşdeğerleri olarak hizmet eden reaktiflere dayalı olarak çeşitli stratejiler geliştirilmiştir. A kullanımı benzofenon imin veya sililamid bu sınırlamanın üstesinden gelebilir, ardından hidroliz birincil anilin.[37][38][39]
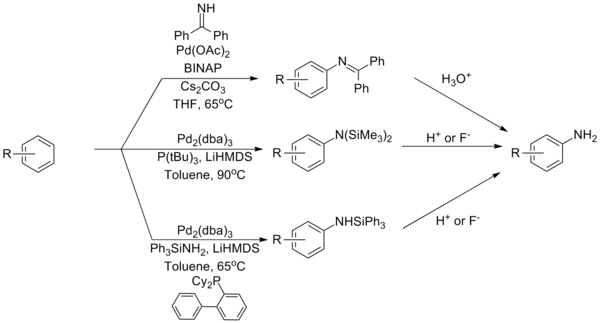
(Denklem 12)
Josiphos tipi bir ligand kullanarak amonyağı doğrudan birleştirebilen bir katalizör sistemi.[40]
C-N kaplinlerinde varyasyonlar: C-O, C-S ve C-C kaplinler
Aminasyon için kullanılanlara benzer koşullar altında, alkoller ve ilgili arili üretmek için aril halojenürler ile birleştirilebilir eterler. Bu, bu işlemin daha sert analogları için uygun bir ikame görevi görür. Ullmann yoğunlaşması.[41][42]

(Denklem 13)
Tiyoller ve tiyofenoller, karşılık gelen aril tiyoeterleri üretmek için Buchwald-Hartwig tipi koşullar altında aril halojenürler ile birleştirilebilir. Ayrıca, merkaptoesterler, H2Karşılık gelen aril halojenürden tiofenolü oluşturmak için S-eşdeğerleri.[43]
Enolatlar ve diğer benzer karbon nükleofiller ayrıca a-aril ketonlar, malonatlar, nitriller, vb. Üretmek için birleştirilebilir. Bu dönüşümün kapsamı benzer şekilde liganda bağlıdır ve bir dizi sistem geliştirilmiştir.[44] Bu işlem için çeşitli enantiyoselektif yöntemler geliştirilmiştir.[45][46]

(Denklem 14)
Aşağıdaki kompleksleri kullanan reaksiyonun çeşitli versiyonları bakır ve nikel paladyum yerine de geliştirilmiştir.[18]
Referanslar
- ^ Forero-Cortés, Paola A .; Haydl, Alexander M. (2 Temmuz 2019). "Buchwald – Hartwig Amination'ın 25. Yıldönümü: Geliştirme, Uygulamalar ve Genel Bakış". Organik Süreç Araştırma ve Geliştirme. 23 (8): 1478–1483. doi:10.1021 / acs.oprd.9b00161.
- ^ Weygand, Conrad (1972). Hilgetag, G .; Martini, A. (editörler). Weygand / Hilgetag Hazırlayıcı Organik Kimya (4. baskı). New York: John Wiley & Sons, Inc. s. 461. ISBN 0471937495.
- ^ Kosugi, M .; Kameyama, M .; Migita, T. (1983), "Aril Bromidlerin Palladyum-Katalize Aromatik Aminasyonu, n-Di-Etilamino-Tributilkalay", Kimya Mektupları, 12 (6): 927–928, doi:10.1246 / cl.1983.927
- ^ Boger, D.L .; Panek, J.S. (1984), "Paladyum (0) - aracılı p-karbolin sentezi: Lavendamisinin CDE halka sisteminin hazırlanması", Tetrahedron Mektupları, 25 (30): 3175–3178, doi:10.1016 / S0040-4039 (01) 91001-9
- ^ Paul, F .; Patt, J .; Hartwig, J.F. (1994), "Palladyum katalizli karbon-nitrojen bağlarının oluşumu. Aril halojenürlerin ve kalay amitlerin hetero çapraz bağlanmasında reaksiyon ara maddeleri ve katalizör iyileştirmeleri", J. Am. Chem. Soc., 116 (13): 5969–5970, doi:10.1021 / ja00092a058
- ^ Guram, A.S .; Buchwald, S.L. (1994), "Yerinde Üretilmiş Aminostannanlar ile Palladyum Katalizlenmiş Aromatik Aminasyonlar", J. Am. Chem. Soc., 116 (17): 7901–7902, doi:10.1021 / ja00096a059
- ^ a b Louie, J .; Hartwig, J.F. (1995), "Aril halojenürlerden arilaminlerin paladyumla katalize edilmiş sentezi. Mekanistik çalışmalar, kalay reaktiflerinin yokluğunda birleşmeye yol açar", Tetrahedron Mektupları, 36 (21): 3609–3612, doi:10.1016 / 0040-4039 (95) 00605-C
- ^ a b c Guram, A.S .; Rennels, R.A .; Buchwald, S.L. (1995), "Aril Bromürlerin Arilaminlere Dönüştürülmesi İçin Basit Bir Katalitik Yöntem", Angewandte Chemie Uluslararası Sürümü, 34 (12): 1348–1350, doi:10.1002 / anie.199513481
- ^ a b c Muci, A.R .; Buchwald, S.L. (2002), "C-N ve C-O Bağ Oluşumu için Pratik Paladyum Katalizörleri", Curr. Konularındaki konular Chem.Güncel Kimyada Konular, 219: 131–209, doi:10.1007 / 3-540-45313-x_5, ISBN 978-3-540-42175-7
- ^ Sürücü, M.S .; Hartwig, J.F. (1997), "Palladyum (II) Fosfin Komplekslerinden Arilaminlerin Karbon Azot Bağı Oluşturan İndirgeyici Eliminasyonu", J. Am. Chem. Soc., 119 (35): 8232–8245, doi:10.1021 / ja971057x
- ^ Hartwig, J.F .; Richards, S .; Barañano, D .; Paul, F. (1996), "C − N Bağı Oluşturan İndirgeyici Eliminasyon ve Amidlerin β-Hidrojen Eliminasyonu için Göreli Oranlar Üzerindeki Etkiler. Aril Halojenürlerin Paladyumla Katalize Edilmiş Aminasyonunda Rekabet Eden İndirgemenin Kökenleri Üzerine Bir Vaka Çalışması" , J. Am. Chem. Soc., 118 (15): 3626–3633, doi:10.1021 / ja954121o
- ^ Sürücü, M.S .; Hartwig, J.F. (1995), "Nadir, Düşük Değerlikli Bir Alkylamido Kompleksi, Bir Difenilamido Kompleksi ve Üç Koordinatlı Ara Maddelerle Aminlerin İndirgeyici Eliminasyonu", J. Am. Chem. Soc., 117 (16): 4708–4709, doi:10.1021 / ja00121a030
- ^ Widenhoefer, R.A .; Buchwald, S.L. (1996), "Palladyum Aril Halide Dimerlerden Palladyum Tris (o-tolil) fosfin Mono (amin) Komplekslerinin Denge Oluşumunda Halojen ve Amin Etkisi", Organometalikler, 15 (12): 2755–2763, doi:10.1021 / om9509608
- ^ a b Hartwig, J.F. (1999), "Katalizör keşfine yaklaşımlar. Yeni karbon-heteroatom ve karbon-karbon bağı oluşumu", Pure Appl. Chem., 71 (8): 1416–1423, doi:10.1351 / pac199971081417, S2CID 34700080
- ^ Hartwig, J.F. (1997), "Aril Halojenürlerin Paladyumla Katalizlenmiş Aminasyonu: Mekanizma ve Rasyonel Katalizör Tasarımı", Synlett, 1997 (4): 329–340, doi:10.1055 / s-1997-789
- ^ Hartwig, J.F. (1998), "Karbon-Heteroatom Bağı Oluşturan Aminler, Eterler ve Sülfitlerin İndirgeyici Eliminasyonları", Acc. Chem. Res., 31: 852–860, doi:10.1021 / ar970282g
- ^ Wolfe, J.P .; Wagaw, S .; Marcoux, J.F .; Buchwald, S.L. (1998), "Aromatik Karbon-Azot Bağ Oluşumu İçin Pratik Katalizörlerin Rasyonel Geliştirilmesi", Acc. Chem. Res., 31: 805–818, doi:10.1021 / ar9600650
- ^ a b Hartwig, J.F. (1998), "Aril Halojenürler ve Triflatlardan Arilaminlerin ve Aril Eterlerin Geçiş Metal Katalizeli Sentezi: Kapsam ve Mekanizma", Angew. Chem. Int. Ed., 37 (15): 2046–2067, doi:10.1002 / (sici) 1521-3773 (19980817) 37:15 <2046 :: aid-anie2046> 3.0.co; 2-l
- ^ a b Hartwig, J.F. (2008), "Aril Halojenürlerin Aminasyonu ve Tiyoeterifikasyonu için Dördüncü Nesil Katalizörün Evrimi", Acc. Chem. Res., 41 (11): 1534–1544, doi:10.1021 / ar800098p, PMC 2819174, PMID 18681463
- ^ a b Surry, D.S .; Buchwald, S.L. (2008), "Palladyum Katalizlenmiş Aminasyonda Biaril Fosfan Ligandları", Angew. Chem. Int. Ed., 47 (34): 6338–6361, doi:10.1002 / anie.200800497, PMC 3517088, PMID 18663711
- ^ Surry, D.S .; Buchwald, S.L. (2011), "Dialkylbiaryl phosphines in Pd-catalyzed amination: a user's guide", Chem. Sci., 2 (1): 27–50, doi:10.1039 / c0sc00331j, PMC 3306613, PMID 22432049
- ^ [15][16][14][9][17][18][19][20][21]
- ^ Thomas J. Colacot. 2010 Nobel Kimya Ödülü: Paladyum-Katalizeli Çapraz Bağlama. Platin Metalleri Rev., 2011, 55, (2) doi: 10.1595 / 147106711X558301
- ^ Wolfe, J. P .; Buchwald, S. L. (1996), "Aril İyodürlerin Palladyum-Katalizlenmiş Aminasyonu", J. Org. Chem., 61 (3): 1133–1135, doi:10.1021 / jo951844h
- ^ Sürücü, M.S .; Hartwig, J.F. (1996), "Aril Halojenür Aminasyonu için İkinci Nesil Katalizör: Aril Halojenürlerden Karma İkincil Aminler ve (DPPF) PdCl2 ile Katalize Edilen Birincil Aminler", J. Am. Chem. Soc., 118 (30): 7217–7218, doi:10.1021 / ja960937t
- ^ Wolfe, J.P .; Wagaw, S .; Buchwald, S.L. (1996), "Aromatik Karbon-Nitrojen Bağ Oluşumu İçin Geliştirilmiş Bir Katalizör Sistemi: Anahtar Ara Maddeler Olarak Bis (Fosfin) Paladyum Komplekslerinin Olası Katılımı", J. Am. Chem. Soc., 118: 7215–7216, doi:10.1021 / ja9608306
- ^ Louie, J .; Sürücü, M.S .; Hamann, B.C .; Hartwig, J.F. (1997), "Aril Triflatların Paladyumla Katalize Edilmiş Aminasyonu ve Triflat Ekleme Hızının Önemi", J. Org. Chem., 62 (5): 1268–1273, doi:10.1021 / jo961930x
- ^ Wagaw, S .; Rennels, R.A .; Buchwald, S.L. (1997), "Optik Olarak Aktif Aminlerin Aril Bromidler ile Paladyum Katalizlenmiş Bağlanması", J. Am. Chem. Soc., 119 (36): 8451–8458, doi:10.1021 / ja971583o
- ^ Eski, D.W .; Wolfe, J.P .; Buchwald, S.L. (1998), "Paladyumla Katalize Edilmiş Çapraz Bağlanma Reaksiyonları İçin Oldukça Aktif Bir Katalizör: Oda Sıcaklığında Suzuki Bağlaşmaları ve Aktifleştirilmemiş Aril Klorürlerin Aminasyonu", J. Am. Chem. Soc., 120: 9722–9723, doi:10.1021 / ja982250 +
- ^ Wolfe, J.P .; Buchwald, S.L. (1999), "Oda Sıcaklığı Aminasyonu ve Aril Klorürlerin Suzuki Bağlanması için Oldukça Aktif Bir Katalizör", Angew. Chem. Int. Ed., 38 (16): 2413–2416, doi:10.1002 / (sici) 1521-3773 (19990816) 38:16 <2413 :: aid-anie2413> 3.0.co; 2-h, PMID 10458806
- ^ Hamann, B.C .; Hartwig, J.F. (1998), "Sterik Olarak Engellenmiş Şelatlayıcı Alkil Fosfinler Aril İyodürlerin, Bromürlerin ve Klorürlerin Paladyumla Katalize Edilmiş Aminasyonunda ve Aril Tosilatların İlk Aminasyonunda Büyük Hız Hızlandırmaları Sağlar", J. Am. Chem. Soc., 120 (29): 7369–7370, doi:10.1021 / ja981318i
- ^ Wolfe, J.P .; Tomori, H .; Sadighi, J.P .; Yin, J .; Buchwald, S.L. (2000), "Aril Klorürlerin, Bromürlerin ve Triflatların Paladyumla Katalize Edilmiş Aminasyonu için Basit, Etkili Katalizör Sistemi" (PDF), J. Org. Chem., 65 (4): 1158–1174, doi:10.1021 / jo991699y, PMID 10814067
- ^ Stambuli, J.P .; Kuwano, R .; Hartwig, J.F. (2002), "Aril Klorürlerin ve Bromürlerin Aktivasyonu için Eşsiz Oranlar: Oda Sıcaklığında Dakikalar İçinde Aminler ve Boronik Asitlerle Bağlanma", Angew. Chem. Int. Ed., 41 (24): 4746–4748, doi:10.1002 / anie.200290036, PMID 12481346
- ^ Huang, X .; Anderson, K.W .; Zim, D .; Jiang, L .; Klapars, A .; Buchwald, S.L. (2003), "Expanding Pd-Catalyzed C-N Bond-Forming Processes: The First Amidation of Aryl Sulfonates, Sulu Aminasyon ve Cu-Katalize Reaksiyonlarla Tamamlayıcılık", J. Am. Chem. Soc., 125 (22): 6653–6655, doi:10.1021 / ja035483w, PMID 12769573
- ^ Anderson, K.W .; Tundel, R.E .; Ikawa, T .; Altman, R.A .; Buchwald, S.L. (2006), "Monodentat Fosfinler, Heteroaromatik Halojenürler / Aminler ve (H) N-Heterosiklelerin Pd-Katalizlenmiş CN Bağı Oluşturan Reaksiyonları için Yüksek Derecede Aktif Katalizörler Sağlar", Angew. Chem. Int. Ed., 45 (39): 6523–6527, doi:10.1002 / anie.200601612, PMID 16955526
- ^ Ikawa, T .; Barder, T.E .; Biscoe, M.R .; Buchwald, S.L. (2007), "Monodentat Biaril Fosfin Ligandlarını Kullanan Aril Klorürlerin Pd-Katalizlenmiş Amidasyonları: Kinetik, Hesaplamalı ve Sentetik Bir Araştırma", J. Am. Chem. Soc., 129 (43): 13001–13007, doi:10.1021 / ja0717414, PMID 17918833
- ^ Wolfe, J.P .; Ahman, J .; Sadighi, J.P .; Singer, R.A .; Buchwald, S.L. (1997), "Aril Halojenürlerin ve Triflatların Palladyum ile Katalize Edilmiş Aminasyonu için Amonyak Eşdeğeri", Tetrahedron Lett., 38 (36): 6367–6370, doi:10.1016 / S0040-4039 (97) 01465-2
- ^ Lee, S .; Jorgensen, M .; Hartwig, J.F. (2001), "Bir Amonyak Eşdeğeri Olarak Aril Halojenürler ve Lityum Bis (trimetilsilil) amidden Arilaminlerin Paladyum Katalizeli Sentezi", Org. Lett., 3 (17): 2729–2732, doi:10.1021 / ol016333y, PMID 11506620
- ^ Huang, X .; Buchwald, S.L. (2001), "Aril Halojenürlerin Pd-Katalizeli Aminasyonu için Yeni Amonyak Eşdeğerleri", Org. Lett., 3 (21): 3417–3419, doi:10.1021 / ol0166808, PMID 11594848
- ^ Vo, G.D .; Hartwig, J.F. (2009), "Amonyağın Aril Klorürler, Bromürler, İyodürler ve Sülfonatlar ile Palladyum-Katalizlenmiş Bağlanması: Birincil Arilaminlerin Hazırlanması için Genel Bir Yöntem", J. Am. Chem. Soc., 131 (31): 11049–11061, doi:10.1021 / ja903049z, PMC 2823124, PMID 19591470
- ^ Mann, G .; Incarvito, C .; Rheingold, A.L .; Hartwig, J.F. (1999), "Aktive Edilmemiş Aril Halojenürleri İçeren Paladyum-Katalize C-O Bağlantısı. Diaryl Eterlerde C-O Bağını Oluşturmak İçin Sterik Olarak İndüklenen İndirgeyici Eliminasyon", J. Am. Chem. Soc., 121: 3224–3225, doi:10.1021 / ja984321a
- ^ Torraca, K.E .; Huang, X .; Parrish, C.A .; Buchwald, S.L. (2001), "Etkin Moleküller Arası Palladyum-Katalize Edilmiş Aril Eter Sentezi", J. Am. Chem. Soc., 123 (43): 10770–10771, doi:10.1021 / ja016863p, PMID 11674023
- ^ Heesgaard Jepsen Sal (2011). "Fonksiyonelleştirilmiş Dibenzotiofenlerin Sentezi - Pd-Katalizeli C-C ve C-S Bağ Oluşumlarına Dayalı Etkili Üç Aşamalı Yaklaşım". Avrupa Organik Kimya Dergisi. 2011: 53–57. doi:10.1002 / ejoc.201001393.
- ^ Culkin, D.A .; Hartwig, J.F. (2003), "Karbonil Bileşiklerinin ve Nitrillerin Palladyum-Katalizlenmiş r-Arilasyonu", Acc. Chem. Res., 36 (4): 234–245, doi:10.1021 / ar0201106, PMID 12693921
- ^ Hamada, T .; Chieffi, A .; Ahman, J .; Buchwald, S.L. (2002), "Keton Enolatlarının Asimetrik Arilasyonu için Geliştirilmiş Bir Katalizör", J. Am. Chem. Soc., 124 (7): 1261–1268, doi:10.1021 / ja011122 +, PMID 11841295
- ^ Liao, X .; Weng, Z .; Hartwig, J.F. (2008), "Palladyum ve Nikelin Difluorfos Kompleksleri Tarafından Katalize Edilmiş Aril Triflatlar ile Ketonların Enantiyoselektif r-Arilasyonu", J. Am. Chem. Soc., 130 (1): 195–200, doi:10.1021 / ja074453g, PMC 2551326, PMID 18076166
Dış bağlantılar
- Buchwald-Hartwig Coupling - Son Literatür
- Buchwald – Hartwig aminasyonu - Sentetik protokoller organic-reaction.com'dan
- Buchwald-Hartwig Kimyası Ian Mangion MacMillan Group Meeting 30 Temmuz 2002 Bağlantı
- Buchwald-Hartwig reaksiyonu Organik sentezde birleştirme reaksiyonları için Acros Organics'ten Değerli Metal katalizörleri Bağlantı














