Öğrenme ve hafızada kadherin-katenin kompleksi - Cadherin–catenin complex in learning and memory
Uzun vadeli güçlendirme Öğrenme ve hafıza için hücresel temel olduğu düşünülen (LTP), sinaptik plastisitenin altında yatan özel bir sinyal iletim sürecini içerir.[1]Sinaptik plastisitenin korunmasından sorumlu birçok mekanizma arasında kadherin –Catenin karmaşık.[2]Hücre içi ile kompleksler oluşturarak Catenin proteinler, nöral kadherinler (N-kadherinler ) sinaptik aktivite arasında bir bağlantı görevi görür ve sinaptik plastisite öğrenme ve hafıza süreçlerinde önemli roller oynarlar.
N-kadherinlerin LTP'ye ve öğrenme ve hafızanın altında yatan sinaptik değişikliklere aracılık etmede rol oynadığına inanılmaktadır. Embriyonik gelişim sırasında, kadherinler başlangıçta geniş çapta dağıtılır, ancak yavaş yavaş sinaptik öncesi ve sonrası sitelere daha yerel hale gelirken sinapslar oluşuyor.[3] Kaderin fonksiyonunun belirli proteinlerle bloke edilmesi, bazal sinaptik özellikleri etkilemez, ancak LTP'nin indüksiyonunu bozabilir.[4]
Yapısal fonksiyon ve yapışma
Kaderin-katenin kompleksinin yapısı
N-kadherinler, CNS sinapslarının çoğunda eksprese edilen transmembran proteinlerdir.[5] N-kadherinler en yaygın olarak hem presinaptik aktif bölge hem de postsinaptik yoğunluk (PSD) bölgelerinde eksprese edilir ve hem hücre dışı Ca2 + bağlanma alanlarını hem de protein partnerlerini bağlamak için hücre içi alanları içerir. Kadherinler için ortak bir bağlanma ortağı, hücre içi katenin proteinleridir, özellikle üç farklı alt tip, a-kateninler, p-kateninler ve p120ctn ailesi kateninleridir. P-kateninler ve p120ctns, kadherinin hücre içi alanını sırasıyla distal ve proksimal bölgelerde bağlar.[6]α-kateninler, monomerik formda olduklarında, kaderin-katenin kompleksi ile β-kateninler yoluyla birleşirler. α-kateninler, β-kateninlere bağlanmazlar, ancak tercihen F-aktin ve F-aktin polimerizasyonunu destekleyen diğer proteinleri bağlarlar. .[7]Her katenin alt tipi ve kadherinlerle etkileşimi, sinaptik plastisite ve omurga yapısının aracılığında farklı bir rol oynar.
Yapışma düzenlenmesi
Kanıtlar, N-Kadherinlerin presinaptik terminal ile postsinaptik omurga arasındaki bağlantıyı stabilize ettiğini göstermektedir. [8] ve bu stabilizasyon Salınan glutamatın postsinaptik nöron üzerindeki reseptörlere bağlanma olasılığını artırır.[9] Sinaptik aktivitenin temel seviyelerinde, N-kadherinler büyük ölçüde monomerlerdir ve bu nedenle sinapsın karşı tarafındaki hücrede bulunan kadherinlere zayıf bir şekilde yapışırlar. NMDAR'lar yoluyla Ca2 + akışı, N-kadherinlerin dimerizasyonunu destekler. Dimerize kadherinler, presinaptik kaderin partnerlerine kolayca bağlanır. Bloke edici antikorlar yoluyla N-kaderin bağlanmasının inhibisyonu, geç faz L-uzun vadeli potensiasyonun indüksiyonunu önler,[10] dimerik N-kaderinin yapışkan özelliğinin geç faz L-LTP için gerekli olduğunu ileri sürerek, presinaptik aksonun KCl depolarizasyonu hem N-kadherinlere proteaz direnci sağlar hem de onları sinaptik puncta'daki orijinal kümelenmelerinden PSD boyunca dağıtır.[11] böylece hücre yapışması için etkinliklerini arttırır.
N-kaderin adezyonu, AMPAR-aktivasyonla indüklenen omurga başı genişlemesini sağlayarak sinapsı daha da stabilize eder.[12] Bu morfolojik değişiklik, halihazırda var olan sinaptik bağlantılar tarafından tutulan bilgileri tehlikeye atabilecek daha fazla sinaptik modifikasyonları önlemeye yardımcı olur. Omurga başı genişlemesi, NMDAR / AMPAR oranını düşürerek, orantılı olarak daha küçük bir kalsiyum akışı oluşturarak ve omurgadan daha hızlı kalsiyum difüzyonuna izin vererek bunu başarır. Kalsiyumun hızlı bir şekilde uzaklaştırılması, sinaptik gücü daha da değiştirecek olan translasyon sonrası değişiklikleri başlatmasını engeller.[13] Yapışma kabiliyetine sahip olmayan bir N-kaderin mutantının aşırı ekspresyonu, omurga başı genişlemesini önleyerek bu süreçte N-kadherinin temel rolünü gösterir.[12]
Kaderin yüzey seviyelerinin, devir hızının ve stabilitenin düzenlenmesi
Düzenleme mekanizmaları, sentez gereksinimleri ve zamansal başlatmaları bakımından farklılık gösterir.[8][14] Kaderin regülasyonunun bir modu, protein sentezinden bağımsız oldukça hızlı bir süreç olan (aktiviteden yaklaşık 100 dakika sonra meydana gelen) yüzey stabilizasyonudur.
NMDAR aktivitesi, tyr-654'te β-katenin fosforilasyonunu azaltır, böylece N-kadherini inhibe eder endositoz ve yüzey tutmayı ve ifadeyi kolaylaştırmak.[8][15]
Yüzey ifadesi ayrıca şu şekilde düzenlenir: Protocadherin aracılı yapışma. Protocadherin-alpha ve protocadherin-gamma, her bir kaderin alt tipinin yüzey ekspresyonunu artıran bir protein kompleksi oluşturmak için etkileşime girer.[16]
Kadherin ekspresyonu, yüzey stabilizasyonundan çok daha sonra (uyarandan ortalama 4 saat sonra) meydana gelen aktivite kaynaklı içselleştirme ile de düzenlenir. İçselleştirme, protein sentezine bağlıdır ve p120 katenin proteinleri (p120ctn), kadherinlerin sinapstaki yapışkan bağlantılara dönüşümünde, bozulmasında ve "kümelenmesinde" rol oynar.[17] P120 ctn proteinlerinin ya nöral kadherinlerin endositozunu inhibe ettiği ya da kaderin döngüsünü kontrol etmek için hücre yüzeyinde hareket ettiği düşünülmektedir.[17][18][19] P120 ctn'nin aşağı regülasyonu, daha fazla kaderin endositoza yol açar ve sinaptik öncesi ve sonrası nöron arasındaki yapışmayı önler.[18] Bu tür kanıtlar, p120'nin kaderin stabilitesi için gerekli olduğunu kuvvetle göstermektedir.
Bağlama ve sinyal verme
Hücre içi bağlanma ortakları
β-katenin, presinaptik bölgelerde rezerv havuz veziküllerini (RPV'ler) lokalize eder.[20]-Katenin in vivo delesyonu, sinaptik bölgede lokalize olan RPV'lerin sayısında bir azalmaya ve akson boyunca dağılmış RPV'lerde bir artışa neden olur. Dahası, RPV'ler, B-katenin nakavtlarında presinaptik nöronun sürekli uyarılma dizilerine yanıt vermedi. B-katenin'in bu etkisi, kaderin aracılı adezyondan bağımsızdır ve bunun yerine Veli gibi PDZ bağlayıcı proteinler tarafından kadherine modüle edilir. Bunlara ek olarak, BDNF /TrkB sinyal yol açar fosforilasyon Y654 bölgesinde β-katenin'in, β-katenin-kaderin kompleksinin çözünmesine ve sonuç olarak artmasına neden olan sinaptik vezikül hareketlilik.[21]Kateninler ayrıca birçok yapı iskeleti proteinini, reseptörünü, kinazı ve fosfatazı bağlar. Örneğin, kaderin-α-katenin kompleksi aktin hücre iskeletini bağlar, ancak bağlanan proteinlerle mi yoksa doğrudan etkileşimlerle mi bağlandığı bilinmemektedir.[22]
Sinyal iletim yolları

p120ctn sinyalleri guanin nükleotid değişim faktörleri (GEF'ler) ve GAP'ler etkinleştirmek için GTPazların Rho ailesi. Omurga yoğunluğunu ve uzunluğunu korumak için RhoA P120ctn tarafından inhibe edilmelidir. Rac (GTPase) inhibisyon, p120ctn eksikliğinde omurga yoğunluğunun azalmasını düzeltir.[23][24]E-kaderin p120ctn'ye bağlanması SRC'yi aktive ederek Rac1'in aktivasyonuna yol açabilir ve bu da LIMK1 ve G-aktin polimerizasyonuna neden olan kofilini devre dışı bırakmak için LIMK2. Bu arada, fosforilasyon PI3K SRC, RhoA'yı aktive ederek kofilin-P'nin aktivasyonuna ve filamentli aktinin bozulmasına yol açar.[25]WAVE-1 geni farelerde bozulduğunda, öğrenmede kayıplar ve Rac yolunun WAVE-1 dalını içeren hafıza kaybı gibi bilişsel kusurlarla sonuçlandı.[26]Bir in vivo dentat girus LTP modeli kullanılarak, LTP indüksiyonunun F-'de bir artışla ilişkili olduğu gösterilmiştir.aktin dendritik dikenlerde ve bu uzun süreli bir değişikliktir. Bu etki için NMDA reseptör aktivasyonunun gerekli olduğu gösterilmiştir. Ayrıca, kullanımı latrunculin A, bu modelde geç faz LTP'yi bozabilmiştir, bu da yine aktin yeniden modellenmesinin LTP için gerekli olduğunu düşündürmektedir.[27]
Hücresel işlev
Alıcı kaçakçılığında / istikrarda rol
Glutamat reseptörü bağlayıcı protein ABP ve p120ctn birlikte ifade edildiğinde, anti-p120ctn serumu, hücre lizatlarından her iki proteini içeren bir kompleksi çıkarır. Aynısı, GRIP adı verilen ABP'ye benzer bir protein için de geçerlidir. cDNA taraması ve maya çiftleşmesi tahliller göstermek PDZ alanı - p120ctn C-terminalindeki bağlama motifi, bu tür etkileşimlere imkan verir. Ortak IP veriler, p120ctn'nin kaderin ve ABP veya GRIP ile aynı anda kompleks yapabileceğini göstermektedir. ABP ve GRIP ile etkileşime girmeyen baskın negatif p120ctn fragmanları, stabilizasyonunu bozmuştur. GluR2 ve GluR3 AMPAR alt birimleri sırasıyla hücre zarı. P120ctn'nin PSD-95 ile birlikte lokalizasyonu, kadherin-p120ctn-ABP / GRIP komplekslerinin AMPAR'ları postsinaptik yoğunluk, ancak perisinaptik bölgelerde de ankrajın meydana gelip gelmediği açık değildir.[28]
Gen ifadesinin düzenlenmesi
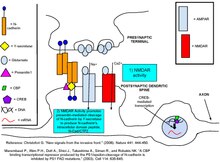
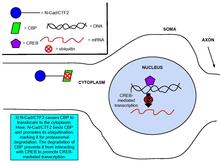
Kadherinlerin ve kateninlerin, sinaptik plastisitede önemli bir süreç olan gen ekspresyonunun düzenlenmesinde rol oynadığı gösterilmiştir.[8] NMDA'ya glutamat bağlanması, NMDA tarafından bloke edilen bir etki olan N-kaderin hücre içi alan peptidi olan N-cad / CTF2 üretimini yukarı düzenler. reseptör antagonisti, APV. Transfeksiyon N-cad / CTF2, nükleer CBP'yi (CREB bağlayıcı protein ) ve artar sitozolik CBP. Ayrıca, CBP ile N-cad / CTF2 ko-immünopresipitatlar ve N-cad / CTF2'nin transfeksiyonu, CBP kararlı durum seviyelerini düşürerek sonuç olarak CREB -kapsamak DNA karmaşık oluşum [29] (Sağdaki şekillere bakın).
İfadesi lenfoid güçlendirici bağlayıcı faktör 1 (LEF-1),-katenin'in çekirdek, transkripsiyonu yukarı düzenlediğinde ve N-kaderin veya a-katenin transfeksiyonu bu etkiyi tersine çevirir.[30] Ek olarak, nöronları NMDAR ile tedavi etmek agonist β-katenin bölünmesine neden olur N-terminal, ve C terminali fragmanlar, transfeksiyon deneylerinin gösterdiği gibi, p-katenin'in T hücre faktörüne (TCF) bağlı transkripsiyonu arttırdığı nükleusa translokasyon yapar.[31]
Referanslar
- ^ Bliss, TVP; Collingridge GL (1993). "Sinaptik bellek modeli: hipokampusta uzun vadeli güçlendirme". Doğa. 361 (6407): 31–39. Bibcode:1993 Natur.361 ... 31B. doi:10.1038 / 361031a0. PMID 8421494.
- ^ Schrick, Christina; Fischer, Andre; Srivastava, Deepak P .; Tronson, Natalie C .; Penzes, Peter; Radulovic, Jelena (Eylül 2007). "N-Cadherin Hücre İskeletiyle İlişkili IQGAP1 / ERK Sinyalizasyonunu ve Hafıza Oluşumunu Düzenliyor". Nöron. 55 (5): 786–798. doi:10.1016 / j.neuron.2007.07.034. PMC 2064867. PMID 17785185.
- ^ Benson, Deanna L .; Tanaka, Hidekazu (1 Eylül 1998). "Hipokampal Nöronlarda Sinaptogenez sırasında N-Kadherin Yeniden Dağıtımı". Nörobilim Dergisi. 18 (17): 6892–6904. doi:10.1523 / JNEUROSCI.18-17-06892.1998. PMID 9712659.
- ^ Tang, L; Hung CP; Schursan EM (1998). "Hipokampal uzun vadeli güçlenmede kaderin hücre adezyon moleküllerinin ailesi için bir rol". Nöron. 17 (3): 423–434. doi:10.1016 / S0896-6273 (00) 80175-0. PMID 8816706.
- ^ Yagi, T; Takeichi, M (15 Mayıs 2000). "Kadherin süper aile genleri: fonksiyonlar, genomik organizasyon ve nörolojik çeşitlilik". Genler ve Gelişim. 14 (10): 1169–80. doi:10.1101 / gad.14.10.1169. PMID 10817752.
- ^ Sharpio, L; Sevgiler, J; Colman, DR (2007). "Sinir sistemindeki yapışma molekülleri: işlev ve çeşitliliğe ilişkin yapısal bilgiler". Annu. Rev. Neurosci. 30: 451–474. doi:10.1146 / annurev.neuro.29.051605.113034. PMID 17600523.
- ^ Yamada, S; Pokutta, S; Drees, F; Weis, WI; Nelson, WJ (2005). "Kaderin-katenin-aktin kompleksini yeniden yapılandırmak". Hücre. 123 (5): 889–901. doi:10.1016 / j.cell.2005.09.020. PMC 3368712. PMID 16325582.
- ^ a b c d Arikkath, Jyothi; Louis F. Reichardt (2008). "Sinapslardaki kadherinler ve kateninler: sinaptogenez ve sinaptik plastisitede roller". Trendler Neurosci. 31 (9): 487–494. doi:10.1016 / j.tins.2008.07.001. PMC 2623250. PMID 18684518.
- ^ Rudy Jerry (2008). Öğrenme ve hafızanın nörobiyolojisi. Sinauer Associates, Inc. Yayıncılar. ISBN 978-0-87893-669-4.
- ^ Bozdago, O; Shan, W; Tanaka, H; Benson, DL; Huntley, GW (2000). "Geç faz LTP sırasında artan sayıda sinaptik puncta: N-kaderin sentezlenir, sinaptik bölgelere alınır ve kuvvetlendirme için gereklidir". Nöron. 28 (1): 245–259. doi:10.1016 / S0896-6273 (00) 00100-8. PMID 11086998.
- ^ Tanaka, H; Shan, W; Phillips, GR; Arndt, K; Bozdağı, O; Shapiro, L; Huntley, GW; Benson, DL; Colman, DR (2000). "Sinaptik aktiviteye yanıt olarak N-kaderin moleküler modifikasyonu". Nöron. 25 (1): 93–107. doi:10.1016 / S0896-6273 (00) 80874-0. PMID 10707975.
- ^ a b Okamura, K (2004). "Aktiviteye bağlı omurga yeniden şekillenmesi için kaderin aktivitesi gereklidir". J. Hücre Biol. 167 (5): 961–972. doi:10.1083 / jcb.200406030. PMC 2172468. PMID 15569714.
- ^ Hayashi, Y; Majewska, AK (2005). "Dendritik Omurga Geometrisi: Fonksiyonel Uygulama ve Düzenleme". Nöron. 46 (4): 529–532. doi:10.1016 / j.neuron.2005.05.006. PMID 15944122.
- ^ Gumbiner, B.M (2000). "Kadherin Yapıştırıcı Aktivitesinin Yönetilmesi". J. Hücre Biol. 148 (3): 399–404. doi:10.1083 / jcb.148.3.399. PMC 2174801. PMID 10662767.
- ^ Coscoy, Sylvie; Gueudry, C .; Amblard, F .; Coscoy, S. (2008). "Olgun adherens bağlantı noktalarında E-kaderin yeniden dağıtımı için endositoz gereklidir". PNAS. 106 (17): 7010–15. doi:10.1073 / pnas.0811253106. PMC 2678428. PMID 19372377.
- ^ Murata, Y; Hamada, S; Morishita, H; Mutoh, T; Yagi, T (2004). "Protocadherin-gamma ile etkileşim, protocadherin-alpha'nın hücre yüzeyi ekspresyonunu düzenler". J. Biol. Kimya. 279 (47): 49508–16. doi:10.1074 / jbc.M408771200. PMID 15347688.
- ^ a b Reynolds, Albert B .; Carnahan, Robert H. (Aralık 2004). "Kaderin stabilitesi ve cirosunun p120ctn ile düzenlenmesi: hastalık ve kanserdeki etkileri". Hücre ve Gelişim Biyolojisi Seminerleri. 15 (6): 657–663. doi:10.1016 / j.semcdb.2004.09.003. PMID 15561585.
- ^ a b Davis, MA; Ireton, RC; Reynolds, AB (2003). "Kaderin cirosunda p120-katenin için temel bir işlev". J. Hücre Biol. 163 (3): 525–534. doi:10.1083 / jcb.200307111. PMC 2173649. PMID 14610055.
- ^ Xiao, Kanyan; Allison, DF; Buckley, KM; Kottke, MD; Vincent, PA; Faundez, V; Kowalczyk, AP (2003). "P120 katenin'in hücresel seviyeleri, mikrovasküler endotel hücrelerinde kaderin ekspresyon seviyeleri için bir ayar noktası olarak işlev görür". J. Hücre Biol. 163 (3): 535–545. doi:10.1083 / jcb.200306001. PMC 2173638. PMID 14610056.
- ^ Bamji, Shernaz X .; Shimazu, Kazuhiro; Kimes, Nikole; Huelsken, Joerg; Birchmeier, Walter; Lu, Bai; Reichardt, Louis F. (Kasım 2003). "Sinaptik Vesikül Lokalizasyonunda ve Presinaptik Montajda β-Catenin'in Rolü". Nöron. 40 (4): 719–731. doi:10.1016 / S0896-6273 (03) 00718-9. PMC 2757419. PMID 14622577.
- ^ Bamji, Shernaz X .; Rico, Beatriz; Kimes, Nikole; Reichardt, Louis F. (17 Temmuz 2006). "BDNF, sinaptik vezikülleri harekete geçirir ve kaderin-β-katenin etkileşimlerini bozarak sinaps oluşumunu artırır". Hücre Biyolojisi Dergisi. 174 (2): 289–299. doi:10.1083 / jcb.200601087. PMC 2064188. PMID 16831887.
- ^ Arikkath, J; Reichardt, LF (2008). "Sinapslardaki kadherinler ve kateninler". Trendler Neurosci. 31 (9): 487–494. doi:10.1016 / j.tins.2008.07.001. PMC 2623250. PMID 18684518.
- ^ Elia, Lisa P .; Yamamoto, Miya; Zang, Keling; Reichardt, Louis F. (Temmuz 2006). "p120 Catenin, Rho Ailesi GTPazlar ve Kadherinler aracılığıyla Dendritik Omurga ve Sinaps Gelişimini Düzenliyor". Nöron. 51 (1): 43–56. doi:10.1016 / j.neuron.2006.05.018. PMC 2587166. PMID 16815331.
- ^ Ohkubo, T; Ozawa, M. (1999). "p120ctn, E-kaderin Sitoplazmik Alanının Membran-proksimal Bölgesine Bağlanır ve Yapışma Aktivitesinin Modülasyonunda Yer Almaktadır". J. Biol. Kimya. 274 (30): 21409–21415. doi:10.1074 / jbc.274.30.21409. PMID 10409703.
- ^ Taylor, Matthew P .; Koyuncu, Orkide O .; Enquist Lynn W. (27 Nisan 2011). "Viral enfeksiyon sırasında aktin hücre iskeletinin bozulması". Doğa İncelemeleri Mikrobiyoloji. 9 (6): 427–439. doi:10.1038 / nrmicro2574. PMC 3229036. PMID 21522191.
- ^ Soderling, S. H .; Langeberg, L. K .; Soderling, J. A .; Davee, S. M .; Simerly, R .; Raber, J .; Scott, J. D. (10 Şubat 2003). "WAVE-1 kaybı, farelerde duyu-motor gecikmesine ve öğrenme ve hafızanın azalmasına neden olur". Ulusal Bilimler Akademisi Bildiriler Kitabı. 100 (4): 1723–1728. Bibcode:2003PNAS..100.1723S. doi:10.1073 / pnas.0438033100. PMC 149900. PMID 12578964.
- ^ Fukazawa, Yugo; Saitoh, Yoshito; Ozawa, Fumiko; Ohta, Yasuhiko; Mizuno, Kensaku; Inokuchi, Kaoru (Mayıs 2003). "Hipokampal LTP'ye, Vivo'da Geç LTP Bakımı için Gerekli Olan Dendritik Omurga içindeki Gelişmiş F-Aktin İçeriği Eşlik Eder". Nöron. 38 (3): 447–460. doi:10.1016 / S0896-6273 (03) 00206-X. PMID 12741991.
- ^ Silverman, J.B .; Restituito, S .; Lee-Edwards, L .; Khatri, L .; Ziff, E.B. (2007). "Nöral Plakofilinle İlişkili Kol Proteini - AMPA Reseptör Bağlayıcı Protein Kompleksleri Yoluyla Kadherinler Tarafından AMPA Reseptörlerinin Sinaptik Ankrajı". J. Neurosci. 27 (32): 8505–8516. doi:10.1523 / JNEUROSCI.1395-07.2007. PMC 6672939. PMID 17687028.
- ^ Marambaud, P; Wen PH; Dutt A; Shioi J; Takashima A .; Siman R; Robakis NK (2003). "N-kaderinin PS1 / epsilon klivajı tarafından üretilen bir CBP bağlayıcı transkripsiyonel baskılayıcı PS1 FAD mutasyonları tarafından inhibe edilir". Hücre. 114 (5): 635–645. doi:10.1016 / j.cell.2003.08.008. PMID 13678586.
- ^ Simcha, I; Shtutman M; Salomon D; Zhurinsky J; Sadot E; Geiger B; Ben-Ze’ev A (1998). "Β-Catenin ve Plakoglobinin Diferansiyel Nükleer Translokasyonu ve Transaktivasyon Potansiyeli". J. Hücre Biol. 141 (6): 1433–1448. doi:10.1083 / jcb.141.6.1433. PMC 2132796. PMID 9628899.
- ^ Abe, K; Takeichi M (2007). "NMDA-Reseptör Aktivasyonu, Gen Ekspresyonunu Tetiklemek İçin Kalpain Aracılı β-Katenin Bölünmelerini İndükler". Nöron. 53 (3): 387–397. doi:10.1016 / j.neuron.2007.01.016. PMID 17270735.
