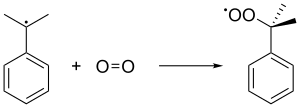Kümen süreci - Cumene process
kümen süreci (kümen-fenol süreci, Hock süreci) bir Endüstriyel süreç sentezlemek için fenol ve aseton itibaren benzen ve propilen. Terim kaynaklanıyor kümen (izopropil benzen), işlem sırasında ara malzeme. R. Ūdris ve P. Sergeyev tarafından 1942'de (SSCB) icat edildi.[1]ve bağımsız olarak 1944'te Heinrich Hock tarafından[2][3]
Bu süreç, iki nispeten ucuz başlangıç malzemesini dönüştürür, benzen ve propilen, daha değerli iki taneye, fenol ve aseton. Gerekli olan diğer reaktanlar oksijen havadan ve küçük miktarlarda radikal başlatıcı. Dünya çapındaki fenol üretiminin çoğu ve aseton artık bu yönteme dayanmaktadır. 2003 yılında kümen işlemiyle yaklaşık 7 milyon ton fenol üretildi.[4] Bu sürecin ekonomik olabilmesi için, aynı zamanda aseton yan ürünün yanı sıra fenol.[5]
Sürecin adımları
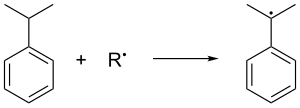
Kümen gaz fazında oluşur Friedel-Crafts alkilasyonu propilen ile benzen. Benzen ve propilen birlikte 30 ° C'lik bir basınca sıkıştırılır. standart atmosferler 250 ° C'de bir katalitik Lewis asidi. Fosforik asit genellikle tercih edilir alüminyum Halojenürler. Kümen havada oksitlenir ve bu da üçüncül benzilik kümenden hidrojen ve dolayısıyla bir kümen oluşturur radikal:
Kümen radikali o zaman tahviller Kümen vermek için bir oksijen molekülü ile peroksit radikal, sırayla oluşan kümen hidroperoksit (C6H5C (CH3)2Ö2H) başka bir kümen molekülünden bir benzilik hidrojeni soyutlayarak. Bu son kümen, kümen radikaline dönüşür ve daha sonraki kümen hidroperoksit zincir oluşumlarına geri beslenir. 5 basınç ATM kararsız peroksidin sıvı halde tutulmasını sağlamak için kullanılır.
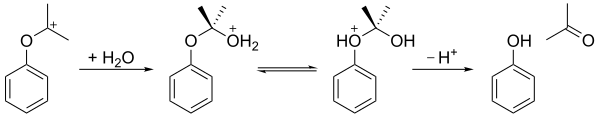
Kümen hidroperoksit daha sonra hidrolize içinde asidik orta ( İç dizinin yeniden düzenlenmesi) vermek fenol ve aseton. İlk adımda, terminal hidroperoksi oksijen atomu protonlanır. Bunu, fenil grubunun benzil karbondan komşu oksijene göç ettiği ve bir su molekülünün kaybolduğu ve bir rezonans stabilize üçüncül karbokatyon. Bu adımın uyumlu mekanizması, Baeyer-Villiger oksidasyonu[6] ve ayrıca oksidasyon aşaması hidroborasyon-oksidasyon.[7]2009'da asitlenmiş bentonit kilin, asit ortamı olarak sülfürik asitten daha ekonomik bir katalizör olduğu kanıtlanmıştır.
Aşağıda gösterildiği gibi, ortaya çıkan karbokatyon daha sonra su tarafından saldırıya uğrar, daha sonra bir proton hidroksi oksijenden eter oksijene aktarılır ve son olarak iyon fenol ve asetona ayrılır.
Aseton ortak üretimine alternatifler
Sikloheksilbenzen izopropilbenzenin yerini alabilir. Hock yeniden düzenlemesi yoluyla, sikloheksilbenzen hidroperoksit, fenol vermek üzere parçalanır ve siklohekzanon. Siklohekzanon, bazılarının önemli bir öncüsüdür. naylon çorap.[8]
Benzenin karışımıyla alkilasyonu ile başlayarak 1 ve 2 butenler kümen işlemi fenol üretir ve butanon.[5]
Fenol üretimine alternatifler
- Hidrokinon benzenin propen ile dialkilasyonu ile hazırlanır. 1,4-diizopropilbenzen. Bu bileşik bis (hidroperoksit) vermek için hava ile reaksiyona girer. Davranışına benzer kümen hidroperoksit vermek için asitte yeniden düzenlenir aseton ve hidrokinon. Hidrokinonun oksidasyonu 1,4-benzokinon verir:[9]
- C6H4(CHMe2)2 + 2,5 O2 → C6H4Ö2 + 2 OCMe2 + H2Ö
- Resorsinol benzer şekilde dönüştürülerek hazırlanır 1,3-Diizopropilbenzen rezorsinol ve asetona parçalanan bis (hidroperoksit) içine.[10]
- 2-Naftol aynı zamanda kümen işlemine benzer bir yöntemle de üretilebilir.[11]
- 3-Klorofenol Fenolün klorlanmasıyla ortaya çıkmayan, klorobenzenin propilen ile alkilasyonu ile başlayan Kümen işlemi ile üretilebilir.[12]
Aseton işleme
Ham aseton sıvı fazda hidrojene edilir. Raney nikeli veya bakır ve krom oksit karışımı vermek izopropil alkol. Bu işlem, fazla aseton üretimi ile birleştiğinde faydalıdır.[13][1]
Mitsui & Co. için ek adımlar geliştirdi hidrojenleme aseton ürünü ve kurutmak izopropanol bir başlangıç reaktantı olarak geri dönüştürülen propene ürün.[5]
Ayrıca bakınız
- Bisfenol A
- Dow süreci
- Friedel Crafts alkilasyonu
- Baeyer-Villiger oksidasyonu
- Raschig-Hooker süreci (ayrıca fenol üretir)
Referanslar
- ^ http://izgudrojumi.lza.lv/izg_en.php?id=54
- ^ Hock, H. ve Lang, S. (1944), Autoxydation von Kohlenwasserstoffen, IX. Mitteil .: Über Peroxyde von Benzol-Derivaten. Berichte der deutschen chemischen Gesellschaft (A ve B Serisi), 77: 257–264 doi:10.1002 / cber.19440770321
- ^ Kısa Ansiklopedi Kimya (1993) Mary Eagleso
- ^ Manfred Weber, Markus Weber, Michael Kleine-Boymann "Fenol", Ullmann'ın Endüstriyel Kimya Ansiklopedisi 2004, Wiley-VCH'de. doi:10.1002 / 14356007.a19_299.pub2.
- ^ a b c "Fenole Giden Doğrudan Yollar". Arşivlenen orijinal 2007-04-09 tarihinde. Alındı 2006-12-26.
- ^ Streitwieser, A; Heathcock, C.H. (1992). "30". Organik Kimyaya Giriş. Kosower, E.M. (4. baskı). New York: MacMillan. pp.1018. ISBN 0-02-418170-6.
- ^ K.P.C., Vollhardt; N.E. Schore (2003). "22". Organik Kimya: Yapı ve İşlev (4. baskı). New York: Freeman. s. 988. ISBN 0-7167-4374-4.
- ^ Plotkin Jeffrey S. (2016-03-21). "Fenol Üretimindeki Yenilikler Neler?". Amerikan Kimya Derneği. Arşivlenen orijinal 2019-10-27 tarihinde. Alındı 2018-01-02.
- ^ Gerhard Franz, Roger A. Sheldon "Oksidasyon" Ullmann'ın Endüstriyel Kimya AnsiklopedisiWiley-VCH, Weinheim, 2000 doi:10.1002 / 14356007.a18_261
- ^ K.W. Schmiedel, D. Decker (2012). "Resorsinol". Ullmann'ın Endüstriyel Kimya Ansiklopedisi. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a23_111.pub2.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ Gerald Booth "Naftalen Türevleri", Ullmann'ın Endüstriyel Kimya Ansiklopedisinde, 2005, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a17_009.
- ^ François Muller, Liliane Caillard (2011). "Klorofenoller". Ullmann'ın Endüstriyel Kimya Ansiklopedisi. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a07_001.pub2.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ Baba, A. J. "Propanoller". Ullmann'ın Endüstriyel Kimya Ansiklopedisi. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a22_173.