Curacin A - Curacin A
 | |
| Tanımlayıcılar | |
|---|---|
| |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| ChemSpider | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Kimyasal ve fiziksel veriler | |
| Formül | C23H35NÖS |
| Molar kütle | 373.60 g · mol−1 |
| 3 boyutlu model (JSmol ) | |
| |
| |
| (Doğrulayın) | |
Curacin A melez poliketid sentaz (PKS) /ribozomal olmayan peptid sentaz (NRPS) türetilmiş doğal ürün izole edilmiş siyanobakteri Lyngbya majuscula.[1] Curacin A, jamaicamide, mupirocin ve Pederin alışılmadık bir terminali olan alken. Ek olarak, Curacin A dikkate değer bir tiazolin yüzük ve benzersiz siklopropil bileşiğin önemli olan kısmı biyolojik aktivite.[1][2] Curacin A, güçlü antiproliferatif olarak karakterize edilmiştir. sitotoksik birkaç için kayda değer antikanser aktivitesine sahip bileşik kanser böbrek, kolon ve meme kanseri dahil hatlar.[2][3] Curacin A'nın, hücre bölünmesi ve proliferasyonu için önemli bir süreç olan mikrotübül polimerizasyonunu inhibe eden, tubulin üzerindeki kolşisin bağlanma bölgeleri ile etkileşime girdiği gösterilmiştir.[1][4]
Biyosentez
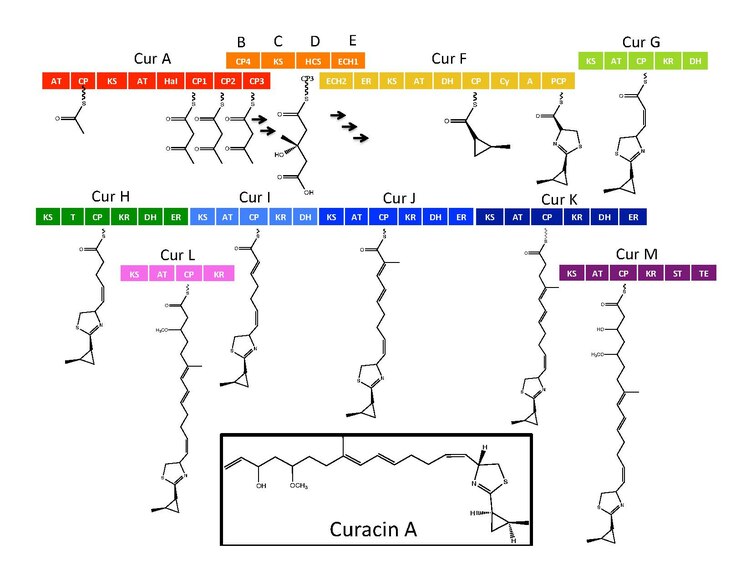
Sentetik enzimler Curacin A için 14 ile bir gen kümesinde bulunur açık okuma çerçeveleri (ORF'ler) CurN üzerinden CurA terminolojisi ile.[1] Yolun analizi, CurF'de bulunan bir NRPS / PKS hibrit modülünün, biri HMG-CoA CurD'de bulunan sentez kaseti ve yedi monomodüler PKS modülü.[1] CurA, GCN5 ile ilgili benzersiz bir N-asetiltransferaz (GNAT) yükleme alanı ve ilişkili bir asil taşıyıcı protein (ACP).[2] Yükleme modülü bir asetil grubunu ACP'ye bağlar ve daha sonra CurA'nın bitişik modülünde bulunan üç tandem ACP'den biri ile yoğunlaşır.[1][2][5] Bir hidroksimetilglutaril-CoA sentaz kaseti (mevalonat yolu), ACP1, ACP2 veya ACP3'ün aseto-asetil-ACP kısmının terminal ketidine bir malonil-CoA biriminin eklenmesiyle hidroksimetilglutaril asit oluşumunu katalize eder.[5] benzersiz bir hem bağımsız halojenaz (HaI) dahil olmak üzere sonraki enzimler, bir siklopropil halkasının oluşumunu katalize eder.[1][5][6] CurF üzerinde bulunan sisteine özgü bir NRPS modülü, siklopropil halkası oluşumundan sonra takip eder ve bir siklize yoğunlaşma alanının aktivitesinden dolayı, yoldaki önceki reaksiyonlardan sikopropil kısmına bağlanan bir tiyazol halkası oluşturur.[1][5][6] Büyümeyi genişletmek için yedi bağımsız PKS modülü izler poliketid zincirle S10 ve 13 pozisyonlarında meydana gelen -adenosil metiyonine (SAM) bağımlı metilasyonlar.[1] Nihai curacin sentaz modülü tarafından bir sülfotransferazı içeren nadir bir boşaltma stratejisi kullanılır. Sülfotransferaz, dekarboksilasyon ve terminal alken oluşumu için molekülü aktive eden karbon 15'in hidroksil grubunu sülfat eder.[7]
Siklopropil halka oluşumu
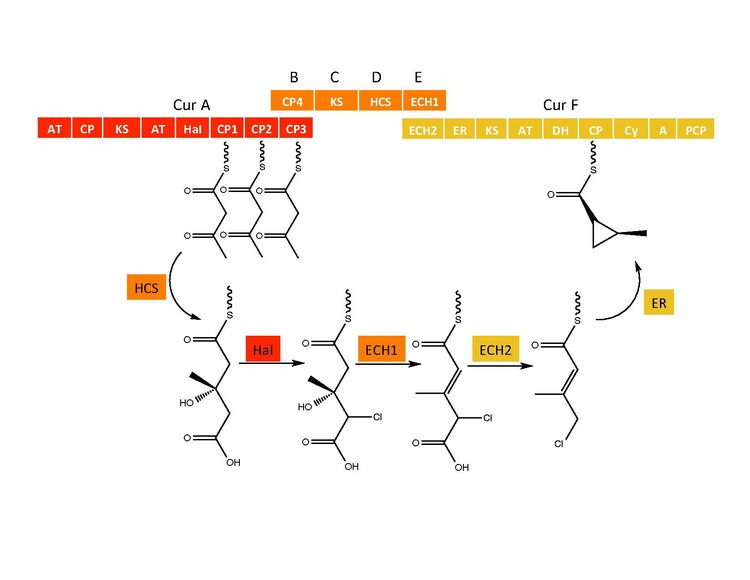
CurB (ACP), CurC (ketosentaz) ve CurD (HMG-CoA redüktaz), (S) HMG-ACP3 oluşumundan sorumludur.[6] CurA geninden HaI, aktifleştirilmemiş bir karbon atomuna bir klor atomu eklemek için sözde bir Fe (IV) = O ara ürününden geçen benzersiz bir hem olmayan halojenazdır.[6] Klorlamadan sonra ECH1, HMG-ACP3'ten 3-metilgultaconyl-ACP3'e bir dehidratat olarak hareket eder ve ECH2 gerekli dekarboksilasyonu gerçekleştirir.[6] Son olarak, ikame benzeri bir mekanizmadan geçtiği iddia edilen alışılmadık bir ER katalizli siklizasyon reaksiyonu, siklopropan halkasını oluşturur.[6] Eklenen klor atomu, dekarboksilasyon adımına yardımcı olur ve muhtemelen siklopropan halka oluşumu sırasında ayrılan grup olarak hizmet eder.[6]
Referanslar
- ^ a b c d e f g h ben Chang Z, Sitachitta N, Rossi JV, Roberts MA, Flatt PM, Jia J, ve diğerleri. (Ağustos 2004). "Tropikal deniz cyanobacterium Lyngbya majuscula'dan bir antitubulin doğal ürünü olan curacin A'nın biyosentetik yolu ve gen kümesi analizi". Doğal Ürünler Dergisi. 67 (8): 1356–67. doi:10.1021 / np0499261. PMID 15332855.
- ^ a b c d Gu L, Geders TW, Wang B, Gerwick WH, Håkansson K, Smith JL, Sherman DH (Kasım 2007). "Poliketid zincir başlatma için TBMM benzeri strateji". Bilim. 318 (5852): 970–4. Bibcode:2007Sci ... 318..970G. doi:10.1126 / science.1148790. PMID 17991863.
- ^ Verdier-Pinard P, Lai JY, Yoo HD, Yu J, Marquez B, Nagle DG, vd. (Ocak 1998). "Güçlü kolşisin bölgesi antimitotik ajan olan curacin A'nın tubulin ile etkileşiminin yapı-aktivite analizi ve analogların MCF-7 göğüs kanseri hücrelerinin büyümesi üzerindeki etkileri". Moleküler Farmakoloji. 53 (1): 62–76. doi:10.1124 / mol.53.1.62. PMID 9443933.
- ^ Blokhin AV, Yoo HD, Geralds RS, Nagle DG, Gerwick WH, Hamel E (Eylül 1995). "Deniz siyanobakteriyel doğal ürünü curacin A'nın tubulinin kolşisin bölgesi ile etkileşiminin karakterizasyonu ve analoglarla ilk yapı-aktivite çalışmaları". Moleküler Farmakoloji. 48 (3): 523–31. PMID 7565634.
- ^ a b c d Gu L, Eisman EB, Dutta S, Franzmann TM, Walter S, Gerwick WH, ve diğerleri. (Mart 2011). "Kurasin biyosentetik yolundaki ardışık asil taşıyıcı proteinler, sinerjistik bir etkiyle ardışık çoklu enzim reaksiyonlarını teşvik eder". Angewandte Chemie. 50 (12): 2795–8. doi:10.1002 / anie.201005280. PMC 3081611. PMID 21387490.
- ^ a b c d e f g Gu L, Wang B, Kulkarni A, Geders TW, Grindberg RV, Gerwick L, vd. (Haziran 2009). "Poliketid çeşitlendirmesinde metamorfik enzim topluluğu". Doğa. 459 (7247): 731–5. Bibcode:2009Natur.459..731G. doi:10.1038 / nature07870. PMC 2918389. PMID 19494914.
- ^ McCarthy JG, Eisman EB, Kulkarni S, Gerwick L, Gerwick WH, Wipf P, vd. (Aralık 2012). "Karmaşık metabolik yollarda sülfotransferazlar tarafından fonksiyonel grup aktivasyonunun yapısal temeli". ACS Kimyasal Biyoloji. 7 (12): 1994–2003. doi:10.1021 / cb300385m. PMC 3528841. PMID 22991895.
