Histidin fosfotransfer alanı - Histidine phosphotransfer domain - Wikipedia
| Histidin fosfotransfer alanı | |||||||||
|---|---|---|---|---|---|---|---|---|---|
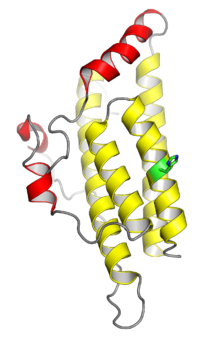 kristal yapı maya histidin fosfotransferaz proteini Ypd1. Sarı ile gösterilen dört sarmal, korunan dört sarmallı demet monomerik HPt alanları için tipik; kırmızıyla gösterilen sarmallar Ypd1'e özgü eklemelerdir. Histidin fosforilasyon bölgesi yeşil renkte gösterilmiştir. Nereden PDB: 1C02.[1] | |||||||||
| Tanımlayıcılar | |||||||||
| Sembol | Hpt | ||||||||
| Pfam | PF01627 | ||||||||
| InterPro | IPR008207 | ||||||||
| AKILLI | HPT | ||||||||
| PROSITE | PS50894 | ||||||||
| |||||||||
| Histidin fosfotransferaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Kristal yapısı Caulobacter crescentus histidin fosfotransferaz proteini ChpT dimerik formda. Sarı renkte gösterilen dört sarmal, korunmuş dört sarmallı demeti içerir ve histidin fosforilasyon bölgeleri yeşille vurgulanmıştır. Kırmızı ve ten rengi olarak gösterilen alanlar, histidin kinazların ATP bağlama alanlarına benzeyen, ancak ATP'ye bağlanmayan veya hidrolize etmeyen sözde CA alanlarıdır. Nereden PDB: 4FMT.[2] | |||||||||
| Tanımlayıcılar | |||||||||
| Sembol | HPTransfase | ||||||||
| Pfam | PF10090 | ||||||||
| InterPro | IPR018762 | ||||||||
| |||||||||
Histidin fosfotransfer alanları ve histidin fosfotransferazlar (her ikisi de sıklıkla kısaltılır HPt) protein alanları "fosfor gecikmesi" şeklinde iki bileşenli düzenleyici sistemler. Bu proteinler bir fosforlanabilir histidin kalıntı ve transferinden sorumludur. fosforil grubu bir aspartat ara "alıcı" üzerindeki kalıntı alan adı, tipik olarak bir melezin parçası histidin kinaz finalde bir aspartata yanıt düzenleyici.
Fonksiyon
Ortodoks iki bileşenli sinyallemede, bir histidin kinaz protein otofosforilatlar bir histidin hücre dışı bir sinyale yanıt olarak kalıntı ve fosforil grubu sonradan bir aspartat a'nın alıcı alanındaki kalıntı yanıt düzenleyici. Fosfor gecikmelerinde, "hibrit" histidin kinaz, fosforil grubunun aktarıldığı bir dahili aspartat içeren alıcı alan içerir, bunun ardından fosforilabilir bir histidin içeren bir HPt proteini, fosforil grubunu alır ve son olarak bunu yanıt düzenleyiciye aktarır. Röle sistemi böylece His-Asp-His-Asp sırasına göre ilerler ve ikinci His Hpt tarafından katkıda bulunur.[3][4][5] Bazı durumlarda, bir fosfor geciktirme sistemi, dahili bir alıcı etki alanına sahip bir hibrid histidin kinaz yerine dört ayrı proteinden oluşturulur ve diğer örneklerde hem alıcı hem de HPt alanları histidin kinaz polipeptit zincirinde mevcuttur.[6]:198 İki bileşenli sistem alanı mimarisinin bir sayımı, bakterilerdeki HPt alanlarının, tek tek proteinlerden daha büyük proteinlerin alanları olarak daha yaygın olduğunu buldu.[4]
Yönetmelik
Ortodoks iki bileşenli sinyallemeye kıyasla fosfor geciktirme sisteminin artan karmaşıklığı, düzenleme için ek fırsatlar sağlar ve yanıtın özgünlüğünü geliştirir.[6]:192[7] Ortodoks iki bileşenli sistemler arasında çok az çapraz konuşma olmasına rağmen, fosfor gecikmeleri daha karmaşık sinyal yollarına izin verir; örnekler, birden çok aşağı akış çıkışı olan çatallı bir yolu içerir. Caulobacter crescentus ChpT HPt dahil Hücre döngüsü düzenleme[2] veya alternatif olarak, birden fazla histidin kinazın tek bir yanıt düzenleyiciyi kontrol ettiği yollar, örneğin sporlanma yol Bacillus subtilis karmaşık zamansal varyasyonlara neden olabilir.[8] Bilinen bazı durumlarda, fosfohistidinde ek bir düzenleme şekli vardır. fosfataz HPt üzerinde etki eden enzimler, örneğin Escherichia coli protein AltıA hangi hedefler ArcB.[6]:206
Yapısı

Histidin fosfotransfer işlevi, her ikisi de aşağıdakilerden oluşan en az iki farklı mimariye sahip proteinler tarafından gerçekleştirilebilir. dört sarmallı demet ancak paketin montaj şekli farklıdır. En yapısal olarak karakterize edilmiş HPt proteinleri, örneğin Hpt alanı Escherichia coli protein ArcB ve Saccharomyces cerevisiae protein Ypd1 demeti monomerler olarak oluşturun.[5][2] Daha az yaygın türde, örneğin Bacillus subtilis sporlanma faktör Spo0B ya da Caulobacter crescentus protein ChpT demet bir protein dimer histidin kinazların yapısına benzerlik gösterir.[7][2] Monomerik HPt alanları yalnızca bir fosforile edilebilir histidin kalıntısına sahiptir ve bir yanıt düzenleyici ile etkileşime girerken, dimerler iki fosforilasyon alanına sahiptir ve aynı anda iki yanıt düzenleyici ile etkileşime girebilir. Monomerik HPt alanlarının enzimatik kendi faaliyetlerine ve tamamen fosfat servis araçlarına göre hareket ederler,[10][4] dimerik Spo0B katalitik iken; alıcı yanıt düzenleyicisine fosfotransfer hızı, histidin fosfata kıyasla önemli ölçüde hızlandırılmıştır.[11] Bazı benzerlik gösteren ikinci bir alana sahip olmasına rağmen ATPase alanlar, dimerik HPt proteinlerinin ATP'yi bağladığı veya hidrolize ettiği ve diğer ATPazlarda bulunan anahtar kalıntılardan yoksun olduğu gösterilmemiştir.[2]
Monomerik ve dimerik formlar tespit edilebilir dizi benzerliği ve büyük olasılıkla evrimsel olarak ilişkili değildir; bunun yerine örnekler yakınsak evrim.[2] Dimerik HPt'ler muhtemelen dejenere histidin kinazlardan kaynaklansalar da, yapı üzerinde birkaç evrimsel kısıtlama olduğundan, monomerik HPt'lerin bir dizi farklı kökene sahip olması mümkündür.[3]
Dağıtım
İçinde bakteri iki bileşenli sinyallemenin son derece yaygın olduğu durumlarda, bilinen histidin kinazların yaklaşık% 25'i hibrit tiptedir. İki bileşenli sistemler çok daha nadirdir Archaea ve ökaryotlar ve daha düşük ökaryotlarda ve bitkilerde bulunur, ancak metazoanlar. Bilinen örnekler arasında, ökaryotik iki bileşenli sistemlerin tümü olmasa da çoğu hibrid kinaz fosfor gecikmeleridir.[3]
Bir biyoinformatik bakteri sayımı genomlar farklı bakterilerde tanımlanan (monomerik) HPt alanlarının sayısında büyük farklılıklar bulmuştur. filum bazı genomlar hiç HPts kodlamaz. Bir genomda bulunan histidin kinaz ve yanıt düzenleyicilerinin sayısına göre, ökaryotlar bakterilerden daha fazla tanımlanabilir HPt alanlarına sahiptir.[12] İçinde mantarlar, HPt proteinlerinin genomik envanteri, filamentli mantarlar genellikle daha fazla HPt proteinine sahip mayalar; iyi karakterize edilmiş olarak yalnızca biri kodlanmıştır Saccharomyces cerevisiae genetik şifre. Bitkiler genellikle birden fazla HPt'ye sahiptir, ancak yanıt düzenleyicilerden daha az HPt'ye sahiptir.[4][10]
Referanslar
- ^ Song HK, Lee JY, Lee MG, Moon J, Min K, Yang JK, Suh SW (Kasım 1999). "Saccharomyces cerevisiae'den Ypd1p'nin kristal yapısının ortaya çıkardığı ökaryotik çok aşamalı fosfor gecikmeli sinyal transdüksiyonuna ilişkin bilgiler". Moleküler Biyoloji Dergisi. 293 (4): 753–61. doi:10.1006 / jmbi.1999.3215. PMID 10543964.
- ^ a b c d e f Blair JA, Xu Q, Childers WS, Mathews II, Kern JW, Eckart M, Deacon AM, Shapiro L (Eylül 2013). "Temel bir bakteri hücre döngüsü fosfotransfer proteininin dallı sinyal kabloları". Yapısı. 21 (9): 1590–601. doi:10.1016 / j.str.2013.06.024. PMC 3787845. PMID 23932593.
- ^ a b c Capra EJ, Laub MT (2012). "İki bileşenli sinyal iletim sistemlerinin evrimi". Mikrobiyolojinin Yıllık İncelemesi. 66: 325–47. doi:10.1146 / annurev-micro-092611-150039. PMC 4097194. PMID 22746333.
- ^ a b c d Surujon D, Ratner DI (2016). "Histidin Fosfotransfer Alanı İçeren Proteinleri Tanımlamak İçin Olasılıksal Motif Aramasının Kullanımı". PLOS ONE. 11 (1): e0146577. Bibcode:2016PLoSO..1146577S. doi:10.1371 / journal.pone.0146577. PMC 4709007. PMID 26751210.
- ^ a b Xu Q, Carlton D, Miller MD, Elsliger MA, Krishna SS, Abdubek P, Astakhova T, Burra P, Chiu HJ, Clayton T, Deller MC, Duan L, Elias Y, Feuerhelm J, Grant JC, Grzechnik A, Grzechnik SK , Han GW, Jaroszewski L, Jin KK, Klock HE, Knuth MW, Kozbial P, Kumar A, Marciano D, McMullan D, Morse AT, Nigoghossian E, Okach L, Oommachen S, Paulsen J, Reyes R, Rife CL, Sefcovic N, Trame C, Trout CV, van den Bedem H, Weekes D, Hodgson KO, Wooley J, Deacon AM, Godzik A, Lesley SA, Wilson IA (Temmuz 2009). "Histidin fosfotransfer proteini ShpA'nın kristal yapısı, Caulobacter crescentus'ta sap biyogenezinin temel bir düzenleyicisi". Moleküler Biyoloji Dergisi. 390 (4): 686–98. doi:10.1016 / j.jmb.2009.05.023. PMC 2726009. PMID 19450606.
- ^ a b c Whitworth, David E. (2012). "Prokaryotlarda İki Bileşenli Düzenleme Sistemleri". Filloux'da Alain A.M. (ed.). Bakteriyel düzenleyici ağlar. Norfolk, İngiltere: Caister Academic Press. s. 191–222. ISBN 9781908230034.
- ^ a b Varughese KI (Nisan 2002). "Bakteriyel fosfor geciktirici proteinlerin moleküler tanıma". Mikrobiyolojide Güncel Görüş. 5 (2): 142–8. doi:10.1016 / s1369-5274 (02) 00305-3. PMID 11934609.
- ^ Salazar ME, Laub MT (Nisan 2015). "İki bileşenli sinyal yollarının zamansal ve evrimsel dinamikleri" (PDF). Mikrobiyolojide Güncel Görüş. 24: 7–14. doi:10.1016 / j.mib.2014.12.003. hdl:1721.1/105366. PMC 4380680. PMID 25589045.
- ^ Zhao X, Copeland DM, Soares AS, West AH (Ocak 2008). "Fosfor geciktirici protein YPD1 ile bir fosforil analoğuna bağlı SLN1'in yanıt düzenleyici alanı arasındaki bir kompleksin kristal yapısı". Moleküler Biyoloji Dergisi. 375 (4): 1141–51. doi:10.1016 / j.jmb.2007.11.045. PMC 2254212. PMID 18076904.
- ^ a b Fassler JS, West AH (Ağustos 2013). "Mantar iki bileşenli sinyal iletim yollarında histidin fosfotransfer proteinleri". Ökaryotik Hücre. 12 (8): 1052–60. doi:10.1128 / ec.00083-13. PMC 3754533. PMID 23771905.
- ^ Zapf J, Sen U, Hoch JA, Varughese KI (Ağustos 2000). "Bir kristal kafeste hapsolmuş iki fosfor geciktirme proteini arasındaki geçici bir etkileşim, sinyal iletiminde moleküler tanıma ve fosfotransfer mekanizmasını ortaya çıkarır". Yapısı. 8 (8): 851–62. doi:10.1016 / s0969-2126 (00) 00174-x. PMID 10997904.
- ^ Salvado B, Vilaprinyo E, Sorribas A, Alves R (2015). "HK, HPt ve RR alanlarına ve bunların iki bileşenli sistemlerde ve tam dizilimli genomlara sahip organizmaların fosfor geciktirici proteinlerinde organizasyonlarına ilişkin bir araştırma". PeerJ. 3: e1183. doi:10.7717 / peerj.1183. PMC 4558063. PMID 26339559.
