Ketene sikloklama - Ketene cycloaddition
Ketene döngüsel koşullar pi sisteminin tepkimeleri ketenler dört üyeli veya daha büyük halkalar sağlamak için doymamış bileşiklerle. Reaksiyonun [2 + 2], [3 + 2] ve [4 + 2] varyantları bilinmektedir.[1]
Giriş
Ketenler, dört üyeli veya daha büyük halkalar elde etmek için doymamış bileşiklerle reaksiyona girebilir. Bu fenomenin ilk örneği 1908'de gözlendi,[2] ve o zamandan beri, ketenlerin döngüsel yüklemeleri genişlemiş ve sentetik kullanım kazanmıştır. [2 + 2], [3 + 2] ve [4 + 2] siklo-katma örnekleri mevcuttur ve konjuge ketenler, [4 + 2] siklokatılmalarda da 4π ortak olarak hareket edebilir.[3] [2 + 2] keten siklo-ilavelerinin benzersiz geçiş durumu geometrisi, önemli stereokimyasal sonuçlara sahiptir (aşağıya bakınız).
(1)

Mekanizma ve Stereokimya
Hakim Mekanizma
Ketene siklokatımları uyumlu, [2 + 2] siklokatılma mekanizması ile ilerler. Çoğu alkenden farklı olarak ketenler hizalanabilir antarafasiyal olarak diğer alkenlere göre. Böylece, uyumlu, termal [2 + 2] siklo-katma için gereken suprafasiyal-antarafasiyal geometri, keten reaksiyonlarında elde edilebilir.[4] Bu geometri, keten üzerindeki daha hacimli ikame edicinin, siklobutanon halkasının sterik olarak daha engellenmiş yüzünde sona erme eğiliminde olmasıyla ilgili ilginç bir sonuca sahiptir. Siklizasyon için geçiş durumunda, küçük ikame edici alkene doğru işaret eder. Bu model aynı zamanda daha yüksek reaktiviteyi açıklar. cis alkenler trans [2 + 2] keten siklokasyonlarındaki alkenler.[5]
(2)
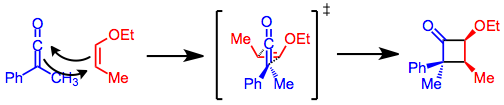
Olefinin konfigürasyonu, döngüsel katılma ürününde tutulur. Keten üzerinde elektron çeken sübstitüentler ve alken üzerinde sübstitüent veren sübstitüentler reaksiyonu hızlandırır,[6] ancak ikame edilmiş ketenler sterik engel nedeniyle yavaş reaksiyona girer.[7]
Enantioselektif Varyantlar
Şiral amin katalizörlerinin kullanımı, yüksek enantiyomerik fazlalıkta siklo katılma ürünlerine erişime izin vermiştir.[8]
(3)

Kapsam ve Sınırlamalar
Ketenler [2 + 2], [3 + 2] veya [4 + 2] (2π veya 4π bileşeni olarak) döngüsel koşullara katılabilir. Belirli bir reaksiyonun hassasiyeti hem ketenin hem de substratın yapısına bağlıdır. Reaksiyon, ağırlıklı olarak dört üyeli halkalar oluşturmak için kullanılsa da, sınırlı sayıda substrat ketenlerle [3 + 2] veya [4 + 2] reaksiyona girer. Her üç siklokatlama modunun örnekleri bu bölümde tartışılmaktadır.
Ketenler, ikame edilmiş siklobutanonları vermek için dimerize olabilir veya iki keten birbiriyle reaksiyona girebilir. Tepkimeye giren kesin çift bağlara bağlı olarak tipik olarak iki olası ürün vardır. İkame edilmiş ketenler yalnızca 1,3-siklobutanedion verir.[9]
(4)

Ketenler, siklobutanon sağlamak için alkenlerle reaksiyona girer. Ketenin kendi başına bir siklo-katma ürünü istenirse, tipik olarak diklorokin kullanılır, ardından çinko-bakır çifti ile halojenasyon giderilir.[10]
(5)

Siklik ve asiklik dienler genellikle Diels-Alder eklentilerinden çok siklobutanon verir. Siklik dienlerin reaksiyonlarında, daha büyük olan keten ikame edicisi, endo durum.[11] Fulvenler tipik olarak halkada reaksiyona girerek çift bağı sağlam bırakır.[12]
(6)
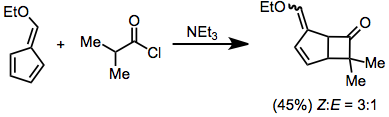
Ketenler,-laktonlar vermek için ketonlar ve aldehitlerle [2 + 2] siklo-ilaveye tabi tutulur. Karbonil bileşiği güçlü bir şekilde elektron çeken ikame edicilere sahip olmadığı sürece, bu işlem için Lewis asit katalizi gereklidir.[13]
(7)

[3 + 2] Döngüsel koşullar 1,3-çift kutuplu olabilir. Bu süreç uyumlu görünmektedir, ancak ketenlerin çift bağı reaksiyona giremez.[14]
(8)
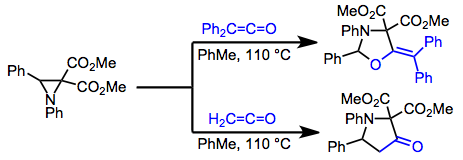
Tipik olarak [2 + 2] şeklinde reaksiyona giren veya [4 + 2] ürünlerin karmaşık karışımlarını sağlayan basit dienlerin aksine, heterodienlerin çoğu zaman [4 + 2] şeklinde reaksiyon gösterirler. Örneğin y-amino veya -alkoksi doymamış ketonlar, sentetik olarak yararlı lakton verimleri vermek için [4 + 2] anlamda ketenler ile reaksiyona girer.[15]
(9)
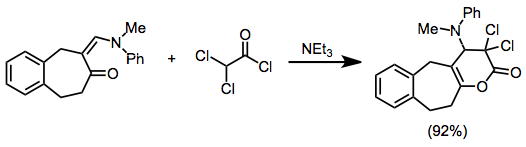
Bir vinilketenin 4p ortağı olarak görev yaptığı örnekler nadirdir, ancak asil ketenler gibi keten içeren heterodienlerin, heterosiklik ürünleri iyi bir verimle vermek için birçok heterodienofil ile reaksiyona girerler.[16]
(10)

Deneysel Koşullar ve Prosedür
Tipik Koşullar
Oda sıcaklığında sıvı olan reaktanlar ile döngüleme en iyi şekilde iki reaktantın çözücü olmadan karıştırılmasıyla gerçekleştirilir. Reaktiflerden biri gaz ise, bir çözücü kullanmak daha uygundur. Polar çözücüler ve katalizörler siklo katılmayı hızlandırmalarına rağmen, bunlar aynı zamanda dimerizasyonu da hızlandırdıkları için genel kullanıma sahip değildirler. Reaksiyonun ilerlemesi, ketenin karakteristik sarı renginin kaybolması, yaklaşık 2100 cm'de bant kaybı ile tahmin edilebilir.−1 kızılötesi spektrumda veya 1H NMR spektroskopisi. Keten, monoalkilketenler ve dimetilketenin genellikle oda sıcaklığında veya altında reaksiyona girmesine izin verilirken, daha yüksek moleküler ağırlıklı ketenler 100 ° 'nin üzerindeki sıcaklıklara kadar ısıtılabilir. Keten, dimerizasyon önemli bir yan reaksiyon olduğunda genellikle fazla kullanılır. Reaksiyonun başarısı genellikle ketenin nispi siklokatılma ve dimerizasyon oranları ile belirlenir.
Örnek Prosedür[17]
(11)

Argon atmosferi, karıştırıcı, geri akış kondansatörü ve sabit basınçlı ekleme hunisi ile donatılmış alevle kurutulmuş, 100 mL'lik üç boyunlu bir şişeye, 0.40 g (18 mmol) aktive edilmiş çinko, 0.576 g (6 mmol) 1-heptin yerleştirildi. ve 50 mL susuz eter. Bu karıştırılmış karışıma 1 saat içinde damla damla 1.79 g (12 mmol) fosfor oksiklorür (potasyum karbonattan yeni damıtılmış), trikloroasetil klorür (12 mmol) ve 10 mL susuz eter eklenmiştir. Karışım daha sonra geri akışta 4 saat karıştırıldı ve tortusal çinko, bir Celite pedi üzerinde süzülerek çıkarıldı. Eter solüsyonu su,% 5 sodyum bikarbonat solüsyonu ve tuzlu suyla yıkandı ve potasyum karbonat üzerinde kurutuldu. Eterin indirgenmiş basınç altında çıkarılmasından sonra ürün, berrak bir yağ halinde 1.08 g (% 90) başlık bileşiği verecek şekilde 100 ° banyo sıcaklığında (0.1 mm) ampulden hazneye damıtma yoluyla arıtıldı. IR νmax (düzgün) 1800, 1585 cm−1; 1H NMR (CDCl3) δ 6,12 (m, 1H, J = 2 Hz), 2,7 (t, 2H, J = 6 Hz), 2,0–0,7 (m, 9H). Anal. Calcd. C için9H13Cl2O: C, 52.19; H, 5,85. Bulunan: C, 52.10; H, 5,79.
Referanslar
- ^ Hyatt, J. A .; Reynolds, P. W. Org. Tepki. 1994, 45, 159. doi:10.1002 / 0471264180.or045.02
- ^ Frances Chick ve Norman Thomas Mortimer Wilsmore (1908) "Asetilketen: bir keten polimeridi" Kimya Derneği Dergisi, İşlemler, 93 : 946-950.
- ^ Staudinger, H. Die Ketene, Verlag von Ferdinand Enke, Stuttgart, 1912.
- ^ Moore, H. W .; Wilbur, D. S. J. Org. Chem. 1980, 45, 4483.
- ^ Rey, M .; Roberts, S .; Dieffenbacher, A .; Dreiding, A. S. Helv. Chim. Açta 1970, 53, 417.
- ^ Isaacs, N. S .; Stanbury, P.F. J. Chem. Soc., Chem. Commun. 1970, 1061.
- ^ Huisgen, R .; Mayr, H. Tetrahedron Lett. 1975, 2965.
- ^ Wynberg, H .; Bakıyorum, E. J. J. Am. Chem. Soc. 1982, 104, 166.
- ^ Tenud, L .; Weilenmann, M .; Dallwigk, E. Helv. Chim. Açta 1977, 60, 975.
- ^ McMurry, J. E .; Miller, D. D. Tetrahedron Lett. 1983, 24, 1885.
- ^ İngiltere, D. C .; Krespan, C.G. J. Org. Chem. 1970, 35, 3300.
- ^ Stadler, H .; Rey, M .; Dreiding, A. S. Helv. Chim. Açta 1984, 67, 1854.
- ^ Metzger, C .; Borrmann, D .; Wegler, R. Chem. Ber. 1967, 100, 1817.
- ^ Texier, F .; Taşıyıcı.; Jaz, J. J. Chem. Soc., Chem. Commun. 1972, 199.
- ^ Mosti, L .; Menozzi, G .; Bignardi, G .; Schenone, P. Il Farmaco (Ed. Sci.) 1977, 32, 794 [C.A. 1978, 88, 62262n].
- ^ Jäger, G .; Wenzelburger, J. Justus Liebigs Ann. Chem. 1976, 1689.
- ^ Hassner, A .; Dilon, J.L. J. Org. Chem. 1983, 48, 3382.
Dış bağlantılar
 İle ilgili medya Keten siklokasyonu Wikimedia Commons'ta
İle ilgili medya Keten siklokasyonu Wikimedia Commons'ta
