Yerinde lobüler karsinom - Lobular carcinoma in situ
| Yerinde lobüler karsinom | |
|---|---|
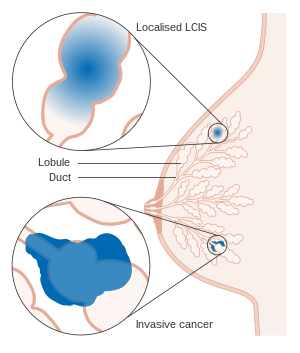 | |
| Lokalize ve invaziv LCIS'yi gösteren diyagram |
Lobüler karsinom yerinde (LCIS), karakteristik hücresel morfolojiye ve çok odaklı doku modellerine sahip tesadüfi bir mikroskobik bulgudur. Koşul bir laboratuvar teşhisi ve içindeki alışılmadık hücreleri ifade eder lobüller of meme.[1] Memenin temel işlevsel birimi olan terminal kanal-lobüler birimin (TDLU) lobülleri ve asinileri, yapıyı oluşturan hücrelerin anormal çoğalması nedeniyle bozulabilir ve genişleyebilir.[2] Bu değişiklikler, genel olarak adı verilen atipik epitel lezyonlarının bir spektrumunu temsil eder. lobüler neoplazi (LN).
LN'nin bir alt kümesi, histolojik olarak görülen belirli hücresel özelliklere ve doku değişikliklerine dayalı olarak LCIS olarak tanımlanabilir. Bu lezyonlardan önce atipik lobüler hiperplazi ve doğrusal bir ilerleme izleyebilir invaziv lobüler karsinom (ILC), spesifik genetik sapmalarla.[3] Bu süreç, duktal neoplazinin ilerlemesi ile çakışmaktadır. in situ duktal karsinom ve invazif karsinom. Nadiren, terminal kanallar lobüler neoplazide yer alabilir. pagetoid yayılmış.
Birçoğu LCIS'i gerçek bir durum olarak görmez kanser ancak ileride kanser riskinin arttığını gösterebilir.[4][5][6] 2018'de, Amerikan Kanser Ortak Komitesi'nin (AJCC) sekizinci baskısı, LCIS'i tümör evrelemesinden çıkardı ve onu iyi huylu bir varlık olarak değerlendirdi.[7]
Nedenleri
Genetik
Hem Atipik Lobüler Hiperplazi hem de LCIS dahil Lobüler Neoplazi (LN) hücreleri ve ILC, histolojik görünümdeki benzerliklerden kısmen sorumlu olan ortak genetik değişiklikleri paylaşır. Klasik LCIS ve invazif lobüler lezyonlar, düşük dereceli ER ve PR pozitif kanserlerdir ve neoplastik hücreler üzerinde Östrojen ve Progesteron reseptörlerinin pozitif ekspresyonuna (immünohistokimya ile belirlenir) atıfta bulunur.[8] Bu varlıkların her ikisi de HER2 (insan epidermal büyüme faktörü reseptörü 2) için klasik olarak negatiftir. Bu hormon ve büyüme faktörü reseptörleri, kemoterapi için hedefleri temsil ettikleri için klinik olarak önemlidir. Ayrıca, LCIS ve ILC arasında da tutarlı bir şekilde kromozomal değişiklikler gözlemlenmiştir - yani, 16q kaybı ve 1q kazancı, 16. kromozomun uzun kolunun (q olarak belirlenmiş) kaybına ve kromozom 1'in uzun kolunun ekstra bir kopyasına atıfta bulunur. , e-kaderin, zar ötesi protein arabuluculuk epitel Hücre adezyonu, LN hücrelerinde ifade kaybı gösterir ve P120 Catenin, sitoplazmik reaktivite sergiler.[9] Bu bulguların mekanizması, sitoplazmada normal olarak p120 katenin ile etkileşime giren E-kaderin ile açıklanmaktadır. E-kaderin kaybolduğunda, p120 kaderin neoplastik hücrelerin sitoplazmasında birikir ve böylece immünohistokimyasal testlerde pozitif bir reaksiyon oluşturur.[8]
LCIS, invaziv karsinomun bitişik alanıyla genellikle aynı genetik değişikliklere (örneğin, e-kaderin geninin yeri olan kromozom 16q'da heterozigotluk kaybı gibi) sahiptir.[9] Bu gözlemler, LCIS ve ILC hücreleri arasındaki klonal ilişkiler için genomik analiz ile birlikte, ILC'nin bir öncüsü olarak LCIS'i destekler ve daha geniş Lobüler Neoplazi (LN) kategorisi tarafından kapsanan lezyonların doğrusal bir ilerleme spektrumuna düştüğünü gösterir. LCIS genellikle invaziv karsinom odaklarıyla eşzamanlı olarak bulunur ve çok sayıda çalışma, genetik sıralama teknikleri kullanılarak, eşzamanlı LCIS ve ILC'nin klonal hücre popülasyonlarını paylaştığını veya aynı mutasyona uğramış hücrelerden kaynaklandığını göstermiştir.
Teşhis
Lobüler lezyonlar, güvenilir klinik korelasyonları olmayan tesadüfi bulgulardır. Şüpheli radyolojik bulgular gösteren rutin mamogramlar, radyolojik olarak görülen anormal alanda bir çekirdek iğne biyopsisini gerektirir ve histolojik olarak lobüler neoplazi gösterebilir veya göstermeyebilir.
Morfoloji

Klasik olarak, LCIS dahil LN, polarite kaybı ve göze çarpmayan sitoplazma ile monomorfik, dinamik, küçük, yuvarlak veya poligonal hücrelerin çoğalmasıyla TDLU'yu oluşturan asinin genişlemesi ve gerilmesi ile karakterize edilir. Esasen, lobül boşluklarını dolduran ve genişleten yuvarlak, neredeyse özdeş görünümlü hücre grupları, ara sıra bitişik terminal kanallara uzanır - buna Pagetoid uzantısı denir.[11] Atipik lobüler hiperplazi ve invazif lobüler karsinom hücreleri gibi, LCIS'nin anormal hücreleri de oval veya yuvarlak çekirdekli küçük hücrelerden ve birbirinden ayrılmış küçük nükleollerden oluşur.[12] Müsin taşlı yüzük içeren hücreler yaygın olarak görülmektedir. LCIS genellikle temel mimariyi olduğu gibi bırakır ve lobüller olarak tanınabilir. Estrojen ve progesteron reseptörler mevcuttur ve HER2 / neu LCIS'nin çoğu durumunda aşırı ifade yoktur.[3] Hücre sınırları belirsizdir ve ne mitotik aktivite ne de nekroz görülmez. Ek olarak, in situ ve invaziv lezyonlar, e-kaderin ekspresyonunun kaybolması (epitel hücre adezyonunda yer alan transmembran protein) nedeniyle karakteristik bir histolojik özellik olarak kabul edilen hücresel adezyon kaybı sergiler.[2] ALH ve LCIS sitolojik olarak ayırt edilemez, bu nedenle lezyonları her iki kategoriye göre sınıflandırmak için kantitatif bir eşik kullanılır. LCIS tanısı, ilgili lobüler birimdeki asinin yarısından fazlasının LN hücreleri ile doldurulmasını gerektirir ve asinin merkezi lümeni görünmemelidir.[13] Bu histolojik özellikleri karşılamayan LN hücrelerinin proliferasyonu, Atipik Lobüler Hiperplazi veya basitçe lobüler distansiyondur. Küçük derecelerde sitolojik varyasyon gözlemlenebilir ve sonraki alt tipler tanımlanmıştır. Bununla birlikte, bu alt tiplerin klinik yararlı olduğu gösterilmemiştir ve LCIS'in tam invazif karsinomaya ilerleyip ilerlemeyeceğine dair bir etkisi yoktur.[14]
İmmünohistokimya
Lobüler Karsinom In Situ histolojik olarak düşük dereceli Duktal Karsinomu In Situ olarak taklit edebilir. Bu senaryolarda, patologlar antiteleri ayırt etmek için immünohistokimyasal testler uygulayabilir.[3] Bu, hücreler üzerinde veya içinde ifade edilen hedef proteinlere bağlanmak için sentetik olarak geliştirilmiş işaretli antikorların kullanılmasını içerir. Spesifik olarak, LCIS'de, e-kaderin proteinini (veya yokluğunu) ve pl20 katenin proteinlerini hedefleyen antikorlar, LCIS'yi DCIS'den ayırmak için kullanılır. LCIS'in hücre membranlarında e-kaderin ekspresyonu eksikliği göstermesi ve ardından sitoplazmada p120 katenin oluşumu nedeniyle, e-kaderin için pozitif membran immünoreaktivitesi gösteren lezyonlar DCIS olarak teşhis edilir.[3]
Tedavi
Lobüler Karsinom In-situ, invaziv karsinomun hem bir risk faktörü hem de öncüsüdür. Dahası, zorunlu olmayan bir öncüdür. Başka bir deyişle, LCIS, kanserin gelişim yolunda, invazif karsinomayı garanti etmeyen ayrı bir varlığı temsil eder. Bununla birlikte, radikal mastektominin tarihsel yaklaşımı (tüm memenin ve koltuk altı lenf düğümlerinin cerrahi olarak çıkarılması) yerini daha konservatif yaklaşımlar almıştır.[2] LCIS'in infiltre edici veya invaziv karsinoma eşlik etmeden tek başına ortaya çıktığı tespit edilirse, gözlem tercih edilen tedavi seçeneğidir. LCIS, yakın muamele edilebilir klinik takip (sık programlı kontroller) ve mamografi tarama, tamoksifen veya kanser gelişme riskini azaltmak için ilgili hormon kontrol edici ilaçlar veya hastalar ve sağlayıcılar daha az muhafazakar bir seçenek isterse, iki taraflı profilaktik mastektomi.[13] Bazı cerrahlar, bilateral profilaktik mastektomiyi, belirli yüksek riskli vakalar dışında aşırı agresif tedavi olarak kabul eder.[11] Bu kısmen, birden fazla çalışmanın, gözetim uygulanan kadınlar ile mastektomi için seçilenler arasında meme kanserine bağlı ölümlerde önemli bir farklılık göstermemesinden kaynaklanmaktadır.
Lobüler Neoplazi veya özellikle LCIS, rutin çalışmalar sırasında çekirdek iğne biyopsisinde bulunduğunda, Ulusal Kapsamlı Kanser Ağı (NCCN), cerrahın patologların eşzamanlı DCIS veya invazif kanseri ekarte etmesine izin vermek için bölgeden eksizyonel bir biyopsi yapmasını önerir. Literatürde, çekirdek iğne biyopsisinde LCIS tanısı alan hastaların% 10-30'unun eksizyon sonrası ileri aşamalı bir tanı alacağı yaygın olarak bildirilmiştir.[13] LCIS, eksizyonel biyopsi sonrasındaki tek tanı olarak kalırsa, NCCN kılavuzları her 6-12 ayda bir yıllık tanısal mamogramlarla klinik takibi önermektedir.
Prognoz

Lobüler neoplazi, kanser öncesi kabul edilir ve LCIS, kadınlarda invazif meme kanseri gelişme riskinin artmasının bir göstergesidir (belirteç). Bu risk 20 yıldan fazladır. Riskin çoğu sonraki ile ilgilidir invaziv duktal karsinom yerine invaziv lobüler karsinom.[4]
Daha eski çalışmalar, artan invaziv kanser geliştirme riskinin her iki meme için de eşit olduğunu göstermiştir ve daha yeni çalışmalar, her iki memenin de invaziv kanser geliştirme riski yüksekken, aynı taraf (aynı taraf) meme daha büyük risk altında olabilir.[3] Öte yandan, SEER verilerinin analizi (Ulusal Kanser Enstitüsü Gözetim, Epidemiyoloji ve Son Sonuçlar programından toplanan veriler), LCIS tanısından sonra invaziv meme kanseri geliştirme kümülatif riskinin 10 yılda% 7,1 olduğunu ve her iki göğüs. LCIS tanısı konulduktan sonra invazif meme kanseri gelişme riski yıllık% 1-2 arasında değişir ve invaziv kanserler intraduktal karsinomun yanı sıra artmış invazif duktal gelişme riski ile intralobüler karsinomu içerebilir.[12] 5 yıllık aralıklarla kümülatif invaziv kanser geliştirme riski ile ilgili araştırma, 10 yılda risk% 13-15, 20 yıldaki risk% 26-35 ve 35 yıldaki risk% 35 ve üzeri olmak üzere değişiklik gösterir. % 50. LCIS tanısından sonra invaziv karsinom gelişme göreceli riski, genel popülasyona göre 8-10 kat daha fazladır.[2] In situ lobüler karsinomun 5 yıllık genel sağkalım oranının% 97 olduğu tahmin edilmektedir.[16]
LCIS (lobüler neoplazi, kanser öncesi kabul edilir), artmış invazif meme kanseri geliştirme riski olan kadınları tanımlayan bir göstergedir (belirteç). Bu risk 20 yıldan fazladır. Riskin çoğu sonraki ile ilgilidir invaziv duktal karsinom yerine invaziv lobüler karsinom.[15]
Daha eski çalışmalar, artan riskin her iki meme için de eşit olduğunu göstermiş olsa da, daha yakın tarihli bir çalışma, aynı taraf (aynı taraf) meme daha büyük risk altında olabilir.[17]
Epidemiyoloji

LCIS, iyi huylu meme biyopsilerinin% 0,5-1,5'inde tanımlanır. Bu biyopsiler, bu makalenin Teşhis bölümünde tartışıldığı gibi, genellikle şüpheli mamografik bulgulara yanıt olarak yapılır. LCIS, tüm meme biyopsilerinin% 1.8-2.5'inde tanımlanır (diğer Lobüler veya Duktal Neoplazinin histolojik kanıtını gösterenler dahil).[13] Önceden meme neoplazisi geçmişi olmayan kadınlarda LCIS insidansı 1980'de 100.000 kişide 0.90'dan 1998'de 100.000 kişide 3.19'a yükselmiştir - ancak bu muhtemelen bir tarama aracı olarak mamografi sıklığının artmasından kaynaklanmaktadır. Bu, LCIS sıklığındaki artışın büyüklüğünün en fazla 50 yaşın üzerindeki kadınlar arasında (rutin mamografi taramasına katılma olasılığı en yüksek olan grup) olduğu gerçeğiyle desteklenmektedir.
Tarih
1941'de, Foote ve Stewart'ın ufuk açıcı bir yayını, invaziv kanserin öncüleri olan sitolojik değişikliklerin bir spektrumunu kategorize etmek için "Lobular Carcinoma In Situ" terimini tanıttı. Bu değişiklikleri, hücrelerin apikal-bazal ayrımını (polarite kaybı) kaybettiği ve boyut olarak değil şekil olarak değiştiği genel incelemede tanınmaz, süzülmeyen ve çok odaklı olarak tanımladılar.[13] Ayrıca, hala bazal membran içinde yer almasına rağmen, LCIS'in gelecekteki kanser riskinin arttığını gösterebileceğini tahmin ettiler. Araştırmacılar ve doktorlar şu anda teşhisi bir öncü lezyon ve daha sonra meme kanserinin gelişimi için risk faktörü olarak görüyorlar.[18]
Bu makale şimdiye kadar Klasik LCIS'i açıkladı ve LCIS'in 2 başka çeşidi daha vardır: Pleomorfik LCIS (PLCIS) ve Apokrin PLCIS, ayrı bir makalede ayrı ayrı tartışılabilir.[19]
Aksine duktal karsinom yerinde (DCIS), LCIS ile ilişkili değil kireçlenme ve tipik olarak başka bir nedenle yapılan biyopside rastlantısal bir bulgudur. LCIS, yalnızca yerinde (duktal veya lobüler) meme kanserleri.[20]
Ayrıca bakınız
Referanslar
- ^ "Yerinde Lobüler Karsinom (LCIS)". Meme kanseri. Stanford Kanser Merkezi.
- ^ a b c d Wen, Hannah Y. (1 Mart 2018). "Yerinde Lobüler Karsinom". Cerrahi Patoloji Klinikleri. 11.
- ^ a b c d e Collins, Laura C. (1 Mart 2018). "Düşük Dereceli Meme Neoplazisi Yolunun Öncü Lezyonları". Cerrahi Patoloji Klinikleri. 11.
- ^ a b "Lobüler karsinom in situ: Göğüs kanseri riski belirteci". MayoClinic.com.
- ^ "Meme Kanseri Tedavisi". Ulusal Kanser Enstitüsü.
- ^ Afonso N, Bouwman D (Ağustos 2008). "Yerinde lobüler karsinom". Avro. J. Kanser Önceki. 17 (4): 312–6. doi:10.1097 / CEJ.0b013e3282f75e5d. PMID 18562954.
- ^ AJCC Kanser Evreleme Kılavuzu, Sekizinci Baskı - Bölüm XI - Göğüs. https://cancerstaging.org/references-tools/deskreferences/Documents/AJCC%20Breast%20Cancer%20Staging%20System.pdf: Amerikan Cerrahlar Koleji. 2018. s. 590.CS1 Maint: konum (bağlantı)
- ^ a b Logan, Greg J .; Dabbs, David J .; Lucas, Peter C .; Jankowitz, Rachel C .; Brown, Daniel D .; Clark, Beth Z .; Oesterreich, Steffi; McAuliffe, Priscilla F. (2015-06-04). "Lobüler karsinomun in situ moleküler sürücüleri". Meme Kanseri Araştırmaları. 17: 76. doi:10.1186 / s13058-015-0580-5. ISSN 1465-542X. PMC 4453073. PMID 26041550.
- ^ a b Canas-Marques, Rita; Schnitt, Stuart J (2016/01/01). "Meme patolojisinde E-kaderin immünohistokimyası: kullanımlar ve tuzaklar". Histopatoloji. 68 (1): 57–69. doi:10.1111 / his.12869. ISSN 1365-2559. PMID 26768029.
- ^ Lakhani SR (2001). "Katı tümörlerin moleküler genetiği: araştırmayı klinik uygulamaya çevirmek. Şimdi ne yapabiliriz: meme kanseri". Mol Pathol. 54 (5): 281–4. doi:10.1136 / mp.54.5.281. PMC 1187082. PMID 11577167.
- ^ a b Jorns, Julie (Ekim 2014). "Lobüler Neoplazi: Morfoloji ve Yönetim". Patoloji ve Laboratuvar Tıbbı Arşivleri. 138 (10): 1344–1399. doi:10.5858 / arpa.2014-0278-CC. PMID 25268198 - 10.5858 / arpa.2014-0278-CC üzerinden.
- ^ a b Kanser, Amerikan Ortak Komitesi (2002). AJCC kanser evreleme el kitabı: AJCC kanser evreleme el kitabından (6. baskı). New York: Springer. s.260. ISBN 9780387952703.
- ^ a b c d e King, Tari A. (1 Temmuz 2014). "Lobüler Neoplazi". Kuzey Amerika Cerrahi Onkoloji Klinikleri. 23.
- ^ Cotran, Ramzi S .; Kumar, Vinay; Fausto, Nelson; Nelso Fausto; Robbins, Stanley L .; Abbas, Abul K. (2005). Robbins ve Cotran hastalığın patolojik temeli (7. baskı). St. Louis, MO: Elsevier Saunders. s.1142. ISBN 978-0-7216-0187-8.
- ^ a b "Meme Kanseri Tedavisi (PDQ®) - Ulusal Kanser Enstitüsü - Lobüler Karsinom Yerinde". Alındı 2013-01-12.
- ^ Xie, Ze-Ming; Sun, Jian; Hu, Zhe-Yu; Wu, Yao-Pan; Liu, Peng; Tang, Haz; Xiao, Xiang-Sheng; Wei, Wei-Dong; Wang, Xi; Xie, Xiao-Ming; Yang, Ming-Tian (2017). "Bilateral mastektomi veya parsiyel mastektomi uygulanan in situ lobüler karsinomlu hastaların sağkalım sonuçları". Avrupa Kanser Dergisi. 82: 6–15. doi:10.1016 / j.ejca.2017.05.030. ISSN 0959-8049. PMID 28646773.
- ^ Sayfa DL, Schuyler PA, DuPont WD, Jensen RA, Plummer WD Jr, Simpson JF (2003). "Meme kanseri riskinin tek taraflı bir prediktörü olarak atipik lobüler hiperplazi: retrospektif bir kohort çalışması". Lancet. 361 (9352): 125–9. doi:10.1016 / S0140-6736 (03) 12230-1. PMID 12531579.
- ^ "Lobüler karsinom in situ: Göğüs kanseri riski belirteci". MayoClinic.com.
- ^ Pieri, Andrew (2014-08-10). "Memede in situ pleomorfik lobüler karsinom: Kanıtlar uygulamaya rehberlik edebilir mi?". Dünya Klinik Onkoloji Dergisi. 5 (3): 546–53. doi:10.5306 / wjco.v5.i3.546. PMC 4127624. PMID 25114868.
- ^ Sayfa DL, Schuyler PA, DuPont WD, Jensen RA, Plummer WD Jr, Simpson JF (2003). "Meme kanseri riskinin tek taraflı bir prediktörü olarak atipik lobüler hiperplazi: retrospektif bir kohort çalışması". Lancet. 361 (9352): 125–9. doi:10.1016 / S0140-6736 (03) 12230-1. PMID 12531579.
Dış bağlantılar
| Sınıflandırma |
|---|
