Büyü - MAGIChip - Wikipedia
BÜYÜLER, Ayrıca şöyle bilinir "bir çip üzerinde jel immobilize bileşiklerin mikro dizileri"veya"3 boyutlu DNA mikrodizileri", hareketsiz hale getirilerek üretilen moleküler hibridizasyon için cihazlardır oligonükleotidler, DNA, enzimler, antikorlar ve fotopolimerize mikromatris üzerindeki diğer bileşikler poliakrilamid jel 100x100x20µm veya daha küçük boyutta pedler. Bu teknoloji aşağıdakilerin analizi için kullanılır nükleik asit hibridizasyonu DNA'nın spesifik bağlanması ve düşük moleküler ağırlıklı bileşikler ile proteinler ve protein-protein etkileşimleri.
Jel pedler, genellikle probların yapıştığı kimyasal bileşikler ile muamele edilen bir cam lamın düz yüzeyine basılan tipik mikrodizilerle karşılaştırıldığında hibridizasyon yüzeyini 50 katına çıkarır. Jel pedlerinin 3 boyutlu yapısı nedeniyle jel pedi başına 1012 molekülden daha fazla prob yoğunluğu elde edilebilir. Dizi, üzerine yapıştırılmış küçük poliakrilamid jel birimlerine sahip bir cam yüzeye dayanmaktadır. Her bir jel ünitesi, jel ünitelerindeki solüsyonun karışmasını önleyen hidrofobik bir cam yüzeyle çevrili olduğu için ayrı bir reaksiyon hücresi olarak işlev görür. Bu performans için bir temel oluşturur ligasyon tek taban uzantısı, PCR amplifikasyonu DNA, çip üzerinde MALDI-TOF kütle spektrometrisi ve diğer tepkiler.

Tarihsel arka plan
MAGIChip teknolojisi, Washington Üniversitesi'nden Dr. David Stahl ile eski Argonne Ulusal laboratuvarından Dr. Andrei Mirzabekov arasındaki işbirliğinin bir sonucu olarak geliştirildi. Andrei Mirzabekov, 1988'de yeni bir yöntem olan oligonükleotidlerle hibridizasyon yoluyla DNA diziliminin geliştirilmesini başlattı. Bu yöntem, DNA yapılarını hızla tanımlamak için biyolojik mikroçipleri kullanan biyoteknoloji için bir temel oluşturdu ve bu, çeşitli türlere karşı mücadelede büyük önem taşıyor. hastalıklar.
1998 yılında Motorola Inc, Packard Instrument Company ve ABD Enerji Bakanlığı'nın Argonne Ulusal Laboratuvarı arasında ortak bir araştırma projesi duyuruldu. 1999'da Argonne Ulusal Laboratuvarı'ndaki araştırmacılar, birlikte tasarladıkları mikroarray tipi biyoçip teknolojisinin geliştirilmesini sağladılar. Engelhardt Enstitüsü dünya çapında bir tüberküloz salgınını önlemek için.
Motorola, biyoçipleri toplu üretmek için üretim süreçleri geliştirdi ve Packard, biyoçipleri işlemek ve analiz etmek için analitik cihazları geliştirdi ve üretti. Argonne'nin katkısı, Engelhardt Moleküler Biyoloji Enstitüsü (EIMB), biyolojik mikroçiplerle ilgili 19 icat şeklindeki fikri mülkiyetti.
Ancak Moskova'daki EIMB ile Illinois'deki Argonne Ulusal Laboratuvarı ve diğer iki ABD merkezli ticari ortak arasındaki bu işbirliği, 2001 yılında taraflar arasındaki sözleşmeye dayalı anlaşmaya ilişkin tartışmalar sonucunda çöktü. Bu anlaşmazlığın bir sonucu olarak, Dr. Andrei Mirzabekov yönetim kurulu başkanlığından istifa etti. Argonne'nin Biochip Teknoloji Merkezi.[kaynak belirtilmeli ]
Yöntem
Cam yüzey (mikromatriks) üzerinde jel elementleri (pedler) dizileri oluşturulur ve ardından farklı bileşiklerin (problar) bu jel pedler üzerine uygulanması ve kimyasal olarak immobilizasyonu takip eder. Daha sonra, jel pedlerinde hareketsizleştirilmiş problar içeren bu mikromatrise test numunesi eklenir ve moleküler tanıma reaksiyonlarının belirli koşullar altında gerçekleşmesine izin verilir. Test örneği floresan moleküler etkileşimleri izlemek için etiketlenmiştir. Moleküler etkileşim modellerinin analizi, özel yazılım kullanılarak yapılır.
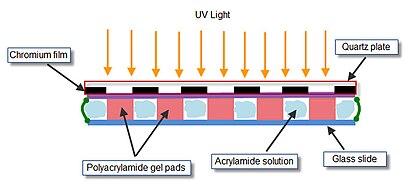

Bir cam slayt üzerindeki jel elementleri dizisi "" fotopolimerizasyon "ile hazırlanır. Polimerize edilecek akrilamid çözeltisi, polimerizasyon bölme. Polimerizasyon odası, bir kuvars maskesi, iki Teflon ara parçası ve iki metal kelepçe ile birbirine kenetlenmiş mikroskobik bir cam slayttan oluşur. Kuvars maskenin iç tarafında, şeffaf olmayan bir krom film içinde belirli bir uzamsal tarzda düzenlenmiş ultraviyole (UV) şeffaf pencereler bulunur. Akrilamid jeli içeren birleştirilmiş bölme, yalnızca bölmenin doğrudan şeffaf pencerelerin altında bulunan konumlarında polimerizasyona izin vermek için UV ışığına maruz bırakılır.
Oligonükleotidler veya DNA fragmanlarının, aktifleştirilmiş jel elementleri ile bağlanmayı kolaylaştırmak için kimyasal olarak reaktif gruplar içerecek şekilde aktive edilmesi gerekir. Prob aktivasyonu, poliakrilamid jellerin aktivasyon kimyasına bağlıdır. Bu nedenle, aldehit içeren jelde hareketsiz hale getirmek için, prob reaktif amino grubuna sahip olmalıdır ve jeller, amino gruplarının eklenmesiyle aktif hale getirilirse, problar, serbest aldehit grubu içermelidir. Sondalar genellikle kimyasal olarak aktif grupların, sentezleri sırasında oligonükleotitlerin terminal pozisyonuna sokulmasıyla hazırlanır.
Hareketsizleştirme probları, dağıtım robotları kullanılarak mikromatrisin jel elemanlarına aktarılır. Robotların fiber optik pimi, hidrofobik bir yan yüzeye ve bir hidrofilik uca sahiptir ve aktarım sırasında numunenin buharlaşmasını önlemek için bir çiğ sıcaklığında çalışır. Aktive edilmiş problar, amino veya aldehit grupları taşıyan oligonükleotitlerin, sırasıyla aldehit veya amino grupları içeren jel destekleriyle birleştirilmesiyle kimyasal olarak immobilize edilir.
Hedef moleküller şu şekilde etiketlenir: floresan boyalar. Floresan algılama, sürecin gerçek zamanlı olarak yüksek uzaysal çözünürlükle izlenmesini sağlar. Etiketleme prosedürü için kriterler şunları içerir:
- Basit, hızlı ve ucuz olmalı
- Hem RNA hem de DNA hedeflerine uygulanabilir olmalıdır
- İkincil yapı oluşumunu azaltmak için gerekli parçalanma ile uyumlu olmalıdır.
- Hibridizasyon yoğunluğunun doğru ölçülmesini sağlamak için bir etiketin bir parçaya dahil edilmesine izin vermelidir
- Birden fazla boyanın bağlanmasına izin vermelidir
Çip üzerinde amplifikasyon reaksiyonları
Hibridizasyon reaksiyonunun çip üzerinde amplifikasyonu, incelenen DNA veya protein, çipe uygulanan moleküler popülasyonda nispeten küçük bir oranda mevcut olduğunda, örneğin, biri tek bir kopya gen veya mRNA ile uğraşırken çok faydalı bir araç olarak hizmet eder. düşük bolluk.
Tek bir temel genişletme yönteminde,[1] bir primer, DNA'ya hibridize edilir ve polimorfik bir bölgede nükleotitle eşleşen bir dideoksiribonükleosit trifosfat ile uzatılır. Bu reaksiyonun, DNA ve hareketsizleştirilmiş prob arasındaki dubleksin erime sıcaklığının üzerindeki bir sıcaklıkta gerçekleştirilmesi, hedef DNA'nın hızlı birleşmesine / ayrılmasına izin verir. Böylece, aynı DNA molekülü birçok bireysel primerle reaksiyona girerek her bir jel pedindeki primerlerin amplifikasyonuna yol açar. Bu işlem beta talasemi hastalarında beta globin gen mutasyonunun belirlenmesi ve şarbon toksin geninin saptanması için uygulandı.
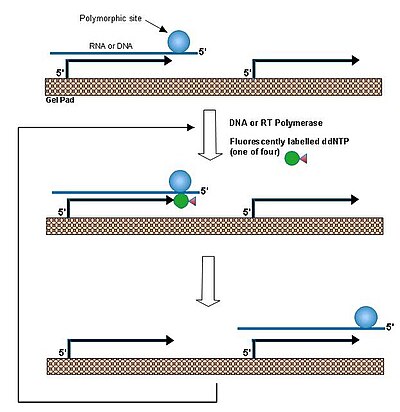
Çipler ayrıca performans için iyi bir platform sağlar PCR doğrudan çip üzerinde (ayrı jel pedlerde) çünkü aynı görevi yaparken ciddi sorunlarla karşılaşan tipik mikrodizi çiplerinin aksine her bir jel pedi komşusundan izole etmek kolaydır
Floresan etiketli hedef moleküller ile elde edilen hibridizasyon sonuçlarının analizi için floresan mikroskopları istihdam edilmektedir. Cihaz, deney sırasında çip içeren reaksiyon haznesindeki sıcaklığı değiştirmek için kontrollü sıcaklık numune tablosu ile donatılmıştır. Soğutulmuş şarj bağlı cihaz (CCD) kamera, çipten gelen ışık sinyallerini kaydetmek için kullanılır ve bunlar daha sonra tüm çip üzerinde hibridizasyon sinyallerinin nicel değerlendirmesi için bilgisayar programına gönderilir. Bu deneylerden elde edilen veriler bir veri tabanında saklanır ve değerlendirme yapılmasına yardımcı olan yazılımlarla analiz edilir, silikoda deney ve donanım ve yazılım kalite kontrolü.
Türler
oligonükleotid çipler
Özelleştirilmiş oligonükleotid biyoçipleri, bilinen nükleotid dizilerinin test örneklerini sorgulamak için tasarlanmıştır. Örneğin, belirli koşullar altında ekspresyon seviyelerine ilgi duyulan durumlarda bilinen genler, nokta mutasyonları içerdiği bilinen veya belirli bir popülasyonda polimorfik olduğu bilinen genler. Mikrodizinin başarısı, bu durumlarda doğru prob seçimine bağlıdır.
Bir dizi potansiyel hibridizasyon probları bu sekansla mükemmel çiftler oluşturan her DNA sekansı için oluşturulur. Hibridizasyon modelinin yorumlanmasında belirsizlikler yaratabilecek potansiyel problar, AT'ye karşı GC içeriği ve hibridizasyonun yoğunluğunu büyük ölçüde etkileyebilecek saç tokası ve diğer stabil ikincil yapı tipleri oluşturma eğilimi temelinde hariç tutulur.
Özelleştirilmiş oligonükleotid çiplerinin başarılı uygulamalarının durumlarından biri, beta-talasemi hastalarda mutasyon. Beta talasemi mutasyonlarının teşhisi için, farklı beta-talasemiye karşılık gelen altı prob içeren basit bir çip tasarlandı. genotipler ve sağlıklı insanlardan ve hastalardan alınan PCR ile amplifiye edilmiş DNA ile hibridize edildi.[2] Hibridizasyon sonuçları, eşleşen ve uyumsuz dupleksler arasındaki sinyal yoğunluğunda beklenen önemli farklılıkları gösterdi, böylece hem homozigot hem de heterozigot mutasyonların güvenilir bir şekilde tanımlanmasına izin verdi.
rRNA çipleri
Bu çipler, yaygın olarak bakterileri tespit etmek için kullanılan ribozomal RNA (rRNA) hedefleri için geliştirilmiştir. rRNA, tipik ökaryotik hücrenin RNA içeriğinin yaklaşık% 80'ini oluşturan hücrede çok bol miktarda bulunur.[3] RRNA, bakteriler tarafından önceden amplifiye edilir ve hücre başına birkaç bin kopya bulunur, bu da mikro testler için iyi bir hedef oluşturur. Bakteriyel rRNA sekansında bulunan tek nükleotid polimorfizmleri, bakterileri cins, tür ve suş düzeyinde ayırt etmek için kullanılır. Bu, bu mikroçipin PCR tabanlı amplifikasyon gerektirmeyen benzersiz bir özelliğidir. Bakteriyi tespit etme süreci nispeten basittir. Bakteriler kültürlenir, yıkanır ve peletlenir. Lizozom, peletleri parçalamak - hücre duvarlarını yok etmek ve nükleik asidi serbest bırakmak için kullanılır. Lize edilen bakteriler, hücreden gelen nükleik asidin hareketsiz hale getirildiği ve diğer kalıntıların yıkandığı bir renkli preparattan geçirilir. Lizizden sonraki tüm işlemler - hedef rRNA'ların izolasyonu, saflaştırılması, parçalanması ve etiketlenmesi - kararlı kimyasal reaksiyonlardır. 500 bp'den küçük parçalar, jel matrisine kolayca hibridize olur. Çipten çıkarılan toplam elüsyon sayısı UV spektrofotometre ile belirlenir. Örnek hazırlamadan organizmaların otomatik algoritmalara göre tanımlanmasına kadar olan süreç 2 saat içinde gerçekleşir.
cDNA
Değişik fizyolojik ve deneysel koşullarda hücrelerden ekstrakte edilen mRNA popülasyonunun ters transkripsiyonundan elde edilen cDNA'lar, hareketsizleştirilmiş problar olarak kullanılır. Bu diziler, gen ifadesini incelemek için yaygın olarak kullanılmaktadır. CDNA'ları kullanmanın önündeki olası engel, uzun molekülleri jel pedlerine enjekte etmenin ve eşit şekilde dağıtmanın zorluğundan kaynaklanmaktadır. Bu problem, daha büyük ortalama gözenek boyutu içeren poliakrilamid jeller geliştirilerek çözülür. Bu soruna yaklaşmanın başka bir yolu, cDNA'yı hareketsizleştirmeden önce rastgele küçük parçalara ayırmaktır.
Proteinler
Protein Biyolojik aktivitelerini koruyacak şekilde problar olarak hareketsizleştirilmiş farklı proteinler içeren çipler hazırlanabilir.[4] Proteinin jele difüzyonunu önlemek için büyük bir gözenekli jel kullanılır. Proteinleri jel pedlerine sabitlemenin iki yolu vardır. İlki jelin aktivasyonuna dayanmaktadır. glutiraldehit. İkinci prosedürde, jel, amino gruplarının kısmi ikamesi ile aktive edilir. hidrazid gruplar. Hidrazid ve aldehit grupları arasındaki reaksiyon, proteini hücreye verimli bir şekilde çapraz bağlar. Protein mikroçipleri, çözeltide görüldüğü gibi moleküler tanıma reaksiyonlarında yüksek özgüllük gösterir. Antijen ve spesifik antikorları arasındaki etkileşim, çeşitli deneysel koşullarda çip üzerinde incelenebilir. Ya antijen veya antikor hem doğrudan hem de dolaylı yöntemlerle hareketsiz hale getirilebilir ve izlenebilir. Doğrudan yöntemde, floresan boya ile etiketlenmiş hedef moleküller kullanılır ve dolaylı yöntemde reaksiyon, hedefi spesifik olarak tanıyan etiketli molekül kullanılarak tespit edilir. Bu çipler, immobilize edilmişlerin enzimatik aktivitesini incelemek için kullanılabilir. enzimler çipi belirli substratlar içeren çözelti ile kaplayarak. Reaksiyon, renkli veya floresan çökeltilerin oluşumu tespit edilerek izlenir.
Diğer uygulamalar
- Yönteminde tek nükleotid polimorfizmlerini (SNP'ler) incelemek için kullanılabilirler. Bakteriyel DNA zaman içinde yüksek oranda korunduğu için, SNP'ler çip üzerindeki bakteriyi tanımlamak için faydalıdır ve SNP'ler insan genomundaki en bol varyasyonlar olduğundan, karmaşık hastalıklara duyarlı genlerin haritalanması ve tanımlanması için genetik araştırmalar için birincil belirteçler haline gelmiştir. .[5]
- Organizmayı istila eden toksinler ve proteinler olan virülans faktörlerini tespit etmek için kullanılabilirler. Bu toksinler, az sayıda kopya kopyasına sahip olma eğilimindedir ve konakçıda bulunan çok özel koşullar altında üretilir. Burada tanımlama stratejisi, MAGIChip'lerin çok etkili olduğu tek kopya DNA dizisine odaklanır.
- Protein biyoçipleri, proteinler tek bir hücrede bulunduğundan ve hepsi tek bir dizi platformunda analiz edilebildiğinden, onu çok heyecan verici kılar. Protein biyoçipleri, hastalıkları veya hastalığın belirli bir aşamasını teşhis etmek için protein biyobelirteçlerini tanımlamak için kullanılabilir. Ayrıca, protein yapısı ve proteinin işlevi arasındaki ilişkiyi tanımlamaya ve aynı veya farklı hücre tipleri boyunca bir proteinin veya farklı proteinlerin işlevini belirlemeye yardımcı olabilirler. MAGIChip'lerin bazı modifikasyonlara ihtiyacı olsa da, uygulamalar ve teknikler oldukça standarttır.[6]
- Çipler, hızlı tespit süresi, yüksek verim, sonuç güvencesi, hiyerarşik tanımlama ve miktar tayini sayesinde kliniklerde teşhis aracı olarak kullanılabilir. Onlarla birlikte, numune toplama ve sonuçların klinik ortamlarda raporlanması için gereken süreyi 2 saat içinde elde etmek mümkündür. Hızlı geri dönüş süresi, hasta sonuçları beklerken bakım noktası testinin çekici bir özelliğidir.
- Bu cihazların yüksek verimli doğası, türlere özel binlerce mikrobiyal proba ve hatta tek bir çip üzerinde aynı anda suşa özel tanımlamaya izin vererek, birden fazla test yapmak için gereken numune miktarını azaltır. Bakteri, virüs ve mantarların insanlara, tarıma ve çevreye karşı biyolojik silah olarak kullanılmasıyla ortaya çıkan potansiyel tehditler, çok kısa sürede doğru ve hassas tespit için teknolojinin geliştirilmesini garanti etmektedir. Önemli virüsleri ayırmak için kullanılan MAGIChip potansiyel teknolojisi. Mantar probları, genetik, üreme, hastalıklar ve hatta mahsulün korunmasında tarımsal araştırmalar için rRNA çiplerine dahil edilmiştir. Doğası gereği veya kasıtlı salınım yoluyla genetik çeşitlilik veya mikrobiyal istilayı aramak için binlerce gen aynı anda hedeflenebilir.
Ayrıca bakınız
- Biyoçip
- Protein Mikroarrayleri
- Antikor mikrodizi
- Hücresel Mikroarray
- Kimyasal Bileşik Mikroarray
- DNA Mikroarray
- MicroArray ve Gen İfadesi
- Lab-on-a-Chip
Referanslar
- ^ (1998) İkinciler. Science 282, 2156–2157.
- ^ Yershov, G., Barsky, V., Belgovskiy, A., Kirillov, E., Kreindlin, E., Ivanov, I., Parinov, S., Guschin, D., Drobyshev, A., Dubiley, S., ve Mirzabekov, A. (1996) DNA analizi ve oligonükleotid mikroçipler üzerinde teşhis. Proc. Natl. Acad. Sci. USA 93, 4913–4918.
- ^ Zlatanova, J., ve Mirzabekov, A., "Jel-Hareketsizleştirilmiş Nükleik Asit ve Protein Mikroarrayları. Makromoleküler Araştırma için Üretim ve Uygulama, ”Yöntemler Mol. Biol. 170, 17-38 (2001).
- ^ Guschin, D., Yershov, G., Zaslavsky, A., Gemmell, A., Shick, V., Proudnikov, D., Arenkov, P., and Mirzabekov, A. (1997) Manuel oligonükleotid, DNA ve protein mikroçipleri. Anal. Biochem. 250, 203–211.
- ^ Weiner, M. P., ve Hudson, T. J., "SNP'lere Giriş: Hastalık Belirteçlerinin Keşfi", Biotechniques 32 (S), 4−13 (2002).
- ^ Biotechnology Industry Organization (Bio), The Technologies and Their Applications, şu adresten ulaşılabilir: http://www.bio.org/er/applications.asp.
