Mitokondriyal biyogenez - Mitochondrial biogenesis
Mitokondriyal biyogenez hücrelerin arttığı süreçtir mitokondriyal kitle.[1][2] İlk olarak 1960'larda John Holloszy tarafından fiziksel olarak keşfedildiği zaman tanımlanmıştır. dayanıklılık eğitimi daha yüksek mitokondriyal içerik seviyelerini indükleyerek kaslar tarafından daha fazla glikoz alımına yol açtı.[3] Mitokondriyal biyogenez, hücresel stres zamanlarında veya çevresel uyaranlara yanıt olarak çok sayıda farklı sinyalle aktive edilir. aerobik egzersizi.[1][2][4]
Arka fon
Bir mitokondrinin kendi kendini kopyalama yeteneği, onun evrimsel geçmişine dayanır. Genelde mitokondrinin oluşan hücrelerden geldiği düşünülmektedir. endosimbiyotik ile ilişkiler α-protobacteria, replikasyon için kendi genomlarına sahipler.[5] Bununla birlikte, son kanıtlar, mitokondrinin simbiyoz olmadan evrimleşmiş olabileceğini düşündürmektedir.[6] Mitokondri, hücrenin metabolik aktivitesinin önemli bir düzenleyicisidir ve aynı zamanda serbest radikallerin hem üretimi hem de bozunmasında önemli bir organeldir.[7] Daha yüksek mitokondriyal kopya sayısının (veya daha yüksek mitokondriyal kütlenin) hücre için koruyucu olduğu varsayılmaktadır.
Mitokondri, hem nükleer genomdaki hem de genlerin transkripsiyonundan ve çevrilmesinden üretilir. mitokondriyal genom. Mitokondriyal proteinin çoğu nükleer genomdan gelirken, mitokondriyal genomun parçalarını kodlar. elektron taşıma zinciri mitokondriyal ile birlikte rRNA ve tRNA. Mitokondriyal biyogenez, glikoliz, oksidatif fosforilasyon için metabolik enzimleri ve nihayetinde daha büyük bir mitokondriyal metabolik kapasiteyi arttırır. Bununla birlikte, mevcut enerji substratlarına ve hücrenin REDOX durumuna bağlı olarak hücre, mitokondrinin sayısını ve boyutunu artırabilir veya azaltabilir.[8] Kritik olarak, mitokondriyal sayılar ve morfoloji, hücre tipine ve bağlama özgü talebe göre değişir, bu nedenle mitokondriyal füzyon / fisyon arasındaki denge mitokondriyal dağılımı, morfolojiyi ve işlevi düzenler.[9][8]
Protein ithalatı
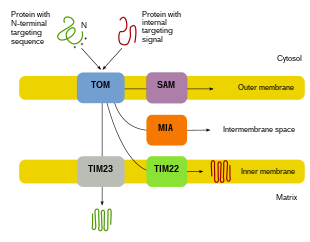
Mitokondriyal proteinin çoğunluğu nükleer genomdan geldiğinden, proteinlerin işlevlerini yerine getirmek için uygun şekilde hedeflenmesi ve mitokondriye taşınması gerekir.[8][10][11] İlk olarak, mRNA hücrenin sitozolüne çevrilir.[10][11] Ortaya çıkan katlanmamış öncü proteinler daha sonra kendi mitokondriyal bölmelerine ulaşabilecektir.[11][10] Öncü proteinler, mitokondrinin dış zar, iç zar, zarlar arası boşluk ve matrisi içeren dört alanından birine taşınacaktır.[10][11] Tüm proteinler, mitokondriye dış mitokondriyal membranda (TOM) bir translokaz yoluyla girecektir.[11][10][12] Bazı proteinler bir N-terminal hedefleme sinyaline sahip olacak ve bu proteinler tespit edilecek ve matrise taşınacak, burada daha sonra bölünecek ve katlanacaklar.[13][11][10] Diğer proteinler, dizilerinde hedefleme bilgilerine sahip olabilir ve bir N-terminal sinyali içermeyecektir.[11][10] Son yirmi yılda, araştırmacılar mitokondriyal protein ithalatına katılan otuzdan fazla protein keşfettiler.[11] Araştırmacılar bu proteinler ve bunları kullanan ilgili mitokondriyal bölmelere nasıl ulaştıkları hakkında daha fazla bilgi edindikçe, hücrede mitokondriyal biyogeneze izin vermek için birlikte çalışan çok sayıda işlem olduğu ortaya çıkıyor.[11][8]
Füzyon ve fisyon
Mitokondri çok yönlüdür ve şekillerini fisyon ve füzyon olaylarıyla değiştirebilir.[9][8] Kesinlikle, bölünme tek bir varlığın parçalanması olayı, füzyon ise iki veya daha fazla varlığın bir bütün oluşturmak için birleşmesi olayıdır.[8] Fisyon ve füzyon süreçleri birbirine zıttır ve mitokondriyal ağın kendisini sürekli olarak yeniden şekillendirmesine izin verir.[9][8] Bir uyaran, bir hücrede fisyon ve füzyon dengesinde bir değişikliğe neden olursa, mitokondriyal ağı önemli ölçüde değiştirebilir.[9][14] Örneğin, mitokondriyal fisyondaki bir artış, hasarlı mitokondriyi ortadan kaldırmak ve enerji gerektiren bölgelere verimli taşıma için daha küçük mitokondri oluşturmak için yararlı olduğu gösterilen birçok parçalanmış mitokondri oluşturacaktır.[14][15] Bu nedenle, bu mekanizmalar arasında bir denge sağlamak, bir hücrenin biyogenez sırasında mitokondriyal ağının uygun organizasyonuna sahip olmasına izin verir ve kasların fizyolojik strese adaptasyonunda önemli bir role sahip olabilir.[14]
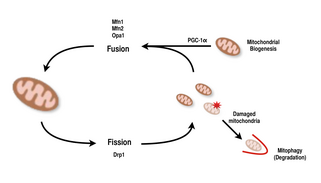
Memelilerde, mitokondriyal füzyon ve fisyon, dynamin ailesinin GTPazları tarafından kontrol edilir.[8][14] Mitokondriyal bölünme süreci, Drp1 sitozolik dinamin ailesinin bir üyesi.[8][9] Bu protein, mitokondri etrafında bir spiral oluşturur ve organelin hem dış hem de iç zarlarını parçalamak için daralır.[15] Öte yandan, füzyon süreci, farklı mitokondri seviyelerinde farklı zara sabitlenmiş dinamin proteinleri tarafından yönetilir.[14] Dış mitokondriyal zar seviyesinde füzyona, Mfn1 ve Mfn2 (Mitofusinler 1 ve 2),[16] ve iç mitokondriyal zar seviyesinde füzyona aracılık edilir Opa1.[8][13][14] Çok sayıda araştırma çalışması, dayanıklılık egzersizlerinden sonra mitokondriyal solunum kapasitesi ile Mfn1, Mnf2 ve Drp1 gen ekspresyonu arasında ilişkili artışlar gözlemledi.[15][16] Bu nedenle kas hücrelerinde mitokondriyal ağın yeniden düzenlenmesinin egzersize yanıt olarak önemli bir rol oynadığı desteklenmektedir.[4][14][16]
Yönetmelik
PGC-1α peroksizom proliferatör ile aktive edilen reseptör gamma (PGC) ailesinin bir üyesi transkripsiyonel koaktivatörler, ana düzenleyici mitokondriyal biyogenez.[1][2][17] Nükleer solunum faktörü 2'yi birlikte aktive ettiği bilinmektedir. (NRF2 / GABPA) ve NRF-2 ile birlikte nükleer solunum faktörü 1'i (NRF1 ).[16][17] NRF'ler de mitokondriyal transkripsiyon faktörü A'yı etkinleştirir. (tfam), nükleer kodlu mitokondriyal proteinlerin kopyalanmasından doğrudan sorumludur.[16][17] Bu, hem yapısal mitokondriyal proteinleri hem de mtDNA transkripsiyonu, çevirisi ve onarımı.[17] PGC-1β, yapısal olarak benzer bir protein PGC-1α, aynı zamanda mitokondriyal biyogenezin düzenlenmesinde rol oynar, ancak egzersize yanıt olarak artmaması bakımından farklılık gösterir.[12][18][17] PGC-1α'nın aşırı eksprese edildiği dokularda bulunan mitokondride önemli artışlar olsa da, kofaktör bu anahtar transkripsiyon faktörleriyle etkileşime girdiğinden, bozulmuş PGC-1α'ya sahip nakavt fareler hala yaşayabilir ve normal mitokondriyal bolluk gösterir.[18][12][17] Bu nedenle, farelerde mitokondrinin normal gelişimi için PGC-1a gerekli değildir, ancak fizyolojik stres altına alındıklarında, bu fareler normal PGC-1α seviyelerine sahip farelere kıyasla daha az tolerans sergiler.[12][17][18] Benzer şekilde, PGC-1-bozukluğuna sahip nakavt farelerde, fareler çoğunlukla normal seviyelerde mitokondriyal fonksiyon gösterdi ve fizyolojik strese uyum sağlama yeteneği azaldı.[19][12] Bununla birlikte, PGC-1α /'nin çift devre dışı bırakma deneyi, kalp dokusunun mitokondriyal olgunlaşmasındaki kusurlar nedeniyle çoğunlukla 24 saat içinde ölen fareler yarattı.[20] Bu bulgular, hem PGC-1α hem de PGC-1β'nin her birinin yalnızca bir hücrenin mitokondriyal biyogenez gerçekleştirme yeteneğini oluşturmadığını, birlikte, fizyolojik stres dönemlerinde optimal mitokondriyal olgunlaşma ve işlev için birbirlerini tamamlayabildiklerini göstermektedir.[20][12][18]
AMP ile aktive olan kinaz (AMPK) ayrıca kasta bir enerji eksikliğini algıladığında PGC-1α'yı fosforile ederek ve aktive ederek mitokondriyal biyogenezi düzenler.[12][17] Egzersiz sırasında meydana gelebilecek ATP / AMP oranlarının düşürüldüğü farelerde, enerji tükenmesinin AMPK aktivasyonu ile ilişkili olduğu gösterilmiştir.[12][19][17] AMPK aktivasyonu daha sonra bu farelerde PGC-1α ve NRF'leri aktive etmeye devam etti ve mitokondriyal biyogenez uyarıldı.[12][19][17]
Yaşlanma
Mitokondriyal biyogenez kapasitesinin yaşla birlikte azaldığı gösterilmiştir ve bu azalmış mitokondriyal fonksiyon, diyabet ve kardiyovasküler hastalık ile ilişkilendirilmiştir.[21][22][23] Yaşlanma ve hastalık, mitokondrinin fisyon ve füzyon mekanizmalarında yer alan proteinlerin ekspresyon seviyelerinde değişikliklere neden olarak işlevsiz mitokondri oluşturabilir.[24][25] Yaşlanmanın zararlı sonuçlarına ilişkin bir hipotez, telomerler, genetik bilgiyi bozulmadan koruyan kromozomların uç kısımları.[22][25] Telomer kaybı, azalmış mitokondriyal fonksiyonla da ilişkilendirilmiştir.[25][22] Eksikliği telomeraz ters transkriptaz (TERT) Telomerlerin korunmasında rol oynayan bir enzim olan PGC-1α'yı baskılayan bir protein olan aktive p53 ile ilişkilendirilmiştir.[25][24][22] Bu nedenle, yaşlanmayla birlikte gelen telomer ve TERT kaybı, mitokondriyal biyogenezde bozulma ile ilişkilendirilmiştir.[22][24][25] AMPK ekspresyonunun yaşla birlikte azaldığı ve bu da mitokondriyal biyogenezin baskılanmasına katkıda bulunabileceği gösterilmiştir.[12][25]
Referanslar
- ^ a b c Valero T (2014). "Editoryal (Tematik Sayı: Mitokondriyal Biyogenez: Farmakolojik Yaklaşımlar)". Güncel İlaç Tasarımı. 20 (35): 5507–5509. doi:10.2174/138161282035140911142118. hdl:10454/13341. PMID 24606795.
- ^ a b c Sanchis-Gomar F, García-Giménez JL, Gómez-Cabrera MC, Pallardó FV (2014). "Sağlıkta ve hastalıkta mitokondriyal biyogenez. Moleküler ve terapötik yaklaşımlar". Güncel İlaç Tasarımı. 20 (35): 5619–33. doi:10.2174/1381612820666140306095106. PMID 24606801.
- ^ Holloszy JO (Nisan 2011). "Mitokondriyal Biyogenezin ve Egzersizle GLUT4 İfadesinin Düzenlenmesi". Kapsamlı Fizyoloji. 1 (2): 921–40. doi:10.1002 / cphy.c100052. ISBN 9780470650714. PMID 23737207.
- ^ a b Boushel R, Lundby C, Qvortrup K, Sahlin K (Ekim 2014). "Egzersiz eğitimi ve aşırı ortamlar ile mitokondriyal esneklik". Egzersiz ve Spor Bilimleri İncelemeleri. 42 (4): 169–74. doi:10.1249 / JES.0000000000000025. PMID 25062000.
- ^ Jornayvaz FR, Shulman GI (2010). "Mitokondriyal biyogenezin düzenlenmesi". Biyokimyada Denemeler. 47: 69–84. doi:10.1042 / bse0470069. PMC 3883043. PMID 20533901.
- ^ Harish A, Kurland CG (Aralık 2017). "Mitokondri tutsak bakteri değildir". Teorik Biyoloji Dergisi. 434: 88–98. doi:10.1016 / j.jtbi.2017.07.011. PMID 28754286.
- ^ Bevilacqua L, Ramsey JJ, Hagopian K, Weindruch R, Harper ME (Mayıs 2004). "Kısa ve orta vadeli kalori kısıtlamasının kas mitokondriyal proton sızıntısı ve reaktif oksijen türlerinin üretimi üzerindeki etkileri". Amerikan Fizyoloji Dergisi. Endokrinoloji ve Metabolizma. 286 (5): E852-61. doi:10.1152 / ajpendo.00367.2003. PMID 14736705.
- ^ a b c d e f g h ben j Mishra P, Chan DC (Şubat 2016). "Mitokondriyal dinamiklerin metabolik düzenlenmesi". Hücre Biyolojisi Dergisi. 212 (4): 379–87. doi:10.1083 / jcb.201511036. PMC 4754720. PMID 26858267.
- ^ a b c d e Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, et al. (Haziran 2016). "Nörodejenerasyon ve nöronal plastisitede mitokondriyal füzyon / fisyon dinamikleri". Hastalığın Nörobiyolojisi. 90: 3–19. doi:10.1016 / j.nbd.2015.10.011. PMID 26494254.
- ^ a b c d e f g Dudek J, Rehling P, van der Laan M (Şubat 2013). "Mitokondriyal protein ithalatı: ortak ilkeler ve fizyolojik ağlar". Biochimica et Biophysica Açta (BBA) - Moleküler Hücre Araştırması. 1833 (2): 274–85. doi:10.1016 / j.bbamcr.2012.05.028. PMID 22683763.
- ^ a b c d e f g h ben Baker MJ, Frazier AE, Gulbis JM, Ryan MT (Eylül 2007). "Mitokondriyal protein ithal etme mekanizması: yapıyı işlevle ilişkilendirme". Hücre Biyolojisindeki Eğilimler. 17 (9): 456–64. doi:10.1016 / j.tcb.2007.07.010. PMID 17825565.
- ^ a b c d e f g h ben j Jornayvaz FR, Shulman GI (2010). "Mitokondriyal biyogenezin düzenlenmesi". Biyokimyada Denemeler. 47: 69–84. doi:10.1042 / bse0470069. PMC 3883043. PMID 20533901.
- ^ a b Ventura-Clapier R, Garnier A, Veksler V (Temmuz 2008). "Mitokondriyal biyogenezin transkripsiyonel kontrolü: PGC-1 alfa'nın merkezi rolü". Kardiyovasküler Araştırma. 79 (2): 208–17. doi:10.1093 / cvr / cvn098. PMID 18430751.
- ^ a b c d e f g Youle RJ, van der Bliek AM (Ağustos 2012). "Mitokondriyal bölünme, füzyon ve stres". Bilim. 337 (6098): 1062–5. doi:10.1126 / science.1219855. PMC 4762028. PMID 22936770.
- ^ a b c Bo H, Zhang Y, Ji LL (Temmuz 2010). "Mitokondrinin egzersizdeki rolünü yeniden tanımlamak: dinamik bir yeniden modelleme". New York Bilimler Akademisi Yıllıkları. 1201: 121–8. doi:10.1111 / j.1749-6632.2010.05618.x. PMID 20649548.
- ^ a b c d e Cartoni R, Léger B, Hock MB, Praz M, Crettenand A, Pich S, ve diğerleri. (Ağustos 2005). "Mitofusin 1/2 ve ERRalpha ekspresyonu, fiziksel egzersizden sonra insan iskelet kasında artar". Fizyoloji Dergisi. 567 (Pt 1): 349–58. doi:10.1113 / jphysiol.2005.092031. PMC 1474174. PMID 15961417.
- ^ a b c d e f g h ben j Johri A, Chandra A, Flint Beal M (Eylül 2013). "PGC-1α, mitokondriyal disfonksiyon ve Huntington hastalığı". Ücretsiz Radikal Biyoloji ve Tıp. 62: 37–46. doi:10.1016 / j.freeradbiomed.2013.04.016. PMC 3722269. PMID 23602910.
- ^ a b c d Lin J, Wu PH, Tarr PT, Lindenberg KS, St-Pierre J, Zhang CY, ve diğerleri. (Ekim 2004). "PGC-1 alfa yoksun farelerde CNS bağlantılı hiperaktivite ile uyarlanabilir enerji metabolizmasındaki kusurlar". Hücre. 119 (1): 121–35. doi:10.1016 / j.cell.2004.09.013. PMID 15454086.
- ^ a b c Scarpulla RC (Temmuz 2011). "PGC-1 aile düzenleyici ağı aracılığıyla mitokondriyal biyogenezin metabolik kontrolü". Biochimica et Biophysica Açta (BBA) - Moleküler Hücre Araştırması. 1813 (7): 1269–78. doi:10.1016 / j.bbamcr.2010.09.019. PMC 3035754. PMID 20933024.
- ^ a b Lai L, Leone TC, Zechner C, Schaeffer PJ, Kelly SM, Flanagan DP, ve diğerleri. (Temmuz 2008). "Transkripsiyonel ortak aktifleştiriciler PGC-1 alfa ve PGC-lbeta, kalbin perinatal olgunlaşması için gereken örtüşen programları kontrol eder". Genler ve Gelişim. 22 (14): 1948–61. doi:10.1101 / gad.1661708. PMC 2492740. PMID 18628400.
- ^ Handy DE, Loscalzo J (Haziran 2012). "Mitokondriyal fonksiyonun Redoks düzenlemesi". Antioksidanlar ve Redoks Sinyali. 16 (11): 1323–67. doi:10.1089 / ars.2011.4123. PMC 3324814. PMID 22146081.
- ^ a b c d e David R (Nisan 2011). "Yaşlanma: Mitokondri ve telomerler bir araya gelir". Doğa Yorumları. Moleküler Hücre Biyolojisi. 12 (4): 204. doi:10.1038 / nrm3082. PMID 21407239.
- ^ Hagen TM, Wehr CM, Ames BN (Kasım 1998). "Yaşlanmada mitokondriyal bozulma. Asetil-L-karnitin ve N-tert-butil-alfa-fenil-nitronun takviyesi yoluyla tersine çevirme". New York Bilimler Akademisi Yıllıkları. 854: 214–23. doi:10.1111 / j.1749-6632.1998.tb09904.x. PMID 9928432.
- ^ a b c Sahin E, Colla S, Liesa M, Moslehi J, Müller FL, Guo M, et al. (Şubat 2011). "Telomer disfonksiyonu, metabolik ve mitokondriyal uzlaşmaya neden olur". Doğa. 470 (7334): 359–65. doi:10.1038 / nature09787. PMC 3741661. PMID 21307849.
- ^ a b c d e f Sahin E, DePinho RA (Mayıs 2012). "Yaşlanma ekseni: telomerler, p53 ve mitokondri". Doğa Yorumları. Moleküler Hücre Biyolojisi. 13 (6): 397–404. doi:10.1038 / nrm3352. PMC 3718675. PMID 22588366.
daha fazla okuma
- Smith JA, Stallons LJ, Collier JB, Chavin KD, Schnellmann RG (Şubat 2015). "Endotoksin kaynaklı akut böbrek hasarında toll benzeri reseptör 4'e bağlı mitojenle aktive olan protein kinaz kinaz / hücre dışı sinyalle düzenlenen kinaz sinyali yoluyla mitokondriyal biyogenezin bastırılması". The Journal of Pharmacology and Experimental Therapeutics. 352 (2): 346–57. doi:10.1124 / jpet.114.221085. PMC 4293437. PMID 25503387.
- Cameron RB, Beeson CC, Schnellmann RG (Aralık 2016). "Akut ve Kronik Dejeneratif Hastalıkların Tedavisinde Mitokondriyal Biyogeneze Neden Olan Terapötiklerin Geliştirilmesi". Tıbbi Kimya Dergisi. 59 (23): 10411–10434. doi:10.1021 / acs.jmedchem.6b00669. PMC 5564430. PMID 27560192.
- Whitaker RM, Corum D, Beeson CC, Schnellmann RG (2016). "Bir Farmakolojik Hedef Olarak Mitokondriyal Biyogenez: Akut ve Kronik Hastalıklara Yeni Bir Yaklaşım". Farmakoloji ve Toksikoloji Yıllık İncelemesi. 56: 229–49. doi:10.1146 / annurev-Pharmtox-010715-103155. PMID 26566156.
