Ozanimod - Ozanimod - Wikipedia
 | |
 | |
| Klinik veriler | |
|---|---|
| Ticari isimler | Zeposia |
| Diğer isimler | RPC-1063 |
| AHFS /Drugs.com | Monografi |
| MedlinePlus | a620029 |
| Lisans verileri |
|
| Gebelik kategori |
|
| Rotaları yönetim | Ağızla |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum |
|
| Farmakokinetik veri | |
| Eliminasyon yarı ömür | 19 saatleri |
| Tanımlayıcılar | |
| |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ECHA Bilgi Kartı | 100.247.081 |
| Kimyasal ve fiziksel veriler | |
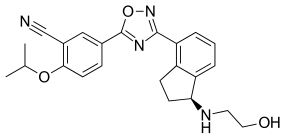
| Formül | C23H24N4Ö3 |
| Molar kütle | 404.470 g · mol−1 |
| 3 boyutlu model (JSmol ) | |
| |
| |
Ozanimod, marka adı altında satılan Zeposia, bir immünomodülatör ilaç tekrarlayanların tedavisi için multipl Skleroz (RMS), yetişkinlerde klinik olarak izole edilmiş sendromu, nükseden-düzelen hastalığı ve aktif ikincil ilerleyen hastalığı içerir.[4][2][5][6] Gibi davranır sfingosin-1-fosfat (S1P) reseptör agonisti, lenfositleri periferal lenfoid organlara ve bunların kronik enflamasyon bölgelerinden uzağa hapsetme.[6] Ozanimod, San Diego'daki Scripps Araştırma Enstitüsü tarafından Hugh Rosen ve Edward Roberts'ın laboratuarları tarafından keşfedildi ve biyoteknoloji şirketi Receptos Inc.'e lisanslandı. [7] Resepsiyonlar tarafından satın alındı Celgene 7.2 milyar dolara.[8]
En yaygın advers reaksiyonlar, üst solunum yolu enfeksiyonu, hepatik transaminaz yüksekliği, ortostatik hipotansiyon, idrar yolu enfeksiyonu, sırt ağrısı ve hipertansiyondur.[5]
Ozanimod, Mart 2020'de Amerika Birleşik Devletleri'nde tıbbi kullanım için onaylandı,[9][4][5] Mayıs 2020'de Avrupa Birliği'nde,[3] ve Temmuz 2020'de Avustralya'da.[1]
Farmakoloji
Farmakodinamik
Ozanimod, S1P1 ve S1P5 reseptörlerinin bir agonistidir.[6] Bu etkiyi doza bağımlı bir şekilde, üç karşılaştırıcıya 10 kat güçle gösterir.[6] Bu, selefine göre seçiciliğin gelişmesidir. Fingolimod, 5 izotipin tümüne özgü değildir.[6] S1P'nin agonizmi, doğrudan içselleştirilmesine ve bozulmasına neden olur. Ubikitin -proteozom yolu.[10] S1P kaybı, özellikle dolaşımdaki toplam lenfosit sayısında bir azalmaya yol açar. CD4 + CCR7 + ve CD8 + CCR7 + T hücreleri.[6][11]
Farmakokinetik
Ozanimod, yüksek oral biyoyararlanıma, yaklaşık 19 saatlik dolaşım yarı ömrüne sahiptir ve yaklaşık 6 saat sonra en yüksek kan plazma konsantrasyonlarına ulaşır.[6][11] Ozanimod, iki CYP enzimi tarafından ikisi de benzer farmakokinetiklere sahip iki aktif metabolit halinde dehidrojenize edilir.[11] Lenfosit sayısındaki azalma, tedavi kesildikten sonra yaklaşık 14 gün sürer.[11] Fingolimodun aksine, aktivasyon için fosforilasyon gerektirmez ve kardiyak anormallikler veya hepatotoksisite göstermez.[6]
Klinik denemeler
Mihenk taşı
Touchstone, ülseratif kolit tedavisi için çift kör, plasebo kontrollü bir faz II kliniktir. NCT01647516 -de ClinicalTrials.gov.[12][13] Orta ila şiddetli ÜK (Mayo Skoru 6-10) olan 18-75 yaş arası 197 hasta alındı ve plasebo, 0.5 mg veya 1 mg oral ozanimod ve ardından 1 haftalık doz artırımı verildi. 1 mg doz, UC'nin klinik remisyon oranında hafif bir artış ve plaseboya kıyasla toplam lenfosit düşüşü gösterdi; en yaygın yan etkiler baş ağrısı ve anemidir.[12] Yazarlar, bu çalışmadaki sınırlamaların kısa bir süre ve küçük örnek boyutu içerdiğini, yani güvenliği veya etkinliği değerlendiremediklerini belirtti.[12]
Parlaklık
Radiance, tekrarlayan multipl sklerozun tedavisi için çift kör, plasebo kontrollü, faz kombine II / III klinik bir çalışmadır.[14][15] Faz II denemesi için, RMS'li 18-55 yaş arası 258 hasta (Ortalama Genişletilmiş Engellilik Durumu Ölçeği 2.9) ya plasebo, 0.5 mg veya 1 mg oral ozanimod ve ardından 1 haftalık doz artırımı verildi.[14] Ozanimod, 24 haftalık bir süre boyunca tekrarlayan multipl sklerozu olan katılımcılarda MRI lezyon aktivitesini önemli ölçüde azalttı.[14] Her iki ozanimod dozu, beklenen% 60-70 azalmış lenfosit aralığına ulaştı ve sağlıklı gönüllülerde önceki bir faz 1 çalışmasıyla tutarlı bir güvenlik profili ile iyi tolere edildi.[14][16] Plaseboya kıyasla en yaygın yan etkiler: nazofarenjit, baş ağrısı ve üriner sistem enfeksiyonları olup, ciddi bulaşıcı veya kardiyak yan etkileri yoktur.[14] Bu sonuçlarla, her iki ozanimod dozu da 2 yıllık uzun faz III denemesine alındı ve tamamlandı, ancak Kasım 2016 itibarıyla yayınlanmadı.[14][15]
Güneş ışını
Sunbeam, tahmini 1200 hasta boyutuyla, optimum güvenlik-fayda ilişkisi ile dozu belirlemek için ikinci RMS faz III klinik çalışmadır.[14][17] Kasım 2014'te başladı ve tahmini tamamlanma tarihi Şubat 2017'dir.[17]
Ticari
Mayıs 2013'te halka açıldıktan sonra, Receptos, Inc. hisseleri, bir S1P immüno-modüle edici ilaç olarak gösterilen ozanimod klinik verileriyle yükseldi.[18][19] Ağustos 2015'te Receptos, eldeki nakit ve yeni borç kombinasyonu yoluyla Celgene tarafından 7,2 milyar dolara satın alındı ve hisse senedi değerinde% 22'lik bir artış sağladı.[8][20] Receptos, Inc. (Celgene), Temmuz 2016'da ozanimod sentezinin patentini aldı.[21] Celgene'in iltihaplanma ve immünoloji profilinin genişlemesiyle, şirket ozanimod'dan yıllık satışlarda 4 ila 6 milyar dolar elde etmeyi bekliyordu; ancak FDA, Şubat 2018'de ilacın onayı için başvurusunu reddetti.[19][22][23] Celgene Mart 2019'da yenilendi. Bristol-Myers Squibb, yeni sahibi olarak 26 Mart 2020'de, nükseden-düzelen MS dahil olmak üzere tekrarlayan multipl skleroz (MS) formları olan yetişkinleri tedavi etmek için ozanimod (Zeposia) oral kapsüller için FDA onayı aldı RRMS), aktif ikincil ilerleyen MS (SPMS) ve klinik olarak izole edilmiş sendrom (CIS).[5] Ozanimod, Mayıs 2020'de Avrupa Birliği'nde tıbbi kullanım için onaylandı,[3] ve Temmuz 2020'de Avustralya'da.[1]
Tarih
Birleşik Devletler Gıda ve İlaç İdaresi (FDA), multipl sklerozun tekrarlayan formları olan 1767 deneğin iki klinik denemesinden (Deneme 1 / NCT 02294058 ve Deneme 2 / NCT02047734) elde edilen kanıtlara dayanarak ozanimodu onayladı.[4] Denemeler ABD, Beyaz Rusya, Polonya, Rusya ve Ukrayna'da 173 merkezde gerçekleştirildi.[4] Denekler ozanimod veya karşılaştırıcı aldı (interferon β1a, bir yıla kadar (Deneme 1'de) veya iki yıla kadar (Deneme 2'de) tekrarlayan multipl skleroz formlarının tedavisi için onaylanmış bir ürün.[4] Denemeler tamamlanana kadar ne denekler ne de sağlık hizmeti sağlayıcıları hangi tedavinin verildiğini bilmiyordu.[4] Ozanimodun yararı, interferon β1a ile tedavi edilen deneklere kıyasla hastalık nüksetmesinde azalma yaşayan deneklerin yüzdesine dayalı olarak değerlendirildi.[4]
Araştırma
Ozanimod, ülseratif kolit ve Crohn hastalığı dahil olmak üzere ek immün inflamatuar endikasyonlar için geliştirilmektedir.[5][6]
Referanslar
- ^ a b c d "Zeposia Avustralya Reçeteli İlaç Karar Özeti". Tedavi Ürünleri İdaresi (TGA). 27 Temmuz 2020. Alındı 16 Ağustos 2020.
- ^ a b "Ağızdan kullanım için Zeposia (ozanimod) kapsülleri" (PDF). Celgene Corporation. 25 Mart 2020. Alındı 26 Mart 2020.
- ^ a b c "Zeposia EPAR". Avrupa İlaç Ajansı. 26 Mart 2020. Alındı 17 Ağustos 2020.
- ^ a b c d e f g "Uyuşturucu Denemelerine İlişkin Anlık Görüntüler: Zeposia". BİZE. Gıda ve İlaç İdaresi (FDA). 25 Mart 2020. Alındı 1 Nisan 2020.
 Bu makale, bu kaynaktan alınan metni içermektedir. kamu malı.
Bu makale, bu kaynaktan alınan metni içermektedir. kamu malı. - ^ a b c d e "ABD Gıda ve İlaç Dairesi, Bristol Myers Squibb'in Multipl Sklerozun Nükseden Formları İçin Yeni Bir Ağızdan Tedavi Olan Zeposia'yı (ozanimod) Onayladı". Bristol-Myers Squibb Şirketi (Basın bülteni). 26 Mart 2020. Alındı 26 Mart 2020.
- ^ a b c d e f g h ben Scott FL, Clemons B, Brooks J, Brahmachary E, Powell R, Dedman H, vd. (Haziran 2016). "Ozanimod (RPC1063), otoimmün hastalığı modifiye edici aktiviteye sahip güçlü bir sfingozin-1-fosfat reseptörü-1 (S1P1) ve reseptör-5 (S1P5) agonistidir". İngiliz Farmakoloji Dergisi. 173 (11): 1778–92. doi:10.1111 / bph.13476. PMC 4867749. PMID 26990079.
- ^ "FDA, multipl skleroz tedavisi için Scripps Research'te icat edilen bir ilaç olan ozanimodu onayladı". www.scripps.edu. Alındı 2020-12-05.
- ^ a b "Celgene Bağışıklık-İnflamatuar Hastalıklarda Receptos Edinerek Liderliği Geliştirecek". Celgene Corporation (Basın bülteni). 14 Temmuz 2015. Arşivlendi orijinal 17 Temmuz 2015. Alındı 26 Mart 2020.
- ^ "İlaç Onay Paketi: Zeposia". BİZE. Gıda ve İlaç İdaresi (FDA). 23 Nisan 2020. Alındı 3 Ekim 2020.
- ^ Jo E, Sanna MG, Gonzalez-Cabrera PJ, Thangada S, Tigyi G, Osborne DA, ve diğerleri. (Haziran 2005). "Yüksek verimli taramadan S1P1 seçici in vivo-aktif agonistler: reseptör etkileşimleri, sinyal verme ve kaderin kullanıma hazır kimyasal sondaları". Kimya ve Biyoloji. 12 (6): 703–15. doi:10.1016 / j.chembiol.2005.04.019. PMID 15975516.
- ^ a b c d Juif PE, Kraehenbuehl S, Dingemanse J (Ağustos 2016). "Sfingosin-1-fosfat reseptör modülatörlerinin klinik farmakolojisi, etkinliği ve güvenlik yönleri". İlaç Metabolizması ve Toksikoloji Üzerine Uzman Görüşü. 12 (8): 879–95. doi:10.1080/17425255.2016.1196188. PMID 27249325. S2CID 21915268.
- ^ a b c Sandborn WJ, Feagan BG, Wolf DC, D'Haens G, Vermeire S, Hanauer SB, ve diğerleri. (Mayıs 2016). "Ülseratif Kolit için Ozanimod İndüksiyon ve İdame Tedavisi". New England Tıp Dergisi. 374 (18): 1754–62. doi:10.1056 / NEJMoa1513248. PMID 27144850.
- ^ Klinik deneme numarası NCT01647516 "Ülseratif Kolitte RPC1063'ün Etkinlik ve Güvenlik Çalışması" için ClinicalTrials.gov
- ^ a b c d e f g Cohen JA, Arnold DL, Comi G, Bar-Or A, Gujrathi S, Hartung JP, ve diğerleri. (Nisan 2016). "Tekrarlayan multipl sklerozda (RADIANCE) seçici sfingosin 1-fosfat reseptör modülatörü ozanimodun güvenliği ve etkinliği: randomize, plasebo kontrollü, faz 2 çalışma". Neşter. Nöroloji. 15 (4): 373–81. doi:10.1016 / s1474-4422 (16) 00018-1. PMID 26879276. S2CID 3236201.
- ^ a b Klinik deneme numarası NCT01628393 "Tekrarlayan Multipl Skleroz Hastalarında RPC1063'ün Etkililik ve Güvenlik Çalışması (Aydınlık Çalışması)" için ClinicalTrials.gov
- ^ Hartung J (2012). "Sağlıklı Yetişkin Gönüllülerde Yeni Bir Seçici S1P1 Reseptör Agonisti olan Ağızdan Verilen RPC1063'ün Kapsamlı QT / QTc (TQT) Çalışmasının Sonuçları" (PDF).
- ^ a b Klinik deneme numarası NCT02294058 "Tekrarlayan MS'de RPC1063'ün 3. Aşama Çalışması" için ClinicalTrials.gov
- ^ Pollack A (2015-07-14). "Celgene, Receptos için 7,2 Milyar Dolarlık Anlaşmayı Kabul Etti". New York Times.
- ^ a b "Celgene 2015 Faaliyet Raporu" (PDF).
- ^ "Celgene 7,2 Milyar Dolara Recepto Satın Alacak". Wall Street Journal. 14 Temmuz 2015.
- ^ US 9388147, Yeager AR, Brahmachary E, Martinborough E, Scott FL, Timony GA, Brooks JL, Tamiya J, Huang L, Moorjani M, Boehm MF, Hanson MA, Peach R, "Seçici sfingosin 1 fosfat reseptör modülatörleri ve kiral sentez yöntemleri" , 22 Ekim 2015 tarihinde Receptos ve Celgene International II Sarl'a atandı
- ^ "Celgene 7,2 Milyar Dolara Recepto'ları Alacak". Genetik Mühendisliği ve Biyoteknoloji Haberleri. 2015-07-14.
- ^ Editör, Reuters. "ABD FDA, Celgene MS ilacına başvurmayı reddetti, hisseler düştü". BİZE. Alındı 2018-03-28.
Dış bağlantılar
- "Ozanimod". İlaç Bilgi Portalı. ABD Ulusal Tıp Kütüphanesi.
- "Ozanimod hidroklorür". İlaç Bilgi Portalı. ABD Ulusal Tıp Kütüphanesi.
