Paulings kuralları - Paulings rules - Wikipedia
Pauling kuralları tarafından yayınlanan beş kural Linus Pauling 1929'da tahmin ve rasyonelleştirmek kristal yapılar nın-nin iyonik bileşikler.[1][2]
İlk kural: yarıçap oranı kuralı
Tipik iyonik katılar için, katyonlar daha küçük anyonlar ve her katyonun çevresi koordine bir oluşturan anyonlar çokyüzlü. Toplamı iyonik yarıçap katyon-anyon mesafesini belirlerken katyon anyon yarıçap oranı (veya ) belirler koordinasyon numarası Katyonun (C.N.) yanı sıra koordine edilmiş anyon polihedronunun şekli.[3][4]
Aşağıdaki tablodaki koordinasyon numaraları ve karşılık gelen çokyüzlüler için Pauling matematiksel olarak minimum Katyonun belirli sayıda anyonla temas halinde olduğu yarıçap oranı (iyonları sert küreler olarak düşünerek). Katyon daha küçükse, anyonlarla temas etmeyecek ve bu da daha düşük bir koordinasyon sayısına yol açan kararsızlığa neden olacaktır.

| C.N. | Çokyüzlü | Yarıçap oranı |
|---|---|---|
| 3 | üçgensel | 0.155 |
| 4 | dörtyüzlü | 0.225 |
| 6 | sekiz yüzlü | 0.414 |
| 7 | başlıklı oktahedron | 0.592 |
| 8 | kare antiprizma (antiküpü) | 0.645 |
| 8 | küp | 0.732 |
| 9 | üç parçalı üçgen prizma | 0.732 |
| 12 | küpoktahedron | 1.00 |
Sağdaki üç diyagram, koordinasyon sayısı altı olan oktahedral koordinasyona karşılık gelir: diyagramların düzleminde dört anyon ve bu düzlemin üstünde ve altında iki (gösterilmemiştir). Merkezi diyagram, minimum yarıçap oranını gösterir. Katyon ve herhangi iki anyon bir sağ üçgen, ile veya . Sonra . Benzer geometrik ispatlar, oldukça simetrik olan C.N. durumları için minimum yarıçap oranlarını verir. = 3, 4 ve 8.[5]


C.N. için = 6 ve minimumdan daha büyük bir yarıçap oranı, katyon altı anyonla hala temas halinde olduğundan kristal daha kararlıdır, ancak anyonlar birbirlerinden daha uzaktır, böylece karşılıklı itmeleri azalır. Daha sonra bir oktahedron, 0,414'e eşit veya daha büyük bir yarıçap oranıyla oluşabilir, ancak oran 0,732'nin üzerine çıktıkça, bir kübik geometri daha kararlı hale gelir. Bu, neden Na'nın+ 0.55 yarıçap oranına sahip NaCl'de oktahedral koordinasyona sahipken Cs+ 0.93 yarıçap oranına sahip CsCl'de kübik koordinasyona sahiptir.[6]
Yarıçap oranı minimumdan azsa, iki anyon ayrılma eğiliminde olacak ve kalan dördü, hepsinin katyonla temas halinde olduğu bir tetrahedral geometriye yeniden düzenlenecektir.
Yarıçap oranı kuralları, koordinasyon sayılarını tahmin etmede bir miktar başarılı olan ilk yaklaşımdır, ancak birçok istisna mevcuttur.[4]
İkinci kural: elektrostatik değerlik kuralı
Pauling belirli bir katyon için[2] elektrostatik bağ gücü her koordine edilmiş anyona burada z, katyon yükü ve ν, katyon koordinasyon numarasıdır. Korumak için kararlı bir iyonik yapı düzenlenmiştir yerel elektronötrlük, böylece elektrostatik bağların bir anyona olan kuvvetlerinin toplamı, şarj etmek o anyonda.
nerede anyon yüküdür ve toplamı bitişik katyonların üzerindedir. Basit katılar için belirli bir anyona koordine edilen tüm katyonlar için eşittir, böylece anyon koordinasyon numarası, anyon yükünün her elektrostatik bağ gücüne bölünmesiyle elde edilir. Tabloda bazı örnekler verilmiştir.
| Katyon | Yarıçap oranı | Katyon C.N. | Elektrostatik bağ kuvveti | Anyon C.N. |
|---|---|---|---|---|
| Li+ | 0.34 | 4 | 0.25 | 8 |
| Mg2+ | 0.47 | 6 | 0.33 | 6 |
| Sc3+ | 0.60 | 6 | 0.5 | 4 |
Pauling, bu kuralın, daha karmaşık kristaller için dikkate alınacak olası yapıları sınırlamada yararlı olduğunu gösterdi. alüminosilikat mineral ortoklaz, KAISi3Ö8, üç farklı katyon ile.[2]
Üçüncü kural: çokyüzlü köşelerin, kenarların ve yüzlerin paylaşılması
Kenarların ve özellikle yüzlerin iki anyon çokyüzlü tarafından paylaşılması, iyonik bir yapının stabilitesini azaltır. Köşelerin paylaşılması istikrarı o kadar azaltmaz, bu nedenle (örneğin) octahedra köşeleri birbirleriyle paylaşabilir.[7]
Stabilitedeki azalma, ortak kenarların ve yüzlerin katyonları birbirine daha yakın yerleştirmesi ve böylece katyon-katyon elektrostatik itmenin artması nedeniyledir. Etki, yüksek yüklü ve düşük C.N. (özellikle r + / r-, çok yüzlü kararlılığın alt sınırına yaklaştığında).
Bir örnek olarak Pauling, üç mineral formunu düşündü. titanyum dioksit Ti için her birinin koordinasyon numarası 64+ katyonlar. En kararlı (ve en bol) biçim rutil, octahedra koordinasyonunun, her birinin bitişik oktahedra ile sadece iki kenarı (ve yüzü olmayan) paylaşacağı şekilde düzenlendiği. Daha az kararlı olan diğer iki form Brookite ve anataz, her bir oktahedronun bitişik oktahedra ile sırasıyla üç ve dört kenarı paylaştığı.[7]
Dördüncü kural: farklı katyonlar içeren kristaller
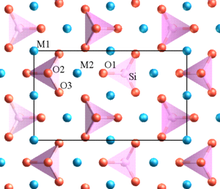
İçinde kristal farklı katyonlar içerenler, yüksek olanlar valans ve küçük koordinasyon sayısı, çokyüzlü unsurları birbirleriyle paylaşmama eğilimindedir.[8] Bu kural, aralarındaki elektrostatik itmeyi azaltmak için yüksek yüklü katyonlar arasındaki mesafeyi artırma eğilimindedir.
Pauling'in örneklerinden biri olivin, M2SiO4M, bir Mg karışımıdır2+ bazı sitelerde ve Fe2+ diğerlerinde. Yapı farklı SiO içerir4 herhangi bir oksijeni (köşelerde, kenarlarda veya yüzlerde) birbirleriyle paylaşmayan tetrahedra. Düşük değerlikli Mg2+ ve Fe2+ katyonlar, oksijenleri paylaşan polihedra ile çevrilidir.
Beşinci kural: cimrilik kuralı
Bir kristaldeki esasen farklı türdeki bileşenlerin sayısı az olma eğilimindedir. Yinelenen birimler aynı olma eğiliminde olacaktır çünkü yapıdaki her atom belirli bir ortamda en kararlıdır. Tetrahedra veya oktahedra gibi iki veya üç tür çokyüzlü olabilir, ancak çok farklı türler olmayacaktır.
Referanslar
- ^ Pauling, Linus (1929). "Karmaşık iyonik kristallerin yapısını belirleyen ilkeler". J. Am. Chem. Soc. 51 (4): 1010–1026. doi:10.1021 / ja01379a006.
- ^ a b c Pauling, Linus (1960). Kimyasal bağın doğası ve molekül ve kristallerin yapısı; modern yapısal kimyaya giriş (3. baskı). Ithaca (NY): Cornell University Press. pp.543–562. ISBN 0-8014-0333-2.
- ^ Pauling (1960) s. 524
- ^ a b Housecroft C.E. ve Sharpe A.G. İnorganik kimya (2. baskı, Pearson Prentice-Hall 2005) s. 145 ISBN 0130-39913-2
- ^ Toofan J. (1994) J. Chem. Educ. 71 (9), 147 (ve Erratum s. 749) Kritik Yarıçap Oranı ve Koordinasyon Numaraları Arasında Basit Bir İfade
- ^ R.H. Petrucci, W.S. Harwood ve F.G. Herring, General Chemistry (8. baskı, Prentice-Hall 2002) s.518 ISBN 0-13-014329-4
- ^ a b Pauling (1960) s. 559
- ^ Pauling (1960), s. 561









