Fosfonyum - Phosphonium - Wikipedia

4ana fosfonyum katyonu.
fosfonyum (daha anlaşılmaz bir şekilde: fosfin) katyon tanımlar çok atomlu katyonlar ile kimyasal formül PR+
4 (R = H, alkil, aril, halojenür). Dört yüzlüdürler ve genellikle renksizdirler.[1]
Fosfonyum katyon türleri
Protonlanmış fosfinler
Ebeveyn fosfonyum dır-dir PH+
4 iyodür tuzunda bulunduğu gibi, fosfonyum iyodür. Ebeveynin tuzları PH+
4 nadiren karşılaşılır, ancak bu iyon, endüstriyel olarak yararlı olanların hazırlanmasında bir ara maddedir. tetrakis (hidroksimetil) fosfonyum klorür:
- PH3 + HCl + 4 CH2O → P (CH
2OH)+
4Cl−
Birçok organofosfonyum tuzu, protonasyonla üretilir. birincil, ikincil ve üçüncül fosfinler:
- PR3 + H+ → HPR+
3
Fosfinlerin bazikliği olağan eğilimleri takip eder, R = alkil, R = arilden daha baziktir.[2]
Tetraorganofosfonyum katyonları
En yaygın fosfonyum bileşikleri, fosfora bağlı dört organik ikame ediciye sahiptir. dörtlü fosfonyum katyonları arasında tetrafenilfosfonyum, (C6H5)4P+ ve tetrametilfosfonyum P (CH
3)+
4.

Kuaterner fosfonyum katyonları (PR+
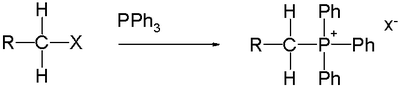
4) organofosfinlerin alkilasyonu ile üretilir.[3] Örneğin, tepkisi trifenilfosfin ile metil bromür verir metiltrifenilfosfonyum bromür, bir öncüsü Wittig reaktifi:[5]
- PPh3 + CH3Br → CH
3PPh+
3Br−
Katı fosfor pentaklorür bir iyonik bileşik, formüle edilmiş PCI+
4PCI−
6yani tetraklorofosfonyum katyonu içeren bir tuz.[6][7] Seyreltik çözeltiler aşağıdaki dengeye göre ayrışır:
- PCI5 ⇌ PCI+
4 + Cl−
Trifenilfosfin diklorür (Ph3PCI2) ortama bağlı olarak hem pentacoordinate fosforan hem de klorotrifenilfosfonyum klorür olarak bulunur.[8] Durum PCI'ninkine benzer5. İyonik bir bileşiktir (PPh3Cl)+Cl− içinde kutupsal çözümler ve moleküler bir tür trigonal bipiramidal moleküler geometri apolar çözümde.[9]
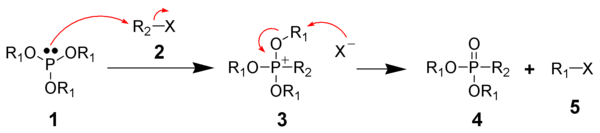
Alkoksifosfonyum tuzları: Arbuzov reaksiyonu
Michaelis-Arbuzov reaksiyonu ... Kimyasal reaksiyon bir üç değerlikli fosfor ester bir alkil halojenür oluşturmak için beş değerli fosfor türleri ve başka bir alkil halojenür. Genellikle, fosfor substratı bir fosfit esterdir (P (OR)3) ve alkilleyici ajan bir alkil iyodürdür.[10]
Kullanımlar
Tekstil yüzeyler

Tetrakis (hidroksimetil) fosfonyum klorür kırışmaya dayanıklı ve kırışmaya dayanıklı üretiminde endüstriyel öneme sahiptir ve alev geciktirici bitirir pamuklu tekstiller ve diğer selülozik kumaşlar üzerinde.[11][12] Proban Prosesi ile THPC'den alev geciktirici bir yüzey hazırlanabilir,[13] THPC'nin üre ile muamele edildiği. üre THPC üzerinde hidroksimetil grupları ile yoğunlaşır. Fosfonyum yapısı, fosfin oksit bu reaksiyonun sonucu olarak.[14]
Faz transfer katalizörleri ve çökeltici maddeler
Organik fosfonyum katyonları lipofiliktir ve şu durumlarda yararlı olabilir: faz transfer katalizi, kuaterner amonyum tuzları gibi.
Katyon tetrafenilfosfonyum (PPh+
4) yararlı bir çökeltme maddesidir.
Organik sentez için reaktifler
Wittig reaktifleri, organik sentez. Fosfonyum tuzlarından elde edilirler. Gibi güçlü bir temel butillityum veya deprotonasyon için sodyum amid gereklidir:
- [Doktor3P+CH2R] X− + C4H9Li → Ph3P = CHR + Sıvı + C4H10
En basit ilidelerden biri metilenetrifenilfosforan (Ph3P = CH2).[5]
Ph bileşikleri3PX2 (X = Cl, Br), Kirsanov reaksiyonu.[15]
Kinnear-Perren reaksiyonu alkilfosfonil diklorürleri hazırlamak için kullanılır (RP (O) Cl2) ve esterler (RP (O) (OR ′)2). Anahtar bir ara ürün, alkiltriklorofosfonyum tuzlarıdır ve aşağıdakilerin alkilasyonu ile elde edilir. fosfor triklorür:[16]
- RCl + PCl3 + AlCl3 → [RPCl3]+AlCl4−
Ayrıca bakınız
- Amonyum (NH+
4) - Hidronyum (H3Ö+)
- Onium bileşikleri
- Organofosfor kimyası
Referanslar
- ^ Corbridge, D.E.C. (1995). Fosfor: Kimyası, Biyokimyası ve Teknolojisinin Ana Hatları (5. baskı). Amsterdam: Elsevier. ISBN 978-0-444-89307-9.
- ^ Aydınlatılmış.; Lough, A. J .; Morris, R.H. (2007). "[D'deki Fosfonyum ve Demir Hidrit Bileşiklerinin Tetrafloroborat Tuzlarının Asitlik Ölçeği2] Diklorometan ". Chem. Avro. J. 13 (13): 3796–3803. doi:10.1002 / chem.200601484. PMID 17245785.
- ^ a b H.F. Klein (1978). Trimetilfosfonyum Metilür (Trimetil Metilenfosforan). İnorganik Sentezler. 18. s. 138–140. doi:10.1002 / 9780470132494.ch23. ISBN 9780470132494.
- ^ Finch, A .; Fitch, A.N .; Gates, P.N. (1993). "Fosfor pentaklorürün yarı kararlı bir modifikasyonunun Kristal ve Moleküler yapısı". Journal of the Chemical Society, Chemical Communications: 957–958.
- ^ a b Wittig; Schoellkopf, U. (1960). "Metilensiklohekzan". Organik Sentezler. 40: 66. doi:10.15227 / orgsyn.040.0066.. Ph'yi açıklar3P = CH2.
- ^ Holleman, A. F .; Wiber, E .; Wiberg, N. (2001). İnorganik kimya. Akademik Basın. ISBN 978-0-12-352651-9.
- ^ Suter, R. W .; Knachel, H. C .; Petro, V. P .; Howatson, J.H. & Shore, S.G. (1978). "İyonlaştırıcı ve İyonlaştırıcı Olmayan Çözücülerde Fosfor (V) Klorürün Doğası". Amerikan Kimya Derneği Dergisi. 95 (5): 1474–1479. doi:10.1021 / ja00786a021.
- ^ S. M. Godfrey; C. A. McAuliffe; R. G. Pritchard; J. M. Sheffield (1996). "Reaktif Ph'nin bir X-ışını kristalorgrafik çalışması3PCI2; ücret transferi değil, R3P – Cl – Cl, trigonal bipiramidal veya [R3PCl] Cl ancak alışılmadık bir dinükleer iyonik tür, [Ph3PCI+⋯ Cl–⋯+CIPPh3] Cl uzun Cl – Cl kontakları içeren ". Kimyasal İletişim (22): 2521–2522. doi:10.1039 / CC9960002521.
- ^ Jennings, EV; Nikitin, K; Ortin, Y; Gilheany, DG (2014). "Fosfonyum Tuzlarında Nükleofilik Yer Değiştirme". J. Am. Chem. Soc. 136 (46): 16217–16226. doi:10.1021 / ja507433g. PMID 25384344.
- ^ Bhattacharya, A. K .; Thyagarajan, G. (1981). "Michaelis-Arbuzov yeniden düzenlemesi". Chem. Rev. 81 (4): 415–430. doi:10.1021 / cr00044a004.
- ^ Weil, Edward D .; Levchik, Sergei V. (2008). "Ticari Kullanımda veya Tekstil İçin Geliştirmede Alev Geciktiriciler". J. Fire Sci. 26 (3): 243–281. doi:10.1177/0734904108089485.
- ^ Svara, Jürgen; Weferling, Norbert; Hofmann, Thomas. Fosfor Bileşikleri, Organik. Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons, Inc., 2008 doi:10.1002 / 14356007.a19_545.pub2
- ^ "Sık sorulan sorular: PROBAN® süreci nedir?". Rhodia Proban. Alındı 25 Şubat 2013.
- ^ Reeves, Wilson A .; Guthrie, John D. (1956). "Aleve Dayanıklı Polimerler için Ara Ürün - Tetrakis (hidroksimetil) fosfonyum Klorür Reaksiyonları". Endüstri ve Mühendislik Kimyası. 48 (1): 64–67. doi:10.1021 / ie50553a021.
- ^ Organofosfor Kimyasında Yapılan Çalışmalar. I.Alkollerin ve Fenollerin Tersiyer Fosfin Dihalidler ile Halojenürlere Dönüşümü G. A. Wiley, R.L. Hershkowitz, B. M. Rein, B. C. Chung J. Am. Chem. Soc., 1964, 86 (5), s. 964–965 doi:10.1021 / ja01059a073
- ^ Svara, J .; Weferling, N .; Hofmann, T. "Fosfor Bileşikleri, Organik". Ullmann'ın Endüstriyel Kimya Ansiklopedisi. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a19_545.pub2.