Fizyorpsiyon - Physisorption - Wikipedia
Fizyorpsiyon, olarak da adlandırılır fiziksel adsorpsiyon, atom veya molekülün elektronik yapısının zorlukla bozulduğu bir süreçtir. adsorpsiyon.[1][2][3]
Giriş
Fizyorpsiyonun temel etkileşim gücü Van der Waals'dır (VDW). Etkileşim enerjisi çok zayıf olsa da (~ 10-100 meV) fiziksel soğurum doğada önemli bir rol oynar. Örneğin, van der Waals'ın yüzeyler ve ayak kılları arasındaki çekim kertenkeleler dikey duvarlara tırmanma konusunda olağanüstü bir yetenek sağlar.[4] Van der Waals kuvvetleri, indüklenmiş, kalıcı veya geçici elektrik dipolleri arasındaki etkileşimlerden kaynaklanır.
Kıyasla kemisorpsiyon Bağlayıcı atomların veya moleküllerin elektronik yapısının değiştiği ve kovalent veya iyonik bağların oluştuğu, fiziksel soğurum kimyasal bağ yapısında değişikliklere neden olmaz. Uygulamada, belirli bir adsorpsiyonun fizisorpsiyon veya kemisorpsiyon olarak sınıflandırılması, temel olarak bağlanma enerjisi Fizyorpsiyon, atom başına bazında kimyasal bir bağ içeren herhangi bir bağlantı türünden çok daha zayıf olmakla birlikte, substrata adsorbatın oranı.
Görüntü ücretine göre modelleme
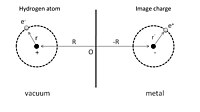
Fizyorpsiyonun basit bir örneğini vermek için, ilk olarak Şekil 1'de gösterildiği gibi, mükemmel bir iletkenin önünde adsorbe edilmiş bir hidrojen atomunu düşünebiliriz. R = (0, 0, Z) ve elektronunun konum koordinatı, r = (x, y, z) çekirdeğe göre verilir. Adsorpsiyon süreci, bu hidrojen atomu ile iletkendeki hem çekirdek hem de elektronun görüntü yükleri arasındaki etkileşim olarak görülebilir. Sonuç olarak, toplam elektrostatik enerji, çekim ve itme terimlerinin toplamıdır:
İlk terim, çekirdeğin ve onun görüntü yükünün çekici etkileşimidir ve ikinci terim, elektron ve onun görüntü yükünün etkileşiminden kaynaklanmaktadır. İtici etkileşim, sırasıyla çekirdek ve görüntü elektronu arasındaki etkileşimden ve elektron ile görüntü çekirdeği arasındaki etkileşimden kaynaklanan üçüncü ve dördüncü terimlerde gösterilir.
Tarafından Taylor genişlemesi güçlerinde |r| / |R|, bu etkileşim enerjisi ayrıca şu şekilde ifade edilebilir:
Yok olmayan ilk terimden, fizisorpsiyon potansiyelinin mesafeye bağlı olduğu bulunabilir. Z adsorbe edilmiş atom ve yüzey arasında Z−3aksine r−6 moleküler bağımlılık van der Waals potansiyel, nerede r ikisi arasındaki mesafedir dipoller.
Kuantum mekanik osilatör ile modelleme
van der Waals bağlanma enerjisi başka bir basit fiziksel resimle analiz edilebilir: bir elektronun çekirdeği etrafındaki hareketini üç boyutlu bir basitle modelleme harmonik osilatör potansiyel enerji ile Va:
nerede me ve ω sırasıyla elektronun kütle ve titreşim frekansıdır.
Bu atom bir metalin yüzeyine yaklaşıp adsorpsiyon oluşturduğunda, bu potansiyel enerji Va yer değiştirmelerde ikinci dereceden ek potansiyel terimlerle görüntü ücretlendirmeleri nedeniyle değiştirilecektir:
- (yukarıdaki Taylor genişlemesinden.)
Varsayım
potansiyel, şu şekilde yaklaşıktır:
- ,
nerede
Elektronun temel durumda olduğu varsayılırsa, van der Waals bağlanma enerjisi esasen sıfır noktası enerjisinin değişimidir:
Bu ifade aynı zamanda Z−3 van der Waals etkileşiminin bağımlılığı.
Dahası, atomik polarize edilebilirlik,
van der Waals potansiyeli daha da basitleştirilebilir:
nerede
atomik polarize edilebilirlik ile ilgili olan van der Waals sabitidir.
Ayrıca, yukarıdaki Taylor açılımındaki dördüncü dereceden düzeltmeyi şu şekilde ifade ederek (ACvZ0) / (Z4), nerede a biraz sabit, tanımlayabiliriz Z0 pozisyonu olarak dinamik görüntü düzlemi ve elde et
| O | Ne | Ar | Kr | Xe | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Cv | Z0 | Cv | Z0 | Cv | Z0 | Cv | Z0 | Cv | Z0 | |
| Cu | 0.225 | 0.22 | 0.452 | 0.21 | 1.501 | 0.26 | 2.11 | 0.27 | 3.085 | 0.29 |
| Ag | 0.249 | 0.2 | 0.502 | 0.19 | 1.623 | 0.24 | 2.263 | 0.25 | 3.277 | 0.27 |
| Au | 0.274 | 0.16 | 0.554 | 0.15 | 1.768 | 0.19 | 2.455 | 0.2 | 3.533 | 0.22 |
Kökeni Z0 elektron dalga fonksiyonunun yüzeyden dökülmesinden gelir. Sonuç olarak, uzay koordinatı için referansı temsil eden görüntü düzleminin konumu, alt tabaka yüzeyinin kendisinden farklıdır ve Z0.
Tablo 1, jöle van der Waals sabiti için model hesaplama Cv ve dinamik görüntü düzlemi Z0 çeşitli metal yüzeyler üzerinde nadir gaz atomları. Artan Cv He'den Xe'ye tüm metal substratlar için daha büyük atomik polarize edilebilirlik daha ağır nadir gaz atomlarının. Dinamik görüntü düzleminin konumu için, artan dielektrik fonksiyonla azalır ve tipik olarak 0,2 Å düzenindedir.
Fizyorpsiyon potansiyeli
Olsa bile van der Waals etkileşimi çekicidir, çünkü adsorbe edilmiş atom yüzeye yaklaştıkça elektronun dalga fonksiyonu yüzey atomlarınınkiyle örtüşmeye başlar. Dahası, yaklaşan atom ve yüzey atomlarının dalga fonksiyonlarının ortogonalliği nedeniyle sistemin enerjisi artacaktır.
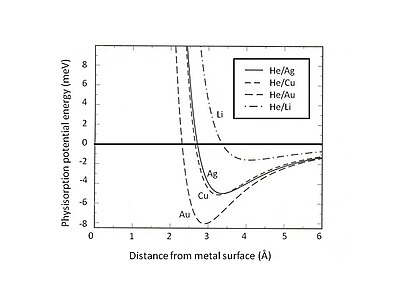
Bu Pauli dışlama ve itme, yüzey etkileşimine hakim olan kapalı değerlik kabuklarına sahip atomlar için özellikle güçlüdür. Sonuç olarak, minimum fiziksel soğurma enerjisi, uzun menzilli van der Waals çekimi ile kısa menzil arasındaki denge ile bulunmalıdır. Pauli itme. Örneğin, fiziksel emilimin toplam etkileşimini iki katkıya ayırarak - kısa vadeli bir terim Hartree – Fock teori ve uzun menzilli van der Waals çekim - adsorbe edilen nadir gazlar için fiziksel soğurmanın denge konumu jöle substrat belirlenebilir.[5] Şekil 2, tarafından açıklanan Ag, Cu ve Au substratlarına adsorbe edilmiş He'nin fizisorpsiyon potansiyel enerjisini gösterir. jöle farklı yoğunluklarda smear-out arka plan pozitif yükleri olan model. Zayıf van der Waals etkileşiminin sığ çekici enerji kuyularına (<10 meV) yol açtığı bulunabilir. Fizyorpsiyon potansiyel enerjisini araştırmak için deneysel yöntemlerden biri saçılma sürecidir, örneğin metal yüzeylerden saçılan inert gaz atomları. Saçılan atomlar ve yüzey arasındaki etkileşim potansiyelinin belirli belirli özellikleri, saçılmış parçacıkların deneysel olarak belirlenen açısal dağılımı ve enine kesitleri analiz edilerek çıkarılabilir.
Kuantum Mekanik - Yüzey alanı ve gözeneklilik için Termodinamik Modelleme
1980'den beri adsorpsiyonu açıklamak ve işe yarayan denklemleri elde etmek için iki teori üzerinde çalışıldı. Bu ikisi, chi hipotezi, kuantum mekaniksel türetme ve Aşırı Yüzey Çalışması, ESW olarak adlandırılır.[6]. Her iki teori de düz yüzeyler için aynı denklemi verir:
Nerede U birim adım işlevidir. Diğer sembollerin tanımları aşağıdaki gibidir:

"reklamlar", "adsorbe edilmiş" anlamına gelirken, "m", "tek katman eşdeğeri" anlamına gelir ve "buhar", katı numune ile aynı sıcaklıkta sıvı adsorptifin buhar basıncına referansta bulunur. Birim işlevi, adsorbe edilen ilk molekül için adsorpsiyon molar enerjisinin tanımını şu şekilde oluşturur:
Arsa adsorbe edilmiş chi arsa olarak adlandırılır. Düz yüzeyler için chi grafiğinin eğimi yüzey alanını verir. Ampirik olarak, bu arsa Polanyi tarafından izoterm için çok iyi bir uyum olarak fark edildi.[7][8][9] ve ayrıca deBoer ve Zwikker tarafından[10] ama takip edilmedi. Bu, önceki durumda Einstein'ın ve ikinci durumda Brunauer'in eleştirisinden kaynaklanıyordu. Bu düz yüzey denklemi, normal karşılaştırma eğrileri geleneğinde bir "standart eğri" olarak kullanılabilir, ancak gözenekli numunenin grafiğin erken kısmı e karşı kendi kendine standart olarak hareket eder. Ultramik gözenekli, mikro gözenekli ve mezogözenekli koşullar bu teknik kullanılarak analiz edilebilir. Gözenekli numuneler dahil tam izoterm uyumları için tipik standart sapmalar tipik olarak% 2'den azdır.
Homojen, gözeneksiz bir yüzey üzerindeki iyi verilere tipik bir uyum şekil 3'te gösterilmektedir. Veriler Payne, Sing ve Turk'e aittir.[11] ve oluşturmak için kullanıldı -s standart eğrisi. BET'in aksine, yalnızca en iyi şekilde 0,05 ile 0,35 P/Pvap, uyum aralığı tam izotermdir.
Kemisorpsiyon ile karşılaştırma
- Fizyorpsiyon genel bir fenomendir ve herhangi bir katı / sıvı veya katı / gaz sisteminde meydana gelir. Kimyasal soğurma kimyasal özgüllük ile karakterizedir.
- Fizyorpsiyonda, adsorban ve adsorbatın elektronik durumlarının bozulması minimumdur. Adsorpsiyon kuvvetleri arasında Londra Kuvvetleri, dipol-dipol çekimleri, dipol kaynaklı çekim ve "hidrojen bağı" bulunur. Kemisorpsiyon için, elektronik hallerdeki değişiklikler, uygun fiziksel yollarla, başka bir deyişle kimyasal bağlanma ile tespit edilebilir.
- Fizyorpsiyonun tipik bağlanma enerjisi yaklaşık 10-300 meV'dir ve lokalize değildir. Kemisorpsiyon genellikle 1-10 eV enerjili ve lokalize bağlanma oluşturur.
- Bir gaz fazından fiziksel soğurmanın temel adımı bir aktivasyon enerjisi içermez. Kimyasal soğurma genellikle bir aktivasyon enerjisi içerir.
- Fizyorpsiyon gaz fazı molekülleri için adsorbatlar, gözeneklilik gibi fiziksel engeller müdahale etmedikçe çok katmanlı adsorpsiyon oluşturur. Kemisorpsiyonda, moleküller yüzeyde değerlik bağları ile adsorbe edilir ve yalnızca tek tabakalı adsorpsiyon oluşturur.
- Atomik kuvvet mikroskobunun ucuna bir CO molekülü ekleyerek ve bunun tek bir demir atomu ile etkileşimi ölçülerek fizyorpsiyondan kemisorpsiyona doğrudan bir geçiş gözlenmiştir. * Huber, F .; et al. (12 Eylül 2019). "Fizyorpsiyondan kemisorpsiyona geçişi gösteren kimyasal bağ oluşumu". Bilim. 365 (xx): xx. Bibcode:2019Sci ... 365..xxxE. doi:10.1126 / science.aay3444. PMID 25791086. Bu etki, 1960'ların sonlarında saha emisyonu ve ESR ölçümlerinden gözlemlenmiş ve Moyes and Wells tarafından rapor edilmiştir.[12]
Ayrıca bakınız
Referanslar
- ^ K. Oura; et al. (2003), Yüzey Bilimi, Giriş, Berlin: Springer, ISBN 978-3-540-00545-2
- ^ M. C. Desjonqueres; et al. (1996), Yüzey fiziğinde kavramlar (2. baskı), New York: Springer-Verlag, ISBN 978-3-540-58622-7, alındı 29 Ağustos 2012
- ^ Hans Luth; et al. (1993), Katıların yüzeyleri ve arayüzleri, Springer-Verlag, ISBN 978-3-540-56840-7
- ^ K. Sonbahar; et al. (2000), "Tek bir kertenkele ayak kılının yapışma kuvveti", Doğa, 405 (6787): 681–5, Bibcode:2000Natur.405..681A, doi:10.1038/35015073, PMID 10864324
- ^ a b E. Zaremba ve W. Kohn (1977), "Basit ve asil metal yüzeylerde helyum adsorpsiyonu teorisi", Phys. Rev. B, 15 (4): 1769–1781, Bibcode:1977PhRvB. 15.1769Z, doi:10.1103 / PhysRevB.15.1769
- ^ Condon James (2020). Fizyorpsiyon ile Yüzey Alanı ve Gözeneklilik Belirlemeleri, 2. baskı. Ölçme, Klasik Teori ve Kuantum Teorisi. Amsterdam.NL: Elsevier. pp. Bölüm 3, 4 ve 5. ISBN 978-0-12-818785-2.
- ^ Polanyi, M. (1914). Verk. Deutsch. Physik, Gaz. 16: 1012. Eksik veya boş
| title =(Yardım) - ^ Polanyi, M. (1920). "Neueres über Adsorption und Ursache der Adsorptionskräfte". Z. Electrochem. 26: 370–374.
- ^ Polanyi, M. (1929). "Grundlagen der Potentialtheorie der Adsorpsiyon". Z Electrohem. 35: 431–432.
- ^ deBoer, J.H .; Zwikker, C. (1929). "Adsorpsiyon ayrıca Folge von Polarization". Z. Phys. Kimya. B3: 407–420.
- ^ Payne, D. A .; Sing, K. S. W .; D.H. Türk (1973). "Gözenekli ve gözenekli olmayan hidroksile silis üzerinde argon ve nitrojen adsorpsiyon izotermlerinin karşılaştırılması". J. Kolloid Arayüz Bilimi. 43: 287.
- ^ Moyes, M. L .; Monson, P.A. (1973). "Benzenin Metaller Üzerindeki Adsorpsiyonu". Adv. Katal. 20: 591–622.