Rossmann kıvrımı - Rossmann fold
| Rossmann benzeri alfa / beta / alfa sandviç katlama | |
|---|---|
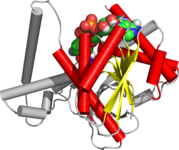
 NAD / NADP bağlayıcı rossmann kat bölgeleri. Resim, alkol dehidrojenazdaki beta-alfa katlanmasını göstermektedir. | |
| Tanımlayıcılar | |
| Sembol | Rossmann benzeri_a / b / a_fold |
| Pfam klan | CL0039 |
| InterPro | IPR014729 |
Rossmann kıvrımı içinde bulunan üçüncül bir kıvrımdır proteinler bu bağlayıcı nükleotidler enzim gibi kofaktörler HEVES, NAD+, ve NADP+. Bu kıvrım, dönüşümlü beta dizileri ve alfa sarmal beta iplikçiklerinin birbirine hidrojene bağlı olduğu segmentler beta sayfası ve alfa sarmalları, üç katmanlı bir sandviç üretmek için yaprağın her iki yüzünü çevreler. Klasik Rossmann kıvrımı altı beta iplikçik içerirken, bazen Rossmann benzeri kıvrımlar, Rossmannoid kıvrımlar, yalnızca beş iplik içerir. İlk beta-alfa-beta (bab) kıvrımı, Rossmann kıvrımının en korunmuş bölümüdür.[1] Motifin adı Michael Rossmann enzimdeki bu yapısal motifi ilk fark eden laktat dehidrogenaz 1970 yılında ve daha sonra bunun nükleotid bağlayıcı proteinlerde sık görülen bir motif olduğunu gözlemleyenler.[2]
Tarih
Rossmann kıvrımı ilk olarak Dr. Michael Rossmann ve iş arkadaşları 1974'te.[3] O, laktat dehidrojenazın yapısını ilk çıkaran ve daha sonra Rossmann kıvrımı olarak adlandırılacak olan bu enzim içindeki yapısal motifi karakterize eden ilk kişiydi. Daha sonra, NAD veya NADP'yi kullanan çoğu dehidrojenazın, aynı yapısal olarak korunmuş Rossmann kıvrım motifini içerdiği bulundu.[3][4]
1989'da, İsrail Hanukoğlu -den Weizmann Bilim Enstitüsü NADP için fikir birliği dizisinin+ NADP kullanan bazı enzimlerde bağlanma bölgesi+ NAD'den farklıdır+ bağlama motifi.[5] Bu keşif, enzimlerin koenzim özgünlüklerini yeniden yapılandırmak için kullanıldı.[6]
Yapısı

Rossmann kıvrımı altı paralelden oluşur beta dizileri genişletilmiş beta sayfası. İlk üç tel birbirine bağlanır α- helisler bir beta-alfa-beta-alfa-beta yapısıyla sonuçlanır. Bu desen, altı şerit içeren ters çevrilmiş bir ardışık tekrar üretmek için bir kez çoğaltılır. Genel olarak, iplikler 321456 (1 = N-terminal, 6 = C-terminal) sırasına göre düzenlenir.[7] Beş şeritli Rossmann benzeri kıvrım 32145 sırasına göre düzenlenmiştir.[8] Katın genel üçüncül yapısı, üç tabakalı bir sandviçi andırır, burada dolgu, uzatılmış bir beta tabakasından oluşur ve iki dilim ekmek, birbirine paralel alfa-sarmalları tarafından oluşturulur.[1]
Rossmann kıvrımının özelliklerinden biri de yardımcı faktör bağlanma özgüllüğü. Dört NADH bağlayıcı enzimin analizi yoluyla, dört enzimin hepsinde nükleotid ko-faktörünün polipeptid zincirine göre aynı konformasyonu ve yönelimi gerektirdiği bulundu.[1]
Kat, kısa sarmallar veya sarmallarla birleştirilmiş ek şeritler içerebilir.[1] Rossmann kıvrımlarının en korunmuş bölümü, ilk beta-alfa-beta bölümüdür. Bu segment ile temas halinde olduğu için ADP dinükleotidlerin bir kısmı, örneğin HEVES, NAD ve NADP aynı zamanda "ADP bağlayıcı beta-beta katlama" olarak da adlandırılır.
Fonksiyon
Rossmann katının enzimlerdeki işlevi, nükleotid kofaktörlerini bağlamaktır. Ayrıca, genellikle alt tabaka bağlanmasına da katkıda bulunur.
Metabolik enzimlerin normalde belirli bir işlevi vardır ve UDP-glikoz 6-dehidrojenaz birincil fonksiyon, iki aşamalı NAD (+) - bağımlı oksidasyonunu katalize etmektir. UDP-glikoz içine UDP-glukuronik asit.[9] UgdG'nin N- ve C-terminal alanları, MAR adlı eski mitokondriyal ribonükleazlarla yapısal özellikleri paylaşır. MAR'lar, düşük ökaryotik mikroorganizmalarda mevcuttur, bir Rossmannoid katına sahiptir ve izokorizataz üst ailesine aittir. Bu gözlem, NAD (+) bağımlı dehidrojenazlarda bulunan Rossmann yapısal motiflerinin, bir nükleotid kofaktör bağlanma alanı ve bir ribonükleaz olarak çalışan ikili bir işleve sahip olabileceğini güçlendirir.
Evrim
Rossmann kıvrımı ile Rossmann benzeri kıvrımlar arasındaki evrimsel ilişki belirsizdir. Bu kıvrımlar, Rossmannoidler olarak adlandırılır. Bir Rossmann kıvrımı da dahil olmak üzere tüm bu kıvrımların, spesifik olmayan katalitik aktiviteye ek olarak nükleotid bağlanma yeteneklerine sahip olan tek bir ortak ata katından kaynaklandığı varsayılmıştır.[3]
NADP bağlayıcı enzimin filogenetik analizi adrenodoksin redüktaz prokaryotlardan, metazoa'ya ve primatlara kadar pek çok FAD ve NAD-bağlanma sahasından sekans motifi farklılığının kesinlikle korunduğunu ortaya çıkardı.[10]
Pek çok makale ve ders kitabında, bir Rossmann kıvrımı, kesin olarak tekrarlanan bir βαβ yapısı serisi olarak tanımlanır. Yine de, birçok NAD (P) ve FAD bağlanma sahasında Rossmann kıvrımlarının kapsamlı incelenmesi, sadece ilk a yapısının kesinlikle korunduğunu ortaya çıkarmıştır. Bazı enzimlerde, beta tabakasını oluşturan beta şeritleri arasında birçok ilmek ve birkaç sarmal (yani tek bir sarmal değil) olabilir.[1][10] Bu ayrışmaya rağmen, korunan dizi ve yapısal özellikler Rossmann kıvrımları için ortak bir evrimsel kökene işaret eder.[10]
Referanslar
- ^ a b c d e Hanukoğlu I (2015). "Proteopedia: Rossmann kat: Dinükleotid bağlanma sitelerinde bir beta-alfa-beta kat". Biyokimya ve Moleküler Biyoloji Eğitimi. 43 (3): 206–9. doi:10.1002 / bmb.20849. PMID 25704928.
- ^ Cox MM, Nelson DL (2013). Biyokimyanın Lehninger Prensipleri (6. baskı). New York: W.H. Özgür adam. ISBN 978-1-4292-3414-6.
- ^ a b c Kessel A (2010). Proteinlere Giriş: Yapı, İşlev ve Hareket. Florida: CRC Press. s. 143. ISBN 978-1-4398-1071-2.
- ^ Rao ST, Rossmann MG (Mayıs 1973). "Proteinlerdeki süper ikincil yapıların karşılaştırılması". Moleküler Biyoloji Dergisi. 76 (2): 241–56. doi:10.1016/0022-2836(73)90388-4. PMID 4737475.
- ^ Hanukoğlu I, Gütfinger T (Mart 1989). "Adrenodoksin redüktazın cDNA dizisi. Oksidoredüktazlarda NADP bağlanma bölgelerinin belirlenmesi" (PDF). Avrupa Biyokimya Dergisi. 180 (2): 479–84. doi:10.1111 / j.1432-1033.1989.tb14671.x. PMID 2924777.
- ^ Scrutton NS, Berry A, Perham RN (Ocak 1990). "Bir dehidrojenazın koenzim özgüllüğünün protein mühendisliği ile yeniden tasarımı". Doğa. 343 (6253): 38–43. doi:10.1038 / 343038a0. PMID 2296288.
- ^ "NAD (P) -bağlayıcı Rossmann-katlamalı alanlar". SCOP: Proteinlerin Yapısal Sınıflandırılması.
- ^ "Nükleotit bağlama alanı". SCOP: Proteinlerin Yapısal Sınıflandırılması.
- ^ Bhattacharyya M, Upadhyay R, Vishveshwara S (2012). "NAD (P) -bağlayıcı Rossmann katını stabilize eden etkileşim imzaları: bir yapı ağı yaklaşımı". PLOS ONE. 7 (12): e51676. doi:10.1371 / journal.pone.0051676. PMC 3524241. PMID 23284738.
- ^ a b c Hanukoğlu I (2017). "FAD ve NADP Bağlayıcı Adrenodoksin Redüktaz-A Yaygın Enzimde Enzim-Koenzim Arayüzlerinin Korunması". Moleküler Evrim Dergisi. 85 (5): 205–218. doi:10.1007 / s00239-017-9821-9. PMID 29177972.