Sandhoff hastalığı - Sandhoff disease - Wikipedia
| Sandhoff hastalığı | |
|---|---|
| Diğer isimler | Sandhoff-Jatzkewitz hastalığı, GM2-gangliosidoz varyantı 0 veya Hekzosaminidaz A ve B eksikliği |
 | |
| Sandhoff hastalığı otozomal resesif bir şekilde kalıtılır | |
| Uzmanlık | Endokrinoloji |
Sandhoff hastalığı, lizozomal bir genetiktir, lipid depolama bozukluğu işlevsel beta-heksosaminidazlar A ve B'yi oluşturmak için kalıtsal eksiklikten kaynaklanır.[1][2] Bu katabolik enzimlere, nöronal membran bileşenlerini, gangliosid GM2'yi, türevi GA2'yi, viseral dokulardaki glikolipid globosidi,[1] ve bazı oligosakaritler. Bu metabolitlerin birikmesi, merkezi sinir sisteminin aşamalı olarak yıkılmasına ve sonunda ölüme yol açar.[1][3] Nadir otozomal resesif[4][5] nörodejeneratif bozukluk klinik olarak neredeyse ayırt edilemez Tay – Sachs hastalığı, beta-heksosaminidaz A ve S'yi bozan başka bir genetik bozukluk. İlk semptomların ortaya çıktığı zamana bağlı olarak Sandhoff hastalığının üç alt grubu vardır: klasik infantil, genç ve yetişkin geç başlangıç.
Semptomlar
Sandhoff hastalığı semptomları klinik olarak belirsizdir. Tay – Sachs hastalığı. Hastalığın klasik çocuksu formu en şiddetli semptomlara sahiptir ve bu erken yaşta teşhis edilmesi inanılmaz derecede zordur.[6] Semptomların ilk belirtileri 6 aylıktan önce başlar ve ebeveyn, çocuk gelişiminde gerilemeye başladığında bunu fark eder. Çocukların kendi kendilerine oturma veya emekleme yetenekleri varsa, bu yeteneklerini kaybederler. Bunun nedeni, GM2 birikimi nedeniyle çocuğun vücudundaki kasların yavaşça bozulmasıdır. gangliosidler. Vücut yaratamadığı için enzimler içinde ihtiyacı var Merkezi sinir sistemi, onları parçalamak ve toksik olmayan hale getirmek için bu gangliositlere bağlanamaz. Bu birikimle birlikte kas / motor zayıflığı, yüksek seslere keskin tepki, körlük, sağırlık, uyarıcılara tepki verememe, solunum problemleri ve enfeksiyonlar, zeka geriliği, nöbetler, retinada kiraz kırmızısı lekeler gibi ortaya çıkmaya başlayan çeşitli semptomlar vardır , genişlemiş karaciğer ve dalak (hepatosplenomegali ), Zatürre veya bronkopnömoni.[7]
Sandhoff hastalığının diğer iki formu benzer semptomlara sahiptir, ancak daha az ölçüde. Sandhoff hastalığının yetişkin ve genç formları, infantil formdan daha nadirdir.[8] Bu vakalarda kurbanlar, kognitif bozukluktan (gerilik) ve yürüme yeteneklerini bozan ve sonunda yok eden kas koordinasyonunda bir kayıp yaşarlar; retinadaki karakteristik kırmızı lekeler de gelişir. Bununla birlikte, hastalığın yetişkin formu bazen daha hafiftir ve yalnızca yürümeyi veya yataktan kalkma yeteneğini bozan kas zayıflığına yol açabilir.[9]
Nedenleri
Mutasyona uğramış bir gen taşıyan ve onu yavrularına aktaran iki ebeveyn hastalığa neden olur. Her iki ebeveyn de hastalığı yanlarında taşıyor olsa bile genetik şifre, hastalığın genetik kodlamasını içeren bir çocuğa sahip olma şansı yalnızca% 25'dir (sağdaki şekle bakın).[10]
Hastalığın her formu, genomun çeşitli mutasyonlarındaki, özellikle de kodonlar 14 üzerinde Eksonlar kromozom 5'te bulunan HEX B geninde (alttaki şekle bakın), semptomların ciddiyetinde farklılıklara yol açar.[6] Kodonlardaki fark, içinde bulunan iki enzimi inhibe etme sonucuna sahiptir. lizozomlar merkezi sinir sistemi nöronlarının Lizozomlar merkezi sinir sisteminin işlevini engelleyecek kadar birikmemelerini sağlamak için yan ürünleri ve toksinleri parçalamak için çeşitli enzimler içerir.[7]
Kısıtlama enzimleri kullanılarak, bir mutasyonun kromozom 5 özellikle C1214T alleli içinde Sandhoff Hastalığının yetişkin başlangıçlı formuna neden olmuştur. İnfantil veya juvenil form semptomlarını gösteren hasta için, babasından I207V eksonunda bir mutasyon ve annesinden 16 baz çifti delesyonu vardır ve bu da beş ekson, 1-5 eksonlarda yer alabilir.[11]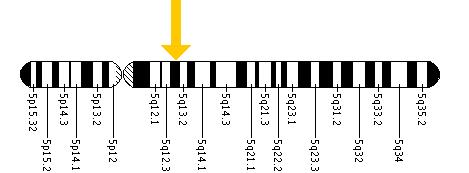
Mutasyonlar ve polimorfizm
Farklı insan grupları arasındaki Sandhoff hastalığı sıklığıyla ilgili makaleler, birbirinden farklılıklar içerir. Yeni mutasyonlar dışında 25'ten fazla mutasyon rapor edilmiştir.[5]
Bir makale Sandhoff hastalığının Yahudi kökenli olmayan kişilerde yaygın olarak bulunduğunu söylüyor.[12]
Diğerleri bunun daha yaygın olduğunu söylüyor:
- kuzeydeki Creole nüfusu Arjantin[13]
- yerli Métis içinde Saskatchewan[10]
- Hıristiyan Maronit toplulukları Kıbrıs[14]
Birkaç mutasyonun keşfi Aşkenaz Yahudileri yansıtabilir tespit önyargısı Tay-Sachs hastalığı için kitlesel tarama programında hedeflenen nüfus Aşkenazi Yahudileri olduğu için yüksek bir nüfus sıklığından ziyade. Araştırmacılar şüpheli TSD taşıyıcıları arasında enzim eksikliği vakalarını çözerken birkaç nadir SD mutasyonu keşfedildi, ancak hastalığın kendisiyle ilgili hiçbir vaka bildirilmedi.[5][15]
Bununla birlikte, otozomal resesif bir hastalık olduğu için, nesilden nesile taşıyıcılar aracılığıyla geçen herhangi bir etnik grupta, yavrularında ifade edilmeden görülmesi muhtemeldir. Ailenin Sandhoff hastalığı öyküsü olmasa da, iki kişinin hastalığı olan bir çocuğu olması mümkündür. Sandhoff hastalığı yalnızca 1968'de keşfedildiğinden beri, hastalığın yanlış teşhisler nedeniyle tespit edilemediği yıllar vardır.[kaynak belirtilmeli ]
Patofizyoloji
Bialelik patojenik varyantlar HEXB gen Sandhoff hastalığına neden olur. Gen, enzimler için çok önemli bir protein yapmak için talimatlar sağlar. beta-heksosaminidaz A ve beta-heksosaminidaz B,[16] sinir hücrelerinde yağlı maddeleri, karmaşık şekerleri ve şekere bağlı molekülleri parçalamak için işlev görür. Özellikle, beta-heksosaminidaz A, GM2 gangliosid adı verilen yağlı bir bileşiği parçalar. Mutasyonlar HEXB gen, bu enzimlerin aktivitesini bozarak GM2 gangliosid ve diğer moleküllerin parçalanmasını önler.
Sonuç olarak GM2 gangliosid birikiminin neden olduğu ilerleyici hasar, sinir hücrelerinin tahrip olmasına yol açarak Sandhoff hastalığı ile ilişkili belirti ve semptomlara neden olur.[kaynak belirtilmeli ]
Teşhis
Sandhoff hastalığı, aşağıdaki prosedürlerle tespit edilebilir (fiziksel muayene ile ortaya çıkmadan önce): a biyopsi bir doku örneğini çıkarmak karaciğer, genetik test moleküler analizi hücreler ve dokular (bir genetik varlığını belirlemek için metabolik bozukluk ), enzim deneyi ve bazen idrar tahlili yukarıda belirtilen bileşiklerin vücut içinde anormal şekilde depolanıp depolanmadığını belirlemek için. Bir çocuğun bu hastalıktan muzdarip olması için, her iki ebeveynin de taşıyıcı olması ve her ikisinin de mutasyonu çocuğa aktarması gerekir. Bu nedenle, her iki ebeveynin de mutasyona sahip olduğu durumda bile, çocuklarının durumu miras alma şansı sadece yüzde 25'dir. Sık sık, ebeveynlere bir DNA çocuk sahibi olmadan önce taşıyıcı durumlarını belirlemek için yüksek risk altında olup olmadıklarını tarama. Bununla birlikte, ailesinde Sandhoff hastalığı olmayan ebeveynler için bile test yaptırmaları şiddetle tavsiye edilir. Sandhoff hastalığı olan çocukları olan ailelerin% 95'inden fazlasının, önceki aile öyküsünün bilinen bir aile öyküsü yoktu, çünkü HEXB gen, yalnızca bir kopya mevcut olduğunda klinik semptomlara neden olmaz ve genellikle bir nesilden diğerine tespit edilmeden geçer.[6] Doğal olarak, bir birey mutasyonu taşıyorsa, bunu doğmamış çocuğa geçirme riski vardır. Mutasyona sahip olanlara genetik danışmanlık önerilir.
Çocuk sahibi olmak üzere olan veya Sandhoff Hastalığı olan bir çocuğu olan ebeveynler için PGD veya PEGD olabilir. PEGD, embriyoların atılmasında dinleri veya olumsuz tutumları nedeniyle implantasyon öncesi genetik tanıdan fayda görmeyen ebeveynler için embriyon öncesi genetik tanıdır. PEGD, genomunu diziler. embriyo bir çocuk sahibi olacaklarsa iki ebeveyn tarafından üretilecek. Ailenin Sandhoff hastalığı geçmişi varsa, taşıyıcı olmadıklarından emin olmak veya çocuklarının genomunu sıralamak için genomlarının dizilenmesi önerilir.[17]
Türler
Üç tür Sandhoff hastalığı vardır: klasik infantil, juvenil ve yetişkin geç başlangıçlı.[16] Her bir form semptomların şiddetine ve hastanın bu semptomları gösterdiği yaşa göre sınıflandırılır.[18]
- Hastalığın klasik infantil formu, 2 aydan 9 aya kadar herhangi bir yerde semptomların gelişmesine göre sınıflandırılır. Tüm formların en şiddetli olanıdır ve hasta üç yaşına gelmeden ölüme yol açacaktır.[19] Bu, Sandhoff hastalığının en yaygın ve şiddetli şeklidir. Bu bozukluğa sahip bebekler tipik olarak, gelişimin yavaşladığı 3 ila 6 aylık olana kadar normal görünür ve kaslar hareket zayıflatmak için kullanılır. Etkilenen bebekler kaybeder motor becerileri Dönmek, oturmak ve sürünmek gibi. Hastalık ilerledikçe bebeklerde nöbet, görme ve işitme kaybı gelişir, demans, ve felç. Bir göz a denilen anormallik kiraz kırmızısı nokta Göz muayenesi ile tespit edilebilen, bu bozukluğun karakteristiğidir. Sandhoff hastalığı olan bazı bebeklerin organları büyümüş olabilir (organomegali ) veya kemik anormallikleri. Bu bozukluğun şiddetli biçimine sahip çocuklar genellikle sadece erken çocukluk döneminde yaşarlar.
- Hastalığın genç formu 3 yaşından başlayarak 10 yaşına kadar değişen belirtiler gösterir ve çocuk genellikle 15 yaşında ölse de sürekli bakım altında ise daha uzun yaşaması mümkündür.[20] Belirtiler şunları içerir: otizm ataksi, motor becerilerde gerileme, spaktisite ve öğrenme bozuklukları.[21]
- Hastalığın yetişkin başlangıçlı formu, daha yaşlı bireylerde ortaya çıkmasına göre sınıflandırılır ve bu bireylerin motor fonksiyonları üzerinde etkisi vardır. Sandhoff hastalığının bu bireylerin yaşam sürelerinin kısalmasına neden olup olmayacağı henüz bilinmemektedir.[6]
Sandhoff hastalığının genç ve yetişkin başlangıçlı formları çok nadirdir. Belirtiler ve semptomlar çocuklukta, ergenlikte veya yetişkinlikte başlayabilir ve genellikle Sandhoff hastalığının infantil formunda görülenlerden daha hafiftir. Çocukluk formunda olduğu gibi, zihinsel yetenekler ve koordinasyon etkilenir. Karakteristik özellikler arasında kas güçsüzlüğü, kas koordinasyonunun kaybı (ataksi ) ve hareket, konuşma sorunları ve akıl hastalığı ile ilgili diğer sorunlar. Bu belirti ve semptomlar, Sandhoff hastalığının geç başlangıçlı formları olan kişiler arasında büyük farklılıklar gösterir.[kaynak belirtilmeli ]
Tedavi
Şu anda Sandhoff hastalığının herhangi bir standart tedavisi yoktur ve bir tedavisi yoktur. Bununla birlikte, hastalıktan muzdarip bir kişinin doğru beslenmeye, hidrasyona ve temiz hava yollarının bakımına ihtiyacı vardır. Sandhoff hastalığı ile ortaya çıkabilecek bazı semptomları azaltmak için hasta, antikonvülsanlar solunum yolu enfeksiyonlarını tedavi etmek için nöbetleri veya ilaçları yönetmek ve yutma güçlükleri nedeniyle püre gıdalardan oluşan hassas bir diyet tüketmek. Hastalığı olan bebekler genellikle solunum yolu enfeksiyonları nedeniyle 3 yaşına kadar ölür. Hasta sürekli gözetim altında tutulmalıdır çünkü aspirasyondan muzdarip olabilir veya geçiş yolundan akciğerlerine ve mideye geçiş yeteneğinden yoksun olabilir ve tükürükleri akciğerlere giderek bronkopnömoniye neden olabilir. Hasta ayrıca öksürme yeteneğinden de yoksundur ve bu nedenle, mukusu akciğerlerinin zarından çıkarmak için vücudunu sallamak için bir tedavi görmesi gerekir. Hastalara nöbetler dahil semptomlarını hafifletmek için ilaç da verilir.
Şu anda hükümet aşağıdakiler dahil çeşitli tedavileri test ediyor N-butil-deoksinojirimisin farelerde ve ayrıca insanlarda kök hücre tedavisi ve test hastalarını kullanan diğer tıbbi tedaviler.[11] CRISPR ve virüs gen düzeltmesi kullanan bir insan model sisteminde gen terapisi için prensip kanıtını gösteren bir Sandhoff hastalığı çalışması, hastalığı iyileştirmek için klinik deneyler yapma şansı veriyor. Ultra nadir olay, klinik deneyler için üstesinden gelinmesi gereken temel bir engeldir.[22][23]
Tarih

Sandhoff hastalığı, eskiden amorotik aptallık olarak bilinen birkaç formdan biridir. Bu kalıtsal hastalık, iç organlarda ve sinir sisteminde lipid içeren hücrelerin birikmesi, zeka geriliği ve görme bozukluğu veya körlük ile karakterizedir. Çeşitli biyokimyasal olarak farklı hastalıkların tanımlanmasına yol açan bir Alman Biyokimyacı olan Konrad Sandhoff (1939-) tarafından amorotik aptallığa sahip çeşitli hastaların kimyasal ve enzimatik analizi: GM1-gangliosidozun 1963'teki ilk biyokimyasal tanımı,[24] 1968'de Sandhoff hastalığı,[1] Tay-Sachs-Hastalığı,[2][25] GM2-Gangliosidosis'in AB varyantı[2][26] ve GM2-gangliosidozun B1 varyantı.[27]
Konrad Sandhoff, bir Alman Biyokimyacı (Max-Planck-Psikiyatri Enstitüsü, Münih) olan Prof. Horst Jatzkewitz'in (1912-2002) laboratuvarında sfingolipidlerin ve gangliosidlerin biyokimyasını incelediğinde, Sandhoff hastalığında moleküler kusurun keşfi geldi. ). Ekim 1966'da, amaurotik aptallıkla bir infantil vakadan derin dondurulmuş otopsi materyali aldı. Glikolipid analizi, daha önce incelenen tüm vakalardan çok geçmeden farklılıklar gösterdi. GM2'nin nöronal depolanmasının yanı sıra, GA2'nin depolanması çok daha belirgindi ve şimdiye kadar incelenen tüm Tay-Sachs hastalığı vakalarından farklı olarak, viseral organlarda biriken globosid ve en önemlisi heksosaminidaz aktivitesi neredeyse tamamen yoktu. Hekzosaminidazların katabolik enzim eksikliğine neden olan hastalık, dört farklı organda dört farklı substrat (p-nitrofenil-β-DN-asetilglukozaminid, p-nitrofenil-β-DN-asetilgalaktozaminid, glikolipid [3H] GA2 ve [3H] globosid) ile gösterilmiştir. ve 1968'de yayınlandı.[1]
Ayrıca bakınız
Referanslar
- ^ a b c d e Sandhoff K, Andreae U, Jatzkewitz H (Mart 1968). "Visseral organlarda böbrek globosidinin ek depolanması ile istisnai bir Tay-Sachs hastalığı vakasında eksik heksosaminidaz aktivitesi". Hayat Bilimi. 7 (6): 283–8. doi:10.1016/0024-3205(68)90024-6. PMID 5651108.
- ^ a b c Sandhoff K (Ağustos 1969). "Tay-Sachs hastalığında beta-N-asetilheksosaminidaz-modelinin değişimi". FEBS Lett. 4 (4): 351–354. doi:10.1016/0014-5793(69)80274-7. PMID 11947222. S2CID 84542601.
- ^ Pilz H, Müller D, Sandhoff K, ter Meulen V (Eylül 1968). "Tay-Sachssche Krankheit mit Hexosaminidase-Defekt (Klinische, morphologische ve biochemische Befunde bei einem Fall mit viszeraler Speicherung von Nierenglobosid)". Dtsch Med Wochenschr. 93 (39): 1833–9. doi:10.1055 / s-0028-1110836. PMID 5679107.
- ^ Harzer K, Sandhoff K, Schall H, Kollmann F (Kasım 1971). "Enzymatische Untersuchungen im Blut von Überträgern einer Variante der Tay-Sachsschen Erkrankung (Variante 0)". Klin Wochenschr. 49 (21): 1189–91. doi:10.1007 / bf01732464. PMID 5124584. S2CID 1735733.
- ^ a b c İnsanda Çevrimiçi Mendel Kalıtımı (OMIM): Sandhoff Hastalığı - 268800
- ^ a b c d Gomez-Lira M, Sangalli A, Mottes M, Perusi C, Pignatti PF, Rizzuto N, Salviati A (1995). "Yetişkin Sandhoff hastalığı hastalarında yaygın bir β heksosaminidaz gen mutasyonu". İnsan Genetiği. 96 (4): 417–422. doi:10.1007 / bf00191799. PMID 7557963. S2CID 39688704.
- ^ a b "Sandhoff Hastalığına Giriş". Tıbbi Biyokimya Sayfası. Alındı 2009-05-03.
- ^ "Sandhoff Hastalığı". Genetik Ana Referans. Alındı 2009-05-03.
- ^ "Sandhoff Hastalığının Belirtileri". Tıbbi Kitap Alıntıları. Lippincott Williams ve Wilkin. 2008.
- ^ a b Lowden JA, vd. (1978). "Sandhoff hastalığında taşıyıcı tespiti". Amerikan İnsan Genetiği Dergisi. 30 (1): 338–345. PMC 1685463. PMID 414620.
- ^ a b "Lizozomal Hastalıklar Test Laboratuvarı". Nöroloji Departmanı Jefferson Hastanesi. Arşivlenen orijinal 10 Nisan 2009. Alındı 2009-05-03.
- ^ "Taşıyıcı Testi". Ulusal Tay-Sachs & Allied Disease Association, Inc.. Alındı 2009-05-03.
- ^ Kleiman FE, vd. (1994). "Arjantin'de Sandhoff hastalığı: HEXB geninde bir ekleme bölgesi mutasyonunun yüksek frekansı ve heterozigot tespiti için enzim ve DNA tabanlı testler arasındaki korelasyon". İnsan Genetiği. 94 (3): 279–82. doi:10.1007 / bf00208283. PMID 8076944. S2CID 9666991.
- ^ Drousiotou A, vd. (2000). "Kıbrıs'ta Sandhoff hastalığı: biyokimyasal ve DNA analizi ile yapılan nüfus taraması, Maronit toplumunda yüksek oranda taşıyıcı olduğunu gösteriyor". İnsan Genetiği. 107 (1): 12–17. doi:10.1007 / s004390050003. PMID 10982028.
- ^ Cantor RM, Kaback MM (1985). "Kuzey Amerika (NA) Yahudi (J) ve Yahudi olmayan (NJ) popülasyonlarda Sandhoff hastalığı (SHD) heterozigot frekansları (HF): taşıyıcı (C) taraması için çıkarımlar". Amerikan İnsan Genetiği Dergisi. 37: A48.
- ^ a b Chamoles NA, Blanco M, Gaggioli D, Casentini C (Nisan 2002). "Tay-Sachs ve Sandhoff hastalıkları: filtre kağıdında kurumuş kan lekelerinde enzimatik teşhis: yenidoğan tarama kartlarında geriye dönük teşhisler". Clinica Chimica Açta. 318 (1–2): 133–7. doi:10.1016 / S0009-8981 (02) 00002-5. PMID 11880123.
- ^ Kuliev A, Rechitsky S, Laziuk K, Verlinsky O, Tur-Kaspa I, Verlinsky Y (2006). "Sandhoff Hastalığı için Pre-Embriyonik Tanı". Üreme Biyotıp Çevrimiçi. 12 (3): 328–333. doi:10.1016 / S1472-6483 (10) 61005-X. PMID 16569321.
- ^ Zhang, Zhi-Xin; Nobuaki Wakamatsu; Emilie H. Mulesi; George H. Thomasi; Roy A. Çakıl (1994). "Erken durdurma kodonlarının infantil Sandhoff hastalığında mRNA seviyeleri üzerindeki etkisi". İnsan Moleküler Genetiği. 3 (1): 139–145. doi:10.1093 / hmg / 3.1.139. PMID 8162015.
- ^ "Ebeveyn perspektifinden: Sandhoff'un ebeveyn görüşü". sandhoffdisease.webs.com. Arşivlenen orijinal 2009-01-29 tarihinde. Alındı 2009-05-03.
- ^ Hendriksz CJ, Corry PC, Wraith JE, Besley GT, Cooper A, Ferrie CD (2004). "Juvenil Sandhoff hastalığı-Dokuz Yeni Vaka ve literatürün gözden geçirilmesi". Kalıtsal Metabolik Hastalık Dergisi. 27 (2): 241–9. doi:10.1023 / B: BOLI.0000028777.38551.5a. PMID 15159655. S2CID 41447979.
- ^ Karbani, Gulshan A (15 Mayıs 2012). "Genetik Danışmanlık: Akrabalık ve Kültürel Beklentiler". eLS. doi:10.1002 / 9780470015902.a0006179.pub2. ISBN 978-0470016176. Eksik veya boş
| title =(Yardım) - ^ Allende, Maria L .; Cook, Emily K .; Larman, Bridget C .; Nugent, Adrienne; Brady, Jacqueline M .; Golebiowski, Diane; Sena-Esteves, Miguel; Tifft, Cynthia J .; Proia, Richard L. (2018/01/22). "Sandhoff hastalığına bağlı pluripotent kök hücrelerden türetilen serebral organoidler, bozulmuş nörodifferentasyon sergiler". Lipid Araştırma Dergisi. 59 (3): 550–563. doi:10.1194 / jlr.M081323. ISSN 0022-2275. PMC 5832932. PMID 29358305.
- ^ "Sandhoff hastalığı çalışması, gen terapisinin ilkesinin kanıtını gösteriyor - Scienmag: En Son Bilim ve Sağlık Haberleri". Scienmag: En Son Bilim ve Sağlık Haberleri. 2018-02-22. Alındı 2018-02-23.
- ^ Jatzkewitz H, Sandhoff K (Haziran 1963). "Biyokimyasal olarak özel bir çocukluk çağı amaturotik aptallığı üzerine". Biochim Biophys Açta. 70: 354–6. doi:10.1016/0006-3002(63)90764-9. PMID 13957544.
- ^ Okada S, O'Brien JS (Ağustos 1969). "Tay-Sachs hastalığı: genel bir beta-D-N-asetilheksosaminidaz bileşeninin yokluğu". Bilim. 165 (894): 698–700. Bibcode:1969Sci ... 165..698O. doi:10.1126 / science.165.3894.698. PMID 5793973. S2CID 8473726.
- ^ Conzelmann E, Sandhoff K (Ağustos 1978). "İnfantil GM2 gangliosidozun AB varyantı: gangliosid GM2 ve glikolipid GA2'nin hekzosaminidaz A ile katalize edilen bozunmasının uyarılması için gerekli bir faktörün eksikliği". Proc Natl Acad Sci U S A. 75 (8): 3979–83. Bibcode:1978PNAS ... 75.3979C. doi:10.1073 / pnas.75.8.3979. PMC 392913. PMID 99746.
- ^ Kytzia HJ, Hinrichs U, Maire I, Suzuki K, Sandhoff K (1983). "Ciddi şekilde değiştirilmiş substrat spesifikliğine sahip olan hekzosaminidaz A ile GM2-gangliosidoz varyantı". EMBO J. 2 (7): 1201–5. doi:10.1002 / j.1460-2075.1983.tb01567.x. PMC 555256. PMID 6226523.
Bu makale bazı kamuya açık metinleri içermektedir. ABD Ulusal Tıp Kütüphanesi
Dış bağlantılar
| Sınıflandırma | |
|---|---|
| Dış kaynaklar |
