Sandmeyer reaksiyonu - Sandmeyer reaction
| Sandmeyer reaksiyonu | |
|---|---|
| Adını | Traugott Sandmeyer |
| Reaksiyon türü | İkame reaksiyonu |
| Tanımlayıcılar | |
| Organik Kimya Portalı | sandmeyer reaksiyonu |
| RSC ontoloji kimliği | RXNO: 0000021 |
Sandmeyer reaksiyonu bir Kimyasal reaksiyon sentezlemek için kullanılır aril halojenürler arilden diazonyum tuzları reaktif veya katalizör olarak bakır tuzlarının kullanılması.[1][2][3]Bir radikal-nükleofilik aromatik ikame örneğidir. Sandmeyer reaksiyonu, benzen üzerinde benzersiz dönüşümler gerçekleştirilebilen bir yöntem sağlar, örneğin halojenleşme, siyanasyon, triflorometilasyon, ve hidroksilasyon.
Reaksiyon 1884 yılında İsviçreli kimyager tarafından keşfedildi Traugott Sandmeyer benzendiazonyum klorürden fenilasetileni sentezlemeye çalıştığında ve bakır asetilid. Bunun yerine, izole ettiği ana ürün fenil klorürdü.[4] Modern zamanlarda Sandmeyer reaksiyonu, bir aromatik amino grubunun diazonyum tuzunun hazırlanması yoluyla ikame edilmesi ve ardından katalitik bakır (I) tuzlarının varlığında bir nükleofil ile yer değiştirmesi için herhangi bir yöntemi ifade eder. (Bakır tuzlarının düşük maliyeti nedeniyle, kataliz mümkün olduğunda bile daha iyi reaktivite için genellikle stokiyometrik bir miktar kullanılır.) En yaygın kullanılan Sandmeyer reaksiyonları, CuCl, CuBr, CuCN kullanarak klorlama, bromlama, siyanasyon ve hidroksilasyon reaksiyonlarıdır. ve Cu2O, sırasıyla. Daha yakın zamanlarda, diazonyum tuzlarının triflorometilasyonu geliştirilmiştir ve bir "Sandmeyer tipi" reaksiyon olarak adlandırılır. Diazonyum tuzları ayrıca boronatlar, iyodür ile reaksiyona girer. tioller, Su, hipofosfor asit ve diğerleri,[5] ve florlama, tetrafloroborat anyonlar (Balz-Schiemann reaksiyonu ). Bununla birlikte, bu işlemler bir metal katalizör gerektirmediğinden, genellikle Sandmeyer reaksiyonları olarak adlandırılmazlar. Geliştirilmiş sayısız varyantta, bakır (II), demir (III) ve kobalt (III) dahil olmak üzere diğer geçiş metal tuzları da kullanılmıştır.[6] Geniş sentetik uygulanabilirliği nedeniyle Sandmeyer reaksiyonu, diazonyum bileşiklerinin diğer dönüşümleri ile birlikte, tamamlayıcıdır. elektrofilik aromatik ikame.
Reaksiyon koşulları ve mekanizması
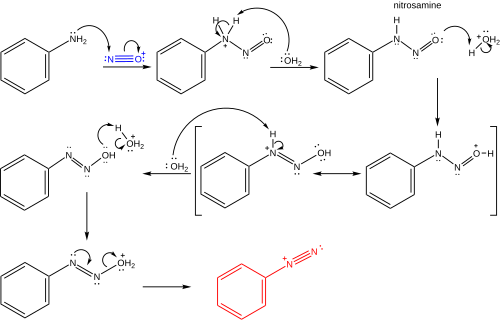
azotlu asit tipik olarak hazırlanır yerinde itibaren sodyum nitrat ve asit. İki takip protonasyon adımlar, bir eşdeğer su kaybolur. nitrosonyum iyonu. Nitrosonyum iyonu daha sonra bir elektrofil bir tepki olarak aromatik (veya heterosiklik ) amin, örneğin anilin, bir diazonyum tuzu oluşturmak için nitrozamin orta düzey.[5] Tipik reaksiyon koşulları aşağıdaki gibidir:[7][8]
Klorlama: ArN2+Cl–CuCl, HCl (% 36 aq.), 50 - 100 ° C; bromlama: ArN2+HSO4–CuBr, HBr (% 48 aq.), 50 - 100 ° C; siyanasyon: ArN2+Cl–, CuCN, KCN, H2O, benzen, 0 ° C; hidroksilasyon: Cu2O, Cu (HAYIR3)2, H2O, 25 ° C.
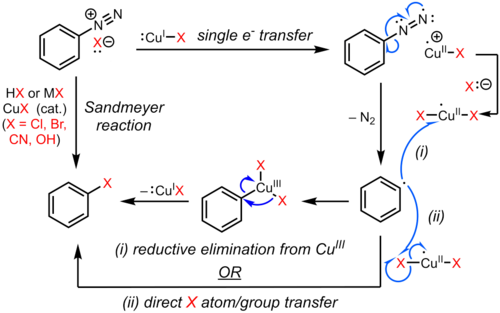
Sandmeyer reaksiyonu bir örnektir. radikal-nükleofilik aromatik ikame (SRNAr). Sandmeyer reaksiyonunun radikal mekanizması aşağıdaki tespitlerle desteklenmektedir: biaril yan ürünler.[9] Aromatik diazo grubunun bir halojen ile ikame edilmesi veya sözde halojen bakır (I) tarafından katalize edilen tek elektronlu bir transfer mekanizması ile başlatılır. aril radikali azot gazı kaybı ile.[10][11][12][9] İkame edilmiş arene Muhtemelen, ikame edilmiş areni üretmek ve bakır (I) katalizörünü yeniden oluşturmak için bir bakır (II) türünden Cl, Br, CN veya OH'nin doğrudan aril radikaline aktarılmasıyla oluşturulur. Alternatif bir öneride, aril radikalinin bakır (II) türleriyle birleştirilmesinden oluşan bir geçici bakır (III) ara ürünü, ürünü vermek ve bakır (I) 'i yeniden oluşturmak için hızlı indirgeyici eliminasyona uğrar.[13][14][15] Bununla birlikte, böyle bir organo-bakır ara ürününe ilişkin kanıtlar zayıftır ve çoğunlukla koşullara bağlıdır,[16][17] ve kesin yol, substrata ve reaksiyon koşullarına bağlı olabilir. Bu olasılıklar aşağıda gösterilmiştir.
Nitrosonyum iyonunun oluşumu

Benzendiazonyum iyonunun oluşumu
Tek elektron transferi
Sentetik uygulamalar
Sandmeyer reaksiyonundaki varyasyonlar, birden çok sentetik uygulamaya uyacak şekilde geliştirilmiştir. Bu reaksiyonlar tipik olarak bir aril diazonyum tuzunun oluşturulması ve ardından aşağıdaki şemaya göre ikame edilmiş bir aren vermek üzere bir bakır (I) tuzu ile bir reaksiyon yoluyla ilerler.
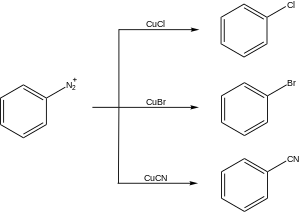
Sandmeyer reaksiyonunun sentetik uygulamalarının bazı örnekleri aşağıda verilmiştir.
Halojenleşme
Sandmeyer reaksiyonunun en önemli kullanımlarından biri aril halojenürlerin oluşumudur. Sentezi için tercih edilen çözücü aril iyodürler dır-dir diiyodometan,[18][19] sentezi için ise aril bromürler, bromoform kullanıldı. Sentezi için aril klorürler, kloroform tercih edilen çözücüdür.[20] Antifungal ve antikanser aktivite gösteren biyoaktif bir bileşik olan (+) - curcuphenol sentezi, bir amin grubunu bir bromo grubu ile ikame etmek için Sandmeyer reaksiyonunu kullanır.[21]

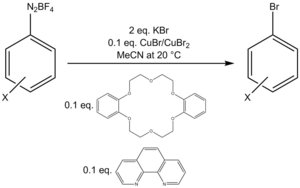
Bir bromlama protokolü, ek miktarlarda bir Cu (I) / Cu (II) karışımı kullanır. iki dişli ligand fenantrolin ve faz transfer katalizörü dibenzo-18-taç-6 bir aril diazonyum tetrafloroborat tuzunu bir aril bromüre dönüştürmek için.[22]
Balz-Schiemann reaksiyonu kullanır tetrafloroborat ve halojenür ikameli ürünü teslim eder, florobenzen kullanımıyla elde edilemeyen bakır florürler. Bu reaksiyon, Sandmeyer reaksiyonunun karakteristik motiflerini gösterir.[23]
Siyanasyon
Sandmeyer reaksiyonunun başka bir kullanımı, siyanasyon oluşumuna izin veren benzonitriller, organik bileşiklerin önemli bir sınıfı. Anti-psikotik ilacın sentezinde önemli bir ara ürün, Fluanxol, Sandmeyer reaksiyonu yoluyla bir siyanasyonla sentezlenir.[24]

Sandmeyer reaksiyonu aynı zamanda neoamphimedine sentezinde de kullanılmıştır. topoizomeraz II bir anti-kanser ilacı olarak.[25]

Triflorometilasyon
Sandmeyer tipi reaksiyonların, triflorometil ikame grupları tarafından işlevselleştirilmiş aril bileşikleri oluşturmak için kullanılabileceği gösterilmiştir. Bu süreç triflorometilasyon çok çeşitli pratik uygulamalarla benzersiz kimyasal özellikler sağlar. Özellikle KF'li ilaçlar3 gruplar gelişti metabolik stabilite, lipofiliklik, ve biyoyararlanım. Sandmeyer tipi triflorometilasyon reaksiyonları, hafif reaksiyon koşulları ve önceki triflorometilasyon yöntemlerine göre daha yüksek fonksiyonel grup toleransı sunar.[26][27] Sandmeyer tipi triflorometilasyon reaksiyonunun bir örneği aşağıda sunulmuştur.[28]

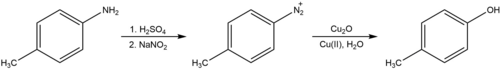
Hidroksilasyon
Sandmeyer reaksiyonu, aril aminleri dönüştürmek için de kullanılabilir. fenoller aşağıda gösterildiği gibi bir aril diazonyum tuzu oluşumuna devam edilir.[8] Bakır katalizör varlığında bu reaksiyon, oda sıcaklığında kolaylıkla gerçekleşir. Cohen ve meslektaşları tarafından bildirilen prosedür, nötr suda fazla bakır nitratla birlikte bakır oksit gerektiriyor. Bu, klasik prosedürün aksine (Alman adıyla bilinir) Verkochung, Verkochung ), diazonyum tuzunun sulu asit içinde kaynatılmasını gerektiren, radikal yerine aril katyonu içerdiğine inanılan ve istenen hidroksilasyon ürününe ek olarak başka nükleofilik ilave yan ürünler ürettiği bilinen bir işlem.
Triazene
İkinci bir anilin eşdeğeri ile tedavi, triazene. Örneğin karşılaştırın, Diminazene (Berenil) ve İzometamidium klorür.
Referanslar
- ^ Traugott Sandmeyer (1884). "Ueber die Ersetzung der Amidgruppe durch Chlor in den aromatischen Substanzen". Berichte der deutschen chemischen Gesellschaft. 17 (3): 1633–1635. doi:10.1002 / cber.18840170219.
- ^ Traugott Sandmeyer (1884). "Ueber die Ersetzung der Amid-gruppe durch Chlor, Brom und Cyan in aromatischen Substanzen". Berichte der Deutschen Chemischen Gesellschaft. 17 (4): 2650–2653. doi:10.1002 / cber.188401702202.
- ^ Ludwig Gattermann (1890). "Untersuchungen über Diazoverbindungen". Berichte der Deutschen Chemischen Gesellschaft. 23 (1): 1218–1228. doi:10.1002 / cber.189002301199.
- ^ Hodgson, Herbert H. (1947-04-01). "Sandmeyer Reaksiyonu". Kimyasal İncelemeler. 40 (2): 251–277. doi:10.1021 / cr60126a003. ISSN 0009-2665. PMID 20291034.
- ^ a b Wang, Zerong (2010). "Sandmeyer Reaksiyonu". Kapsamlı Organik İsim Reaksiyonları ve Reaktifler. John Wiley & Sons, Inc. s. 2471–2475. ISBN 9780470638859.
- ^ M.P. Doyle, B. Siegfried ve J.F. Dellaria (1977). "Alkil nitrit-metal halojenür deaminasyon reaksiyonları. 2. Alkil nitritler ve bakır (II) halojenürler ile arilaminlerin ikame edici deaminasyonu. Arilaminlerin aril halojenürlere doğrudan ve önemli ölçüde verimli bir dönüşümü". J. Org. Chem. 42 (14): 2426–2431. doi:10.1021 / jo00434a017.
- ^ Chandler, Norman, R.O.C. (Richard Oswald (1993). Organik sentezin ilkeleri. Coxon, J.M. (James Morriss), 1941- (3. baskı). Londra: Blackie Akademik ve Profesyonel. ISBN 978-0751401264. OCLC 27813843.
- ^ a b Cohen, Theodore; Dietz, Albert G .; Miser, Jane R. (1977-06-01). "Bakır tuzları tarafından aril radikallerinin oluşturulması ve oksidasyonu yoluyla diazonyum iyonlarından basit bir fenol üretimi". Organik Kimya Dergisi. 42 (12): 2053–2058. doi:10.1021 / jo00432a003. ISSN 0022-3263.
- ^ a b Galli, Carlo (Ağustos 1988). "Arendiazonyum iyonlarının radikal reaksiyonları: Aril radikalinin kimyasına kolay bir giriş". Kimyasal İncelemeler. 88 (5): 765–792. doi:10.1021 / cr00087a004.
- ^ J. K. Kochi (1957). "Sandmeyer ve Meerwein Reaksiyonlarının Mekanizması". J. Am. Chem. Soc. 79 (11): 2942–2948. doi:10.1021 / ja01568a066.
- ^ H. H. Hodgson (1947). "Sandmeyer Reaksiyonu". Chem. Rev. 40 (2): 251–277. doi:10.1021 / cr60126a003. PMID 20291034.
- ^ Nonhebel, D. C .; Waters, W. A. (8 Ekim 1957). "Sandmeyer Reaksiyonunun Mekanizmasının İncelenmesi". Royal Society A: Matematik, Fizik ve Mühendislik Bilimleri Bildirileri. 242 (1228): 16–27. Bibcode:1957 RSPSA.242 ... 16N. doi:10.1098 / rspa.1957.0150. S2CID 97536209.
- ^ 1960-, Anslyn, Eric V. (2006). Modern fiziksel organik kimya. Dougherty, Dennis A., 1952-. Sausalito, CA: Üniversite Bilimi. ISBN 978-1891389313. OCLC 55600610.CS1 bakimi: sayısal isimler: yazarlar listesi (bağlantı)
- ^ C., Vollhardt, K.Peter (2018/01/29). Organik kimya: yapı ve işlev. Schore, Neil Eric, 1948- (8. baskı). New York. ISBN 9781319079451. OCLC 1007924903.
- ^ 1937-, Carey, Francis A. (2007). İleri organik kimya. Bölüm B, Reaksiyonlar ve sentez. Sundberg, Richard J., 1938- (5. baskı). New York, NY: Springer. ISBN 9781601195494. OCLC 223941000.CS1 bakimi: sayısal isimler: yazarlar listesi (bağlantı)
- ^ Timms, Allan W .; Walton, Paul H .; Rowell, Simon C .; Hanson, Peter (2004-06-28). "Sandmeyer hidroksilasyonunun (homolitik hidroksidediazyonasyon) ve bakır katalizörün şelasyonu yoluyla hidrodediyazyonun teşvik edilmesi: iki dişli ligandlar". Organik ve Biyomoleküler Kimya. 2 (13): 1838–1855. doi:10.1039 / B404699D. ISSN 1477-0539. PMID 15227536.
- ^ Timms, Allan W .; Walton, Paul H .; Taylor, Alec B .; Rowell, Simon C .; Hanson, Peter (2002-05-22). "Sandmeyer reaksiyonları. Bölüm 6. Sandmeyer siyanasyonunun indirgeme ve ligand transfer aşamalarına ilişkin mekanik bir araştırma". Kimya Derneği Dergisi, Perkin İşlemleri 2. 0 (6): 1126–1134. doi:10.1039 / B200747A. ISSN 1364-5471.
- ^ W. B. Smith; O. C. Ho (1990). "İzoamil nitrit-diiyodometan yolunun aril iyodürlere uygulanması". J. Org. Kimya. 55 (8): 2543–2545. doi:10.1021 / jo00295a056.
- ^ V. Nair; S. G. Richardson (1982). "Radikal Ara Maddelerle Nükleik Asit Bazlarının Modifikasyonu: Dihalojenlenmiş Pürin Nükleositlerin Sentezi". Sentez. 1982 (8): 670–672. doi:10.1055 / s-1982-29896.
- ^ J. I. G. Cadogan; D. A. Roy; D. M. Smith (1966). "Sandmeyer reaksiyonuna bir alternatif". J. Chem. Soc.: 1249–1250. doi:10.1039 / J39660001249.
- ^ Kim, Sung-Gon; Kim, Jaehak; Jung, Heejung (Nisan 2005). "Asimetrik organokataliz yoluyla (+) - curcuphenol'ün verimli toplam sentezi". Tetrahedron Mektupları. 46 (14): 2437–2439. doi:10.1016 / j.tetlet.2005.02.047.
- ^ P. Beletskaya; Alexander S. Sigeev; Alexander S. Peregudov; Pavel V. Petrovskii (2007). "Katalitik Sandmeyer Brominasyonu". Sentez. 2007 (16): 2534–2538. doi:10.1055 / s-2007-983784.
- ^ Wang, Zerong (2009). Kapsamlı organik isim reaksiyonları ve reaktifler. Hoboken, NJ: John Wiley. s. 185–190. ISBN 9780471704508.
- ^ Nielsen, Martin Anker; Nielsen, Michael Kim; Pittelkow, Thomas (Kasım 2004). "Bir Sandmeyer Reaksiyonunun Ölçek Büyütmesi ve Güvenlik Değerlendirmesi". Organik Süreç Araştırma ve Geliştirme. 8 (6): 1059–1064. doi:10.1021 / op0498823.
- ^ LaBarbera, Daniel V .; Bugni, Tim S .; İrlanda, Chris M. (Ekim 2007). "Neoamphimedinin Toplam Sentezi". Organik Kimya Dergisi. 72 (22): 8501–8505. doi:10.1021 / jo7017813. PMC 2547140. PMID 17900144.
- ^ Browne, Duncan L. (3 Şubat 2014). "Triflorometilleyici Sandmeyer Reaksiyonu: C-N'yi C-CF'ye Dönüştürmek İçin Bir Yöntem". Angewandte Chemie Uluslararası Sürümü. 53 (6): 1482–1484. doi:10.1002 / anie.201308997. PMID 24376150.
- ^ Dai, Jian-Jun; Fang, Chi; Xiao, Bin; Yi, Jun; Xu, Jun; Liu, Zhao-Jing; Lu, Xi; Liu, Lei; Fu, Yao (12 Haziran 2013). "Bakır Destekli Sandmeyer Triflorometilasyon Reaksiyonu". Amerikan Kimya Derneği Dergisi. 135 (23): 8436–8439. doi:10.1021 / ja404217t. PMID 23718557.
- ^ Danoun, Grégory; Bayarmagnai, Bilguun; Grünberg, Matthias F .; Gooßen, Lukas J. (29 Temmuz 2013). "Arenediazonyum Tetrafloroboratların Sandmeyer Triflorometilasyonu". Angewandte Chemie Uluslararası Sürümü. 52 (31): 7972–7975. doi:10.1002 / anie.201304276. PMID 23832858.