Schizosaccharomyces pombe - Schizosaccharomyces pombe
| Schizosaccharomyces pombe | |
|---|---|
 | |
| bilimsel sınıflandırma | |
| Krallık: | |
| Bölünme: | |
| Sınıf: | |
| Sipariş: | |
| Aile: | |
| Cins: | |
| Türler: | S. pombe |
| Binom adı | |
| Schizosaccharomyces pombe Lindner (1893) | |
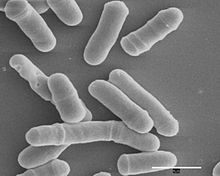
Schizosaccharomyces pombe, olarak da adlandırılır "fisyon mayası", bir Türler nın-nin Maya geleneksel bira yapımında ve bir model organizma içinde moleküler ve hücre Biyolojisi. Tek hücreli ökaryot, kimin hücreler çubuk şeklindedir. Hücreler tipik olarak 3 ila 4 arasındadır mikrometre çapında ve 7 ila 14 mikrometre uzunluğunda. Onun genetik şifre Yaklaşık 14,1 milyon baz çifti olan, 4,970 protein kodlama içerdiği tahmin edilmektedir. genler ve en az 450 kodlamayan RNA'lar.[1]
Bu hücreler, sadece hücre uçları boyunca büyüyerek şekillerini korurlar ve mediyal ile bölünürler. bölünme eşit büyüklükte iki yavru hücre üretmek, bu da onları güçlü bir araç haline getirir. Hücre döngüsü Araştırma.
Fisyon mayası 1893'te Paul Lindner Doğu Afrika dan darı birası. Tür adı Pombe ... Svahili bira için kelime. İlk olarak 1950'lerde deneysel bir model olarak geliştirildi: Urs Leupold genetik okumak için[2][3] ve tarafından Murdoch Mitchison hücre döngüsünü incelemek için.[4][5][6]
Paul Hemşire Bir fisyon mayası araştırmacısı, fisyon maya genetiği ve hücre döngüsü araştırmasının bağımsız okullarını başarıyla birleştirdi. Birlikte Lee Hartwell ve Tim Hunt, Hemşire 2001'i kazandı Nobel Fizyoloji veya Tıp Ödülü hücre döngüsü düzenlemesi üzerindeki çalışmaları için.
Dizisi S. pombe genetik şifre 2002 yılında, liderliğindeki bir konsorsiyum tarafından yayınlandı. Sanger Enstitüsü, altıncı model ökaryotik organizma oldu. genetik şifre tamamen oldu sıralanmış. S. pombe araştırmacıları, PomBase MOD (Model Organizma Veritabanı ). Bu, insan genlerine ortolog birçok gen tanımlanarak bu organizmanın gücünü tamamen açığa çıkardı - bugüne kadar% 70,[7][8] insan hastalığına karışan birçok gen dahil.[9] 2006 yılında, hemen hemen tüm proteinlerin hücre altı lokalizasyonu S. pombe kullanılarak yayınlandı yeşil floresan protein moleküler bir etiket olarak.[10]
Schizosaccharomyces pombe ayrıca hücresel tepkilerin incelenmesinde önemli bir organizma haline gelmiştir. DNA hasarı ve süreci DNA kopyalama.
Yaklaşık 160 doğal suş S. pombe izole edilmiştir. Bunlar, Avrupa, Kuzey ve Güney Amerika ve Asya dahil olmak üzere çeşitli yerlerden toplanmıştır. Bu suşların çoğu, aşağıdaki gibi kültür meyvelerinden toplanmıştır. elmalar ve üzüm veya çeşitli alkollü içecekler Brezilya gibi Cachaca. S. pombe fermente çayda da bulunduğu bilinmektedir, Kombucha.[11] Şu anda net değil S. pombe bu tür demlemelerde ana fermentör veya kirletici maddedir. Doğal ekolojisi Schizosaccharomyces mayalar iyi incelenmemiştir.
Tarih
Schizosaccharomyces pombe ilk olarak 1893'te Almanya'daki Biracılık Derneği Laboratuvarı'nda çalışan bir grup, Doğu Afrika'dan ithal edilen darı birasında bulunan ve asidik bir tat veren tortuya bakarken keşfedildi. "Bölünme" veya "bölünme" anlamına gelen şizo terimi, daha önce diğerlerini tanımlamak için kullanılmıştı. Şizosakkaromisetler. Pombe kelimesinin eklenmesi, Swahili dilinde "bira" anlamına gelen pombe anlamına gelen Doğu Afrika birasından izole edilmesinden kaynaklanıyordu. Standart S. pombe suşlar, Urs Leupold tarafından 1946 ve 1947'de maya koleksiyonundan elde ettiği bir kültürden izole edildi. Delft, Hollanda. Orada A. Osterwalder adı altında saklandı. S. pombe var. sıvılaştırıcılar, 1924'te, şarap ve Bahçıvanlık Federal Deney İstasyonunda Fransız şarabından (büyük olasılıkla kokulu) izole ettikten sonra Wädenswil, İsviçre. Urs Leupold tarafından kullanılan kültür, çiftleşme türleri h90 (suş 968), h- (suş 972) ve h + (suş 975) ile (diğerlerinin yanı sıra) hücreleri içeriyordu. Bundan sonra, izole etmek için iki büyük çaba olmuştur. S. pombe meyve, nektar veya fermantasyonlardan: Florenzano ve ark.[12] batı Sicilya'daki üzüm bağlarında ve diğeri Gomes et al. (2002) Güneydoğu Brezilya'nın dört bölgesinde.[13]
Ekoloji
Fisyon mayası S. pombe en büyük ve en çeşitli mantar grubunu temsil eden divisio Ascomycota'ya aittir. Serbest yaşayan askomisetler genellikle ağaç sızıntılarında, bitki köklerinde ve çevreleyen toprakta, olgun ve çürüyen meyvelerde ve onları substratlar arasında taşıyan böcek vektörleriyle bağlantılı olarak bulunur. Bu birlikteliklerin çoğu simbiyotik veya saprofitiktir, ancak çok sayıda askomiset (ve bunların basidiomycete kuzenleri) ticari mahsuller dahil sayısız bitki türünü hedefleyen önemli bitki patojenlerini temsil eder. Ascomycetous maya cinsleri arasında fisyon mayası Schizosaccharomyces daha iyi bilinen β-glukanlara ve sanal kitin eksikliğine ek olarak hücre duvarında a- (1,3) -glukan veya psödonigeran birikimi nedeniyle benzersizdir. Bu cinsin türleri, mannanın yan zincirlerinde terminal d-galaktoz şekerlerini gösteren mannan bileşiminde de farklılık gösterir. S. pombe uğramak aerobik fermantasyon aşırı şeker varlığında.[14] S. pombe Şarapta baskın organik asitlerden biri olan L-malik asidi bozabilir ve bu da onları diğerlerinden farklı kılar. Saccharomyces suşlar.
Tomurcuklanan maya ile karşılaştırma (Saccharomyces cerevisiae)
Maya türleri Schizosaccharomyces pombe ve Saccharomyces cerevisiae her ikisi de kapsamlı olarak incelenmiştir; bu iki tür, günümüzden yaklaşık 300 ila 600 milyon yıl önce ayrıldı,[15] ve moleküler ve hücresel biyolojide önemli araçlardır. Bu iki tür arasındaki teknik ayrımcılardan bazıları şunlardır:
- S. cerevisiae yaklaşık 5,600 açık okuma çerçeveleri; S. pombe yaklaşık 5.070 açık okuma çerçevesine sahiptir.
- Benzer gen sayılarına rağmen, S. cerevisiae sadece 250 civarında intronlar, süre S. pombe yaklaşık 5.000'e sahiptir.
- S. cerevisiae var 16 kromozomlar, S. pombe var 3.
- S. cerevisiae sıksıktır diploid süre S. pombe genellikle haploid.
- S. pombe var Barınak -sevmek telomer karmaşık süre S. cerevisiae değil.[16]
- S. cerevisiae G1 aşamasında Hücre döngüsü uzun bir süre için (sonuç olarak, G1-S geçişi sıkı bir şekilde kontrol edilir) S. pombe hücre döngüsünün G2 fazında uzun bir süre kalır (sonuç olarak, G2-M geçişi sıkı kontrol altındadır).
- Her iki tür de birbirleriyle paylaşmadıkları yüksek ökaryotlu genleri paylaşır. S. pombe vardır RNAi makineleri Omurgalılardaki gibi genler, bu eksik S. cerevisiae. S. cerevisiae ayrıca heterokromatini büyük ölçüde basitleştirmiştir. S. pombe.[17] Tersine, S. cerevisiae iyi gelişmiştir peroksizomlar, süre S. pombe değil.
- S. cerevisiae küçük noktası var sentromer 125 bp ve dizi tanımlı çoğaltma kaynakları yaklaşık aynı boyuttadır. Sohbet üzerine, S. pombe memeli sentromere daha benzer büyük, tekrarlayan sentromerlere (40-100 kb) ve en az 1 kb'lik dejenere replikasyon kökenlerine sahiptir.
S. pombe yolları ve hücresel süreçler
S. pombe gen ürünleri (proteinler ve RNA'lar) tüm yaşam boyunca ortak olan birçok hücresel sürece katılır. fisyon mayası ince GO tüm S. pombe gen ürünlerinin biyolojik rolü hakkında kategorik yüksek düzeyde bir genel bakış sağlar.[7]
Yaşam döngüsü

Fisyon mayası, basit, tam olarak karakterize edilmiş genoma ve hızlı bir büyüme oranına sahip tek hücreli bir mantardır. Uzun zamandır mayalama, fırınlama ve moleküler genetikte kullanılmaktadır. S. pombe yaklaşık 3 um çapında, uçlarında uzama ile tamamen büyüyen çubuk şeklinde bir hücredir. Mitozdan sonra bölünme, hücreyi orta noktasından ayıran bir septum veya hücre plakası oluşumuyla gerçekleşir.
Hücre çoğalmasının ana olayları, S (Sentetik) fazında gerçekleşen kromozom kopyalanması, ardından topluca M (Mitotik) fazı olarak adlandırılan kromozom ayrımı ve nükleer bölünme (mitoz) ve hücre bölünmesidir (sitokinez). G1, M ve S fazları arasındaki boşluktur ve G2, S ve M fazları arasındaki boşluktur. Fisyon mayasında, G2 fazı özellikle uzar ve sitokinez (yavru hücre ayrımı), yeni bir S (Sentetik) fazı başlatılana kadar gerçekleşmez.
Bölünme mayası, çok hücreli hayvanlardakine benzer mekanizmalarla mitozu yönetir. Normalde haploid bir durumda çoğalır. Açlıktan öldüklerinde, karşıt çiftleşme türlerinin (P ve M) hücreleri, dört haploid spor oluşturmak için hemen mayoza giren diploid bir zigot oluşturmak üzere birleşirler. Koşullar iyileştiğinde, bu sporlar çoğalan haploid hücreler üretmek için filizlenir.[18]

Hücre döngüsünün genel özellikleri.

Bir fisyon mayasının belirli hücre döngüsü.
Bölünme aşamaları Schizosaccharomyces parlak ve karanlık alan ışık mikroskobunda
Sitokinez

Sitokinezin genel özellikleri burada gösterilmektedir. Hücre bölünme yeri anafazdan önce belirlenir. Anafaz mili (şekilde yeşil renkte) daha sonra, ayrılmış kromozomlar önceden belirlenmiş bölünme düzleminin zıt taraflarında olacak şekilde konumlandırılır.
Boyut kontrolü

Büyümenin G2 / M yoluyla ilerlemeyi yönettiği fisyon mayasında, bir wee1 mutasyonu, anormal derecede küçük bir boyutta mitoza girerek daha kısa bir G2'ye neden olur. G1 uzar, bu da Başlangıç boyunca ilerlemenin (hücre döngüsünün başlangıcı) G2 / M kontrolü kaybedildiğinde büyümeye yanıt verdiğini gösterir. Ayrıca, yetersiz besin koşullarındaki hücreler yavaş büyür ve bu nedenle boyut olarak ikiye katlanıp bölünmeleri daha uzun sürer. Düşük besin seviyeleri de büyüme eşiğini sıfırlar, böylece hücre daha küçük bir boyutta hücre döngüsü boyunca ilerler. Stresli koşullara [ısı (40 ° C) veya oksitleyici ajan hidrojen peroksit] maruz kaldığında S. pombe hücreler geçer yaşlanma artan hücre bölünme süresi ve artan hücre ölümü olasılığı ile ölçüldüğü gibi.[19] Son olarak, wee1 mutant fisyon maya hücreleri, vahşi tip hücrelerden daha küçüktür, ancak hücre döngüsünden geçmesi tam da bu kadar uzun sürer. Bu mümkündür, çünkü küçük maya hücreleri daha yavaş büyür, yani birim zamanda eklenen toplam kütleleri normal hücrelerden daha küçüktür.
Uzamsal bir gradyanın, hücre boyutunu ve fisyon mayasında mitotik girişi koordine ettiği düşünülmektedir.[20][21][22] Pom1 protein kinaz (yeşil), hücre uçlarında en yüksek konsantrasyonla hücre korteksinde lokalizedir. Hücre döngüsü düzenleyicileri Cdr2, Cdr1 ve Wee1, hücrenin ortasındaki kortikal düğümlerde (mavi ve kırmızı noktalar) bulunur. a, Küçük hücrelerde Pom1 gradyan, kortikal düğümlerin çoğuna (mavi noktalar) ulaşır. Pom1 Cdr2'yi inhibe eder, Cdr2 ve Cdr1'in Wee1'i inhibe etmesini önler ve Wee1'in Cdk1'i fosforile etmesine izin verir, böylece sikline bağlı kinaz (CDK) aktivitesini inaktive eder ve mitoza girişi önler. b, Uzun hücrelerde Pom1 gradyan kortikal düğümlere (kırmızı noktalar) ulaşmaz ve bu nedenle Cdr2 ve Cdr1 düğümlerde aktif kalır. Cdr2 ve Cdr1, Wee1'i inhibe ederek Cdk1'in fosforilasyonunu önler ve böylece CDK'nın aktivasyonuna ve mitotik girişe yol açar. (Bu basitleştirilmiş diyagram, CDK etkinliğinin diğer birkaç düzenleyicisini atlar.)
Çiftleşme tipi anahtarlama
Bölünme mayası, hücre döngüsünün S fazı sırasında meydana gelen bir çoğaltma-bağlı rekombinasyon olayı ile çiftleşme tipini değiştirir. Fisyon mayası, çiftleşme tipini değiştirmek için DNA replikasyon işleminin içsel asimetrisini kullanır; hücre tipinin değişmesi için replikasyon yönünün gerekli olduğu gösterilen ilk sistemdi. Çiftleşme tipi anahtarlama sistemi çalışmaları, bölgeye özgü replikasyon sonlandırma bölgesi RTS1, bölgeye özgü replikasyon duraklama bölgesi MPS1 ve çiftleşmedeki kardeş kromatitlerden birini işaretleyen yeni bir kromozom baskısı türünün keşfine ve karakterizasyonuna yol açar. -tip lokus mat1. Ek olarak, susturulmuş donör bölgesi üzerinde yapılan çalışmalar, heterokromatinin oluşumu ve sürdürülmesinin anlaşılmasında büyük ilerlemelere yol açmıştır.[23]
DNA hasarına verilen yanıtlar
Schizosaccharomyces pombe besinler sınırlandığında çiftleşmeye uğrayabilen isteğe bağlı bir cinsel mikroorganizmadır.[24] Maruziyeti S. pombe neden olan bir ajan olan hidrojen peroksit oksidatif stres oksidatife yol açan DNA hasarı, kuvvetle uyarır çiftleşme ve mayotik sporların oluşumu.[25] Bu bulgu, mayozun ve özellikle mayotik rekombinasyonun, DNA hasarını onarmak için bir adaptasyon olabileceğini düşündürmektedir.[kaynak belirtilmeli ] Bu görüşü destekleyen, DNA'daki dU: dG tipi tek bazlı lezyonların bulunmasıdır. S. pombe mayotik rekombinasyonu uyarır.[26] Bu rekombinasyon, urasil-DNA glikozilaz urasili DNA omurgasından çıkaran ve baz eksizyon onarımını başlatan bir enzim. Bu bulgudan yola çıkarak, bir urasil tabanı, bir abasik bölge veya tek sarmallı bir çentiğin temel eksizyon onarımının, başlatmak için yeterli olduğu öne sürülmüştür. rekombinasyon S. pombe.[26] İle diğer deneyler S. pombe DNA replikasyon ara ürünlerinin hatalı işlendiğini gösterdi, örn. Okazaki parçaları, tek iplikli çentikler veya boşluklar gibi DNA hasarlarına neden olur ve bunlar mayotik rekombinasyonu uyarır.[27]
Model sistem olarak
Fisyon mayası, memeliler ve özellikle insanlar gibi daha karmaşık organizmaları anlamak için kullanılabilen bir hücrenin temel prensiplerini incelemek için dikkate değer bir model sistem haline geldi.[28][29] Bu tek hücreli ökaryot patojenik değildir ve laboratuvarda kolayca büyütülür ve manipüle edilir.[30][31] Fisyon mayası, bir ökaryot için bilinen bir genom dizisinin en küçük sayıdaki genlerinden birini içerir ve genomunda yalnızca üç kromozoma sahiptir.[32] Fisyon maya hücresindeki hücre bölünmesi ve hücresel organizasyondan sorumlu genlerin çoğu, insan genomunda da bulunur.[30][31][33] Hücre döngüsünün düzenlenmesi ve bölünmesi, herhangi bir hücrenin büyümesi ve gelişmesi için çok önemlidir. Fisyon mayasının korunan genleri yoğun bir şekilde incelenmiştir ve birçok yeni biyomedikal gelişmenin nedeni budur.[34][35] Fisyon mayası aynı zamanda hücre bölünmesini gözlemlemek için pratik bir model sistemdir çünkü fisyon mayaları, medial fisyon ile bölünen ve çoğalan silindirik şekilli tek hücreli ökaryotlardır.[30] Bu, mikroskopi kullanılarak kolayca görülebilir. Fisyon mayası ayrıca 2 ila 4 saat gibi son derece kısa bir üretim süresine sahiptir, bu da laboratuvarda gözlemlenmesi ve büyümesi kolay bir model sistem olmasını sağlar.[31] Fisyon mayasının genomik yapıdaki basitliği, ancak memeli genomu ile benzerlikler, manipüle etme kolaylığı ve ilaç analizi için kullanılma yeteneği, fisyon mayasının biyotıp ve hücresel biyoloji araştırmalarına ve genetik analiz için bir model sisteme birçok katkıda bulunmasının nedenidir.[31][24][29][36][37]
Genetik şifre
Schizosaccharomyces pombe Heterokromatin proteinleri, büyük replikasyon kaynakları, büyük sentromerler, korunmuş hücresel kontrol noktaları, telomer işlevi, gen ekleme ve diğer birçok hücresel süreç dahil olmak üzere insanda da görülen korunmuş genomik bölgeler nedeniyle hücre bölünmesi ve büyümesini incelemek için sıklıkla kullanılır.[32][38][39] S. pombe'Genom Projesi'nin bir parçası olarak dizilenecek olan altıncı ökaryotik genomun genomu 2002'de tamamen dizildi. Yaklaşık 14 Mb DNA içeren üç kromozom içinde tahmini 4,979 gen keşfedildi. Bu DNA, sentromerik (40kb) ve telomerik (260kb) bölgelerdeki boşluklarla çekirdekteki 3 farklı kromozom içinde bulunur.[32] Fisyon mayasının genomunun ilk dizilişinden sonra, genlerin diğer önceki dizilenmemiş bölgeleri dizilenmiştir. Bu gen bölgelerinin yapısal ve fonksiyonel analizi, büyük ölçekli fisyon maya veri tabanlarında bulunabilir. PomBase.[40]
Genom Projesi'ndeki genlerin yüzde kırk üçünün 4.739 gende intron içerdiği bulundu. Fisyon mayası, tomurcuklanan maya ile karşılaştırıldığında çok fazla çoğaltılmış gene sahip değildir, sadece% 5 içerir, bu da fisyon mayasını gözlemlemek için harika bir model genom yapar ve araştırmacılara daha işlevsel araştırma yaklaşımları oluşturma yeteneği verir. S. pombe'Çok sayıda introna sahip olmak, alternatif birleştirme ve insandaki benzer genleri kodlayan genlerden üretilen protein türlerinin çeşitliliğinin artması için fırsatlar sağlar.[32]Fisyon mayasındaki üç sentromerin% 81'i sıralandı. Üç sentromerin uzunlukları 34, 65 ve 110 kb olarak bulundu. Bu, tomurcuklanan mayanın sentromerlerinden 300-100 kat daha uzundur. Centromere'nin DGS bölgelerinde 1.780 bp üzerinde son derece yüksek bir koruma seviyesi (% 97) de görülmektedir. Sentromerlerin bu uzaması ve konservatif dizileri, fisyon mayasını hücre bölünmesini gözlemlemek için ve benzerliklerinden dolayı insanlarda kullanmak için pratik bir model sistem haline getirir.[32][41][42]
PomBase[7][43] protein kodlayan genlerin% 69'undan fazlasının insan ortologları ve bunların 500'den fazlası insan hastalığı ile ilişkili . Bu yapar S. pombe insan genlerini ve hastalık yollarını, özellikle hücre döngüsü ve DNA kontrol noktası sistemlerini incelemek için harika bir sistem.[42][44][45][46]
Genetik çeşitlilik
Biyoçeşitlilik ve fisyon mayasının evrimsel çalışması, 20 ülkeden toplanan 161 Schizosaccharomyces pombe suşu üzerinde gerçekleştirildi.[47] Evrim oranının modellenmesi, tüm suşların ~ 2.300 yıl önce yaşamış ortak bir atadan türediğini gösterdi. Çalışma ayrıca, her biri ≥1.900 SNP ile farklılık gösteren 57 fisyon maya suşundan oluşan bir set belirledi;[47] ve saptanan 57 fisyon maya suşunun tümü prototrofiktir (referans suş ile aynı minimal ortamda büyüyebilir).[47] S. pombe genomu üzerine yapılan bir dizi çalışma, fisyon maya suşlarının genetik çeşitliliğinin tomurcuklanan mayadan biraz daha az olduğu fikrini desteklemektedir.[47] Nitekim, farklı ortamlarda çoğalmada S. pombe'nin yalnızca sınırlı varyasyonları meydana gelir. Ek olarak, fisyon mayasında ayrılan fenotipik varyasyon miktarı, S. cerevisiae'de görülenden daha azdır.[48] Çoğu fisyon maya suşu, demlenmiş içeceklerden izole edildiğinden, bu dağılımın ekolojik veya tarihsel bağlamı yoktur.
Hücre döngüsü analizi
Mayadaki DNA replikasyonu, birçok araştırmacı tarafından giderek daha fazla incelenmektedir. Mayadaki DNA replikasyonu, gen ekspresyonu ve korunan mekanizmaların daha fazla anlaşılması, araştırmacılara bu sistemlerin genel olarak memeli hücrelerinde ve özelde insan hücrelerinde nasıl işlediği hakkında bilgi sağlayabilir.[39][49][50][51] Daha karmaşık sistemlerde bu mekanizmaları anlamak için mayada hücresel büyüme ve yaşlanma gibi diğer aşamalar da gözlemlenir.[33][52][53][54]
S. pombe sabit faz hücreleri kronolojik olarak yaşlanma üretimi nedeniyle Reaktif oksijen türleri bu sebep DNA hasarları. Bu tür hasarların çoğu normalde DNA ile onarılabilir. taban eksizyon onarımı ve nükleotid eksizyon onarımı.[55] Bu onarım süreçlerindeki kusurlar hayatta kalmanın azalmasına neden olur.
Sitokinez, bölünme mayasında sıklıkla gözlenen hücre bölünmesinin bileşenlerinden biridir. İyi korunmuş sitokinez bileşenleri, fisyon mayasında gözlemlenir ve çeşitli genomik senaryolara bakmamızı ve mutasyonları kesin olarak belirlememizi sağlar.[45][56][57] Sitokinez kalıcı bir adımdır ve hücrenin sağlığı için çok önemlidir.[58] Özellikle kontraktil halka oluşumu, araştırmacılar tarafından yoğun bir şekilde incelenmiştir. S. pombe model sistem olarak. Kasılma halkası, hem fisyon mayasında hem de insan sitokinezinde yüksek oranda korunur.[45] Sitokinezdeki mutasyonlar, hücre ölümü ve kanserli hücrelerin gelişimi dahil olmak üzere hücrenin birçok işlev bozukluğuna neden olabilir.[45] Bu, insan hücre bölünmesinde karmaşık bir süreçtir, ancak S. pombe Daha basit deneyler, daha sonra insanlar gibi daha yüksek seviyeli model sistemlerinde araştırma için uygulanabilecek sonuçlar verebilir.
Hücrenin hassas hücre bölünmesinin gerçekleşmesini sağlamak için aldığı güvenlik önlemlerinden biri, hücre döngüsü kontrol noktasıdır.[59][60] Bu kontrol noktaları, mutajenlerin ortadan kaldırılmasını sağlar.[61] Bu genellikle hedeflerin her yerde bulunmasını uyaran ve sitokinezi geciktiren röle sinyalleriyle yapılır.[32] Bunlar gibi mitotik kontrol noktaları olmadan, mutajenler oluşturulur ve kopyalanır, bu da kanserli hücrelerde görülen hücre ölümü veya tümörijenez gibi çok sayıda hücresel sorunla sonuçlanır. Paul Nurse, Leland Hartwell ve Tim Hunt, 2001 yılında Nobel Fizyoloji veya Tıp Ödülüne layık görüldü. Bir hücrenin düzgün şekilde bölünmesi için çok önemli olan korunmuş anahtar kontrol noktalarını keşfettiler. Bu bulgular kanser ve hastalıklı hücrelere bağlanmıştır ve biyotıp için dikkate değer bir bulgudur.[62]
Fisyon mayasını bir model sistem olarak kullanan araştırmacılar ayrıca organel dinamiklerine ve tepkilerine ve maya hücreleri ile memeli hücreleri arasındaki olası korelasyonlara da bakıyor.[63][64] Mitokondri hastalıkları ve Golgi aygıtı ve endoplazmik retikulum gibi çeşitli organel sistemleri, fisyon mayasının kromozom dinamikleri ve protein ekspresyon seviyeleri ve regülasyonu gözlemlenerek daha da anlaşılabilir.[46][50][65][66][67][68]
Biyomedikal araç
Bununla birlikte, bir model sistem olarak fisyon mayasını kullanmanın sınırlamaları vardır: çoklu ilaç direnci. "MDR yanıtı, iki tip ilaç dışa akış pompasının aşırı ifadesini içerir, ATP bağlayıcı kaset (ABC) ailesi ... ve başlıca kolaylaştırıcı süper ailesi".[34] Paul Nurse ve bazı meslektaşları yakın zamanda S. pombe fisyon mayasını kimyasal ilaç araştırma modeli olarak kullanmanın mümkün olup olmadığını görmek için kimyasal inhibitörlere duyarlı suşlar ve ortak araştırmalar.[34]
Örneğin, çok yaygın bir kemoterapötik antibiyotik olan Doksorubisin birçok yan etkiye sahiptir. Araştırmacılar, bir model sistem olarak fisyon mayası kullanarak dirençle bağlantılı genleri gözlemleyerek doksorubisinin nasıl çalıştığını daha iyi anlamanın yollarını arıyorlar. Doksorubisin yan etkileri ile kromozom metabolizması ve membran taşınması arasındaki bağlantılar görülmüştür. İlaç hedeflemeye yönelik metabolik modeller artık biyoteknolojide kullanılıyor ve gelecekte fisyon maya model sistemi kullanılarak daha fazla ilerleme bekleniyor.[35]
Deneysel yaklaşımlar
Bölünme mayasına kolayca erişilebilir, mutantlar yapmak için kolayca büyütülür ve manipüle edilir ve haploid veya diploid durumda tutulabilir. S. pombe normalde bir haploid hücredir, ancak stresli koşullar altına konulduğunda, genellikle nitrojen eksikliği, iki hücre, daha sonra bir tetrad ascus içinde dört spor oluşturan bir diploid oluşturmak üzere birleşecektir.[31] Bu süreç, herhangi bir mikroskop altında kolayca görülebilir ve gözlemlenebilir ve bu fenomenin nasıl işlediğini görmek için daha basit bir model sistemde mayoza bakmamızı sağlar.
Bu nedenle, tetrad diseksiyon, mutajen analizi, dönüşümler ve FRAP ve FRET gibi mikroskopi teknikleri gibi hemen hemen tüm genetik deneyler veya teknikler bu model sisteme uygulanabilir. Tug-Of-War (gTOW) gibi yeni modeller de maya sağlamlığını analiz etmek ve gen ifadesini gözlemlemek için kullanılıyor. Knock-in ve knock-out genleri yapmak oldukça kolaydır ve fisyon mayasının genomu dizilenirken bu görev çok erişilebilir ve iyi bilinir.[69][70]
Ayrıca bakınız
Referanslar
- ^ Wilhelm BT, Marguerat S, Watt S, Schubert F, Wood V, Goodhead I, ve diğerleri. (Haziran 2008). "Tek nükleotid çözünürlüğünde incelenen bir ökaryotik transkriptom dinamik repertuvarı". Doğa. 453 (7199): 1239–43. Bibcode:2008Natur.453.1239W. doi:10.1038 / nature07002. PMID 18488015. S2CID 205213499.
- ^ Leupold U (1950). "Die Vererbung von Homothallie und Heterothallie bei Schizosaccharomyces pombe". CR Trav Lab Carlsberg Ser Physiol. 24: 381–480.
- ^ Leupold U. (1993) Kökenleri Schizosaccharomyces pombe genetik. İçinde: Hall MN, Linder P. eds. Maya Genetiğinin İlk Günleri. New York. Cold Spring Harbor Laboratuvar Basın. p 125–128.
- ^ Mitchison JM (Ekim 1957). "Tek hücrelerin büyümesi. I. Schizosaccharomyces pombe". Deneysel Hücre Araştırması. 13 (2): 244–62. doi:10.1016/0014-4827(57)90005-8. PMID 13480293.
- ^ Mitchison JM (Nisan 1990). "Fisyon mayası, Schizosaccharomyces pombe". BioEssays. 12 (4): 189–91. doi:10.1002 / bies.950120409. PMID 2185750.
- ^ Fantes PA, Hoffman CS (Haziran 2016). "Schizosaccharomyces pombe Araştırmasının Kısa Tarihi: Son 70 Yıl İçinde Bir Bakış Açısı". Genetik. 203 (2): 621–9. doi:10.1534 / genetik.116.189407. PMC 4896181. PMID 27270696.
- ^ a b c Wood V, Harris MA, McDowall MD, Rutherford K, Vaughan BW, Staines DM ve diğerleri. (Ocak 2012). "PomBase: fisyon mayası için kapsamlı bir çevrimiçi kaynak". Nükleik Asit Araştırması. 40 (Veritabanı sorunu): D695-9. doi:10.1093 / nar / gkr853. PMC 3245111. PMID 22039153.
- ^ "PomBase".
- ^ "PomBase".
- ^ Matsuyama A, Arai R, Yashiroda Y, Shirai A, Kamata A, Sekido S, vd. (Temmuz 2006). "ORFeome klonlama ve fisyon mayası Schizosaccharomyces pombe'de protein lokalizasyonunun global analizi". Doğa Biyoteknolojisi. 24 (7): 841–7. doi:10.1038 / nbt1222. PMID 16823372. S2CID 10397608.
- ^ Teoh AL, Heard G, Cox J (Eylül 2004). "Kombucha fermantasyonunun maya ekolojisi". Uluslararası Gıda Mikrobiyolojisi Dergisi. 95 (2): 119–26. doi:10.1016 / j.ijfoodmicro.2003.12.020. PMID 15282124.
- ^ Florenzano G, Balloni W, Materassi R (1977). "Contributo alla ecologia dei lieviti Schizosaccharomyces sulle uve". Vitis. 16: 38–44.
- ^ Gómez EB, Bailis JM, Forsburg SL (2002). "Bölünme mayası neşeli yeni bir çağa giriyor". Genom Biyolojisi. 3 (6): RAPORLAR4017. doi:10.1186 / gb-2002-3-6-raporlar4017. PMC 139370. PMID 12093372.
- ^ Lin Z, Li WH (Nisan 2011). "Schizosaccharomyces pombe'deki aerobik fermantasyonun evrimi, düzenleyici yeniden programlamayla ilişkilendirildi, ancak nükleozomun yeniden düzenlenmesi ile ilişkilendirilmedi". Moleküler Biyoloji ve Evrim. 28 (4): 1407–13. doi:10.1093 / molbev / msq324. PMC 3058771. PMID 21127171.
- ^ Douzery EJ, Snell EA, Bapteste E, Delsuc F, Philippe H (Ekim 2004). "Ökaryotik evrimin zamanlaması: Rahat bir moleküler saat, proteinlerle fosilleri uzlaştırır mı?". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 101 (43): 15386–91. Bibcode:2004PNAS..10115386D. doi:10.1073 / pnas.0403984101. PMC 524432. PMID 15494441.
- ^ Fiyat CM, Boltz KA, Chaiken MF, Stewart JA, Beilstein MA, Shippen DE (Ağustos 2010). "Telomer bakımında CST işlevinin gelişimi". Hücre döngüsü. 9 (16): 3157–65. doi:10.4161 / cc.9.16.12547. PMC 3041159. PMID 20697207.
- ^ Grunstein, Michael ve Susan Gasser. "Saccharomyces cerevisiae'de epigenetik." Epigenetik. 1. Cold Spring Harbor Press, 2007.
- ^ Morgan, David O. (2007). Hücre Döngüsü Kontrol Prensipleri. Londra: Yeni Bilim Basını. ISBN 978-0-19-920610-0. OCLC 70173205.
- ^ Coelho M, Dereli A, Haese A, Kühn S, Malinovska L, DeSantis ME, ve diğerleri. (Ekim 2013). "Bölünme mayası uygun koşullar altında yaşlanmaz, ancak stres sonrasında yaşlanır". Güncel Biyoloji. 23 (19): 1844–52. doi:10.1016 / j.cub.2013.07.084. PMC 4620659. PMID 24035542.
- ^ Moseley, James B .; Mayeux, Adeline; Paoletti, Anne; Hemşire, Paul (2009). "Uzaysal bir gradyan, hücre boyutunu ve fisyon mayasındaki mitotik girişi koordine eder". Doğa. 459 (7248): 857–860. Bibcode:2009Natur.459..857M. doi:10.1038 / nature08074. ISSN 1476-4687. PMID 19474789. S2CID 4330336.
- ^ Martin, Sophie G .; Berthelot-Grosjean, Martine (2009-06-11). "DYRK ailesi kinaz Pom1'in polar gradyanları, hücre uzunluğunu hücre döngüsü ile birleştirir". Doğa. 459 (7248): 852–856. Bibcode:2009Natur.459..852M. doi:10.1038 / nature08054. ISSN 1476-4687. PMID 19474792. S2CID 4412402.
- ^ Sawin KE (Haziran 2009). "Hücre döngüsü: Hücre bölünmesi boyuta indirildi". Doğa. 459 (7248): 782–3. Bibcode:2009Natur.459..782S. doi:10.1038 / 459782a. PMID 19516326. S2CID 4402226.
- ^ Klar, Amar J.S. (2007-12-01). "Fisyon Mayası Çiftleşme Tipi Değiştirme ve Susturma Çalışmalarından Alınan Dersler". Genetik Yıllık İnceleme. 41 (1): 213–236. doi:10.1146 / annurev.genet.39.073103.094316. ISSN 0066-4197. PMID 17614787.
- ^ a b Davey J (Aralık 1998). "Bir fisyon mayasının füzyonu". Maya. 14 (16): 1529–66. doi:10.1002 / (SICI) 1097-0061 (199812) 14:16 <1529 :: AID-YEA357> 3.0.CO; 2-0. PMID 9885154.
- ^ Bernstein C, Johns V (Nisan 1989). "Schizosaccharomyces pombe'de H2O2 hasarına yanıt olarak cinsel üreme". Bakteriyoloji Dergisi. 171 (4): 1893–7. doi:10.1128 / jb.171.4.1893-1897.1989. PMC 209837. PMID 2703462.
- ^ a b Pauklin S, Burkert JS, Martin J, Osman F, Weller S, Boulton SJ, vd. (Mayıs 2009). "DNA deaminazlarının tek bazlı lezyonlarından miyotik rekombinasyonun alternatif indüksiyonu". Genetik. 182 (1): 41–54. doi:10.1534 / genetik.109.101683. PMC 2674839. PMID 19237686.
- ^ Farah JA, Cromie G, Davis L, Steiner WW, Smith GR (Aralık 2005). "Bir DNA flep endonükleazının yokluğunda bir alternatif, rec12 (spo11) -bağımsız fisyon maya mayotik rekombinasyon yolağının aktivasyonu". Genetik. 171 (4): 1499–511. doi:10.1534 / genetik.105.046821. PMC 1456079. PMID 16118186.
- ^ Forsburg SL (Haziran 2005). "Saccharomyces cerevisiae ve Schizosaccharomyces pombe mayaları: hücre biyolojisi araştırmaları için modeller". Yerçekimi ve Uzay Biyolojisi Bülteni. 18 (2): 3–9. PMID 16038088.
- ^ a b Forsburg SL, Rhind N (Şubat 2006). "Fisyon mayası için temel yöntemler". Maya. 23 (3): 173–83. doi:10.1002 / yıl.1347. PMC 5074380. PMID 16498704.
- ^ a b c Wixon J (2002). "Öne çıkan organizma: Schizosaccharomyces pombe, fisyon mayası". Karşılaştırmalı ve Fonksiyonel Genomik. 3 (2): 194–204. doi:10.1002 / cfg.92. PMC 2447254. PMID 18628834.
- ^ a b c d e Forsburg SL. "PombeNet". Alındı 7 Şubat 2016.
- ^ a b c d e f Wood V, Gwilliam R, Rajandream MA, Lyne M, Lyne R, Stewart A, ve diğerleri. (Şubat 2002). "Schizosaccharomyces pombe'nin genom dizisi". Doğa. 415 (6874): 871–80. Bibcode:2002Natur.415..871W. doi:10.1038 / nature724. PMID 11859360.
- ^ a b Das M, Wiley DJ, Medina S, Vincent HA, Larrea M, Oriolo A, Verde F (Haziran 2007). "Bölünme mayası Rho-GAP Rga4p ile hücre çapı, For3p lokalizasyonu ve hücre simetrisinin düzenlenmesi". Hücrenin moleküler biyolojisi. 18 (6): 2090–101. doi:10.1091 / mbc.E06-09-0883. PMC 1877093. PMID 17377067.
- ^ a b c Kawashima SA, Takemoto A, Nurse P, Kapoor TM (Temmuz 2012). "Kimyasal biyoloji için genetik olarak izlenebilir bir model sistemi geliştirmek için fisyon mayası çoklu ilaç direnç mekanizmalarının analizi". Kimya ve Biyoloji. 19 (7): 893–901. doi:10.1016 / j.chembiol.2012.06.008. PMC 3589755. PMID 22840777.
- ^ a b Tay Z, Eng RJ, Sajiki K, Lim KK, Tang MY, Yanagida M, Chen ES (24 Ocak 2013). "Genetik karışma ile sağlanan hücresel sağlamlık, fisyon mayasında kemoterapötik ilaç doksorubisine karşı direncin altında yatar". PLOS ONE. 8 (1): e55041. Bibcode:2013PLoSO ... 855041T. doi:10.1371 / journal.pone.0055041. PMC 3554685. PMID 23365689.
- ^ Forsburg SL (Eylül 1999). "En iyi maya?" Genetikte Eğilimler. 15 (9): 340–4. doi:10.1016 / s0168-9525 (99) 01798-9. PMID 10461200.
- ^ Hoffman CS, Wood V, Fantes PA (Ekim 2015). "Genç Genetikçiler için Eski Bir Maya: Schizosaccharomyces pombe Model Sistemi Üzerine Bir Başlangıç". Genetik. 201 (2): 403–23. doi:10.1534 / genetik.115.181503. PMC 4596657. PMID 26447128.
- ^ Sabatinos SA, Mastro TL, Green MD, Forsburg SL (Ocak 2013). "Fisyon mayasının nükleosit analoglarına memeli benzeri DNA hasarı tepkisi". Genetik. 193 (1): 143–57. doi:10.1534 / genetik.112.145730. PMC 3527242. PMID 23150603.
- ^ a b Hayano M, Kanoh Y, Matsumoto S, Renard-Guillet C, Shirahige K, Masai H (Ocak 2012). "Rif1, fisyon mayasında replikasyon kaynaklı ateşlemenin zamanlamasının küresel bir düzenleyicisidir". Genler ve Gelişim. 26 (2): 137–50. doi:10.1101 / gad.178491.111. PMC 3273838. PMID 22279046.
- ^ "PomBase Series Edition". EMBL-Avrupa Biyoinformatik Enstitüsü. Wellcome Trust Genome Kampüsü Yayınlandığı Yer: Hinxton, Cambridge.
- ^ Burrack LS, Berman J (Temmuz 2012). "Neosentromerler ve sentromerlerin epigenetik olarak miras alınan özellikleri". Kromozom Araştırması. 20 (5): 607–19. doi:10.1007 / s10577-012-9296-x. PMC 3409321. PMID 22723125.
- ^ a b Stimpson KM, Matheny JE, Sullivan BA (Temmuz 2012). "İki merkezli kromozomlar: sentromer işlevi ve inaktivasyonu incelemek için benzersiz modeller". Kromozom Araştırması. 20 (5): 595–605. doi:10.1007 / s10577-012-9302-3. PMC 3557915. PMID 22801777.
- ^ McDowall MD, Harris MA, Lock A, Rutherford K, Staines DM, Bähler J, ve diğerleri. (Ocak 2015). "PomBase 2015: fisyon mayası veri tabanında güncellemeler". Nükleik Asit Araştırması. 43 (Veritabanı sorunu): D656-61. doi:10.1093 / nar / gku1040. PMC 4383888. PMID 25361970.
- ^ Kadura S, Sazer S (Temmuz 2005). "SAC-ing mitotik hatalar: iş mili düzeneği kontrol noktası (SAC), kromozomun yanlış ayrılmasına karşı nasıl savunma yapar". Hücre Hareketliliği ve Hücre İskeleti. 61 (3): 145–60. doi:10.1002 / cm.20072. PMID 15887295.
- ^ a b c d Lee IJ, Coffman VC, Wu JQ (Ekim 2012). "Fisyon maya sitokinezinde kasılma halkası montajı: Son gelişmeler ve yeni perspektifler". Hücre iskeleti. 69 (10): 751–63. doi:10.1002 / cm. 21052. PMC 5322539. PMID 22887981.
- ^ a b Rinaldi T, Dallabona C, Ferrero I, Frontali L, Bolotin-Fukuhara M (Aralık 2010). "Mitokondriyal hastalıklar ve maya modellerinin rolü". FEMS Maya Araştırması. 10 (8): 1006–22. doi:10.1111 / j.1567-1364.2010.00685.x. PMID 20946356.
- ^ a b c d Daniel C Jeffares ve diğerleri. (2015). Schizosaccharomyces pombe Nature Genetics 47'nin genomik ve fenotipik çeşitliliği 47, 235–241 doi: 10.1038 / ng.3215
- ^ Brown vd. (2011) Coğrafi Olarak Farklı Bir Schizosaccharomyces pombe İzolatları Koleksiyonu, Sınırlı Fenotipik Varyasyon, ancak Kapsamlı Karyotipik Çeşitlilik Göstermektedir. G3 (Bethesda) 7: 615-26 doi: 10.1534 / g3.111.001123.
- ^ Mojardín L, Vázquez E, Antequera F (Kasım 2013). "Fisyon mayalarında DNA replikasyon kökenlerinin ve genomik baz bileşiminin belirlenmesi". Moleküler Biyoloji Dergisi. 425 (23): 4706–13. doi:10.1016 / j.jmb.2013.09.023. hdl:10261/104754. PMID 24095860.
- ^ a b Forsburg SL (Nisan 2002). "Yalnızca bağlan: mayotik DNA replikasyonunu kromozom dinamiklerine bağlama". Moleküler Hücre. 9 (4): 703–11. doi:10.1016 / S1097-2765 (02) 00508-7. PMID 11983163.
- ^ Moriya H, Chino A, Kapuy O, Csikász-Nagy A, Novák B (Aralık 2011). "Fisyon maya hücre döngüsü düzenleyicilerinin in vivo ve in siliko aşırı ekspresyon limitleri". Moleküler Sistem Biyolojisi. 7 (1): 556. doi:10.1038 / msb.2011.91. PMC 3737731. PMID 22146300.
- ^ Das M, Wiley DJ, Chen X, Shah K, Verde F (Ağustos 2009). "Korunan NDR kinaz Orb6, küçük GTPaz Cdc42'nin uzamsal regülasyonu ile polarize hücre büyümesini kontrol eder". Güncel Biyoloji. 19 (15): 1314–9. doi:10.1016 / j.cub.2009.06.057. PMID 19646873. S2CID 12744756.
- ^ Moseley JB (Ekim 2013). "Hücresel yaşlanma: simetri yaşlanmadan kaçar". Güncel Biyoloji. 23 (19): R871-3. doi:10.1016 / j.cub.2013.08.013. PMC 4276399. PMID 24112980.
- ^ Cooper S (2013). "Schizosaccharomyces pombe, bölünme döngüsü sırasında hız değişim noktası olmadan katlanarak büyüyor" (PDF). FEMS Maya Res. 13 (7): 650–8. doi:10.1111/1567-1364.12072. PMID 23981297.
- ^ Senoo T, Kawano S, Ikeda S (Mart 2017). "DNA baz eksizyon onarımı ve nükleotid eksizyon onarımı sinerjistik olarak fisyon mayası Schizosaccharomyces pombe'nin sabit faz hücrelerinin hayatta kalmasına katkıda bulunur". Hücre Biyolojisi Uluslararası. 41 (3): 276–286. doi:10.1002 / cbin.10722. PMID 28032397.
- ^ Cadou A, Couturier A, Le Goff C, Xie L, Paulson JR, Le Goff X (Mart 2013). "Kin1 kinaz ve kalsinörin fosfataz, fisyon mayasında aktin halka düzeneğini ve septum sentezini bağlamak için işbirliği yapar". Hücrenin Biyolojisi. 105 (3): 129–48. doi:10.1111 / boc.201200042. PMID 23294323.
- ^ Balazs A, Batta G, Miklos I, Acs-Szabo L, Vazquez de Aldana CR, Sipiczki M (Mart 2012). "Schizosaccharomyces'te hücre ayırma sürecinin korunmuş düzenleyicileri". Mantar Genetiği ve Biyolojisi. 49 (3): 235–49. doi:10.1016 / j.fgb.2012.01.003. hdl:10261/51389. PMID 22300943.
- ^ Rincon SA, Paoletti A (Ekim 2012). "Mid1 / anillin ve fisyon mayasında sitokinezin uzamsal düzenlenmesi". Hücre iskeleti. 69 (10): 764–77. doi:10.1002 / cm.21056. PMID 22888038.
- ^ Das M, Chiron S, Verde F (2010). "Bölünme mayasında mitokondrinin mikrotübüle bağlı uzaysal organizasyonu". Mikrotübüller: In vivo. Hücre Biyolojisinde Yöntemler. 97. s. 203–21. doi:10.1016 / S0091-679X (10) 97012-X. ISBN 9780123813497. PMID 20719273.
- ^ Fraser HB (2013). "Hücre döngüsü düzenlenmiş transkripsiyon, maya ve insanda DNA replikasyon zamanlaması ile ilişkilidir". Genom Biyolojisi. 14 (10): R111. arXiv:1308.1985. doi:10.1186 / gb-2013-14-10-r111. PMC 3983658. PMID 24098959.
- ^ Li PC, Yeşil MD, Forsburg SL (2013). "Histon metilasyonunu bozan mutasyonlar, S. pombe centromere'de replikasyon zamanlaması üzerinde farklı etkilere sahiptir". PLOS ONE. 8 (5): e61464. Bibcode:2013PLoSO ... 861464L. doi:10.1371 / journal.pone.0061464. PMC 3641051. PMID 23658693.
- ^ "Sör Paul Hemşire - Biyografik". Nobel Ödülü Resmi Sitesi. 2001. Alındı 7 Şubat 2016.
- ^ Zhao J, Lendahl U, Nistér M (Mart 2013). "Mitokondriyal dinamiklerin düzenlenmesi: maya ve omurgalılar arasındaki yakınsamalar ve farklılıklar". Hücresel ve Moleküler Yaşam Bilimleri. 70 (6): 951–76. doi:10.1007 / s00018-012-1066-6. PMC 3578726. PMID 22806564.
- ^ Abelovska L (2011). "Protean organelleri olarak mitokondri: mayadaki mitokondriyal şekli etkileyen zar süreçleri". Genel Fizyoloji ve Biyofizik. 30 Teknik Özellik No (5): S13-24. doi:10.4149 / gpb_2011_SI1_13. PMID 21869447.
- ^ Chino A, Makanae K, Moriya H (3 Eylül 2013). "Schizosaccharomyces pombe'de hücre döngüsü düzenleyici gen kopya sayıları ve protein ekspresyon seviyeleri arasındaki ilişkiler". PLOS ONE. 8 (9): e73319. Bibcode:2013PLoSO ... 873319C. doi:10.1371 / journal.pone.0073319. PMC 3760898. PMID 24019917.
- ^ Raychaudhuri S, Young BP, Espenshade PJ, Loewen C (Ağustos 2012). "Lipid metabolizmasının düzenlenmesi: iki maya hikayesi". Hücre Biyolojisinde Güncel Görüş. 24 (4): 502–8. doi:10.1016 / j.ceb.2012.05.006. PMC 4339016. PMID 22694927.
- ^ Babu M, Vlasblom J, Pu S, Guo X, Graham C, Bean BD, ve diğerleri. (Eylül 2012). "Saccharomyces cerevisiae'deki zar-protein komplekslerinin etkileşim manzarası". Doğa. 489 (7417): 585–9. Bibcode:2012Natur.489..585B. doi:10.1038 / nature11354. PMID 22940862. S2CID 4344457.
- ^ Suda Y, Nakano A (Nisan 2012). "Maya Golgi aygıtı". Trafik. 13 (4): 505–10. doi:10.1111 / j.1600-0854.2011.01316.x. PMID 22132734.
- ^ "Trans-NIH.pombe Girişimi". 2002. Alıntı dergisi gerektirir
| günlük =(Yardım) - ^ Yeşil, M. D. Sabatinos, S.A. Forsburg, S. L. (2009). Fisyon mayası Journal'da DNA replikasyonunu incelemek için mikroskopi teknikleri. Moleküler Biyolojide Yöntemler. 521. sayfa 463–82. doi:10.1007/978-1-60327-815-7_26. ISBN 978-1-60327-814-0. PMID 19563123.CS1 bakimi: birden çok ad: yazarlar listesi (bağlantı)


