Gerinim (kimya) - Strain (chemistry)
İçinde kimya, bir molekül deneyimler Gerginlik olduğu zaman kimyasal yapı biraz geçirir stres onu yükselten içsel enerji gerilimsiz bir referansa kıyasla bileşik. içsel enerji bir molekülün tamamı, enerji içinde saklanır. Gerilmiş bir molekül, kısıtlanmamış bir molekülün sahip olmadığı ek bir iç enerjiye sahiptir. Bu ekstra iç enerji veya gerilme enerjisi, benzetilebilir sıkıştırılmış ilkbahar.[1] Serbest kalmasını önlemek için sıkıştırılmış bir yayın olduğu gibi yerinde tutulmalıdır. potansiyel enerji bir molekül, enerji açısından elverişsiz bir konformasyonda tutulabilir. tahviller o molekülün içinde. Konformasyonu yerinde tutan bağlar olmadan, gerinim enerjisi açığa çıkacaktır.
Özet
Termodinamik
denge iki moleküler konformasyonlar arasındaki fark tarafından belirlenir Gibbs serbest enerjisi iki biçimden. Bu enerji farkından, denge sabiti iki biçim için belirlenebilir.
Gibbs serbest enerjisinde bir durumdan diğerine bir azalma varsa, bu dönüşüm doğal ve düşük enerji durumu daha fazladır kararlı. Oldukça gergin, daha yüksek bir enerji moleküler yapı kendiliğinden daha düşük enerjili moleküler yapıya dönüşecektir.

Entalpi ve entropi Gibbs serbest enerjisi ile denklem aracılığıyla ilişkilidir (sabit sıcaklık ):
Entalpi, daha kararlı bir moleküler konformasyonu belirlemek için tipik olarak daha önemli termodinamik fonksiyondur.[1] Farklı tür türleri varken, hepsiyle ilişkili gerilim enerjisi, molekül içindeki bağların zayıflamasından kaynaklanmaktadır. Entalpi genellikle daha önemli olduğundan, entropi genellikle göz ardı edilebilir.[1] Bu her zaman böyle değildir; Entalpi farkı küçükse, entropinin denge üzerinde daha büyük bir etkisi olabilir. Örneğin, n-bütan iki olası şekli vardır, anti ve gauche. Anti konformasyon 0,9 kcal mol ile daha kararlıdır−1.[1] Oda sıcaklığında bütanın kabaca% 82 anti ve% 18 gauche olmasını bekleriz. Bununla birlikte, iki olası gauche konformasyonu ve sadece bir anti konformasyon vardır. Bu nedenle entropi, gauche konformasyonu lehine 0,4 kcal katkı sağlar.[2] Bütanın gerçek konformasyonel dağılımının oda sıcaklığında% 70 anti ve% 30 gauche olduğunu bulduk.
Moleküler suşu belirleme

standart oluşum ısısı (ΔfH°) bir bileşiğin entalpi değişimi, bileşiğin ayrılmış elementlerinden oluşması olarak tanımlanır.[3] Bir bileşiğin oluşum ısısı, bir tahmin veya bir referans bileşikten farklı olduğunda, bu fark genellikle suşa atfedilebilir. Örneğin, ΔfH° için siklohekzan -29.9 kcal mol−1 iken ΔfH° için metilsiklopentan -25,5 kcal mol−1.[1] Aynı atom ve bağ sayısına sahip olmasına rağmen, metilsiklopentanın enerjisi siklohekzandan daha yüksektir. Enerjideki bu fark, halka gerginliği siklohekzan içinde bulunmayan beş üyeli bir halkanın. Deneysel olarak, gerinim enerjisi genellikle kullanılarak belirlenir yanma ısısı bu genellikle gerçekleştirmesi kolay bir deneydir.
Bir molekül içindeki gerilim enerjisinin belirlenmesi, gerilim olmadan beklenen iç enerji hakkında bilgi sahibi olmayı gerektirir. Bunu yapmanın iki yolu var. Birincisi, önceki gibi, gerilimi olmayan benzer bir bileşikle karşılaştırılabilir. metilsiklohekzan misal. Ne yazık ki, uygun bir bileşik elde etmek çoğu zaman zor olabilir. Bir alternatif kullanmaktır Benson grubu artış teorisi. Bir bileşik içindeki atomlar için uygun grup artışları mevcut olduğu sürece, ΔfH° yapılabilir. Deneysel Δ isefH° tahmin edilenden farklı ΔfH°, enerjideki bu fark, gerilim enerjisine bağlanabilir.
Tür suş
Van der Waals suşu
Van der Waals suşu veya sterik suş, atomlar kendilerinden daha yakın olmaya zorlandıklarında meydana gelir. Van der Waals yarıçapları izin vermek. Spesifik olarak, Van der Waals suşu, etkileşen atomların birbirinden en az dört bağ uzakta olduğu bir tür suş olarak kabul edilir.[4] Benzer moleküllerdeki sterik suş miktarı, etkileşen grupların boyutuna bağlıdır; hantal tert-butil grupları daha fazla yer kaplıyor metil grupları ve genellikle daha büyük sterik etkileşimler yaşar.
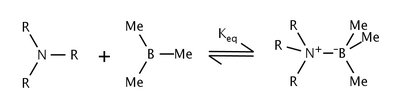
Trialkilaminlerin reaksiyonunda sterik suşun etkileri ve trimetilboron Nobel ödüllü tarafından incelendi Herbert C. Brown et al.[5] Amin üzerindeki alkil gruplarının boyutu arttıkça denge sabitinin de azaldığını bulmuşlardır. Dengedeki kayma, aşağıdakiler arasındaki sterik gerginliğe atfedildi. alkil grupları amin ve bor üzerindeki metil grupları.
Syn-pentan suşu
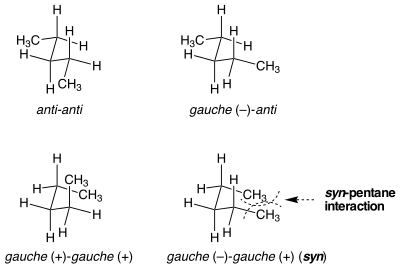
Görünüşte özdeş konformasyonların gerilim enerjisinde eşit olmadığı durumlar vardır. Syn-pentan suşu bu duruma bir örnektir. Her iki bağı da merkeze koymanın iki farklı yolu vardır. npentan biri 3 kcal mol olan bir gauche konformasyonuna−1 Diğerinden daha yüksek enerji.[1] Metil ikameli iki bağ ters yönlerde anti'den gauche'ye döndürüldüğünde, molekül bir siklopentan benzeri iki terminal metil grubunun yakınlaştığı konformasyon. Bağlar aynı yönde döndürülürse bu gerçekleşmez. İki terminal metil grubu arasındaki sterik gerginlik, iki benzer, ancak çok farklı konformasyon arasındaki enerji farkını açıklar.
Alilik suş

Allylic suşu veya A1,3 suş, syn-pentan suşu ile yakından ilişkilidir. Bir örnek müttefik bileşikte suş görülebilir 2-penten. İçin mümkün etil yerine geçen olefin terminal metil grubunun yakınına getirilecek şekilde döndürmek için yakın olefinin metil grubu. Bu tür bileşikler, ikame ediciler arasındaki sterik gerilimi önlemek için genellikle daha doğrusal bir yapı alır.[1]
1,3-diaxial strain
1,3-diaxial suş, syn-pentana benzer başka bir suş şeklidir. Bu durumda, suş, bir ikame edicisi arasındaki sterik etkileşimler nedeniyle oluşur. siklohekzan halka ('α') ve alfa ikame edicisi ve her ikisi arasındaki gauche etkileşimleri metilen söz konusu ikame ediciden iki bağ uzakta karbonlar (dolayısıyla 1,3-iki eksenli etkileşimler). İkame edici olduğunda eksenel eksenel bir gama hidrojene yaklaştırılır. Suş miktarı, büyük ölçüde ikame edicinin boyutuna bağlıdır ve ikame ediciyi bir ekvator pozisyonuna yerleştiren ana sandalye konformasyonuna dönüştürülerek giderilebilir. Konformasyonlar arasındaki enerji farkına Bir değer ve birçok farklı ikame maddesi ile iyi bilinmektedir. Bir değer termodinamik bir parametredir ve başlangıçta diğer yöntemlerle birlikte ölçülmüştür. Gibbs serbest enerjisi denklem ve örneğin Meerwein – Ponndorf – Verley azaltma /Oppenauer oksidasyonu siklohekzanon / sikloheksanolün eksenel ve ekvator değerlerinin ölçümü için denge (0.7 kcal mol−1).[6]
Burulma gerilmesi
Burulma gerilmesi bağ bükülmesine karşı dirençtir. Siklik moleküllerde de denir Pitzer suşu.
Burulma gerinimi, üç bağ ile ayrılan atomlar, daha kararlı kademeli konformasyon yerine örtülü bir konformasyona yerleştirildiğinde meydana gelir. Aşamalı biçimler arasındaki dönme engeli etan yaklaşık 2.9 kcal mol−1.[1] Başlangıçta dönme engelinin, komşu hidrojenler arasındaki sterik etkileşimlerden kaynaklandığına inanılıyordu, ancak Van der Waals hidrojenin yarıçapı, durum için çok küçük. Yakın zamanda yapılan araştırmalar, kademeli konformasyonun bir hiperkonjugatif etki.[7] Aşamalı konformasyondan uzağa dönüş, bu stabilize edici kuvveti kesintiye uğratır.
Bütan gibi daha karmaşık moleküller, birden fazla olası kademeli yapıya sahiptir. Bütan anti konformasyonu yaklaşık 0,9 kcal mol−1 (3,8 kJ mol−1) gauche konformasyonundan daha kararlı.[1] Bu kademeli biçimlerin her ikisi de, gölgede kalan biçimlerden çok daha kararlıdır. Hiperkonjugatif bir etki yerine, örneğin etan, içindeki gerilim enerjisi bütan arasındaki her iki sterik etkileşimden kaynaklanmaktadır metil grupları ve bu etkileşimlerin neden olduğu açı gerilmesi.
Halka gerginliği
Göre VSEPR teorisi Moleküler bağlanma konusunda, bir molekülün tercih edilen geometrisi, hem bağlanan hem de bağlanmayan elektronların mümkün olduğu kadar uzak olduğu şeklidir. Moleküllerde, bu açıların, optimal değerlerine kıyasla bir şekilde sıkıştırılması veya genişlemesi oldukça yaygındır. Bu suş, açı suşu veya Baeyer suşu olarak adlandırılır.[8] Açı suşunun en basit örnekleri, aşağıda tartışılan siklopropan ve siklobütan gibi küçük sikloalkanlardır. Dahası, sık sık gölgelenme veya Pitzer döngüsel sistemlerde gerinim. Bunlar ve olası transannüler etkileşimler erken dönemde özetlenmiştir. H.C. Kahverengi iç gerilim veya I-Gerinim olarak.[9] Moleküler mekanik veya kuvvet alanı yaklaşımları, bu tür gerilim katkılarının hesaplanmasına izin verir, bu daha sonra örn. reaksiyon hızları veya denge ile. Birçok tepki alisiklik Tümü reaksiyon merkezinde sp2 ve sp3 durumu arasında geçiş ile karakterize edilen denge, redoks ve solvoliz reaksiyonları dahil bileşikler, karşılık gelen suş enerjisi farkları SI (sp2 -sp3) ile ilişkilidir.[10]. Veriler, artan SI ile keton indirgeme oranlarındaki ciddi artışla gösterildiği gibi, esas olarak orta halkalardaki elverişsiz komşu açıları yansıtmaktadır (Şekil 1). Diğer bir örnek, geçiş durumu için sp2-modeli olarak karşılık gelen bromür türevleri (sp3) ile karbenium iyonu arasında sterik enerji farklılıkları olan köprübaşı tosilatların solvolizidir.[11] (Şekil 2)


| Yüzük boyutu | Gerinim enerjisi (kcal mol−1) | Yüzük boyutu | Gerinim enerjisi (kcal mol−1) | |
|---|---|---|---|---|
| 3 | 27.5 | 10 | 12.4 | |
| 4 | 26.3 | 11 | 11.3 | |
| 5 | 6.2 | 12 | 4.1 | |
| 6 | 0.1 | 13 | 5.2 | |
| 7 | 6.2 | 14 | 1.9 | |
| 8 | 9.7 | 15 | 1.9 | |
| 9 | 12.6 | 16 | 2.0 |
Prensip olarak, asiklik bileşiklerde açı gerilmesi meydana gelebilir, ancak bu fenomen nadirdir.
Küçük halkalar
Siklohekzan sikloalkanlarda halka türünün belirlenmesinde bir ölçüt olarak kabul edilir ve genel olarak çok az gerinim enerjisi olduğu veya hiç olmadığı kabul edilir.[1] Karşılaştırıldığında, daha küçük sikloalkanlar, artan gerilim nedeniyle enerji bakımından çok daha yüksektir. Siklopropan bir üçgene benzer ve dolayısıyla 60 ° 'lik bağ açıları vardır, bir sp'nin tercih edilen 109.5 °' sinden çok daha düşüktür.3 melezleştirilmiş karbon. Ayrıca, siklopropan içindeki hidrojenler tutulmaktadır. Siklobütan yaklaşık 88 ° 'lik bağ açıları (tamamen düzlemsel değildir) ve tutulmuş hidrojenler ile benzer gerilim yaşar. Siklopropan ve siklobutanın gerinim enerjisi 27.5 ve 26.3 kcal mol'dür.−1, sırasıyla.[1] Siklopentan Esas olarak tutulan hidrojenlerden kaynaklanan burulma gerilimi nedeniyle çok daha az gerilim yaşar ve 6.2 kcal mol gerinim enerjisine sahiptir−1.
Halka gerginliği önemli ölçüde daha yüksek olabilir bisiklik sistemler. Örneğin, bisiklobütan, C4H6, büyük ölçekte izole edilebilen en gergin bileşiklerden biri olduğu için belirtilmiştir; gerinim enerjisi 63.9 kcal mol olarak tahmin edilmektedir−1 (267 kJ mol−1).[12][13]
Transannüler suş
Orta büyüklükteki halkalar (7-13 karbon), çoğunlukla ideal yakın açılardan veya Pitzer suşundan sapma nedeniyle sikloheksandan daha fazla gerilim enerjisi yaşar. Moleküler makanik hesaplamaları, transannüler suşun, aynı zamanda Ön kayıt suşu önemli bir rol oynamıyor. Bununla birlikte, siklooktan ikame reaksiyonlarında 1,5-kayma gibi transannüler reaksiyonlar iyi bilinmektedir.
Bisiklik sistemler
İçindeki gerinim enerjisi miktarı bisiklik sistemler genellikle her bir halkadaki gerilim enerjisinin toplamıdır.[1] Bu her zaman geçerli değildir, çünkü bazen halkaların füzyonu fazladan bir gerilmeye neden olur.
Allosterik sistemlerde zorlanma
Sentetik olarak allosterik sistemlerde tipik olarak, gerilim katkılarından dolayı stabilite farklılıkları olan iki veya daha fazla konformer vardır. Pozitif işbirliği, örneğin, bir efektör molekül E'nin bağlanmasıyla üretilen bir substrat A'nın bir konformer C2'ye artan bağlanmasından kaynaklanır. Konformer C2, başka bir dengeleyici konformer Cl ile benzer bir stabiliteye sahipse a uyum indüklenmiş substrat A tarafından, aynı zamanda efektör E'nin yokluğunda da A'nın C2'ye bağlanmasına yol açacaktır. Allosterik sinyalin etkinliğini ölçen C1 oranı K2 / K1 artacaktır. K2 / K1 oranı, C1 ve C2 konformerleri arasındaki gerinim enerjisi farkıyla doğrudan ilişkilendirilebilir; eğer küçükse, daha yüksek A konsantrasyonları doğrudan C2'ye bağlanacak ve efektör E'yi etkisiz hale getirecektir. Ek olarak, bu tür allosterik anahtarların yanıt süresi, konformer arası dönüşüm geçiş durumunun gerilimine bağlıdır.[14]
Ayrıca bakınız
Referanslar
- ^ a b c d e f g h ben j k l m Anslyn ve Dougherty, Modern Fiziksel Organik Kimya, Üniversite Bilim Kitapları, 2006, ISBN 978-1-891389-31-3
- ^ Coxon ve Norman, Organik Sentez İlkeleri, 3. baskı, Blackie Academic & Pro., 1993, ISBN 978-0-7514-0126-4
- ^ Levine, Fiziksel kimya, 5. baskı, McGraw-Hill, 2002, ISBN 978-0-07-253495-5
- ^ Brown, Foote ve Iverson, Organik Kimya, 4. baskı, Brooks / Cole, 2005, ISBN 978-0-534-46773-9
- ^ Kahverengi, H. C.; Johannesen, R.B. (1952). "Trimethlboron İlave Bileşiklerinin Ayrışması n-Butil- ve Neopentildimetilaminler; Trimetilboron ve Bor Triflorürün yüksek oranda engellenmiş bazlarla etkileşimi ". J. Am. Chem. Soc. 75: 16–20. doi:10.1021 / ja01097a005.
- ^ Eliel, E.L., Wilen, S.H., The Stereochemistry of Organic Compounds, Wiley-Interscience, 1994.
- ^ Weinhold, F. (2001). "Kimya: Moleküler Şekilde Yeni Bir Bükülme". Doğa. 411 (6837): 539–541. doi:10.1038/35079225. PMID 11385553.
- ^ Wiberg, K. (1986). "Organik Kimyada Suş Kavramı". Angew. Chem. Int. Ed. Engl. 25 (4): 312–322. doi:10.1002 / anie.198603121.
- ^ H. C. Brown, R.S. Fletcher, R.B. Johannes J. Am. Chem. Soc. 1951, 73, 212. https://pubs.acs.org/doi/pdf/10.1021/ja01145a072 DOI: 10.1021 / ja01145a072; H.C. Kahverengi, G. Ham J. Am. Chem. Soc. 1956, 78 , 2735 https://pubs.acs.org/doi/pdf/10.1021/ja01593a024
- ^ H.-J. Schneider, G. Schmidt, F. Thomas J. Am. Chem. Soc. 1983, 105, 3556. https://pubs.acs.org/doi/pdf/10.1021/ja00349a031
- ^ P. Müller, J. Mareda, D. Milin J. Phys.Org. Chem., 1995, 8, 507. https://onlinelibrary.wiley.com/doi/epdf/10.1002/poc.610080802
- ^ Wiberg, K. B. (1968). "Küçük Halka Bisiklo [n.m.0] alkanlar ". Hart, H .; Karabatsos, G. J. (ed.). Alisiklik Kimyadaki Gelişmeler. 2. Akademik Basın. s. 185–254. ISBN 9781483224213.
- ^ Wiberg, K. B.; Lampman, G. M .; Ciula, R. P .; Connor, D. S .; Schertler, P .; Lavanish, J. (1965). "Bisiklo [1.1.0] bütan". Tetrahedron. 21 (10): 2749–2769. doi:10.1016 / S0040-4020 (01) 98361-9.
- ^ H.-J. Schneider. Org. Biomol. Chem. 2016,14, 7994. https://pubs.rsc.org/en/content/articlepdf/2016/ob/c6ob01303a


