Hacim kontrollü anyon kanalı - Volume-regulated anion channel
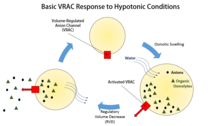
Hacim ayarlı anyon kanalları (VRAC'ler) klorür iyonlarını ve çeşitli organik maddeleri taşıyarak hücre boyutunun düzenlenmesi için çok önemlidir. osmolitler, gibi taurin veya glutamat, karşısında hücre zarı,[1] ve bu kanalların bağlantılı olduğu tek işlev bu değildir. Bazı araştırmalar, VRAC'lerin de su geçirgen olabileceğini ileri sürdü.[2]
Hücre hacminin düzenlenmesi, yalnızca hücrenin çevresindeki bir değişikliğin neden olduğu şişme veya küçülmeye karşı bir önleme olarak değil, aynı zamanda bir hücrenin yaşamının tüm aşamaları boyunca gereklidir. Bir hücrenin hacmindeki değişim, ister şişme ister büzülme olsun, genellikle plazma zarının ekzositik yerleştirilmesi veya endositik geri kazanımı gibi büyük değişiklikler olmaksızın gerçekleşir.[1] Bunun yerine, hacim düzenlemesi çoğunlukla potasyum, sodyum, klorür ve organik maddenin taşınması yoluyla gerçekleşir. osmolitler zarın karşısında.[1] Hacim boyutlarını çevrelerine göre düzenleyemeyen hücrelerin sonuçları büyüktür çünkü şişme liziz ve küçülme sonunda dehidrasyondan apoptoz.[3] VRAC'lerin spesifik olarak hücre hacminin düzenlenmesinde oynadığı spesifik rol, hücrelerin düzenleyici hacim azalmasıdır (RVD).[1]
VRAC'lerin araştırılması, bazılarının memeli hücrelerinde geniş çapta ifade edildikleri ve hatta her yerde ifade edilebilecekleri sonucuna varmalarına yol açtı.[4] VRAC'lerin ayrıca temel hacim düzenlemesi dışındaki temel hücresel işlemlere de katıldıkları gösterilmiştir. hücre çoğalması, göç, ve apoptoz.[5][6]
Yapı ve mekanizma
Bilimsel topluluk VRAC'leri uzun süredir biliyor olsa da,[7] kanalların moleküler bileşiminin ne olduğu henüz yeni keşfedildi. LRRC8'den oluşurlar protein heteromerler, bunların beş çeşidi vardır.[8] Bununla birlikte, spesifik bileşimi LRRC8A, LRRC8B, LRRC8C, LRRC8D, ve LRRC8E düzgün çalışan bir VRAC için gerekli olduğu bilinmemektedir. LRRC8A tek başına heksamerik bir VRAC oluşturabilir, bunun için cyro-EM yapısı farelerinde ve insan versiyonlarında belirlenmiştir.[9][10][11]
Araştırmalar ayrıca, alt birimlerin bileşimindeki değişikliklerin, VRAC'lerin belirli parçaları taşıma kabiliyetinde değişikliklere yol açtığını göstermiştir. metabolitler.[12] Örneğin, alt birim LRRC8D VRAC'ın bileşimine dahil olmak, taurin spesifik kanser önleyici ilaçlarla birlikte.[12] Bunun gibi deneyler sayesinde, LRRC8 proteinlerinin de VRAC gözeneğini oluşturmasının muhtemel olduğunu biliyoruz.
VRAC'ler için bir mekanizmaya gelince, son araştırmalar, hücre içi iyonik güçte bir azalma olduğunda bunların etkinleştirildiğini ileri sürdü; bu, VRAC'lerin aynı zamanda sensör olarak ve hücre hacmi düzenlemesinin etkileyicileri olarak da görev yapabileceğini ima ediyor.[13] Bununla birlikte, araştırmacılar, VRAC aktivasyonunda baskın bir rol oynayan herhangi bir hücre içi sinyalleşme mekanizması bulamadılar.[3]
LRRC8 proteinlerinin transmembran kısmı, Panneksinler.[14]
Nöronlardaki roller
VRAC'ler yalnızca klorür değil, aynı zamanda taurin, glutamat, ve aspartat.[3][1] Bu organik osmolitler hücre dışı sinyalleşme için de çok önemli oldukları için hücresel hacim düzenlemesinden daha fazlası için önemlidir. VRAC'lerin hücre dışı sinyalleşmedeki rolüne zemin hazırlamak için, bazı sonuçları tartışmalıyız. glutamat ve taurin VRAC'lardan çevredeki nöronlar sırasıyla.
İçin glutamat uyarıcı olduğunda nörotransmiterler serbest bırakılır ve çevredeki kanalları etkinleştirir nöronlar aşırı aktif depolarizasyona ve kalsiyum iyonlarında artışa ve sonunda hücresel apoptoz.[3] Buna genellikle eksitotoksisite denir ve normalde nöronal şişmeye neden olur.[6] VRAC'lerin organik sürümü osmolitler Bu şişmeye ve iyon akışına bir yanıt olarak, büyük olasılıkla iyonların önlenmesine yardımcı olur. nöron bir hücreden inorganik bileşiklerin salınması yalnızca yaklaşık% 20-30'luk bir hücresel hacim azalması ile ilişkilendirildiğinden, patlamadan kaynaklanır.[15] Yine de, önlenmesine ek olarak liziz nöron için, salınımı taurin ve glutamat yaymaya da devam edecek eksitotoksisite komşu üzerindeki etkisi nöronlar. VRAC'lerin rolü ve tepkileri ile ilgili çalışılacak en alakalı hücreler eksitotoksisite vardır astrositler. Bunun nedeni, beyindeki nöronal iletişimin destekçileri olarak rolleri, VRAC'leri içerdikleri kanıtlanmış olmaları ve ilgili patolojilere yanıt olarak şişmiş bir durumda bulunmaları gerçeğidir. eksitotoksisite.[3] Belirtmiş olduğumuz gibi, bir nöron üzerindeki uyarımın artması, eksitotoksisite, ve glutamat biridir nörotransmiterler aşırı olması bu nöronal tepkiye neden olabilir. Bu hücresel yanıta atfedilen birçok patoloji vardır: inme ve hipoglisemi diğerleri arasında.[16] Örnek olarak, birkaç çalışma şunu bulmuştur: astrositler hücresel VRAC aktivasyonu, aşağıdaki gibi maddelerdeki felce bağlı artışlarla ilişkili olabilir. ATP.[17] Deneyler, VRAC inhibitörlerinin inme ile ilişkili uyarıcı salınımını azaltabildiğini bulmuştur. nörotransmiterler beyinde;[6] Bu, VRAC'lerin muhtemelen hücresel ATP ve diğer moleküllerin artmasıyla aktive edildiği anlamına gelir. astrositler ve serbest bırakılması glutamat bu hücreler tarafından nöronlar çevrelerinde depolarize olmak, kalsiyum iyon konsantrasyonlarını artırmak ve apoptoz.[6]
Diğer organik osmolit VRAC'larla ilişkili, taurin ayrıca birçok hücre dışı sinyalleşme fonksiyonuna sahiptir. Özellikle, piyasaya sürüldüğü düşünülmektedir. taurin itibaren glia VRACs, osmosensing supraoptik çekirdekte (SON) sistemik hacim düzenlemesiyle bağlantılıdır.[18] İlk başta araştırmacılar şunu düşündü: nöronlar SON'da bulunan, RVD'ye maruz kalamadı, ancak daha sonra, belirli bir süre sonra sonunda bir klorür iyon akımı geliştirdikleri bulundu.[18] Astrositler bu keşifle ilgili olarak tekrar incelendi ve hücrelerin bir hipertonik yayınlayarak çevre taurin VRAC benzeri kanallar aracılığıyla.[18] Sırayla, taurin komşu SON nöronlarında glisin reseptör klorür kanallarını aktive eder ve bu da onların hiperpolarize etmek.[18] SON nöronları küçüldüğünden ve depolarize olduğundan hipertonik çevre[18] arasındaki bu etkileşim astrositler salgılanmasının bir inhibitörü olarak hareket eder vazopressin SON tarafından.
Her ikisinde de VRAC'lerin rolü üzerine yürütülen bu çalışmalara dayanarak eksitotoksisite osmosensing supraoptical nükleusun (SON) koşulları ve regülasyonu, bu kanalın günlük nöronal aktivite üzerindeki gerçek etkisinin büyük çıkarımları vardır. VRAC'lerin nöronal regülasyonda pek çok önemli rol oynaması muhtemeldir; ancak, araştırmacıların etkilerinin kapsamını daraltması zordur. Bir başka önemli yönü nöronlar Unutulmaması gereken, potasyum, klorür yardımcı taşıyıcılarının (KCC'ler) RVD işleminin bir parçası olan ve hücreler şiştiğinde aktive olan diğer proteinlerdir.[3][1] Bunun akılda tutulması önemlidir çünkü VRAC'ler, hücre hacminin düzenlenmesine yardımcı olan mevcut tek molekül değildir ve son araştırmalar, bu iki kanalın birlikte çalışma olasılığının yüksek olduğunu göstermiştir.[3]
Tıbbi bağlantılar
VRAC'lerin birçok rolünün tartışılmasında sunulan bağlantılara ek olarak, nöronlar Araştırmalar, hücre küçülmesinin büyük ölçüde hücre ölümünden önce geldiğini göstermiştir (AVD olarak bilinir - apoptotik hacim azalması),[19] ve VRAC'lerin bu süreçte rol oynadığını gösteren araştırmalar var.[5] Hücre küçülme inhibisyonunun VRAC'lerin inhibitörleri veya LRRC8 proteinlerinin genel bozulması ile bağlantılı olması muhtemeldir.[5][19] Bu inhibisyon veya bozulma, sonuçta baskılanmış ilaca bağlı apoptoz. Bu nedenle, VRAC'ler belirli kanser türlerinde ilaç direncinde rol oynayabilir.
İlgili genler
Referanslar
- ^ a b c d e f Jentsch TJ (Mayıs 2016). "Hücre hacminin düzenlenmesinde ve ötesinde VRAC'ler ve diğer iyon kanalları ve taşıyıcılar". Doğa Yorumları. Moleküler Hücre Biyolojisi. 17 (5): 293–307. doi:10.1038 / nrm.2016.29. PMID 27033257.
- ^ Nilius B (Ocak 2004). "Hacim ayarlı anyon kanalı VRAC" su geçirgen "bir kanal mı?". Nörokimyasal Araştırma. 29 (1): 3–8. doi:10.1023 / B: NERE.0000010430.23137.be. PMID 14992260.
- ^ a b c d e f g Mongin AA (Mart 2016). "Hacim ayarlı anyon kanalı - beyinde bir çılgınlık". Pflügers Arşivi. 468 (3): 421–41. doi:10.1007 / s00424-015-1765-6. PMC 4752865. PMID 26620797.
- ^ Nilius B, Sehrer J, Viana F, De Greef C, Raeymaekers L, Eggermont J, Droogmans G (Ekim 1994). "Farklı memeli uyarılamayan hücre tiplerinde hacimle aktive olan Cl-akımları". Pflügers Arşivi. 428 (3–4): 364–71. doi:10.1007 / BF00724520. PMID 7816559.
- ^ a b c Eggermont J, Trouet D, Karton I, Nilius B (Aralık 2001). "Hücresel işlev ve ses düzeyi ayarlı anyon kanallarının kontrolü". Hücre Biyokimyası ve Biyofizik. 35 (3): 263–74. doi:10,1385 / CBB: 35: 3: 263. PMID 11894846.
- ^ a b c d Inoue H, Okada Y (Şubat 2007). "Eksitotoksik nöronal yaralanmada hacme duyarlı klorür kanalının rolü". Nörobilim Dergisi. 27 (6): 1445–55. doi:10.1523 / JNEUROSCI.4694-06.2007. PMC 6673589. PMID 17287519.
- ^ Nilius B, Eggermont J, Voets T, Buyse G, Manolopoulos V, Droogmans G (1997). "Memeli hücrelerinde hacimle düzenlenen anyon kanallarının özellikleri". Biyofizik ve Moleküler Biyolojide İlerleme. 68 (1): 69–119. doi:10.1016 / S0079-6107 (97) 00021-7. PMID 9481145.
- ^ Voss FK, Ullrich F, Münch J, Lazarow K, Lutter D, Mah N, Andrade-Navarro MA, von Kries JP, Stauber T, Jentsch TJ (Mayıs 2014). "LRRC8 heteromerlerinin, hacim regülasyonlu anyon kanalı VRAC'ın temel bir bileşeni olarak tanımlanması" (PDF). Bilim. 344 (6184): 634–8. Bibcode:2014Sci ... 344..634V. doi:10.1126 / science.1252826. PMID 24790029.
- ^ Deneka, D; Sawicka, M; Lam, AKM; Paulino, C; Dutzler, R (Haziran 2018). "LRRC8 ailesinin hacimle düzenlenmiş bir anyon kanalının yapısı". Doğa. 558 (7709): 254–259. Bibcode:2018Natur.558..254D. doi:10.1038 / s41586-018-0134-y. PMID 29769723.
- ^ Kefauver, JM; Saotome, K; Dubin, AE; Pallesen, J; Cottrell, CA; Cahalan, SM; Qiu, Z; Hong, G; Crowley, CS; Whitwam, T; Lee, WH; Ward, AB; Patapoutian, A (10 Ağustos 2018). "İnsan hacmi düzenlenmiş anyon kanalının yapısı". eLife. 7. doi:10.7554 / eLife.38461. PMC 6086657. PMID 30095067.
- ^ Kasuya, G; Nakane, T; Yokoyama, T; Jia, Y; Inoue, M; Watanabe, K; Nakamura, R; Nishizawa, T; Kusakizako, T; Tsutsumi, A; Yanagisawa, H; Dohmae, N; Hattori, M; Ichijo, H; Yan, Z; Kikkawa, M; Shirouzu, M; Ishitani, R; Nureki, O (Eylül 2018). "İnsan hacmi düzenlenmiş anyon kanalı LRRC8'in Cryo-EM yapıları". Doğa Yapısal ve Moleküler Biyoloji. 25 (9): 797–804. doi:10.1038 / s41594-018-0109-6. PMID 30127360.
- ^ a b Planells-Cases R, Lutter D, Guyader C, Gerhards NM, Ullrich F, Elger DA, Kucukosmanoglu A, Xu G, Voss FK, Reincke SM, Stauber T, Blomen VA, Vis DJ, Wessels LF, Brummelkamp TR, Borst P, Rottenberg S, Jentsch TJ (Aralık 2015). "VRAC kanallarının alt birim bileşimi, substrat özgüllüğünü ve Pt bazlı anti-kanser ilaçlarına karşı hücresel direnci belirler". EMBO Dergisi. 34 (24): 2993–3008. doi:10.15252 / embj.201592409. PMC 4687416. PMID 26530471.
- ^ Love L (Kasım 1977). "Görünüm kutusu". Illinois Tıp Dergisi. 152 (5): 5298–5303. PMID 21858.
- ^ Abascal, F; Zardoya, R (Temmuz 2012). "LRRC8 proteinleri, pannexinlerle ortak bir atayı paylaşır ve hücre-hücre iletişiminde yer alan heksamerik kanallar oluşturabilir". BioEssays: Moleküler, Hücresel ve Gelişimsel Biyolojide Haberler ve İncelemeler. 34 (7): 551–60. doi:10.1002 / bies.201100173. hdl:10261/124027. PMID 22532330.
- ^ Model MA (Mart 2014). "Apoptotik hacim azalmasının olası nedenleri: kantitatif inceleme denemesi". Amerikan Fizyoloji Dergisi. Hücre Fizyolojisi. 306 (5): C417–24. doi:10.1152 / ajpcell.00328.2013. PMID 24196536.
- ^ Choi DW (Ekim 1988). "Glutamat nörotoksisitesi ve sinir sistemi hastalıkları". Nöron. 1 (8): 623–34. doi:10.1016/0896-6273(88)90162-6. PMID 2908446.
- ^ Hyzinski-García MC, Rudkouskaya A, Mongin AA (Kasım 2014). "LRRC8A proteini, sıçan astrositlerinde uyarıcı amino asitlerin şişmeyle aktive olan ve ATP'nin neden olduğu salınım için vazgeçilmezdir". Fizyoloji Dergisi. 592 (22): 4855–62. doi:10.1113 / jphysiol.2014.278887. PMC 4259531. PMID 25172945.
- ^ a b c d e Katz RS, Baker DH (Eylül 1975). "Civcivlerde metiyonin toksisitesi: beslenme ve metabolik etkiler". Beslenme Dergisi. 105 (9): 1168–75. doi:10.1111 / j.1469-7793.1997.609bj.x. PMC 1159532. PMID 9279812.
- ^ a b Maeno E, Ishizaki Y, Kanaseki T, Hazama A, Okada Y (Ağustos 2000). "Düzensiz hacim regülasyonu nedeniyle normotonik hücre küçülmesi, apoptoz için erken bir ön koşuldur". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 97 (17): 9487–92. doi:10.1073 / pnas.140216197. PMC 16891. PMID 10900263.
