Adyabatik süreç - Adiabatic process
| Termodinamik | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Klasik Carnot ısı motoru | ||||||||||||
| ||||||||||||
| ||||||||||||
İçinde termodinamik, bir Adyabatik süreç bir tür termodinamik süreç transfer olmadan gerçekleşir sıcaklık veya kitle arasında sistemi ve Onun çevre. Aksine izotermal süreç adyabatik bir süreç, enerjiyi çevreye yalnızca iş.[1][2] Aynı zamanda, açıklamak için kullanılan teoriyi kavramsal olarak destekler. termodinamiğin birinci yasası ve bu nedenle bir anahtardır termodinamik kavram.
Bazı kimyasal ve fiziksel süreçler, enerjinin ısı olarak sisteme girmesi veya çıkması için çok hızlı gerçekleşir ve bu da uygun bir "adyabatik yaklaşım" sağlar.[3] Örneğin, adyabatik alev sıcaklığı bu yaklaşımı, üst sınırını hesaplamak için kullanır alev Yanmanın çevresine ısı kaybetmediğini varsayarak sıcaklık.
İçinde meteoroloji ve oşinografi, adyabatik soğutma, nem veya tuzluluk yoğunlaşmasına neden olarak aşırı doygunluğa neden olur. parsel. Bu nedenle fazlalığın giderilmesi gerekir. Burada süreç bir sözde adyabatik süreç böylece yoğunlaşan sıvı su veya tuzun idealize edilmiş anlık olarak oluşması üzerine çıkarıldığı varsayılır. yağış. Sözde diyabatik süreç yalnızca genişleme için tanımlanır çünkü sıkıştırılmış bir parsel ısınır ve yetersiz doyurulur.[4]
Açıklama
Bir sisteme veya sistemden ısı veya madde transferinin olmadığı bir süreç, böylece Q = 0, adyabatik olarak adlandırılır ve böyle bir sistemin adyabatik olarak izole edildiği söylenir.[5][6] Bir sürecin adyabatik olduğu varsayımı, sıklıkla yapılan basitleştirici bir varsayımdır. Örneğin, bir motorun bir silindiri içindeki bir gazın sıkıştırılmasının o kadar hızlı gerçekleştiği varsayılır ki, sıkıştırma işleminin zaman ölçeğinde, sistemin enerjisinin küçük bir kısmı ısı olarak çevreye aktarılabilir. Silindirler yalıtılmamış ve oldukça iletken olsalar bile, bu işlem adyabatik olması için ideal hale getirilmiştir. Aynısının böyle bir sistemin genişleme süreci için de geçerli olduğu söylenebilir.
Adyabatik izolasyon varsayımı faydalıdır ve genellikle bir sistemin davranışının iyi bir ilk yaklaşımını hesaplamak için bu tür diğer idealleştirmelerle birleştirilir. Örneğin, göre Laplace, ses bir gazda hareket ettiğinde, ortamda ısı iletimi için zaman yoktur ve bu nedenle sesin yayılması adyabatiktir. Böyle adyabatik bir süreç için, esneklik modülü (Gencin modülü ) olarak ifade edilebilir E = γP, nerede γ ... özgül ısı oranı sabit basınçta ve sabit hacimde (γ = Cp/Cv ) ve P gazın basıncıdır.
Adyabatik varsayımın çeşitli uygulamaları
Kapalı bir sistem için, termodinamiğin birinci yasası gibi : ΔU = Q – W, nerede ΔU sistemin iç enerjisindeki değişimi ifade eder, Q ona ısı olarak eklenen enerji miktarı ve W sistemin çevresi üzerinde yaptığı iş.
- Sistemin, işin içeri veya dışarı aktarılamayacağı kadar sert duvarları varsa (W = 0) ve duvarlar adyabatik değildir ve ısı şeklinde enerji eklenir (Q > 0) ve faz değişikliği olmazsa, sistemin sıcaklığı yükselir.
- Sistemin, basınç-hacim işi yapılamayacak kadar sert duvarları varsa, ancak duvarlar adyabatiktir (Q = 0) ve enerji izokorik çalışma olarak sürtünme veya sistem içindeki viskoz bir sıvının karıştırılması şeklinde eklenir (W < 0) ve faz değişikliği olmazsa, sistemin sıcaklığı yükselir.
- Sistem duvarları adyabatik ise (Q = 0) ama katı değil (W ≠ 0) ve kurgusal idealize edilmiş bir süreçte, sisteme sürtünmesiz, viskoz olmayan basınç-hacim işi şeklinde enerji eklenir (W < 0) ve faz değişikliği olmazsa, sistemin sıcaklığı yükselir. Böyle bir sürece bir izantropik süreç ve "tersine çevrilebilir" olduğu söylenir. Hayal ürünü olarak, süreç tersine çevrilirse, sistem tarafından yapılan iş olarak enerji tamamen geri kazanılabilir. Sistem sıkıştırılabilir bir gaz içeriyorsa ve hacmi azalırsa, gazın konumunun belirsizliği azalır ve görünüşe göre sistemin entropisini azaltır, ancak süreç izantropik olduğundan sistemin sıcaklığı yükselir (ΔS = 0). İş, sistem içinde sürtünme veya viskoz kuvvetler çalışacak şekilde eklenirse, süreç izantropik değildir ve faz değişikliği yoksa, sistemin sıcaklığı yükselir, işlemin olduğu söylenir. "geri döndürülemez" ve sisteme eklenen iş, iş biçiminde tamamen kurtarılamaz.
- Bir sistemin duvarları adyabatik değilse ve enerji ısı olarak aktarılıyorsa, entropi ısı ile sisteme aktarılır. Böyle bir süreç ne adyabatik ne de izantropiktir. Q > 0, ve ΔS > 0 göre termodinamiğin ikinci yasası.
Doğal olarak oluşan adyabatik süreçler geri döndürülemez (entropi üretilir).
Enerjinin iş olarak adyabatik olarak izole edilmiş bir sisteme aktarılması, idealize edilmiş iki aşırı tür olarak düşünülebilir. Bu tür bir türde, sistem içinde hiç entropi üretilmez (sürtünme, viskoz dağılım, vb.) Ve iş yalnızca basınç-hacim işidir ( P dV). Doğada, bu ideal tür, yalnızca yaklaşık olarak, sonsuz derecede yavaş bir süreç gerektirdiği ve hiçbir yayılma kaynağı olmadığı için oluşur.
Diğer ekstrem çalışma türü, izokorik çalışmadır (dV = 0), enerjinin yalnızca sistem içinde sürtünme veya viskoz dağılım yoluyla iş olarak eklendiği. Faz değişimi olmaksızın, sert duvarlara sahip adyabatik olarak izole edilmiş bir sistemin viskoz akışkanına enerji aktaran bir karıştırıcı, akışkanın sıcaklığında bir artışa neden olacaktır, ancak bu iş geri kazanılamaz. İzokorik çalışma geri döndürülemez.[7] Termodinamiğin ikinci yasası, doğal bir sürecin, iş olarak enerji aktarımının her zaman en azından izokorik çalışmadan ve çoğu zaman bu aşırı türdeki işlerin her ikisinden oluştuğunu gözlemler. Adyabatik olsun ya da olmasın her doğal süreç geri döndürülemez. ΔS > 0sürtünme veya viskozite her zaman bir dereceye kadar mevcut olduğundan.
Adyabatik ısıtma ve soğutma
Bir gazın adyabatik olarak sıkıştırılması, gazın sıcaklığında bir artışa neden olur. Basınca veya bir yaya karşı adyabatik genişleme, sıcaklıkta düşüşe neden olur. Tersine, serbest genişleme bir izotermal ideal bir gaz için proses.
Adyabatik ısıtma bir gazın basıncı, çevresi tarafından yapılan çalışma ile artırıldığında meydana gelir, örn. piston bir silindir içinde bulunan bir gazı sıkıştırmak ve birçok pratik durumda duvarlardan ısı iletiminin sıkıştırma süresine kıyasla yavaş olabileceği yerlerde sıcaklığı yükseltmek. Bu, pratik uygulama bulur dizel motorlar Bu, yakıt buharı sıcaklığını tutuşturmaya yetecek kadar yükseltmek için sıkıştırma stroku sırasında ısı yayılımının olmamasına dayanır.
Adyabatik ısınma Dünya atmosferi Ne zaman hava kütlesi iner, örneğin, bir katabatik rüzğarı, Foehn rüzgarı veya Chinook rüzgarı bir dağ silsilesi üzerinden yokuş aşağı akan. Bir paket hava alçaldığında parsel üzerindeki basınç artar. Basınçtaki bu artış nedeniyle parselin hacmi azalır ve hava parselinde iş yapıldıkça sıcaklığı artar, böylece hava kütlesinin sıcaklığındaki artışla kendini gösteren iç enerjisi artar. Hava parseli, enerjiyi iletim veya radyasyon (ısı) yoluyla ancak yavaşça dağıtabilir ve ilk yaklaşıma göre adyabatik olarak izole edilmiş ve işlem adyabatik bir süreç olarak kabul edilebilir.
Adyabatik soğutma adyabatik olarak izole edilmiş bir sistem üzerindeki basınç azaldığında, genişlemesine izin verdiğinde ve böylece çevresi üzerinde çalışmasına neden olduğunda oluşur. Bir paket hava üzerine uygulanan basınç azaldığında, kolideki havanın genleşmesi sağlanır; hacim arttıkça, iç enerjisi azaldıkça sıcaklık düşer. Adyabatik soğutma, Dünya atmosferinde orografik kaldırma ve Lee dalgaları ve bu oluşabilir Pileus veya merceksi bulutlar.
Adyabatik soğutmanın bir sıvı içermesi gerekmez. Çok düşük sıcaklıklara (mutlak sıfırın üzerindeki bir derecenin binde biri ve hatta milyonda biri) ulaşmak için kullanılan bir teknik, adyabatik demanyetizasyon, değişim nerede manyetik alan manyetik bir malzeme üzerinde adyabatik soğutma sağlamak için kullanılır. Ayrıca, bir genişleyen evren (birinci dereceden) adyabatik olarak soğutma sıvısı olarak tanımlanabilir. (Görmek evrenin ısı ölümü.)
Yükselen magma, püskürmeden önce adyabatik soğumaya da uğrar, bu özellikle büyük derinliklerden hızla yükselen magmalar durumunda önemlidir. kimberlitler.[8]
Litosferin altındaki Dünya'nın kıvrımlı mantosunda (astenosfer), manto sıcaklığı yaklaşık olarak bir adyabattır. Sığ derinlik ile sıcaklıktaki hafif düşüş, malzemenin Dünya'da daha sığ olduğu basınçtaki düşüşten kaynaklanmaktadır.[9]
Bu tür sıcaklık değişiklikleri, ideal gaz kanunu, ya da hidrostatik denklem atmosferik işlemler için.
Pratikte hiçbir süreç tam anlamıyla adyabatik değildir. Birçok işlem, ilgili sürecin zaman ölçeklerinde büyük bir farka ve bir sistem sınırı boyunca ısı yayılımına dayanır ve bu nedenle adyabatik bir varsayım kullanılarak yaklaşık olarak hesaplanır. Mükemmel yalıtıcılar olmadığından her zaman bir miktar ısı kaybı olur.
İdeal gaz (ters çevrilebilir işlem)

Bir için matematiksel denklem Ideal gaz tersine çevrilebilir (yani, entropi oluşumu yok) adyabatik bir süreç geçiren politropik süreç denklem[3]
nerede P baskı V hacimdir ve bu durum için n = γ, nerede
CP olmak özısı sabit basınç için, CV sabit hacim için özgül ısı olmak, γ ... adyabatik indeks, ve f sayısı özgürlük derecesi (Monatomik gaz için 3, diatomik gaz ve eşdoğrusal moleküller için 5, örneğin karbon dioksit).
Tek atomlu ideal bir gaz için, γ = 5/3ve diatomik bir gaz için (örneğin azot ve oksijen, havanın ana bileşenleri) γ = 7/5.[10] Yukarıdaki formülün yalnızca klasik ideal gazlar için geçerli olduğunu ve Bose-Einstein veya Fermi gazları.
Tersinir adyabatik süreçler için şu da doğrudur:[3]
nerede T mutlak bir sıcaklıktır. Bu aynı zamanda şu şekilde de yazılabilir:[3]
Adyabatik sıkıştırma örneği
Bir sıkıştırma darbesi benzinli motor adyabatik kompresyon örneği olarak kullanılabilir. Model varsayımları şöyledir: silindirin sıkıştırılmamış hacmi bir litredir (1 L = 1000 cm3 = 0,001 m3); içindeki gaz, yalnızca moleküler nitrojen ve oksijenden oluşan havadır (dolayısıyla 5 derece serbestliğe sahip bir diatomik gaz vb.) γ = 7/5); motorun sıkıştırma oranı 10: 1'dir (yani, 1 L'lik sıkıştırılmamış gaz hacmi, piston tarafından 0.1 L'ye düşürülür); ve sıkıştırılmamış gaz yaklaşık oda sıcaklığı ve basıncındadır (~ 27 ° C veya 300 K sıcak oda sıcaklığı ve 1 bar = 100 kPa basınç, yani tipik deniz seviyesinde atmosferik basınç).
yani bu örnek için adyabatik sabitimiz yaklaşık 6,31 Pa m4.2.
Gaz şimdi 0,1 L'ye (0,0001 m3) Hacim (bunun yeterince hızlı olduğunu varsayacağız ki, duvarlardan hiçbir ısı gaza giremez veya çıkamaz). Adyabatik sabit aynı kalır, ancak ortaya çıkan basınç bilinmemektedir.
bu yüzden çözüyorum P2:
veya 25.1 bar. Bu basınç artışının basit bir 10: 1 sıkıştırma oranının göstereceğinden daha fazla olduğuna dikkat edin; bunun nedeni, gazın sadece sıkıştırılmaması, aynı zamanda gazı sıkıştırmak için yapılan işin iç enerjisini de arttırmasıdır; bu, gaz sıcaklığındaki bir yükselme ve basit bir hesaplamadan kaynaklanacak olanın üzerinde ilave bir basınç artışı ile kendini gösterir. orijinal basıncın katı.
İdeal gaz yasasını kullanarak motor silindirindeki sıkıştırılmış gazın sıcaklığını da çözebiliriz, PV = nRT (n mol cinsinden gaz miktarı ve R o gaz için gaz sabiti). Başlangıç koşullarımız 100 kPa basınç, 1 L hacim ve 300 K sıcaklıktır, deneysel sabitimiz (nR) dır-dir:
Sıkıştırılmış gazın V = 0.1 L ve P = 2.51×106 Baba, böylece sıcaklığı çözebiliriz:
Bu, 753 K veya 479 ° C veya 896 ° F'lik son sıcaklıktır, birçok yakıtın tutuşma noktasının çok üzerindedir. Bu nedenle, yüksek sıkıştırmalı bir motor, kendiliğinden tutuşmayacak şekilde özel olarak formüle edilmiş yakıtlar gerektirir ( motor vuruntusu bu sıcaklık ve basınç koşulları altında çalıştırıldığında) veya süper şarj cihazı bir ile ara soğutucu bir basınç artışı sağlamak, ancak daha düşük bir sıcaklık artışı ile avantajlı olacaktır. Bir dizel motor, enjekte edilen yakıtın anında ateşlenmesini sağlayan çok yüksek bir gaz sıcaklığı sağlamak için tipik olan 16: 1 veya daha fazla sıkıştırma oranları ile daha da aşırı koşullar altında çalışır.
Bir gazın adyabatik serbest genleşmesi
İdeal bir gazın adyabatik serbest genleşmesi için, gaz yalıtılmış bir kapta tutulur ve daha sonra bir vakumda genleşmesine izin verilir. Gazın genleşeceği bir dış basınç olmadığı için sistem tarafından veya sistem üzerinde yapılan iş sıfırdır. Bu süreç herhangi bir ısı transferi veya iş içermediğinden, termodinamiğin birinci yasası, sistemin net iç enerji değişiminin sıfır olduğunu ima eder. İdeal bir gaz için sıcaklık sabit kalır çünkü bu durumda dahili enerji yalnızca sıcaklığa bağlıdır. Sabit sıcaklıkta entropi hacimle orantılı olduğundan, bu durumda entropi artar, bu nedenle bu süreç geri döndürülemez.
Türetilmesi P–V adyabatik ısıtma ve soğutma ilişkisi
Adyabatik bir sürecin tanımı, sisteme ısı transferinin sıfır olmasıdır, δQ = 0. Daha sonra termodinamiğin birinci yasasına göre,
nerede dU sistemin iç enerjisindeki değişimdir ve δW iş bitti mi tarafından sistem. Herhangi bir iş (δW) iç enerji pahasına yapılmalıdır Uısı olmadığı için δQ çevreden temin ediliyor. Basınç-hacim işi δW bitti tarafından sistem şu şekilde tanımlanır:
Ancak, P adyabatik bir süreç sırasında sabit kalmaz, bunun yerine V.
Değerlerinin nasıl bilinmesi istenir dP ve dV adyabatik süreç ilerledikçe birbirleriyle ilişki kurarlar. İdeal bir gaz için (ideal gaz yasasını hatırlayın PV = nRT ) iç enerji verilir
nerede α serbestlik derecesi sayısının ikiye bölünmesidir, R ... Evrensel gaz sabiti ve n sistemdeki mol sayısıdır (sabittir).
Diferansiyel denklem (3) verimi
Denklem (4) genellikle şu şekilde ifade edilir: dU = nCV dT Çünkü CV = αR.
Şimdi (2) ve (4) denklemlerini (1) denklemine koyun.
çarpanlara ayırmak −P dV:
ve her iki tarafı da PV:
Sol ve sağ tarafları entegre ettikten sonra V0 -e V ve den P0 -e P ve sırasıyla tarafları değiştirmek,
Her iki tarafı da üsleyin, yerine koyun α + 1/α ile γ, ısı kapasitesi oranı
ve negatif işareti ortadan kaldırmak için
Bu nedenle,
ve
Türetilmesi P–T adyabatik ısıtma ve soğutma ilişkisi
İdeal gaz yasasını yukarıdakilerle değiştirerek şunu elde ederiz:
basitleştiren
Ayrık formül türetilmesi ve iş ifadesi
Durum 1'den durum 2'ye ölçülen bir sistemin iç enerjisindeki değişim şuna eşittir:
Aynı zamanda, bu işlemin bir sonucu olarak basınç-hacim değişikliklerinin yaptığı iş,
İşlemin adyabatik olmasını istediğimiz için aşağıdaki denklemin doğru olması gerekir
Önceki türetme ile,
Yeniden düzenleme (4) verir
Bunu (2) ile değiştirmek,
Entegre ederek iş için ifade elde ederiz,
İkame γ = α + 1/α ikinci dönemde,
Yeniden düzenleme,
İdeal gaz yasasını kullanarak ve sabit bir molar miktar varsayarak (pratik durumlarda sıklıkla olduğu gibi),
Sürekli formülle,
veya
Önceki ifadenin yerine geçerek W,
Bu ifadeyi ve (1) (3) 'te ikame etmek
Basitleştirilmiş,
Adyabat grafik
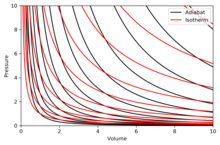
Bir adyabat sabit bir eğridir entropi bir diyagramda. Adyabatların bazı özellikleri P–V diyagram belirtilmiştir. Bu özellikler, ideal gazların klasik davranışından okunabilir. PV kuantum etkilerinin önemli hale geldiği yerde küçülür (düşük sıcaklık).
- Her adyabat asimptotik olarak hem yaklaşır V eksen ve P eksen (tıpkı izotermler ).
- Her adyabat, her izotermle tam olarak bir kez kesişir.
- Bir adyabat, bir genişleme sırasında, bir adyabatın bir izotermden daha fazla basınç kaybetmesi, dolayısıyla daha dik bir eğime sahip olması dışında (daha dikey) bir izoterm gibi görünür.
- İzotermler kuzey-doğu yönüne (45 °) doğru içbükey ise, adyabatlar doğu kuzey-doğuya (31 °) doğru içbükeydir.
- Adyabatlar ve izotermler, sırasıyla düzenli entropi ve sıcaklık aralıklarında (bir kontur haritasındaki yükseklik gibi) grafiğe dökülürse, o zaman göz eksenlere doğru (güney-batıya doğru) hareket ettikçe, izotermlerin yoğunluğunun sabit kaldığını görür, ancak adyabatların yoğunluğunun arttığını görür. Bunun istisnası, adyabatların yoğunluğunun keskin bir şekilde düştüğü ve nadir hale geldikleri mutlak sıfıra çok yakındır (bkz. Nernst teoremi ).[açıklama gerekli ]
Doğru diyagram bir P–V adyabatların ve izotermlerin üst üste geldiği diyagram:
İzotermler kırmızı eğriler ve adyabatlar siyah eğrilerdir.
Adyabatlar izantropiktir.
Hacim yatay eksendir ve basınç dikey eksendir.
Etimoloji
Dönem adyabatik (/ˌædbenəˈbætɪk/) bir köşelendirmedir Yunan ἀδιάβατος "geçilmez" terimi (kullanılan Xenophon nehirler). tarafından termodinamik anlamda kullanılır. Rankine (1866),[11][12] ve tarafından kabul edildi Maxwell 1871'de (terimi açıkça Rankine'e atfederek).[13]Etimolojik köken, burada bir imkansızlığa karşılık gelir. ısı olarak enerji transferi ve maddenin duvar boyunca aktarılması.
Yunanca ἀδιάβατος kelimesi şunlardan oluşur: özel ἀ- ("değil") ve διαβατός, "geçilebilir", sırayla διά ("üzerinden") ve βαῖνειν ("yürümek, gitmek, gelmek") 'den türetilir.[14]
Termodinamik teoride kavramsal önemi
Adyabatik süreç, ilk günlerinden beri termodinamik için önemli olmuştur. Joule'un çalışmasında önemliydi çünkü ısı ve iş miktarlarını neredeyse doğrudan ilişkilendirmenin bir yolunu sağladı.
Enerji, duvarlarla çevrili bir termodinamik sisteme girebilir veya buradan çıkabilir. kütle Transferi sadece ısı veya iş olarak. Bu nedenle, böyle bir sistemdeki bir miktar iş, iki uzuvdan oluşan bir döngüdeki eşdeğer bir ısı miktarıyla neredeyse doğrudan ilişkilendirilebilir. İlk ekstremite izokorik adyabatik bir iş sürecidir ve sistemin içsel enerji; ikincisi, sistemi orijinal durumuna döndüren izokorik ve işsiz bir ısı transferi. Buna göre Rankine, ısı miktarını kalorimetrik bir miktar yerine iş birimlerinde ölçtü.[15] 1854'te Rankine, daha sonra entropi olarak adlandırılan "termodinamik fonksiyon" adını verdiği bir nicelik kullandı ve o sırada "ısı iletiminin olmadığı eğri" ni de yazdı.[16] daha sonra adyabatik bir eğri olarak adlandırdı.[11] İki izotermal uzvunun yanı sıra, Carnot'un döngüsünde iki adyabatik uzuv vardır.
Termodinamiğin temelleri için bunun kavramsal önemi Bryan tarafından vurgulandı,[17] Carathéodory tarafından,[1] ve Born tarafından.[18] Bunun nedeni, kalorimetrinin, termodinamiğin birinci yasasının ifadesinden önce tanımlandığı gibi, deneysel ölçeklere dayalı bir sıcaklık türünü önceden varsaymasıdır. Böyle bir ön varsayım, ampirik sıcaklık ile mutlak sıcaklık arasındaki ayrımın yapılmasını içerir. Daha ziyade, mutlak termodinamik sıcaklığın tanımı, ikinci yasa kavramsal bir temel olarak mevcut olana kadar en iyisidir.[19]
On sekizinci yüzyılda, enerjinin korunumu yasası henüz tam olarak formüle edilmemiş veya tesis edilmemiş ve ısının doğası tartışılmıştır. Bu problemlere bir yaklaşım, kalorimetre ile ölçülen ısıyı, miktar olarak korunan birincil madde olarak kabul etmekti. On dokuzuncu yüzyılın ortalarında, bir enerji biçimi olarak kabul edildi ve böylece enerjinin korunumu yasası da kabul edildi. Sonunda kendini kanıtlayan ve şu anda haklı olarak kabul edilen görüş, enerjinin korunumu yasasının birincil bir aksiyom olduğu ve ısının sonuç olarak analiz edileceğidir. Bu ışıkta ısı, tek bir cismin toplam enerjisinin bir bileşeni olamaz çünkü bir durum değişkeni daha ziyade, iki gövde arasındaki transferi tanımlayan bir değişkendir. Adyabatik süreç önemlidir çünkü bu mevcut görüşün mantıksal bir bileşenidir.[19]
Kelimenin farklı kullanımları adyabatik
Bu makale, makroskobik termodinamik açısından yazılmıştır ve adyabatik Bu makalede, Rankine tarafından sunulan geleneksel termodinamik yönteminde kullanılmaktadır. Bu makalede, örneğin, bir gazın sıkıştırılması hızlı ise, gaz belirli bir duvar tarafından adyabatik olarak izole edilmemiş olsa bile, ısı transferinin gerçekleşmesi için çok az zaman olduğu belirtilmektedir. Bu anlamda, bir gazın hızlı bir şekilde sıkıştırılmasının bazen yaklaşık veya gevşek bir şekilde olduğu söylenir. adyabatik, ancak gaz belirli bir duvar tarafından adyabatik olarak izole edilmediğinde bile, genellikle izantropikten uzak olsa da.
Kuantum mekaniği ve kuantum istatistiksel mekanik ancak şu kelimeyi kullanın adyabatik çok farklı bir anlamda, zaman zaman klasik termodinamik anlamda neredeyse zıt görünebilen biri. Kuantum teorisinde kelime adyabatik belki izantropik ya da yarı statik bir anlama gelebilir, ancak kelimenin kullanımı iki disiplin arasında çok farklıdır.
Bir yandan, kuantum teorisinde, sıkıştırıcı işin tedirgin edici bir unsuru neredeyse sonsuz derecede yavaş (yani yarı statik olarak) yapılırsa, bunun yapıldığı söylenir. adyabatik olarak. Buradaki fikir, özfonksiyonların şekillerinin yavaş ve sürekli değiştiği, böylece hiçbir kuantum sıçramasının tetiklenmemesi ve değişimin neredeyse tersine çevrilebilir olmasıdır. Meslek sayıları değişmezken, yine de sıkıştırma öncesi ve sonrası öz durumlara karşılık gelen bire bir enerji seviyelerinde değişiklik vardır. Böylelikle, ısı transferi olmadan ve sistem içinde rastgele bir değişiklik olmadan, tedirgin edici bir iş elemanı yapılmıştır. Örneğin, Max Doğum "Aslında, bizim yapmamız gereken genellikle 'adyabatik' durumdur: yani, dış kuvvetin (veya sistemin parçalarının birbiri üzerindeki tepkisinin) çok yavaş hareket ettiği sınırlayıcı durum. Bu durumda, çok yüksek bir yaklaşım
yani, bir geçiş olasılığı yoktur ve sistem, tedirginliğin durmasından sonra başlangıç durumundadır. Böylesine yavaş bir tedirginlik, klasik olarak olduğu gibi, bu nedenle tersine çevrilebilir. "[20]
Öte yandan, kuantum teorisinde, sıkıştırıcı işin tedirgin edici bir unsuru hızlı bir şekilde yapılırsa, özdurumların işgal sayılarını ve şekillerini de rastgele değiştirir. Bu teoride, bu kadar hızlı bir değişimin adyabatikve tam tersi kelime diyabatik ona uygulanır. Belki de Clausius, bununla karşı karşıya kalsaydı, kendi zamanında kullandığı artık kullanılmayan dilde, "iç işin" yapıldığını ve "ısı aktarılmasa da üretildiğini" söylerdi.[kaynak belirtilmeli ]
Dahası, atmosferik termodinamikte diyabatik süreç, ısının değiş tokuş edildiği süreçtir.[21]
Klasik termodinamikte, böylesine hızlı bir değişime yine adyabatik denir çünkü sistem adyabatik olarak izole edilmiştir ve ısı olarak enerji transferi yoktur. Viskozite veya diğer entropi üretimine bağlı olarak değişimin güçlü geri çevrilemezliği, bu klasik kullanıma etki etmez.
Bu nedenle, makroskopik termodinamikte bir gaz kütlesi için kelimeler o kadar kullanılır ki, sistem adyabatik olarak izole edilmemiş olsa bile, ısı transferini engelleyecek kadar hızlıysa, bir sıkıştırmanın bazen gevşek veya yaklaşık olarak adyabatik olduğu söylenir. Ancak kuantum istatistik teorisinde, sistem terimin klasik termodinamik anlamında adyabatik olarak izole edilmiş olsa bile, hızlı ise sıkıştırmaya adyabatik denmez. Yukarıda belirtildiği gibi, kelimeler iki disiplinde farklı şekilde kullanılmaktadır.
Ayrıca bakınız
- İlgili fizik konuları
- Termodinamiğin birinci yasası
- Entropi (klasik termodinamik)
- Adyabatik iletkenlik
- Adyabatik atlanma oranı
- Toplam hava sıcaklığı
- Manyetik soğutma
- İlgili termodinamik süreçler
- Döngüsel süreç
- İzobarik süreç
- İzentalpik süreç
- İzantropik süreç
- İzokorik süreç
- İzotermal süreç
- Politropik süreç
- Kuasistatik süreç
Referanslar
- ^ a b Carathéodory, C. (1909). "Untersuchungen über die Grundlagen der Thermodynamik". Mathematische Annalen. 67 (3): 355–386. doi:10.1007 / BF01450409.. Bir çeviri bulunabilir İşte Arşivlendi 2019-10-12'de Wayback Makinesi. Ayrıca çoğunlukla güvenilir çeviri bulunacak içinde Kestin, J. (1976). Termodinamiğin İkinci Yasası. Stroudsburg, PA: Dowden, Hutchinson & Ross.
- ^ Bailyn, M. (1994). Termodinamik Üzerine Bir İnceleme. New York, NY: American Institute of Physics Press. s. 21. ISBN 0-88318-797-3.
- ^ a b c d Bailyn, M. (1994), s. 52–53.
- ^ "sözde diyabatik süreç". Amerikan Meteoroloji Derneği. Alındı 3 Kasım 2018.
- ^ Tisza, L. (1966). Genelleştirilmiş Termodinamik. Cambridge, MA: MIT Press. s. 48.
(adyabatik bölmeler ısı ve kütle transferini engeller)
- ^ Münster, A. (1970), s. 48: "Kütle, adyabatik olarak engellenen bir değişkendir."
- ^ Münster, A. (1970). Klasik Termodinamik. Halberstadt, E. S. London: Wiley – Interscience tarafından çevrilmiştir. s. 45. ISBN 0-471-62430-6.
- ^ Kavanagh, J. L .; Sparks, R. S. J. (2009). "Yükselen kimberlit magmalarındaki sıcaklık değişiklikleri". Dünya ve Gezegen Bilimi Mektupları. Elsevier. 286 (3–4): 404–413. Bibcode:2009E ve PSL.286..404K. doi:10.1016 / j.epsl.2009.07.011. Alındı 18 Şubat 2012.
- ^ Turcotte ve Schubert (2002). Jeodinamik. Cambridge: Cambridge University Press. pp.185. ISBN 0-521-66624-4.
- ^ Adyabatik Süreçler.
- ^ a b Rankine, W.J.McQ. (1866). Patlayıcı gaz motorları teorisi üzerine, Mühendis27 Temmuz 1866; yeniden basımın 467. sayfasında Çeşitli Bilimsel Makaleler W.J. Millar, 1881, Charles Griffin, Londra tarafından düzenlenmiştir.
- ^ Partington, J.R. (1949), Fiziksel Kimya Üzerine İleri Bir İnceleme., 1, Temel prensipler. Gazların Özellikleri, Londra: Longmans, Green and Co., s. 122
- ^ Maxwell, J. C. (1871), Isı Teorisi (ilk baskı), Londra: Longmans, Green and Co., s. 129
- ^ Liddell, H.G., Scott, R. (1940). Yunanca-İngilizce Sözlük, Clarendon Press, Oxford UK.
- ^ Rankine, W.J.McQ. (1854). "Isının genişleyen etkisinin geometrik temsili ve termodinamik motorlar teorisi üzerine". Proc. Roy. Soc. 144: 115–175. Çeşitli Bilimsel Makaleler s. 339
- ^ Rankine, W.J.McQ. (1854). "Isının genişleyen etkisinin geometrik temsili ve termodinamik motorlar teorisi üzerine". Proc. Roy. Soc. 144: 115–175. Çeşitli Bilimsel Makaleler s. 341.
- ^ Bryan, G.H. (1907). Termodinamik. Esas olarak İlk İlkeleri ve bunların Doğrudan Uygulamalarını ele alan bir Giriş İncelemesi. Leipzig: B. G. Teubner.
- ^ Doğum, M. (1949). "Sebep ve Şansın Doğal Felsefesi". Londra: Oxford University Press. Alıntı dergisi gerektirir
| günlük =(Yardım) - ^ a b Bailyn, M. (1994). "Bölüm 3". Termodinamik Üzerine Bir İnceleme. New York, NY: Amerikan Fizik Enstitüsü. ISBN 0-88318-797-3.
- ^ M. (1927) doğdu. "Kuantum mekaniğinin fiziksel yönleri". Doğa. 119 (2992): 354–357. Bibcode:1927Natur.119..354B. doi:10.1038 / 119354a0. (Robert Oppenheimer çevirisi.)
- ^ "diyabatik süreç". Amerikan Meteoroloji Derneği. Alındı 24 Kasım 2020.
- Genel
- Silbey, Robert J .; et al. (2004). Fiziksel kimya. Hoboken: Wiley. s. 55. ISBN 978-0-471-21504-2.
- Broholm, Collin. "Adyabatik serbest genişleme". Fizik ve Astronomi @ Johns Hopkins Üniversitesi. N.p., 26 Kasım 1997. Web. 14 Nisan.
- Nave, Carl Rod. "Adyabatik Süreçler". HiperFizik. N.p., tarih yok. Ağ. 14 Nisan 2011. [1].
- Thorngren, Dr. Jane R. "Adyabatik Süreçler". Daphne - Bir Palomar College Web Sunucusu. N.p., 21 Temmuz 1995. Web. 14 Nisan 2011. [2].
Dış bağlantılar
![]() İle ilgili medya Adyabatik süreçler Wikimedia Commons'ta
İle ilgili medya Adyabatik süreçler Wikimedia Commons'ta


























































