Asimetrik hidrojenasyon - Asymmetric hydrogenation
Asimetrik hidrojenasyon bir Kimyasal reaksiyon iki atom ekleyen hidrojen tercihen iki yüzünden birine doymamış bir alken veya keton gibi substrat molekülü. Seçicilik, substratın şirale bağlanma şeklinden kaynaklanır. katalizörler. Jargonda, bu bağlama mekansal bilgiyi iletir (kimyagerlerin kiralite ) katalizörden hedefe, ürünü tek bir enantiyomer. Bu "enzim benzeri seçicilik "bazı ticari reklamların sentezine uygulanır.farmasötik ajanlar ve zirai kimyasallar.

Tarih
1956'da heterojen yapılmış katalizör paladyum ipek üzerine çökeltinin asimetrik hidrojenasyonu etkilediği gösterilmiştir.[1] Daha sonra, 1968'de, William Knowles ve Leopold Horner bağımsız olarak asimetrik hidrojenasyon örneklerini bir homojen katalizörler. Sadece mütevazı sergilerken enantiyomerik aşırılıklar, bu erken tepkiler fizibilite gösterdi. 1972'ye gelindiğinde,% 90 enantiyomerik fazlalık elde edildi ve ilk endüstriyel sentez Parkinson uyuşturucu madde L-DOPA bu teknolojiyi kullanmaya başladı.[2][3]

Asimetrik hidrojenasyon alanı, bir dizi dikkate değer ilerleme yaşamaya devam etti. Henri Kagan gelişmiş DIOP, kolayca hazırlanan bir C2Bazı reaksiyonlarda yüksek ee veren simetrik difosfin. Ryōji Noyori tanıttı rutenyum ketonlar ve aldehitler gibi asimetrik hidrojene polar substratlar için bazlı katalizörler. Tanımı P, N ligandları daha sonra C'nin kapsamını daha da genişletti2- simetrik ligandlar, temelde eksik olan kiral ligandlardan üstün olmasalar da dönme simetrisi.[4] Günümüzde asimetrik hidrojenasyon, laboratuvar ve endüstriyel ölçekli organik kimyada rutin bir metodolojidir.
Asimetrik hidrojenasyonun önemi 2001 yılında kabul edildi. Nobel Kimya Ödülü Ödüllendirildi William Standish Knowles ve Ryōji Noyori.
Mekanizma
İç küre mekanizmaları
İki büyük mekanizmalar ile katalitik hidrojenasyon için önerilmiştir rodyum kompleksler: doymamış mekanizma ve dihidrit mekanizması. İki mekanizma arasında ayrım yapmak zor olsa da, asimetrik hidrojenasyon için ikisi arasındaki fark nispeten önemsizdir, çünkü her ikisi de herhangi bir stereokimyasal bilgi ürün molekülüne aktarılmadan önce ortak bir ara maddeye yakınsar.[5]
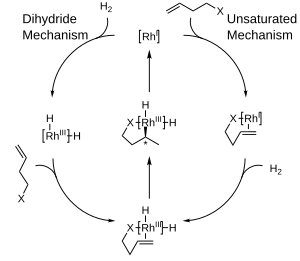
Bu reaksiyonlarda bir enantiyomerin yerine diğerinin üretilmesi tercihi genellikle şu terimlerle açıklanır: sterik arasındaki etkileşimler ligand ve prokiral substrat. Bu etkileşimlerin dikkate alınması, "bloke edilmiş" alanların gölgeli bir kutuyla gösterildiği ve "açık" alanların doldurulmadan bırakıldığı çeyrek diyagramların geliştirilmesine yol açmıştır. Modellenmiş reaksiyonda, gelen bir büyük gruplar olefin Diyagramın açık alanlarını doldurmak için yönlendirme eğilimi gösterirken, daha küçük gruplar bloke edilmiş alanlara yönlendirilecek ve daha sonra olefinin arka yüzüne hidrojen dağıtımı gerçekleşecek ve stereokimya. Açıklık amacıyla kiral fosfin ligandının sadece bir kısmının gösterildiğine dikkat edin.

Metaller
Platin grubu metaller
Rodyum homojen bir asimetrik hidrojenasyonda kullanılacak ilk metal,[6] yaygın olarak kullanılmaya devam ediyor. Rodyum ile asimetrik hidrojenasyon için hedefler genellikle yakın bir koordinasyon grubu gerektirir. olefin.[5] Bu gereklilik bir sınırlama olmakla birlikte, birçok substrat sınıfı bu tür bir işlevselleştirmeye sahiptir, örn. doymamış amidler.[7]
Noyori asimetrik hidrojenasyon dayanır rutenyum.[8][9] Daha sonraki çalışmalar, Noyori'nin orijinal katalizör şablonu üzerine genişledi ve geleneksel olarak zor substratların dahil edilmesine yol açtı. t-butil ketonlar[10] ve 1-tetralonlar[11] rutenyum katalizörleri ile hidrojenasyon için uygun substratlar olarak. Ru ve Ts'ye dayalı transfer hidrojenasyonuDPEN ticari başarı da elde etti.[12]
İridyum katalizörler, Ru ve Rh ile iyi katalizörlerin bulunmadığı bir dizi "geleneksel olmayan" substrat için kullanışlıdır.[13] İşlevsiz olefinler[14] arketipsel durumdur, ancak ketonlar dahil diğer örnekler[15][16] var olmak. İridyum bazlı katalizörle ilgili yaygın bir zorluk, trimerize etmek çözümde.[16] Kullanımı koordine edici olmayan anyon BarF
4− toplama problemine en yaygın olarak uygulanabilir çözüm olduğunu kanıtlamıştır.[16][17] Katalizör stabilitesini artırmak için diğer stratejiler, kiral liganda ek bir koordinasyon kolunun eklenmesini içerir,[15] ligandın sterik kütlesini arttırmak,[18] kullanarak dendrimerik ligand[19] ligandın sertliğini arttırmak,[20] ligandı hareketsiz hale getirmek,[21] ve heterobimetalik sistemler kullanmak (metallerden biri iridyum ile).[21]
Adi metaller
Demir büyük ölçüde düşük maliyeti ve diğer geçiş metallerine göre düşük toksisitesi nedeniyle birçok katalitik süreç için popüler bir araştırma hedefidir.[22] Demir kullanan asimetrik hidrojenasyon yöntemleri gerçekleştirilmiştir, ancak oranlar ve seçicilik açısından değerli metallere dayalı katalizörlerden daha düşüktürler.[23] Bazı durumlarda yapısal olarak kötü tanımlanmış nanopartiküller aktif türler olduğunu kanıtladılar yerinde ve gözlemlenen mütevazı seçicilik, kontrolsüz geometrilerinden kaynaklanabilir.[24]
Ligand sınıfları
Fosfin ligandları
Kiral fosfin ligandlar, özellikle C2- simetrik ligandlar asimetrik hidrojenasyon katalizörlerinin çoğunda kiralite kaynağıdır. Bunlardan BINAP ligand, Nobel ödüllü uygulamasının bir sonucu olarak iyi bilinir. Noyori asimetrik hidrojenasyon.[2]
Kiral fosfin ligandları genel olarak şu şekilde sınıflandırılabilir: tek veya iki dişli. Ayrıca stereojenik merkezin konumuna göre - fosfor - organik ikame ediciler - göre sınıflandırılabilirler. C ile ligandlar2 Simetri elemanı özellikle popüler olmuştur, çünkü kısmen böyle bir elemanın mevcudiyeti, bir alt tabakanın bir metal-ligand kompleksine olası bağlanma biçimlerini önemli ölçüde azaltır (genellikle istisnai enantioselektiflik ile sonuçlanır).[25]
Monodentat fosfinler
Monofosfin tipi ligandlar, asimetrik hidrojenasyonda ilk ortaya çıkan ligandlar, örneğin, CAMP ligandıydı.[26] Bu tür ligandlarla ilgili devam eden araştırmalar, her ikisini de araştırmıştır. P-alkil ve P-heteroatom bağlı ligandlar, P-fosfitler gibi heteroatom ligandları ve fosforamiditler genellikle daha etkileyici sonuçlar elde etmek.[27] Başarılı olan yapısal ligand sınıfları, MonoPHOS'un binapil yapısına dayalı olanları içerir. [28] veya SiPHOS'un spiro halka sistemi.[29] Özellikle, bu tek dişli ligandlar, enantioseçicilikte sinerjistik bir gelişme elde etmek için birbirleriyle kombinasyon halinde kullanılabilir;[30] ile mümkün olmayan bir şey difosfin ligandları.[27]
Kiral difosfin ligandları
Difosfin ligandları, monofosfinlerden önemli ölçüde daha fazla ilgi görmüştür ve belki de sonuç olarak çok daha uzun bir başarı listesine sahiptir. Bu sınıf, yüksek seçicilik elde etmek için ilk ligandı içerir (DIOP ), endüstriyel asimetrik sentezde kullanılacak ilk ligand (DIPAMP[31][32][3]) ve muhtemelen en iyi bilinen kiral ligand (BINAP) nedir.[2] Kiral difosfin ligandları artık asimetrik hidrojenasyonda her yerde bulunur.

P, N ve P, O ligandları


Asimetrik hidrojenasyonda P, N ligandlarının kullanımı C'ye kadar izlenebilir.2 simetrik bisoksazolin ligandı.[33] Bununla birlikte, bu simetrik ligandların yerini kısa süre sonra monooksazolin C eksikliği olan ligandlar2 simetri hiçbir şekilde asimetrik katalizdeki etkinliğini sınırlamaz.[34] Bu tür ligandlar genellikle, hem heterosiklin tam doğası hem de kimyasal ortam fosfor merkezi büyük ölçüde değişmesine rağmen, asılı bir fosfor içeren kol ile işlevselleştirilmiş aşiral nitrojen içeren bir heterosiklden oluşur. Kesin olmasına rağmen, geniş bir substrat yelpazesiyle tutarlı bir şekilde etkili tek bir yapı ortaya çıkmamıştır. ayrıcalıklı yapılar (fosfin-oksazolin gibi veya PHOX mimari) kurulmuştur.[14][34][35] Dahası, dar tanımlanmış bir substrat sınıfı içinde, metalik komplekslerin kiral P, N ligandları ile performansı, aksi takdirde hedeflenmesi çok zor olan sistemlerde mükemmel dönüşüme ve seçiciliğe yakından yaklaşabilir.[36] P-O ligandlarının şelatlanmasından türetilen belirli kompleksler, a, P-doymamış ketonlar ve esterlerin hidrojenasyonunda ümit verici sonuçlar göstermiştir.[37]
NHC ligandları
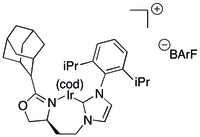
Basit N-heterosiklik karben (NHC) esaslı ligandların asimetrik hidrojenasyon için pratik olmadığı kanıtlanmıştır.
Bazı C, N ligandları bir şelatlama ligandını vermek için bir NHC'yi bir kiral oksazolin ile birleştirir.[38][39] Birinci tipteki NHC bazlı ligandlar, tek tek NHC'lerin ve oksazolinlerin daha küçük kütüphanelerinin reaksiyonundan büyük kütüphaneler olarak oluşturulmuştur.[38][39] İridyum üzerinde hacimli yedi üyeli bir metalosikl içeren NHC bazlı katalizörler, işlevsiz olefinlerin katalitik hidrojenasyonuna uygulanmıştır.[38] ve vinil 80'li veya 90'lı yıllarda dönüşümlü ve ee'li eter alkolleri.[40] Aynı sistem birkaç aldol sentezinde de uygulanmıştır,[41] visinal dimetil[42] ve deoksipoliketid[43] motifler ve deoksipoliketidlerin kendilerine.[44]
C2- simetrik NHC'ler, asimetrik hidrojenasyon için oldukça yararlı ligandlar olduklarını göstermişlerdir.[45]
Asiklik substratlar
Asiklik doymamış substratlar (olefinler, ketonlar, Emaminler iminler ) en yaygın prokiral substratları temsil eder. Asimetrik hidrojenasyona özellikle yatkın olan substratlar genellikle hidrojene edilecek alana bitişik bir polar fonksiyonel gruba sahiptir. Bu fonksiyonel grubun yokluğunda, kataliz genellikle düşük ee ile sonuçlanır. İşlevsiz olefinler için, iridyum ile P,N-based ligandlar) kanıtlanmış başarılı katalizörlere sahiptir. Bu kategorideki katalizör yardımcı programı alışılmadık derecede dardır; sonuç olarak, birçok farklı çözülmüş ve çözülmemiş katalitik problem kategorisi gelişmiştir. 1,1-disübstitüe, 1,2-diaril trisübstitüe, 1,1,2-trialkil ve tetrasübstitüe olefinler, ayrı ayrı incelenen sınıfları temsil eder,[46][47] ve hatta bu sınıflar içinde farklı çözümleri en uygun hale getiren varyasyonlar olabilir.[48]


Olefin durumunun tersine, enaminlerin asimetrik hidrojenasyonu difosfin tipi ligandları tercih etti; Hem iridyum hem de rodyum bazlı sistemlerle mükemmel sonuçlar elde edilmiştir. Bununla birlikte, en iyi sistemler bile genellikle düşük ee'den ve genellik eksikliğinden muzdariptir. Belirli pirolidin aromatik ketonların türetilmiş enaminleri, katyonik rodyum (I) fosfonit sistemleri ile asimetrik olarak hidrojenasyona yatkındır ve I2 ve ee değerleri genellikle% 90'ın üzerinde ve potansiyel olarak% 99.9 kadar yüksek asetik asit sistemi.[49] İridyum (I) kullanan benzer bir sistem ve çok yakından ilişkili fosforamidit ligand, çift bağın halka içinde olduğu pirolidin tipi enaminlerin, yani dihidropirollerin asimetrik hidrojenasyonu için etkilidir.[50] Her iki durumda da, halka boyutu beşten altıya çıkarıldığında enantioselektiflik önemli ölçüde düştü.
İminler ve ketonlar

Ketonlar ve iminler ilişkili fonksiyonel gruplardır ve her birinin asimetrik hidrojenasyonu için etkili teknolojiler de yakından ilişkilidir. Bunlardan Noyori'nin rutenyum-kiral difosfin-diamin sistemi belki de en iyi bilinenlerden biridir.[51] Çok çeşitli fosfinler ve aminler (aminin kiral olabileceği, ancak gerekli olmadığı durumlarda) ile birlikte kullanılabilir ve hedef substrat ile optimum eşleşme için kolayca ayarlanabilir, genel olarak enantiyomerik aşırılıklar (ee)% 90'ın üzerinde.[52][53]
Karbonil ve imin substratlar için, uçtan uca, η1 koordinasyon η ile rekabet edebilir2 modu. Η için1bağlı substratlar, hidrojen kabul eden karbon katalizörden çıkarılır ve hidrojenasyona direnir.[54]
İridyum / P, N ligand bazlı sistemler ayrıca ketonların ve iminlerin asimetrik hidrojenasyonu için yaygın olarak kullanılır. Örneğin, benzilik aril iminler için tutarlı bir sistem, ee>% 90 ile asimetrik hidrojenasyon elde etmek için katyonik bir komplekste iridyum (I) ile birlikte P, N ligandı SIPHOX kullanır.[20] Ketonların asimetrik hidrojenasyonu için şimdiye kadar geliştirilmiş en verimli ve etkili katalizörlerden biri, ciro numarası 4.550.000'e kadar (TON) ve% 99.9'a kadar ee, yakından ilişkili başka bir iridyum (I) sistemi kullanır. üç dişli ligand.[15]

Benzerliklerine rağmen, iki işlevsel grup aynı değildir; önemli ölçüde farklılaştıkları birçok alan var. Bunlardan biri asimetrik hidrojenasyondur. N- birincil aminler vermek için işlevsiz iminler. Bu tür türlerin seçici olarak indirgenmesi zor olabilir çünkü bunlar karmaşık imin ve enamin dengelerinde bulunma eğilimindedirler. tautomerler, Hem de (E) ve (Z) izomerler.[55] Bu soruna bir yaklaşım, ketiminler hidroklorür tuzu olarak ve bitişik alkilin sterik özelliklerine güvenir veya aril katalizörün ikisi arasında ayrım yapmasına izin veren gruplar enantiyotopik ketimin yüzleri.[56][57]
Aromatik substratlar
Asimetrik hidrojenasyonu aromatik (özellikle heteroaromatik ), substratlar, devam eden araştırma için çok aktif bir alandır. Bu alandaki katalizörler, oldukça kararlı aromatik bileşiklerin hidrojenasyona direnme eğilimi, hem substratın hem de ürünün potansiyel koordinasyon (ve dolayısıyla katalizör zehirleme) yetenekleri ve ikame modellerinde büyük çeşitlilik dahil olmak üzere bir dizi karmaşık faktörle mücadele etmelidir. herhangi bir aromatik halka üzerinde mevcut olabilir.[58] Bu substratlar arasında en tutarlı başarı nitrojen içeren heterosikllerde görülmüştür, burada aromatik halka genellikle ya protonasyonla ya da nitrojenin daha fazla işlevselleştirilmesiyle (genellikle bir elektron çeken koruma grubu ile) etkinleştirilir. Bu tür stratejiler, hem daha az bazik hem de daha az nükleofilik oldukları için oksijen ve kükürt içeren heterosikllere daha az uygulanabilir; bu ek zorluk, asimetrik hidrojenasyonu için neden birkaç etkili yöntemin var olduğunu açıklamaya yardımcı olabilir.
Kinolinler, izokinolinler ve kinoksalinler
2-ikameli asimetrik hidrojenasyon için iki sistem mevcuttur. kinolinler izole edilmiş verimler genellikle% 80'den büyük ve ee değerleri genellikle% 90'dan büyüktür. İlki bir iridyum (I) / kiral fosfin / I'dir2 sistem, ilk olarak Zhou tarafından bildirildi ve diğerleri.[59] Bu sistemde kullanılan ilk kiral fosfin MeOBiPhep iken, yeni iterasyonlar bu ligandın performansını iyileştirmeye odaklanmıştır. Bu amaçla, sistemler gelişmiş hava stabilitesine sahip fosfinler (veya ilgili ligandlar) kullanır,[60] geri dönüştürülebilirlik,[60] hazırlık kolaylığı,[61] daha düşük katalizör yükü[19][62] ve aşiral fosfin katkı maddelerinin potansiyel rolü.[63] Ekim 2012 itibariyle herhangi bir mekanizma önerilmemiş gibi görünmektedir, ancak her ikisi de I2 veya bir halojen vekili ve heteroaromatik N'nin reaktiviteye yardımcı olma olası rolü belgelenmiştir.[58]
İkincisi, bir organokatalitik transfer hidrojenasyonu sisteme dayalı Hantzsch esterleri ve bir kiral Brønsted asidi. Bu durumda yazarlar, izokinolinin dönüşümlü olarak bir aktive edici adımda protonlandığı ve daha sonra Hantzsch esterinden konjugat hidrit ilavesiyle indirgendiği bir mekanizma tasarlarlar.[64]

Kinoksalinlerin asimetrik hidrojenasyon kimyasının çoğu, yapısal olarak benzer olanla yakından ilgilidir. kinolinler. Ir (I) / phophinite / I ile etkili (ve verimli) sonuçlar elde edilebilir2 sistemi[65] ve bir Hantzsh ester bazlı organokatalitik sistem,[66] her ikisi de daha önce tartışılan sistemlere benzer kinolinler.
Piridinler
Piridinler asimetrik indirgeme için oldukça değişken substratlardır (diğer heteroaromatiklerle karşılaştırıldığında bile), çünkü ilk halkada farklı ikame için beş karbon merkezi mevcuttur. Ekim 2012 itibariyle, en az bir makul ölçüde genel yöntem mevcut olmasına rağmen, beşini de kontrol edebilecek hiçbir yöntem mevcut görünmemektedir.
Asimetrik piridin hidrojenasyonunun en genel yöntemi aslında, piridinin C2 konumuna bağlı bir kiral oksazolidinondan asimetrinin üretildiği heterojen bir yöntemdir. Bu tür işlevselleştirilmiş piridinlerin bir dizi farklı heterojen metal katalizör üzerinde hidrojene edilmesi, karşılık gelen piperidini, ikame edicilerle birlikte C3, C4 ve C5 pozisyonlarındacis geometri, yüksek verim ve mükemmel enantioseçicilik. Oksazolidinon yardımcı maddesi de hidrojenasyon koşulları altında uygun bir şekilde bölünür.[67]

2-ikame edilmiş piridin hidrojenasyonu için özel olarak tasarlanmış yöntemler, 2-ikame edilmiş kinolinler ve kinoksalinler gibi ilgili substratlar için geliştirilmiş asimetrik sistemleri içerebilir. Örneğin, bir iridyum (I) kiral fosfin2 sistemi, aktifleştirilmiş (alkillenmiş) 2-piridinyumların asimetrik hidrojenasyonunda etkilidir.[68] veya belirli sikloheksanon ile kaynaşmış piridinler.[69] Benzer şekilde, kiral Brønsted asidi bir hidrit kaynağı olarak bir Hantzsh ester ile kataliz, ilave aktive edici ikame ile bazı 2-alkil piridinler için etkilidir.[70]
Indoles
Asimetrik hidrojenasyonu Indoles başlangıçta odaklandı N- korumalı indoller, burada koruma grubu hem heterosikliyi hidrojenasyona aktive etmeye hem de metal için ikincil bir koordinasyon sahası olarak hizmet edebilir. Daha sonraki çalışma, korumasız indollerin, indolün Brønsted asit aktivasyonu yoluyla hedeflenmesine izin verdi.
Asimetrik indol hidrojenasyonu ile ilgili ilk raporda, N-asetil 2-ikameli indoller, yüksek verim ve% 87-95 ee ile korunabilir. 3-ikameli indoller, koruyucu grubun hidrolizi, indolün hidrojenasyonunu geride bırakarak daha az başarılıydı.[71] Bir N-tosil koruma grubu, hidroliz reaksiyonunu inhibe etti ve hem 2- hem de 3-ikame edilmiş indollerin, yüksek verim ve ee ile hidrojene olmasına izin verdi.[72][73] Ancak her iki yöntemle ilgili sorun şudur: N-asetil ve N-tosil grupları, karmaşık substratlar ile uyumsuz olabilen sert bölünme koşulları gerektirir. Kolayca bölünmüş bir N-Boc grubu bu problemi hafifletecek ve bu tür indollerin asimetrik hidrojenasyonu için oldukça etkili yöntemler (hem 2- hem de 3-ikame edilmiş) yakında geliştirildi.[74][75]

Korunan indollerin asimetrik hidrojenasyonundaki bu ilerlemelere rağmen, koruyucu grubun tamamen çıkarılmasıyla önemli operasyonel basitlik kazanılabilir. Bu, indolü etkinleştirmek için Brønsted asitleri kullanan katalitik sistemlerle başarılmıştır. İlk sistem bir Pd (TFA) kullandı2/ Enantioselektif için H8-BINAP sistemi cis- yüksek verim ve mükemmel ee ile 2,3- ve 2-ikameli indollerin hidrojenasyonu. Sıralı olduğu benzer bir süreç Friedel-Crafts alkilasyonu ve asimetrik hidrojenasyon bir kapta meydana gelir, asimetrik 2,3-ikameli indolinlerin benzer şekilde yüksek verimlerde ve ee'de 2-ikameli indollerden seçici olarak hazırlanmasına izin verir.[76][77]

Umut verici organokatalitik Bir kiral Lewis bazı kullanan 2,3-ikameli indollerin asimetrik hidrojenasyonu için yöntem de mevcuttur, ancak gözlemlenen ee'ler metal esaslı hidrojenasyonlarınkilere tam olarak eşdeğer değildir.[76]
Piroller
Tam dönüşüme ulaşmak piroller -e pirrolidinler asimetrik hidrojenasyon ile şimdiye kadar zor olduğu kanıtlanmıştır, kısmi hidrojenasyon ürünleri sıklıkla gözlemlenmiştir.[78][79] Sonuç hem başlangıç substratına hem de yönteme bağlı olarak tam enantiyoselektif azalma mümkündür.
2,3,5-sübstitüe edilmiş pirrollerin asimetrik hidrojenasyonu, bu tür sübstratların 2-sübstitüe indollerle aynı sübstitüsyon modelini taşıdığının ve bu sübstratlardan biri için etkili bir asimetrik hidrojenasyon sisteminin her ikisi için de etkili olabileceğinin anlaşılmasıyla elde edildi. Böyle bir analiz, 2,3,5-ikameli için bir rutenyum (I) / fosfin / amin baz sisteminin geliştirilmesine yol açtı. N-Pirol ikame edicilerinin doğasına bağlı olarak dihidro veya tetrahidropiroller (pirolidinler) verebilen Boc piroller. Tüm fenil ikame modeli, çok yüksek verimde (>% 96) ve esasen mükemmel enantioselektiflikte dihidropirollere yol açar. Tamamen hidrojene edilmiş, hepsi ...cis dihidropirrol daha sonra diastereoselektif heterojen hidrojenasyon yoluyla erişilebilir olabilir. Alkil ikamesi, dihidro veya tetrahidropirole yol açabilir, ancak verimler (>% 70) ve enantioseçicilikler (genellikle>% 90) genellikle yüksek kalır. bölge seçiciliği her iki durumda da, daha az ikame edilmiş çift tercihli olarak hidrojene edilmiş olmak üzere, sterikler tarafından yönetiliyor gibi görünmektedir.[78]

Korumasız 2,5-pirroller ayrıca bir Brønsted asit / Pd (II) / kiral fosfin katalizli yöntemle asimetrik olarak hidrojene edilebilir ve karşılık gelen 2,5-ikameli 1-pirolinler kabaca% 70-80 verim ve% 80-90 ee.[79]
Oksijen içeren heterosikller
Asimetrik hidrojenasyonu furanlar ve Benzofuranlar şimdiye kadar zorlu olduğunu kanıtladı.[80] Bazı Ru-NHC kompleksi, asimetrik hidrojenasyonlarını katalize eder. Benzofuranlar[81] ve furanlar.[82] yüksek düzeyde enantioindüksiyon ile.
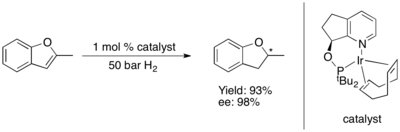
Sülfür içeren heterosikller
Oksijen içeren heterosikllerde olduğu gibi, sülfürün başlangıçtaki doymamışlığın bir parçası olduğu bileşiklerin asimetrik hidrojenasyonu pi-bonding sistem şu ana kadar sınırlı görünüyor tiyofenler ve benzotiyofenler. Bu heterosikllerin asimetrik hidrojenasyonuna temel yaklaşım, bir rutenyum (II) katalizörü ve şiral, C2 simetrik N-heterosiklik karben (NHC). Bu sistem, mükemmel seçiciliğe (ee>% 90) ve mükemmel diastereo seçiciliğe (tümü cis) eğer substrat kaynaşmış (veya doğrudan bağlı) bir fenil halkasına sahipse, ancak sadece rasemik diğer tüm test edilen durumlarda ürün.[83]

Heterojen kataliz
Asimetrik hidrojenasyon için hiçbir heterojen katalizör ticarileştirilmemiştir.
İlk asimetrik hidrojenasyon, ipek bir destek üzerinde biriken paladyuma odaklandı. Kınakına alkaloidler enantioselektiflik hidrojenasyonu için kiral değiştiriciler olarak kullanılmıştır.[84]

Aktif katalitik alanların yapısal ve elektronik özellikleri üzerinde daha fazla kontrole izin veren alternatif bir teknik, heterojen bir destek üzerinde homojen kataliz için geliştirilen katalizörlerin hareketsizleştirilmesidir. Katalizörün bir polimere veya başka bir katı desteğe kovalent bağlanması, belki de en yaygın olanıdır, ancak katalizörün hareketsizleştirilmesi, adsorpsiyon bir yüzeye iyon değişimi hatta fiziksel kapsülleme. Bu yaklaşımın bir dezavantajı, desteğin yakınlığının katalizörün davranışını değiştirerek reaksiyonun enantiyo seçiciliğini düşürme potansiyelidir. Bundan kaçınmak için, katalizör genellikle desteğe uzun bir bağlayıcıyla bağlanır, ancak desteğin yakınlığının katalizörün performansını gerçekten artırabildiği durumlar bilinmektedir.[84]
Son yaklaşım, potansiyel olarak kiral ve aşiral organik ligandlar, yapısal metal iyonları, katalitik olarak aktif metal iyonları ve / veya önceden birleştirilmiş katalitik olarak aktif organometalik çekirdekler dahil olmak üzere bir dizi farklı bileşenden kiral reaksiyon bölgelerini içeren MOF'lerin yapımını içerir.[85] Bunlardan biri dahil rutenyum bazlı katalizörler. Bu tür katalizörlerin% 0.005 mol kadar azı, aril ketonların asimetrik hidrojenasyonunu elde etmek için yeterli olduğunu kanıtladı, ancak olağan koşullar% 0.1 mol katalizör içeriyordu ve bir enantiyomerik fazlalık % 90.6-99.2 arasında.[86]

Endüstriyel uygulamalar

Knowles'ın asimetrik hidrojenasyon üzerine araştırması ve bunun L-Dopa'nın üretim ölçeğinde sentezine uygulanması[3] asimetrik hidrojenasyona endüstriyel dünyada güçlü bir başlangıç verdi. 2001 tarihli bir inceleme, asimetrik hidrojenasyonun, genel olarak asimetrik katalitik yöntemlerin henüz yaygın olarak kullanılmadığı uyarısıyla, endüstride üretim ölçeğinin% 50'sini, pilot ölçeğin% 90'ını ve tezgah ölçekli katalitik, enantiyoselektif işlemlerin% 74'ünü oluşturduğunu gösterdi.[87]
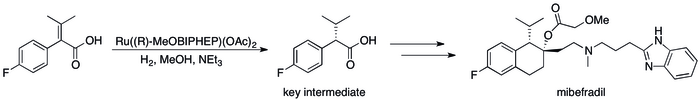
Endüstride asimetrik hidrojenasyonun başarısı[88] kinetik çözünürlüğe dayalı yöntemlerin değiştirilmesinin, işlemin verimliliğinde önemli iyileştirmelerle sonuçlandığı bir dizi özel durumda görülebilir. Örneğin, Roche'un Kataliz Grubu şu sentezini başardı:S,S) -Ro 67-8867,% 53 genel verimle, çözünürlük bazlı sentezde elde edilen% 3.5'in üzerinde çarpıcı bir artış.[89] Roche'un sentezi mibefradil aynı şekilde çözünürlüğü asimetrik hidrojenasyonla değiştirerek, adım sayısını üçe düşürerek ve bir anahtar ara ürünün verimini orijinal% 70'ten% 80'e çıkararak iyileştirildi.[90]
Referanslar
- ^ Akabori, S .; Sakurai, S .; Izumi, Y .; Fujii, Y. (1956). "Bir Asimetrik Katalizör". Doğa. 178 (4528): 323. Bibcode:1956Natur.178..323A. doi:10.1038 / 178323b0. PMID 13358737. S2CID 4221816.
- ^ a b c Noyori, R. (2003). "Asimetrik Kataliz: Bilim ve Fırsatlar (Nobel Lecture 2001)". Gelişmiş Sentez ve Kataliz. 345 (12): 15–41. doi:10.1002 / adsc.200390002.
- ^ a b c Knowles, W. S. (2002). "Asimetrik Hidrojenasyonlar (Nobel Dersi)". Angewandte Chemie Uluslararası Sürümü. 41 (12): 1998–2007. doi:10.1002 / 1521-3773 (20020617) 41:12 <1998 :: AID-ANIE1998> 3.0.CO; 2-8. PMID 19746594.
- ^ Pfaltz, A. (2004). "Asimetrik Kataliz Özel Özellik Bölüm II: Asimetrik kataliz için kiral ligandların tasarımı: C'den2-simetrik P,P- ve N,N-sterik ve elektronik olarak simetrik olmayan ligandlar P,Nligandlar ". Ulusal Bilimler Akademisi Bildiriler Kitabı. 101 (16): 5723–5726. Bibcode:2004PNAS..101.5723P. doi:10.1073 / pnas.0307152101. PMC 395974. PMID 15069193.
- ^ a b Gridnev, I. D .; Imamoto, T. (2004). "Rh-Katalize Asimetrik Hidrojenasyonda Stereoseleksiyon Mekanizması: Enantioselektiflik Duyusunu Öngörmek İçin Genel Bir Yaklaşım". Kimyasal Araştırma Hesapları. 37 (9): 633–644. doi:10.1021 / ar030156e. PMID 15379579.
- ^ Knowles, W. S .; Sabacky, M.J. (1968). "Çözünür, optik olarak aktif, rodyum kompleksi kullanan katalitik asimetrik hidrojenasyon". Kimyasal İletişim (Londra) (22): 1445. doi:10.1039 / C19680001445.
- ^ Pilkington, C .; Lennon, I. (2003). "Farmasötik Ara Maddelerin İmalatında Asimetrik Hidrojenasyon Uygulaması: Katalizör Çeşitliliği İhtiyacı". Sentez. 2003 (11): 1639. doi:10.1055 / s-2003-40871.
- ^ Miyashita, A .; Yasuda, A .; Takaya, H .; Toriumi, K .; Ito, T .; Souchi, T .; Noyori, R. (1980). "2,2'-bis (difenilfosfino) -1,1'-binaftil (BINAP) sentezi, bir atropizomerik kiral bis (triaril) fosfin ve rodyum (I) -katalize asimetrik α- (açilamino) hidrojenasyonunda kullanımı ) akrilik asitler ". Amerikan Kimya Derneği Dergisi. 102 (27): 7932. doi:10.1021 / ja00547a020.
- ^ Noyori, R .; Ohkuma, T .; Kitamura, M .; Takaya, H .; Sayo, N .; Kumobayashi, H .; Akutagawa, S. (1987). "Β-keto karboksilik esterlerin asimetrik hidrojenasyonu. Yüksek enantiyomerik saflıkta β-hidroksi esterlere pratik, tamamen kimyasal erişim". Amerikan Kimya Derneği Dergisi. 109 (19): 5856. doi:10.1021 / ja00253a051.
- ^ Ohkuma, Takeshi; Sandoval, Christian A .; Srinivasan, Rajagopal; Lin, Quinghong; Wei, Yinmao; Roxanne, Kilian; Noyori, Ryoji (2005-06-01). "Asimetrik Hidrojenasyon tert-Alkil Ketonlar ". Amerikan Kimya Derneği Dergisi. 127 (23): 8288–9. doi:10.1021 / ja052071. ISSN 0002-7863. PMID 15941254.
- ^ Ohkuma, T .; Hattori, T .; Ooka, H .; Inoue, T .; Noyori, R. (2004). "1-Tetralonların ve Analoglarının Etkili Asimetrik Hidrojenasyonu için BINAP / 1,4-Diamin − Rutenyum (II) Kompleksleri". Organik Harfler. 6 (16): 2681–2683. doi:10.1021 / ol049157c. PMID 15281743.
- ^ Ikariya, T .; Daha siyah, A.J. (2007). "İki Fonksiyonlu Geçiş Metal Tabanlı Moleküler Katalizörlerle Ketonların Asimetrik Transfer Hidrojenasyonu". Kimyasal Araştırma Hesapları. 40 (12): 1300–1308. doi:10.1021 / ar700134q. PMID 17960897.
- ^ Kilise, T.L .; Andersson, P.G. (2008). "Geleneksel olmayan fonksiyonel ikame edicilerle olefinlerin asimetrik hidrojenasyonu için iridyum katalizörleri". Koordinasyon Kimyası İncelemeleri. 252 (5–7): 513. doi:10.1016 / j.ccr.2007.09.015.
- ^ a b Lightfoot, A .; Schnider, P .; Pfaltz, A. (1998). "Olefinlerin İridyum-Fosfanodihidrooksazol Katalizörleri ile Enantioselektif Hidrojenasyonu". Angewandte Chemie Uluslararası Sürümü. 37 (20): 2897–2899. doi:10.1002 / (SICI) 1521-3773 (19981102) 37:20 <2897 :: AID-ANIE2897> 3.0.CO; 2-8. PMID 29711115.
- ^ a b c Xie, J. H .; Liu, X. Y .; Xie, J. B .; Wang, L. X .; Zhou, Q.L (2011). "Ek Bir Koordinasyon Grubu Ketonların Asimetrik Hidrojenasyonu için Son Derece Etkili Kiral İridyum Katalizörlerine Yol Açıyor". Angewandte Chemie Uluslararası Sürümü. 50 (32): 7329–32. doi:10.1002 / anie.201102710. PMID 21751315.
- ^ a b c Pfaltz, A .; Blankenstein, J. R .; Hilgraf, R .; Hörmann, E .; McIntyre, S .; Menges, F .; Schönleber, M .; Smidt, S. P .; Wüstenberg, B .; Zimmermann, N. (2003). "Olefinlerin İridyumla Katalize Edilmiş Enantiyoselektif Hidrojenasyonu". Gelişmiş Sentez ve Kataliz. 345 (12): 33. doi:10.1002 / adsc.200390027.
- ^ Cui, X .; Burgess, K. (2005). "Büyük Ölçekte İşlevsiz Alkenlerin Katalitik Homojen Asimetrik Hidrojenasyonları". Kimyasal İncelemeler. 105 (9): 3272–3296. doi:10.1021 / cr0500131. PMID 16159153.
- ^ Xu, Y.; Mingos, D. M. P .; Brown, J.M. (2008). "Crabtree'nin katalizörü yeniden gözden geçirildi; Ligand'ın istikrar ve dayanıklılık üzerindeki etkileri". Kimyasal İletişim (2): 199–201. doi:10.1039 / B711979H. PMID 18092086.
- ^ a b Wang, Z. J .; Deng, G. J .; Li, Y .; He, Y. M .; Tang, W. J .; Fan, Q.H (2007). "Ir (BINAP) -Cored Dendrimers ile Katalizlenen Kinolinlerin Enantiyoselektif Hidrojenasyonu: Katalitik Aktivitenin Dramatik Artışı". Organik Harfler. 9 (7): 1243–1246. doi:10.1021 / ol0631410. PMID 17328554.
- ^ a b Zhu, S. F .; Xie, J. B .; Zhang, Y. Z .; Li, S .; Zhou, Q.L (2006). "Ortam Basıncında Iminlerin Yüksek Enantiyoselektif Hidrojenasyonu için İyi Tanımlanmış Kiral Spiro İridyum / Fosfin − Oksazolin Katyonik Kompleksleri". Amerikan Kimya Derneği Dergisi. 128 (39): 12886–12891. doi:10.1021 / ja063444p. PMID 17002383.
- ^ a b Blaser, H. U .; Pugin, B. T .; Spindler, F .; Togni, A. (2002). "Ir difosfin katalizörleri ile enantiyoselektif imin hidrojenasyonu: Deaktivasyonla mücadele". Rendus Chimie Comptes. 5 (5): 379. doi:10.1016 / S1631-0748 (02) 01391-7.
- ^ Enthaler, S .; Junge, K .; Beller, M. (2008). "Demir ile Sürdürülebilir Metal Katalizasyonu: Pastan Yükselen Bir Yıldıza mı?". Angewandte Chemie Uluslararası Sürümü. 47 (18): 3317–21. doi:10.1002 / anie.200800012. PMID 18412184.
- ^ Mikhailine, A .; Lough, A. J .; Morris, R.H. (2009). "Şablon Senteziyle Oluşturulan P − N − N − P Tetradentat Ligand İçeren Demir Kompleksi ile Katalizlenen Ketonların Etkili Asimetrik Transfer Hidrojenasyonu". Amerikan Kimya Derneği Dergisi. 131 (4): 1394–1395. doi:10.1021 / ja809493h. PMID 19133772.
- ^ Sonnenberg, J. F .; Coombs, N .; Dube, P. A .; Morris, R.H. (2012). "Ketonların Asimetrik Transfer Hidrojenasyonunu Katalize Eden Demir Nanopartiküller". Amerikan Kimya Derneği Dergisi. 134 (13): 5893–5899. doi:10.1021 / ja211658t. PMID 22448656.
- ^ Whitesell, J. K. (1989). "C2 simetri ve asimetrik indüksiyon ". Kimyasal İncelemeler. 89 (7): 1581–1590. doi:10.1021 / cr00097a012.
- ^ Knowles, W. S .; Sabacky, M. J .; Üzüm Bağı, B.D. (1972). "Katalitik asimetrik hidrojenasyon". Journal of the Chemical Society, Chemical Communications (1): 10. doi:10.1039 / C39720000010. PMID 4270504.
- ^ a b Jerphagnon, T .; Renaud, J. L .; Bruneau, C. (2004). "Rodyum katalizli asimetrik hidrojenasyon için kiral monodentat fosfor ligandları". Tetrahedron: Asimetri. 15 (14): 2101. doi:10.1016 / j.tetasy.2004.04.037.
- ^ Van Den Berg, M .; Minnaard, A. J .; Schudde, E. P .; Van Esch, J .; De Vries, A. H. M .; De Vries, J. G .; Feringa, B.L. (2000). "Monodentat Ligandlarla Yüksek Enantiyoselektif Rodyum Katalizeli Hidrojenasyon" (PDF). Amerikan Kimya Derneği Dergisi. 122 (46): 11539. doi:10.1021 / ja002507f.
- ^ Fu, Y .; Xie, J. H .; Hu, A. G .; Zhou, H .; Wang, L. X .; Zhou, Q.L (2002). "Rodyum ile katalize edilen hidrojenasyon reaksiyonları için yeni monodentat spiro fosfor ligandları". Kimyasal İletişim (5): 480–481. doi:10.1039 / B109827F. PMID 12120551.
- ^ Reetz, M. T .; Sat, T .; Meiswinkel, A .; Mehler, G. (2003). "Kombinatoryal Asimetrik Geçiş-Metal Katalizinde Yeni Bir İlke: Kiral Monodentat P Ligandlarının Karışımları". Angewandte Chemie Uluslararası Sürümü. 42 (7): 790–3. doi:10.1002 / anie.200390209. PMID 12596201.
- ^ Vineyard, B. D .; Knowles, W. S .; Sabacky, M. J .; Bachman, G.L .; Weinkauff, D.J. (1977). "Asimetrik hidrojenasyon. Rodyum kiral bifosfin katalizörü". Amerikan Kimya Derneği Dergisi. 99 (18): 5946. doi:10.1021 / ja00460a018.
- ^ Knowles, W. S .; Sabacky, M. J .; Vineyard, B. D .; Weinkauff, D.J. (1975). "Bir rodyum kompleksi ve bir kiral bifosfin ile asimetrik hidrojenasyon". Amerikan Kimya Derneği Dergisi. 97 (9): 2567. doi:10.1021 / ja00842a058.
- ^ Müller, D .; Umbricht, G .; Weber, B .; Pfaltz, A. (1991). "C2- Enantioselektif Kataliz Ön İletişim için Kiral Ligandlar olarak Simetrik 4,4 ', 5,5'-Tetrahidrobi (oksazoller) ve 4,4', 5,5'-Tetrahidro-2,2'-metilenbis [oksazoller]. Helvetica Chimica Açta. 74: 232–240. doi:10.1002 / hlca.19910740123.
- ^ a b Helmchen, G. N .; Pfaltz, A. (2000). "Fosfinooksazolinler Yeni Bir Çok Yönlü, Modüler Sınıf P,NAsimetrik Kataliz için -Ligands ". Kimyasal Araştırma Hesapları. 33 (6): 336–345. doi:10.1021 / ar9900865. PMID 10891051.
- ^ Franzke, A .; Pfaltz, A. (2011). "Zwitterionic Iridium Kompleksleri ile P,N-Alkenlerin Asimetrik Hidrojenasyonu için Katalizör Olarak Ligandlar ". Kimya: Bir Avrupa Dergisi. 17 (15): 4131–44. doi:10.1002 / chem.201003314. PMID 21381140.
- ^ Maurer, F .; Huch, V .; Ullrich, A .; Kazmaier, U. (2012). "Α, β-Doymamış Ketonların Stereoselektif Hidrojenasyonu için Katalizörlerin Geliştirilmesi". Organik Kimya Dergisi. 77 (11): 5139–5143. doi:10.1021 / jo300246c. PMID 22571628.
- ^ Rageot, D .; Woodmansee, D. H .; Pugin, B. T .; Pfaltz, A. (2011). "Yüksek Seçici Katalizörler Olarak Prolin Bazlı P, O Ligand / İridyum Kompleksleri: Üç İkameli Alkenlerin Asimetrik Hidrojenasyonu". Angewandte Chemie Uluslararası Sürümü. 50 (41): 9598–601. doi:10.1002 / anie.201104105. PMID 21882320.
- ^ a b c Perry, M. C .; Cui, X .; Powell, M. T .; Hou, D. R .; Reibenspies, J. H .; Burgess, K. (2003). "Optik Olarak Aktif İridyum İmidazol-2-iliden-oksazolin Kompleksleri: Arilalkenlerin Asimetrik Hidrojenasyonunda Hazırlama ve Kullanım". Amerikan Kimya Derneği Dergisi. 125 (1): 113–123. doi:10.1021 / ja028142b. PMID 12515512.
- ^ a b Nanchen, S .; Pfaltz, A. (2006). "Kiral Sentezi ve Uygulaması N-Heterosiklik Karben-Oksazolin Ligandları: İridyum Katalizeli Enantiyoselektif Hidrojenasyon ". Kimya: Bir Avrupa Dergisi. 12 (17): 4550–8. doi:10.1002 / chem.200501500. PMID 16557626.
- ^ Zhu, Y .; Burgess, K. (2008). "İridyumla Katalize Edilmiş Asimetrik Vinil Eterlerin Hidrojenlenmesi". Gelişmiş Sentez ve Kataliz. 350 (7–8): 979. doi:10.1002 / adsc.200700546.
- ^ Zhao, J .; Burgess, K. (2009). "Üç İkameli Alkenlerin Asimetrik Hidrojenasyonlarından Aldol Tipi Kironlar". Organik Harfler. 11 (10): 2053–2056. doi:10.1021 / ol900308w. PMID 19368378.
- ^ Zhao, J .; Burgess, K. (2009). "Üçlü İkameli Alkenlerin Asimetrik Hidrojenasyonu ile Çevresel Dimetil Kironların Sentezi". Amerikan Kimya Derneği Dergisi. 131 (37): 13236–13237. doi:10.1021 / ja905458n. PMID 19719102.
- ^ Zhou, J .; Burgess, K. (2007). "Α, ω-Fonksiyonelleştirilmiş 2,4-Dimetilpentan Çiftler ve 2,4,6-Trimetilheptan Triadlar Asimetrik Hidrojenasyon Yoluyla". Angewandte Chemie Uluslararası Sürümü. 46 (7): 1129–31. doi:10.1002 / anie.200603635. PMID 17200966.
- ^ Zhou, J .; Zhu, Y .; Burgess, K. (2007). "Sentezi (S,R,R,S,R,S) -4,6,8,10,16,18- Hexamethyldocosane Antitrogus parvulus Diastereoselektif Hidrojenasyonlar yoluyla ". Organik Harfler. 9 (7): 1391–1393. doi:10.1021 / ol070298z. PMID 17338543.
- ^ Urban, S .; Ortega, N .; Glorius, F. (2011). "Ruthenium Tarafından Katalize Edilmiş Kinoksalinlerin Ligand Kontrollü Yüksek Düzeyde Regioselektif ve Asimetrik Hidrojenasyonu N-Heterosiklik Karben Kompleksleri ". Angewandte Chemie Uluslararası Sürümü. 50 (16): 3803–6. doi:10.1002/anie.201100008. PMID 21442699.
- ^ Pàmies, O.; Andersson, P. G.; Diéguez, M. (2010). "Asymmetric Hydrogenation of Minimally Functionalised Terminal Olefins: An Alternative Sustainable and Direct Strategy for Preparing Enantioenriched Hydrocarbons". Kimya: Bir Avrupa Dergisi. 16 (48): 14232–40. doi:10.1002/chem.201001909. PMID 21140401.
- ^ Woodmansee, D. H.; Pfaltz, A. (2011). "Asymmetric hydrogenation of alkenes lacking coordinating groups". Kimyasal İletişim. 47 (28): 7912–7916. doi:10.1039/c1cc11430a. PMID 21556431.
- ^ Mazuela, J.; Verendel, J. J.; Coll, M .; SchäFfner, B. N.; BöRner, A.; Andersson, P. G.; PàMies, O.; DiéGuez, M. (2009). "Iridium Phosphite−Oxazoline Catalysts for the Highly Enantioselective Hydrogenation of Terminal Alkenes". Amerikan Kimya Derneği Dergisi. 131 (34): 12344–12353. doi:10.1021/ja904152r. PMID 19658416.
- ^ Hou, G. H.; Xie, J. H.; Wang, L. X .; Zhou, Q. L. (2006). "Highly Efficient Rh(I)-Catalyzed Asymmetric Hydrogenation of Enamines Using Monodente Spiro Phosphonite Ligands". Amerikan Kimya Derneği Dergisi. 128 (36): 11774–11775. doi:10.1021/ja0644778. PMID 16953614.
- ^ Hou, G. H.; Xie, J. H.; Yan, P. C.; Zhou, Q. L. (2009). "Iridium-Catalyzed Asymmetric Hydrogenation of Cyclic Enamines". Amerikan Kimya Derneği Dergisi. 131 (4): 1366–1367. doi:10.1021/ja808358r. PMID 19132836.
- ^ Ohkuma, T .; Ooka, H.; Hashiguchi, S.; Ikariya, T .; Noyori, R. (1995). "Practical Enantioselective Hydrogenation of Aromatic Ketones". Amerikan Kimya Derneği Dergisi. 117 (9): 2675. doi:10.1021/ja00114a043.
- ^ Noyori, R .; Ohkuma, T. (2001). "Asymmetric Catalysis by Architectural and Functional Molecular Engineering: Practical Chemo- and Stereoselective Hydrogenation of Ketones". Angewandte Chemie Uluslararası Sürümü. 40 (1): 40–73. doi:10.1002/1521-3773(20010105)40:1<40::AID-ANIE40>3.0.CO;2-5. PMID 11169691.
- ^ Hems, W. P.; Groarke, M.; Zanotti-Gerosa, A.; Grasa, G. A. (2007). "[(Bisphosphine) Ru(II) Diamine] Complexes in Asymmetric Hydrogenation: Expanding the Scope of the Diamine Ligand". Kimyasal Araştırma Hesapları. 40 (12): 1340–1347. doi:10.1021/ar7000233. PMID 17576143.
- ^ Noyori, R .; Yamakawa, M.; Hashiguchi, S. (2001). "Metal−Ligand Bifunctional Catalysis: A Nonclassical Mechanism for Asymmetric Hydrogen Transfer between Alcohols and Carbonyl Compounds". Organik Kimya Dergisi. 66 (24): 7931–7944. doi:10.1021/jo010721w. PMID 11722188.
- ^ Yu, Z .; Jin, W .; Jiang, Q. (2012). "Brønsted Acid Activation Strategy in Transition-Metal Catalyzed Asymmetric Hydrogenation of N-Unprotected Imines, Enamines, and N-Heteroaromatic Compounds". Angewandte Chemie Uluslararası Sürümü. 51 (25): 6060–72. doi:10.1002/anie.201200963. PMID 22577004.
- ^ Hou, G .; Gosselin, F.; Li, W .; McWilliams, J. C.; Sun, Y .; Weisel, M.; O'Shea, P. D.; Chen, C. Y .; Davies, I. W.; Zhang, X. (2009). "Enantioselective Hydrogenation of N−H Imines". Amerikan Kimya Derneği Dergisi. 131 (29): 9882–9883. doi:10.1021/ja903319r. PMID 19569686.
- ^ Hou, G .; Tao, R.; Sun, Y .; Zhang, X .; Gosselin, F. (2010). "Iridium−Monodentate Phosphoramidite-Catalyzed Asymmetric Hydrogenation of Substituted Benzophenone N−H Imines". Amerikan Kimya Derneği Dergisi. 132 (7): 2124–2125. doi:10.1021/ja909583s. PMID 20104899.
- ^ a b Zhou, Y. G. (2007). "Asymmetric Hydrogenation of Heteroaromatic Compounds". Kimyasal Araştırma Hesapları. 40 (12): 1357–1366. CiteSeerX 10.1.1.653.5495. doi:10.1021/ar700094b. PMID 17896823.
- ^ Wang, W. B.; Lu, S. M.; Yang, P. Y.; Han, X. W.; Zhou, Y. G. (2003). "Highly Enantioselective Iridium-Catalyzed Hydrogenation of Heteroaromatic Compounds, Quinolines". Amerikan Kimya Derneği Dergisi. 125 (35): 10536–10537. CiteSeerX 10.1.1.651.3119. doi:10.1021/ja0353762. PMID 12940733.
- ^ a b Xu, L .; Lam, K. H.; Ji, J .; Wu, J .; Fan, Q. H.; Lo, W. H.; Chan, A. S. C. (2005). "Air-stable Ir-(P-Phos) complex for highly enantioselective hydrogenation of quinolines and their immobilization in poly(ethylene glycol) dimethyl ether (DMPEG)". Kimyasal İletişim (11): 1390–2. doi:10.1039/B416397D. PMID 15756313.
- ^ Lam, K. H.; Xu, L .; Feng, L .; Fan, Q. H.; Lam, F. L.; Lo, W. H.; Chan, A. S. C. (2005). "Highly Enantioselective Iridium-Catalyzed Hydrogenation of Quinoline Derivatives Using Chiral Phosphinite H8-BINAPO". Gelişmiş Sentez ve Kataliz. 347 (14): 1755. doi:10.1002/adsc.200505130.
- ^ Qiu, L .; Kwong, F. Y.; Wu, J .; Lam, W. H.; Chan, S .; Yu, W. Y.; Li, Y. M.; Guo, R.; Zhou, Z .; Chan, A. S. C. (2006). "A New Class of Versatile Chiral-Bridged Atropisomeric Diphosphine Ligands: Remarkably Efficient Ligand Syntheses and Their Applications in Highly Enantioselective Hydrogenation Reactions". Amerikan Kimya Derneği Dergisi. 128 (17): 5955–5965. doi:10.1021/ja0602694. PMID 16637664.
- ^ Reetz, M. T .; Li, X. (2006). "Asymmetric hydrogenation of quinolines catalyzed by iridium complexes of BINOL-derived diphosphonites". Kimyasal İletişim (20): 2159–60. doi:10.1039/b602320g. PMID 16703140.
- ^ Rueping; Antonchick, A .; Theissmann, T. (2006). "Oldukça enantiyoselektif bir Brønsted asit katalizli kademeli reaksiyon: kinolinlerin organokatalitik transfer hidrojenasyonu ve alkaloidlerin sentezinde uygulamaları". Angewandte Chemie International Edition İngilizce. 45 (22): 3683–3686. doi:10.1002 / anie.200600191. PMID 16639754.
- ^ Tang, W .; Xu, L .; Fan, Q. H.; Wang, J .; Fan, B.; Zhou, Z .; Lam, K. H.; Chan, A. S. C. (2009). "Asymmetric Hydrogenation of Quinoxalines with Diphosphinite Ligands: A Practical Synthesis of Enantioenriched, Substituted Tetrahydroquinoxalines". Angewandte Chemie Uluslararası Sürümü. 48 (48): 9135–8. doi:10.1002/anie.200904518. PMID 19876991.
- ^ Rueping, M.; Tato, F.; Schoepke, F. R. (2010). "The First General, Efficient and Highly Enantioselective Reduction of Quinoxalines and Quinoxalinones". Kimya: Bir Avrupa Dergisi. 16 (9): 2688–91. doi:10.1002/chem.200902907. PMID 20140920.
- ^ Glorius, F.; Spielkamp, N.; Holle, S.; Goddard, R.; Lehmann, C. W. (2004). "Efficient Asymmetric Hydrogenation of Pyridines". Angewandte Chemie Uluslararası Sürümü. 43 (21): 2850–2. doi:10.1002/anie.200453942. PMID 15150766.
- ^ Ye, Z. S.; Chen, M. W.; Chen, Q. A.; Shi, L .; Duan, Y.; Zhou, Y. G. (2012). "Iridium-Catalyzed Asymmetric Hydrogenation of Pyridinium Salts". Angewandte Chemie Uluslararası Sürümü. 51 (40): 10181–4. doi:10.1002/anie.201205187. PMID 22969060.
- ^ Tang, W. J.; Tan, J .; Xu, L. J.; Lam, K. H.; Fan, Q. H.; Chan, A. S. C. (2010). "Highly Enantioselective Hydrogenation of Quinoline and Pyridine Derivatives with Iridium-(P-Phos) Catalyst". Gelişmiş Sentez ve Kataliz. 352 (6): 1055. doi:10.1002/adsc.200900870.
- ^ Rueping, M.; Antonchick, A. P. (2007). "Organocatalytic Enantioselective Reduction of Pyridines". Angewandte Chemie Uluslararası Sürümü. 46 (24): 4562–5. doi:10.1002/anie.200701158. PMID 17492817.
- ^ Kuwano, R.; Sato, K .; Kurokawa, T.; Karube, D.; Ito, Y. (2000). "Catalytic Asymmetric Hydrogenation of Heteroaromatic Compounds, Indoles". Amerikan Kimya Derneği Dergisi. 122 (31): 7614. doi:10.1021/ja001271c.
- ^ Kuwano, R.; Kaneda, K.; Ito, T .; Sato, K .; Kurokawa, T.; Ito, Y. (2004). "Highly Enantioselective Synthesis of Chiral 3-Substituted Indolines by Catalytic Asymmetric Hydrogenation of Indoles". Organik Harfler. 6 (13): 2213–2215. doi:10.1021/ol049317k. PMID 15200323.
- ^ Kuwano, R.; Kashiwabara, M.; Sato, K .; Ito, T .; Kaneda, K.; Ito, Y. (2006). "Catalytic asymmetric hydrogenation of indoles using a rhodium complex with a chiral bisphosphine ligand PhTRAP". Tetrahedron: Asimetri. 17 (4): 521. doi:10.1016/j.tetasy.2006.01.016.
- ^ Kuwano, R.; Kashiwabara, M. (2006). "Ruthenium-Catalyzed Asymmetric Hydrogenation of N-Boc-Indoles". Organik Harfler. 8 (12): 2653–2655. doi:10.1021/ol061039x. PMID 16737337.
- ^ Baeza, A.; Pfaltz, A. (2010). "Iridium-Catalyzed Asymmetric Hydrogenation of N-Protected Indoles". Kimya: Bir Avrupa Dergisi. 16 (7): 2036–9. doi:10.1002/chem.200903105. PMID 20104554.
- ^ a b Xiao, Y. C.; Wang, C .; Yao, Y .; Sun, J .; Chen, Y. C. (2011). "Direct Asymmetric Hydrosilylation of Indoles: Combined Lewis Base and Brønsted Acid Activation". Angewandte Chemie Uluslararası Sürümü. 50 (45): 10661–4. doi:10.1002/anie.201105341. PMID 21932274.
- ^ Duan, Y.; Chen, M. W.; Ye, Z. S.; Wang, D. S.; Chen, Q. A.; Zhou, Y. G. (2011). "An Enantioselective Approach to 2,3-Disubstituted Indolines through Consecutive Brønsted Acid/Pd-Complex-Promoted Tandem Reactions". Kimya: Bir Avrupa Dergisi. 17 (26): 7193–7. doi:10.1002/chem.201100576. PMID 21567504.
- ^ a b Kuwano, R.; Kashiwabara, M.; Ohsumi, M.; Kusano, H. (2008). "Catalytic Asymmetric Hydrogenation of 2,3,5-Trisubstituted Pyrroles". Amerikan Kimya Derneği Dergisi. 130 (3): 808–809. doi:10.1021/ja7102422. PMID 18154340.
- ^ a b Wang, D. S.; Ye, Z. S.; Chen, Q. A.; Zhou, Y. G.; Yu, C. B.; Fan, H. J .; Duan, Y. (2011). "Highly Enantioselective Partial Hydrogenation of Simple Pyrroles: A Facile Access to Chiral 1-Pyrrolines". Amerikan Kimya Derneği Dergisi. 133 (23): 8866–8869. doi:10.1021/ja203190t. PMID 21591641.
- ^ Wang, D. S.; Chen, Q. A.; Lu, S. M.; Zhou, Y. G. (2012). "Asymmetric Hydrogenation of Heteroarenes and Arenes". Kimyasal İncelemeler. 112 (4): 2557–2590. doi:10.1021/cr200328h. PMID 22098109.
- ^ Ortega, Nuria; Urban, Slawomir; Beiring, Bernhard; Glorius, Frank (2012). "Ruthenium NHC Catalyzed Highly Asymmetric Hydrogenation of Benzofurans". Angewandte Chemie Uluslararası Sürümü. 51 (7): 1710–3. doi:10.1002/anie.201107811. PMID 22311814.
- ^ Wysocki, Jędrzej; Ortega, Nuria; Glorius, Frank (2014). "Asymmetric Hydrogenation of Disubstituted Furans". Angewandte Chemie Uluslararası Sürümü. 53 (33): 8751–5. doi:10.1002/anie.201310985. PMID 24554623.
- ^ Urban, S .; Beiring, B.; Ortega, N.; Paul, D.; Glorius, F. (2012). "Asymmetric Hydrogenation of Thiophenes and Benzothiophenes". Amerikan Kimya Derneği Dergisi. 134 (37): 15241–15244. doi:10.1021/ja306622y. PMID 22934527.
- ^ a b Heitbaum, M.; Glorius, F.; Escher, I. (2006). "Asymmetric Heterogeneous Catalysis". Angewandte Chemie Uluslararası Sürümü. 45 (29): 4732–62. doi:10.1002/anie.200504212. PMID 16802397.
- ^ Yoon, M.; Srirambalaji, R.; Kim, K. (2012). "Homochiral Metal–Organic Frameworks for Asymmetric Heterogeneous Catalysis". Kimyasal İncelemeler. 112 (2): 1196–1231. doi:10.1021/cr2003147. PMID 22084838.
- ^ Hu, A.; Ngo, H. L.; Lin, W. (2003). "Chiral Porous Hybrid Solids for Practical Heterogeneous Asymmetric Hydrogenation of Aromatic Ketones". Amerikan Kimya Derneği Dergisi. 125 (38): 11490–11491. doi:10.1021 / ja0348344. PMID 13129339.
- ^ Blaser, H. U.; Spindler, F .; Studer, M. (2001). "Enantioselective catalysis in fine chemicals production". Uygulamalı Kataliz A: Genel. 221 (1–2): 119–143. doi:10.1016/S0926-860X(01)00801-8. PMID 12613584.
- ^ Dub, Pavel A .; Gordon, John C. (2018). "Noyori tipi moleküler katalizörlerde metale bağlı N-H işlevselliğinin rolü". Doğa İncelemeleri Kimya. 2 (12): 396–408. doi:10.1038 / s41570-018-0049-z. S2CID 106394152.
- ^ Blaser, Hans-Ulrich; Federsel, Hans-Jürgen, eds. (2010). Asymmetric Catalysis on Industrial Scale. Weinheim: Wiley-VCH. s. 13–16. doi:10.1002/9783527630639. ISBN 978-3-527-63063-9.
- ^ Jacobsen, E.N.; Pfaltz, Andreas; Yamamato, H., eds. (1999). Comprehensive Asymmetric Catalysis. Berlin; New York: Springer. pp. 1443–1445. ISBN 978-3-540-64336-4.



