İridyum - Iridium
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| İridyum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Telaffuz | /ɪˈrɪdbenəm/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Görünüm | gümüş beyazı | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standart atom ağırlığı Birr, std(Ir) | 192.217(2)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| İridyum periyodik tablo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomik numara (Z) | 77 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup | grup 9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periyot | dönem 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | d bloğu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eleman kategorisi | Geçiş metali | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron konfigürasyonu | [Xe ] 4f14 5 g7 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 18, 32, 15, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fiziki ozellikleri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Evre -deSTP | katı | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erime noktası | 2719 K (2446 ° C, 4435 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kaynama noktası | 4403 K (4130 ° C, 7466 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yoğunluk (yakınr.t.) | 22,56 g / cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ne zaman sıvım.p.) | 19 g / cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Füzyon ısısı | 41.12 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Buharlaşma ısısı | 564 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar ısı kapasitesi | 25.10 J / (mol · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Buhar basıncı
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomik özellikler | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidasyon durumları | −3, −1, 0, +1, +2, +3, +4, +5, +6, +7, +8, +9[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 2.20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| İyonlaşma enerjileri |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom yarıçapı | ampirik: 136öğleden sonra | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent yarıçap | 141 ± 18:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diğer özellikler | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Doğal olay | ilkel | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal yapı | yüz merkezli kübik (fcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sesin hızı ince çubuk | 4825 m / s (20 ° C'de) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termal Genleşme | 6,4 µm / (m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termal iletkenlik | 147 W / (m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektriksel direnç | 47.1 nΩ · m (20 ° C'de) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Manyetik sıralama | paramanyetik[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Manyetik alınganlık | +25.6·10−6 santimetre3/ mol (298 K)[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gencin modülü | 528 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kayma modülü | 210 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplu modül | 320 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson oranı | 0.26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs sertliği | 6.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers sertliği | 1760–2200 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell sertliği | 1670 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS numarası | 7439-88-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tarih | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Keşif ve ilk izolasyon | Smithson Tennant (1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ana iridyum izotopları | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
İridyum bir kimyasal element ile sembol Ir ve atomik numara 77. Çok sert, kırılgan, gümüşi beyaz Geçiş metali of platin grubu İridyum, ikinci en yoğun metal olarak kabul edilir (sonra osmiyum ) yoğunluğu ile 22,56 g / cm3 deneysel X-ışını kristalografisi ile tanımlandığı gibi. Ancak oda sıcaklığında ve standart atmosferik basınçta iridyumun yoğunluğa sahip olduğu hesaplanmıştır. 22,65 g / cm3, 0,04 g / cm3 osmiyumdan daha yüksek aynı şekilde ölçüldü.[5] Yine de, deneysel X-ışını kristalografisi değeri en doğru olarak kabul edilir ve bu nedenle iridyum ikinci en yoğun element olarak kabul edilir.[6] En çok aşınma 2000 ° C'ye kadar yüksek sıcaklıklarda bile dayanıklı metal. Sadece belirli erimiş tuzlar olmasına rağmen ve halojenler katı iridyumu aşındırır, ince bölünmüş iridyum tozu çok daha reaktiftir ve yanıcı olabilir.
İridyum, 1803 yılında doğal ortamda çözünmeyen safsızlıklar arasında keşfedildi. platin. Smithson Tennant, birincil kaşif, Yunan tanrıçasından sonra iridyum adını verdi İris, tuzlarının çarpıcı ve farklı renkleri nedeniyle gökkuşağının kişileştirilmesi. İridyum en nadir unsurlardan biri içinde yerkabuğu, yıllık üretim ve tüketim sadece üç ton. 191Ir ve 193Ir, doğal olarak oluşan tek iki izotoplar iridyumun yanı sıra tek kararlı izotoplar; ikincisi daha çoktur.
Kullanımdaki en önemli iridyum bileşikleri, birlikte oluşturdukları tuzlar ve asitlerdir. klor iridyum da bir dizi oluştursa da organometalik bileşikler sanayide kullanılan kataliz ve araştırmada. İridyum metal, yüksek performansta olduğu gibi yüksek sıcaklıklarda yüksek korozyon direnci gerektiğinde kullanılır. bujiler, potalar yarı iletkenlerin yüksek sıcaklıklarda yeniden kristalizasyonu için ve içinde klor üretimi için elektrotlar kloralkali işlemi. Bazılarında iridyum radyoizotopları kullanılır. radyoizotop termoelektrik jeneratörler.
İridyum bulunur göktaşları Dünya'nın kabuğundan çok daha yüksek bir bollukta.[7] Bu nedenle, kil tabakasında alışılmadık derecede yüksek iridyum bolluğu Kretase-Paleojen sınırı doğmasına neden oldu Alvarez hipotezi devasa bir dünya dışı nesnenin etkisinin 66 milyon yıl önce dinozorların ve diğer birçok türün neslinin tükenmesi. Benzer şekilde, çekirdek örneklerinde bir iridyum anomalisi Pasifik Okyanusu önerdi Eltanin etkisi yaklaşık 2,5 milyon yıl önce.
Dünya gezegenindeki toplam iridyum miktarının kabuksal kayalarda gözlenenden çok daha yüksek olduğu düşünülmektedir, ancak diğer platin grubu metallerde olduğu gibi, yüksek yoğunluk ve eğilim İridyumun demir ile bağlanması, gezegen genç ve hala erimişken iridyumun çoğunun kabuğun altına inmesine neden oldu.
Özellikler
Fiziki ozellikleri
Bir üyesi platin grubu metaller iridyum beyazdır, benzer platin, ancak hafif sarımsı bir döküm ile. Onun yüzünden sertlik, kırılganlık ve çok yüksek erime noktası katı iridyumun işlenmesi, şekillendirilmesi veya çalıştırılması zordur; Böylece toz metalurjisi bunun yerine yaygın olarak kullanılır.[8] 1.600 ° C'nin (2.910 ° F) üzerindeki sıcaklıklarda havada iyi mekanik özellikler sağlayan tek metaldir.[9] 10. en yüksek tüm elementler arasında kaynama noktası ve bir süperiletken 0.14'ün altındaki sıcaklıklardaK.[10]
İridyum esneklik modülü metaller arasında ikinci en yüksek olanıdır, sadece geçildi osmiyum.[9] Bu, yüksek ile birlikte kayma modülü ve çok düşük bir rakam Poisson oranı (boyuna ile yanal arasındaki ilişki Gerginlik ), yüksek derecesini gösterir sertlik ve imalatını yararlı bileşenlere dönüştüren deformasyona karşı direnç, büyük bir zorluk meselesi. Bu sınırlamalara ve iridyumun yüksek maliyetine rağmen, modern teknolojide karşılaşılan son derece ağır koşulların bazılarında mekanik mukavemetin önemli bir faktör olduğu bir dizi uygulama geliştirilmiştir.[9]
Ölçülen yoğunluk iridyum oranı osmiyumunkinden sadece biraz daha düşüktür (yaklaşık% 0,12 oranında), en yoğun metal bilinen.[11][12] İki unsurdan hangisinin daha yoğun olduğu konusunda, yoğunluktaki farkın küçük boyutu ve doğru bir şekilde ölçülmesindeki zorluklar nedeniyle bazı belirsizlikler oluştu.[13] ancak yoğunluğu hesaplamak için kullanılan faktörlerde artan doğrulukla, X-ışını kristalografik veri yoğunlukları verdi 22,56 g / cm3 iridyum için ve 22,59 g / cm3 osmiyum için.[14]
Kimyasal özellikler
İridyum, korozyona en dayanıklı metaldir bilinen:[15] neredeyse hiç kimse tarafından saldırıya uğramaz asit, aqua regia, erimiş metaller veya yüksek sıcaklıklarda silikatlar. Bununla birlikte, bir miktar erimiş madde tarafından saldırıya uğrayabilir. tuzlar, gibi sodyum siyanür ve potasyum siyanür,[16] Hem de oksijen ve halojenler (özellikle flor )[17] daha yüksek sıcaklıklarda.[18] İridyum ayrıca doğrudan reaksiyona girer kükürt atmosferik basınçta iridyum disülfür.[19]
Bileşikler
| Oksidasyon durumları[not 1] | |
|---|---|
| −3 | [Ir (CO) 3]3− |
| −1 | [Ir (CO) 3(PPh 3)]− |
| 0 | Ir 4(CO) 12 |
| +1 | [Ir (CO) Cl (PPh 3) 2] |
| +2 | IrCl 2 |
| +3 | IrCl 3 |
| +4 | IRO 2 |
| +5 | Ir 4F 20 |
| +6 | IrF 6 |
| +7 | [(η2 -Ö 2IRO 2]+ |
| +8 | IRO 4 |
| +9 | [IrO 4]+ [2] |
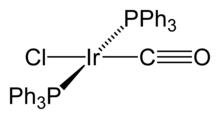
İridyum içinde bileşikler oluşturur oksidasyon durumları -3 ile +9 arasında; en yaygın oksidasyon durumları +3 ve +4'tür.[8] Yüksek + 6 oksidasyon durumunun iyi karakterize edilmiş örnekleri nadirdir, ancak şunları içerir: IrF
6 ve iki karışık oksit Sr
2MgIrO
6 ve Sr
2Kahire
6.[8][20] Ayrıca, 2009 yılında iridyum (VIII) oksit (IRO
4) matris izolasyon koşulları altında (Ar içinde 6 K) bir iridyum-perokso kompleksinin UV ışıması ile hazırlandı. Bununla birlikte, bu türün, daha yüksek sıcaklıklarda dökme bir katı olarak stabil olması beklenmemektedir.[21] En yüksek oksidasyon durumu (+9), aynı zamanda en yüksek hiç element, sadece bir katyonda bilinir, IRO+
4; sadece gaz fazlı türler olarak bilinir ve herhangi bir şekilde oluştuğu bilinmemektedir. tuzlar.[2]
İridyum dioksit, IRO
2mavi siyah bir katı, iridyumun iyi karakterize edilmiş tek oksitidir.[8] Bir seskioksit, Ir
2Ö
3mavi-siyah bir toz olarak tanımlanmıştır. IRO
2 tarafından HNO
3.[17] Karşılık gelen disülfidler, diselenidler, seskisülfidler ve seskiselenidler bilinmektedir ve IrS
3 ayrıca bildirildi.[8] İridyum ayrıca +4 ve +5 oksidasyon durumlarına sahip iridatlar oluşturur, örneğin K
2IRO
3 ve KIrO
3reaksiyonundan hazırlanabilen potasyum oksit veya potasyum süperoksit yüksek sıcaklıklarda iridyum ile.[22]
Hayır olmasına rağmen ikili hidrürler iridyum Ir
xH
y biliniyor, içeren kompleksler biliniyor IrH4−
5 ve IrH3−
6iridyum sırasıyla +1 ve +3 oksidasyon durumlarına sahiptir.[23] Üçlü hidrit Mg
6Ir
2H
11 ikisini de içerdiğine inanılıyor IrH4−
5 ve 18 elektronlu IrH5−
4 anyon.[24]
Hiçbir monohalid veya dihalid bilinmemektedir, oysa trihalidler, IrX
3, tüm halojenler için bilinir.[8] +4 ve üzeri oksidasyon durumları için, yalnızca tetraflorür, pentaflorür ve heksaflorür bilinmektedir.[8] İridyum hekzaflorür, IrF
6, oktahedral moleküllerden oluşan uçucu ve oldukça reaktif sarı bir katıdır. Suda ayrışır ve azalır. IrF
4, iridyum siyahından kristal bir katı.[8] İridyum pentaflorür benzer özelliklere sahiptir, ancak aslında bir tetramer, Ir
4F
20, dört köşe paylaşımlı oktahedradan oluşur.[8] İridyum metal, erimiş alkali metal siyanürlerde çözünerek Ir (CN)3+
6 (heksasiyanoiridat) iyonu.
Hekzakloroiridik (IV) asit, H
2IrCl
6ve amonyum tuzu endüstriyel açıdan en önemli iridyum bileşikleridir.[25] İridyumun saflaştırılmasında yer alırlar ve diğer birçok iridyum bileşiği için öncül olarak kullanılırlar. anot kaplamalar. IrCl2−
6 iyon yoğun koyu kahverengi bir renge sahiptir ve daha açık renkliye kolayca indirgenebilir. IrCl3−
6 ve tam tersi.[25] İridyum triklorür, IrCl
3, susuz formda iridyum tozunun doğrudan oksidasyonundan elde edilebilir. klor 650 ° C'de,[25] veya çözülerek sulu formda Ir
2Ö
3 içinde hidroklorik asit, genellikle diğer Ir (III) bileşiklerinin sentezi için bir başlangıç malzemesi olarak kullanılır.[8] Başlangıç malzemesi olarak kullanılan başka bir bileşik, amonyum heksakloroiridattır (III), (NH
4)
3IrCl
6. İridyum (III) kompleksleri diyamanyetik (düşük dönüş ) ve genellikle bir oktahedral moleküler geometri.[8]
Organoiridium bileşikleri iridyum içerir–karbon metalin genellikle daha düşük oksidasyon durumlarında olduğu bağlar. Örneğin, oksidasyon durumu sıfır bulunur tetrairidyum dodekakarbonil, Ir
4(CO)
12, en yaygın ve kararlı ikili karbonil iridyum.[8] Bu bileşikte, iridyum atomlarının her biri diğer üçüne bağlanarak bir tetrahedral küme oluşturur. Bazı organometalik Ir (I) bileşikleri, keşiflerinin adını alacak kadar dikkate değerdir. Biri Vaska'nın kompleksi, IrCl (CO) [P (C
6H
5)
3]
2alışılmadık bir şekilde bağlanma özelliğine sahip olan dioksijen molekülü, Ö
2.[26] Bir diğeri Crabtree'nin katalizörü, bir homojen katalizör için hidrojenasyon reaksiyonlar.[27] Bu bileşiklerin ikisi de kare düzlemsel, d8 kompleksler, toplam 16 değerlik elektronları, reaktivitelerini açıklar.[28]
İridyum bazlı bir organik LED malzeme belgelendi ve daha parlak olduğu görüldü DPA veya PPV Bu, gelecekte esnek OLED aydınlatmanın temeli olabilir.[29]
İzotoplar
İridyumun doğal olarak oluşan iki kararlı izotoplar, 191Ir ve 193Ir, ile doğal bolluk sırasıyla% 37,3 ve% 62,7'dir.[30] En az 37 radyoizotoplar ayrıca sentezlenmiştir, kütle Numarası 164 ile 202 arası. 192Ir iki kararlı izotop arasına düşen, en kararlı radyoizotoptur. yarı ömür 73.827 gün içinde uygulama buluyor brakiterapi[31] ve endüstriyel radyografi, özellikle petrol ve gaz endüstrilerinde çelikteki kaynakların tahribatsız testi için; iridyum-192 kaynakları bir dizi radyolojik kazaya karışmıştır. Diğer üç izotopun en az bir günlük yarılanma ömrü vardır.188Ir, 189Ir ve 190Ir.[30] 191'in altındaki kütleli izotoplar β+ çürüme, α çürümesi ve (nadir) proton emisyonu, nın istisnası ile 189Ir, çürüyen elektron yakalama. 191 bozunumundan daha ağır sentetik izotoplar β− çürüme, olmasına rağmen 192Ir ayrıca küçük bir elektron yakalama bozunum yoluna sahiptir.[30] İridyumun bilinen tüm izotopları 1934 ile 2008 yılları arasında keşfedildi ve en son keşifler 200–202Ir.[32]
En az 32 yarı kararlı izomerler 164 ile 197 arasında değişen, karakterize edilmiştir. Bunlardan en kararlı olanı 192 m2Ir, çürüyen izomerik geçiş 241 yıllık yarı ömre sahip,[30] onun temel hallerinde iridyumun sentetik izotoplarından daha kararlı olmasını sağlar. En az kararlı izomer 190m3Sadece 2 µs'lik yarı ömre sahip Ir.[30] İzotop 191Ir, herhangi bir unsurun bir Mössbauer etkisi. Bu, onu aşağıdakiler için yararlı kılar Mössbauer spektroskopisi fizik, kimya, biyokimya, metalurji ve mineralojide araştırmalar için.[33]
Tarih
Platin grubu

İridyumun keşfi, platin ve platin grubunun diğer metalleri ile iç içe geçmiştir. Yerli Eski Etiyopyalılar tarafından kullanılan platin[34] ve Güney Amerika kültürleri tarafından[35] her zaman az miktarda iridyum dahil diğer platin grubu metalleri içeriyordu. Platin Avrupa'ya şu şekilde ulaştı: Platina ("silverette"), 17. yüzyılda İspanyol fatihler tarafından bugün bilinen bir bölgede bulunan Chocó bölümü içinde Kolombiya.[36] Bu metalin bilinen elementlerin bir alaşımı olmadığı, bunun yerine ayrı bir yeni element olduğunun keşfi 1748 yılına kadar gerçekleşmedi.[37]
Keşif
Platin üzerinde çalışan kimyagerler onu aqua regia (karışımı hidroklorik ve nitrik asitler ) çözünür tuzlar oluşturmak için. Her zaman az miktarda koyu, çözülmez kalıntı gözlemlediler.[9] Joseph Louis Proust kalıntının olduğunu düşündüm grafit.[9] Fransız kimyagerler Victor Collet-Descotils, Antoine François, Comte de Fourcroy, ve Louis Nicolas Vauquelin 1803'te siyah kalıntı da gözlemlendi, ancak daha fazla deney için yeterince elde edilmedi.[9]
1803'te İngiliz bilim adamı Smithson Tennant (1761-1815) çözünmeyen artığı analiz etti ve yeni bir metal içermesi gerektiği sonucuna vardı. Vauquelin, tozu dönüşümlü olarak alkali ve asitlerle işlemden geçirdi[15] ve bu yeni metalden olduğuna inandığı uçucu yeni bir oksit elde etti. pteneYunanca kelimeden πτηνός ptēnós, "kanatlı".[38][39] Çok daha fazla miktarda kalıntı avantajına sahip olan Tennant, araştırmasına devam etti ve siyah kalıntı, iridyum ve osmiyumdaki daha önce keşfedilmemiş iki elementi tespit etti.[9][15] Koyu kırmızı kristaller elde etti (muhtemelen Na
2[IrCl
6]·nH
2Ö) ile bir dizi reaksiyonla sodyum hidroksit ve hidroklorik asit.[39] İridyum adını İris (Ἶρις), gökkuşağının Yunan kanatlı tanrıçası ve Olimpiya tanrılarının habercisi, çünkü tuzlar o kuvvetli renklerle elde edildi.[not 2][40] Yeni unsurların keşfi, bir mektupla belgelendi. Kraliyet toplumu 21 Haziran 1804'te.[9][41]
Metal işleme ve uygulamalar
İngiliz bilim adamı John George Çocuklar 1813'te "şimdiye kadar yapılmış en büyük galvanik pil" (o zamana kadar) yardımıyla bir iridyum numunesini eriten ilk kişiydi.[9] Yüksek saflıkta iridyum elde eden ilk Robert Hare 1842'de. 21,8 g / cm3 ve metalin neredeyse hareketsiz ve çok sert olduğunu belirtti. Kayda değer miktarda ilk eritme, Henri Sainte-Claire Deville ve Jules Henri Debray 1860'da. 300 litreden fazla saf yakılması gerekiyordu. Ö
2 ve H
2 her kilogram iridyum için gaz.[9]
Metalin eritilmesindeki bu aşırı zorluklar, iridyum işleme olasılıklarını sınırladı. John Isaac Hawkins dolmakalem uçları için ince ve sert bir nokta arıyordu ve 1834'te iridyum uçlu altın bir kalem yapmayı başardı. 1880'de, John Holland ve William Lofland Dudley ekleyerek iridyumu eritebildiler fosfor ve sürecin Amerika Birleşik Devletleri'nde patentini aldı; İngiliz şirketi Johnson Matthey daha sonra 1837'den beri benzer bir işlem kullandıklarını ve halihazırda bir dizi iridyumu sunmuş olduklarını belirtti. Dünya Fuarları.[9] Rutenyum ile iridyum alaşımının ilk kullanımı termokupllar Otto Feussner tarafından 1933'te yapılmıştır. Bunlar, havadaki 2.000 ° C'ye (3.630 ° F) kadar yüksek sıcaklıkların ölçülmesine olanak tanımıştır.[9]
1957'de Münih, Almanya'da Rudolf Mössbauer "yirminci yüzyıl fiziğinde dönüm noktası deneyleri" denen şeyde,[42] rezonansı keşfetti ve geri tepme -ücretsiz emisyon ve absorpsiyon Gama ışınları sadece içeren katı metal numunedeki atomlar tarafından 191Ir.[43] Bu fenomen olarak bilinen Mössbauer etkisi (o zamandan beri diğer çekirdekler için gözlemlenmiştir, örneğin 57Fe ) ve geliştirildi Mössbauer spektroskopisi fizik, kimya, biyokimya, metalurji ve mineraloji araştırmalarına önemli katkılarda bulunmuştur.[33] Mössbauer, Nobel Fizik Ödülü 1961'de, 32 yaşındayken, keşfini yayınladıktan sadece üç yıl sonra.[44] 1986'da Rudolf Mössbauer Albert Einstein Madalyası ve Elliot Cresson Madalyası ile kazandığı başarılardan dolayı onurlandırıldı.
Oluşum
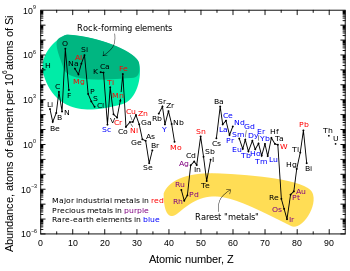

İridyum, Dünya'nın kabuğunda en az bulunan dokuz kararlı elementten biridir ve ortalama kütle oranı 0,001'dir.ppm kabuklu kayaçta; platin 10 kat daha bol, altın 40 kat daha fazladır ve gümüş ve Merkür 80 kat daha fazladır.[8] Tellür iridyum kadar bol miktarda bulunur.[8] Kabuk kayasındaki düşük bolluğunun aksine, iridyum nispeten yaygındır. göktaşları 0.5 ppm veya daha fazla konsantrasyonlarda.[46] Dünyadaki toplam iridyum konsantrasyonunun, kabuk kayalarında gözlenenden çok daha yüksek olduğu düşünülmektedir, ancak yoğunluk ve yan düşmanı İridyumun ("demir seven") karakteri, kabuğun altına indi ve Dünyanın çekirdeği gezegen hala eriyik haldeyken.[25]
İridyum doğada birleşmemiş bir element olarak veya doğal olarak bulunur. alaşımlar; özellikle iridyum-osmiyum alaşımları, osmiridyum (osmiyum açısından zengin) ve iridosmium (iridyum bakımından zengin).[15] İçinde nikel ve bakır birikintiler, platin grubu metaller olarak sülfitler (yani (Pt, Pd) S), Tellurides (yani PtBiTe), antimonidler (PdSb) ve arsenidler (yani PtA'lar
2). Tüm bu bileşiklerde platin, az miktarda iridyum ve osmiyum ile değiştirilir. Tüm platin grubu metallerde olduğu gibi, iridyum doğal olarak ham nikelli alaşımlarda veya ham bakır.[47] Türleri oluşturan element olarak iridyum içeren bir dizi iridyum baskın mineral bilinmektedir. Son derece nadirdirler ve genellikle yukarıda verilenlerin iridyum analoglarını temsil ederler. Örnekler irarsit ve kuproiridittir.[48][49][50][51][52]
Yerkabuğunun içinde, iridyum üç tür jeolojik yapıda en yüksek konsantrasyonlarda bulunur: magmatik tortular (aşağıdan kabuk izleri), çarpma kraterleri ve eski yapılardan birinden yeniden işlenmiş tortular. Bilinen en büyük birincil rezervler, Bushveld magmatik kompleksi içinde Güney Afrika,[53] (bilinen en büyük çarpma kraterinin yakınında, Vredefort krateri ) yakınındaki büyük bakır-nikel yatakları Norilsk içinde Rusya, ve Sudbury Havzası (ayrıca bir çarpma krateri) Kanada aynı zamanda önemli iridyum kaynaklarıdır. Amerika Birleşik Devletleri'nde daha küçük rezervler bulunur.[53] İridyum ayrıca platin ve diğer platin grubu metallerle birlikte ikincil yataklarda da bulunur. alüvyon mevduat. Tarafından kullanılan alüvyon çökeltileri Kolomb öncesi içindeki insanlar Chocó Bölümü nın-nin Kolombiya hala platin grubu metaller için bir kaynaktır. 2003 yılı itibarıyla dünya rezervleri tahmin edilmemiştir.[15]
Deniz Oşinografisi
İridyum deniz organizmalarında, tortularda ve su kolonunda bulunur. Organizmalarda iridyum ortalama olarak trilyonda 20 parçadan az bulunur.[54] Bunun nedeni büyük olasılıkla "Ir'ın deniz suyunda kararlı kloro-metal kompleksleri oluşturma yeteneğinin zayıf olmasıdır".[54] Bu, Kretase / Tersiyer (K-T) sınır sedimanları tarafından gösterilen Kretase-Paleojen zamanına ait biyosfer kalıntılarında bulunandan 5 kadirden daha azdır.[54] İridyum, su kolonunda düşük konsantrasyonlarda (platinden 100 kat daha az) bulunur. Bu konsantrasyonlar ve iridyumun halojenürlerle daha düşük kompleks oluşturma kabiliyeti, etkileşimlerin hidrolize olma eğiliminin daha yüksek olmasına neden olur.[55] Sıcaklık, anoksi veya hipoksik basınç, jeolojik ve biyolojik süreçle birlikte su kolonundaki ve tortu bileşimindeki iridyum oranlarını etkileyebilir.[56]
İridyum, dünya dışı birikintiler, volkanik aktivite, deniz suyu birikimi, mikrobiyal işleme, hidrotermal havalandırma ekshalasyonları vb. Gibi tortuların bileşiminin kökenini belirlemek için kullanılabilir. [56] Bu kaynakların çoğu, son derece küçük miktarlarda iridyum içerir ve daha önemli bulgular, bilim adamlarını alt tektonik veya dünya dışı kökenli sonuçlara götürür. İridyum, deniz sedimanlarının bazı deniz minerallerinde oksitlenir ve ferromanganezde "deniz suyu oranına" yaklaşan konsantrasyonlarda mineralleşme olasılığı, bir cevher olarak ağır metal değerini arttırır.[55] Bu çökeltilerdeki kurşun veya altına kıyasla iridyum konsantrasyonunun, çökeltilerin karasal ayrışmadan mı, alt tektonik faaliyetlerden mi yoksa kozmik bir kökene mi sahip olduğunun bir göstergesi olduğu bulunmuştur. Örneğin, volkanik ekshalasyon daha yüksek oranda kurşun ve altın içerir, ancak aynı iridyum seviyelerine sahiptir. [57][56] düşük seviyelerde iridyum içeren yüksek altın, kurşun ve platin hidrotermal ekshalasyonun özellikleridir.[56]
Deniz çökeltilerindeki ilginç bir iridyum kaynağı, dünya dışı maddedir ve diğer kozmik elementlerden daha hassas ve uçucu olmaması nedeniyle onu harika bir izleyici yapar.[58] İridyum, çökeltilerde birikmek için Dünya atmosferinde yol alan asteroitler ve göktaşları gibi yıldızlararası maddenin birikme miktarını ölçmek için temel gösterge olarak kullanılmıştır.[59] İridyum, iridyumun kökenini rutenyum veya osmiyum gibi diğer elementlere izotop oranı aracılığıyla tanımlayarak bazı büyük küresel yok oluşlara bağlanabilir.[56] K-T sınır çökeltileri gibi kitlesel yok oluşlarla ilişkili çökelti katmanları, meteorlarda bulunan miktarlara benzeyen iridyum oranı artışları gösterir.[60] Düşük sıcaklıklarda pek iyi anlaşılamayan iridyumun jeokimyasal süreçleri bu miktarları bir dereceye kadar etkileyebilir. Bununla birlikte, bilim adamları, değişikliklerin en yüksek konsantrasyonları görmezden gelmek için yeterince önemli olmayacağı, ancak muhtemelen daha az önemli ani artışların dünya dışı etki aktivitesi konusunda daha az kesin olmasına neden olacağı sonucuna vardı.[60]
Kretase-Paleojen sınır varlığı

Kretase-Paleojen sınırı 66 milyon yıl öncesinin Kretase ve Paleojen dönemleri jeolojik zaman, ince bir tabaka nın-nin iridyum bakımından zengin kil.[61] Liderliğinde bir ekip Luis Alvarez 1980'de bu iridyum için dünya dışı bir köken önerdi ve onu bir asteroit veya kuyruklu yıldız etki.[61] Teorileri, Alvarez hipotezi, artık kuş olmayanların neslinin tükenmesini açıklamak için yaygın olarak kabul edilmektedir. dinozorlar. Yaklaşık 66 milyon yıllık tahmini bir yaşa sahip büyük bir gömülü krater yapısı, daha sonra şu anki Yucatan yarımadası ( Chicxulub krateri ).[62][63] Dewey M. McLean ve diğerleri, iridyumun volkanik bunun yerine menşe, çünkü Dünya çekirdeği iridyum açısından zengindir ve aşağıdaki gibi aktif yanardağlar Piton de la Fournaise adasında Réunion, hala iridyum salmaktadır.[64][65]
Üretim
| Yıl | Tüketim (ton) | Fiyat (Amerikan Doları /ozt )[66] |
|---|---|---|
| 2001 | 2.6 | 415.25 |
| 2002 | 2.5 | 294.62 |
| 2003 | 3.3 | 93.02 |
| 2004 | 3.60 | 185.33 |
| 2005 | 3.86 | 169.51 |
| 2006 | 4.08 | 349.45 |
| 2007 | 3.70 | 444.43 |
| 2008 | 3.10 | 448.34 |
| 2009 | 2.52 | 420.4 |
| 2010 | 10.40 | 642.15 |
2019'da dünya çapında iridyum üretimi 242.000 ons (6860 kg) oldu.[67]
İridyum ayrıca ticari olarak bir yan ürün olarak elde edilir. nikel ve bakır madencilik ve işleme. Sırasında bakırın elektro rafinasyonu ve nikel, gümüş, altın ve altın gibi asil metaller platin grubu metaller Hem de selenyum ve tellür olarak hücrenin dibine yerleşmek anot çamuru, çıkarılmaları için başlangıç noktasını oluşturur.[66] Metalleri ayırmak için önce içeri sokulmaları gerekir. çözüm. Karışımın doğasına bağlı olarak birkaç ayırma yöntemi mevcuttur; iki temsili yöntem ile füzyon sodyum peroksit ardından çözülme aqua regia ve karışım içinde çözünme klor ile hidroklorik asit.[25][53]
Karışım çözüldükten sonra, iridyum diğer platin grubu metallerden çökeltilerek ayrılır. amonyum heksakloroiridat ((NH
4)
2IrCl
6) veya çıkararak IrCl2−
6 organik aminler ile.[68] İlk yöntem, Tennant ve Wollaston'un ayrılması için kullandıkları prosedüre benzer. İkinci yöntem sürekli olarak planlanabilir sıvı-sıvı ekstraksiyonu ve bu nedenle endüstriyel ölçekli üretim için daha uygundur. Her iki durumda da, ürün hidrojen kullanılarak indirgenir, metali bir toz olarak verir veya sünger kullanılarak tedavi edilebilir toz metalurjisi teknikleri.[69][70]
İridyum fiyatları önemli bir aralıkta dalgalandı. Dünya pazarında nispeten küçük bir hacimle (diğer endüstriyel metallerle karşılaştırıldığında) alüminyum veya bakır ), iridyum fiyatı üretimdeki istikrarsızlıklara, talebe, spekülasyon Nadir özelliklere sahip bir madde olarak fiyatı, özellikle modern teknolojideki değişikliklerden etkilenmiştir: 2001 ve 2003 arasındaki kademeli düşüş, endüstriyel büyüme için kullanılan kızılötesi potaların aşırı arzıyla ilişkilendirilmiştir. büyük tek kristaller.[66][71]Aynı şekilde 2010-2014 yılları arasında 1000 USD / ons üzerindeki fiyatlar tek kristal için üretim tesislerinin kurulması ile açıklanmıştır. safir kullanılan LED TV'ler için arka ışıklar.[72]
Başvurular
İridyum talebi, çoğunlukla 0,2 tondan 6 tona yükselen elektronikle ilgili uygulamalar nedeniyle 2009'da 2,5 tondan 2010'da 10,4 tona yükseldi - iridyum potalar yaygın olarak, talebi keskin bir şekilde artan büyük yüksek kaliteli tek kristallerin yetiştirilmesi için kullanılır. İridyum tüketimindeki bu artışın, 2000'li yılların başlarında olduğu gibi, pota stoklarının birikmesi nedeniyle doyacağı tahmin ediliyor. Diğer önemli uygulamalar arasında 2007'de 0,78 ton iridyum tüketen bujiler, kloralkali işlemi (2007'de 1,1 t) ve kimyasal katalizörler (2007'de 0,75 t).[66][73]
Endüstriyel ve tıbbi
3
Yüksek erime noktası, sertlik ve korozyon direnci İridyum ve alaşımları, uygulamalarının çoğunu belirler. İridyum (veya bazen platin alaşımları veya osmiyum) ve çoğunlukla iridyum alaşımlarının düşük aşınma ve örneğin, çok gözenekli düzeler plastik polimer eriyiğinin içinden lifler oluşturmak için ekstrüde edildiği, örneğin suni ipek.[74] Osmiyum-iridyum, pusula rulmanlar ve teraziler için.[75]
Ark erozyonuna karşı dirençleri, iridyum alaşımlarını elektrik kontakları için ideal hale getirir. bujiler,[76][77] ve iridyum bazlı bujiler özellikle havacılıkta kullanılmaktadır.
Saf iridyum son derece kırılgandır ve ısıdan etkilenen bölge çatladığından kaynaklanması zor olacak kadar kırılgandır, ancak küçük miktarlarda ilave edilerek daha sünek hale getirilebilir. titanyum ve zirkonyum (Görünüşe göre her birinin% 0,2'si iyi çalışıyor).[78]
Korozyon ve ısı direnci, iridyumu önemli bir alaşımlama ajanı yapar. Bazı uzun ömürlü uçak motor parçaları iridyum alaşımından ve iridyumdan yapılmıştır.titanyum Alaşım, korozyon direnci nedeniyle derin su borularında kullanılır.[15] İridyum, platin alaşımlarında sertleştirici olarak da kullanılır. Vickers sertliği Saf platin% 56 HV iken,% 50 iridyum içeren platin 500 HV'nin üzerine çıkabilir.[79][80]
Aşırı yüksek sıcaklıklara dayanması gereken cihazlar genellikle iridyumdan yapılır. Örneğin, yüksek sıcaklık potalar iridyumdan yapılmış Czochralski süreci oksit tek kristalleri üretmek için (örneğin safir ) bilgisayar bellek aygıtlarında ve katı hal lazerlerinde kullanım için.[76][81] Gibi kristaller gadolinyum galyum garnet ve itriyum galyum granat, 2100 ° C'ye kadar olan sıcaklıklarda oksitleme koşulları altında önceden sinterlenmiş karışık oksit yüklerinin eritilmesiyle büyütülür.[9]
İridyum bileşikleri şu şekilde kullanılır: katalizörler içinde Cativa süreci için karbonilasyon nın-nin metanol üretmek için asetik asit.[82]
Radyoizotop iridyum-192 endüstriyel kullanım için en önemli iki enerji kaynağından biridir. γ-radyografi için tahribatsız test nın-nin metaller.[83][84] Bunlara ek olarak, 192Ir bir kaynak olarak kullanılır gama radyasyonu kullanarak kanser tedavisi için brakiterapi, tedavi gerektiren alanın içine veya yanına kapalı bir radyoaktif kaynağın yerleştirildiği bir tür radyoterapi. Spesifik tedaviler arasında yüksek doz hızlı prostat brakiterapisi, safra kanalı brakiterapisi ve intrakaviter serviks brakiterapisi bulunur.[15]
Şubat 2019'da tıp bilimcileri, iridyumun albümin, yaratmak ışığa duyarlılaştırılmış molekül, nüfuz edebilir kanser hücreleri ve ışıkla ışınlandıktan sonra (işlem denilen fotodinamik tedavi ), kanser hücrelerini yok edin.[85][86]
İridyum, parçalanması için iyi bir katalizördür. hidrazin (sıcak nitrojen ve amonyağa) ve bu pratikte düşük itmeli roket motorlarında kullanılır; daha fazla ayrıntı var monopropellant roket makale.
İlmi
1889'da% 90 platin ve% 10 iridyum alaşımı, Uluslararası Prototip Ölçer ve kilogram tarafından tutulan kitle Uluslararası Ağırlıklar ve Ölçüler Bürosu yakın Paris.[15] Temel uzunluk biriminin tanımı olarak metre çubuğu, 1960 yılında bir çizgi ile değiştirildi. atomik spektrum nın-nin kripton,[not 3][87] ancak kilogram prototipi uluslararası kütle standardı olarak kaldı 20 Mayıs 2019 tarihine kadar, kilogram açısından yeniden tanımlandığında Planck sabiti.[88]
İridyum, genellikle iletken olmayan malzemeler için, gözlem için hazırlık aşamasında bir kaplama olarak kullanılır. taramalı elektron mikroskopları (SEM). 2-20 nm'lik bir iridyum tabakasının eklenmesi, özellikle organik malzemelerin hayatta kalmasına yardımcı olur elektron ışını hasarı ve azaltır Statik yük SEM ışınının odak noktasının hedef alanı içinde birikme.[89] Bir iridyum kaplaması, aynı zamanda, X-Ray spektrografik kompozisyon analizi için SEM'lerin kullanılması için gerekli olan ikincil elektron emisyonu ile ilişkili sinyal / gürültü oranını da arttırır. Diğer metaller, SEM kullanımı için nesneleri kaplamak için kullanılabilirken, örnekler çok çeşitli görüntüleme parametreleri ile çalışılacağı zaman tercih edilen kaplama iridyumdur.[90]
İridyum, radyoizotop termoelektrik jeneratörler gibi insansız uzay aracının Voyager, Viking, Öncü, Cassini, Galileo, ve Yeni ufuklar. İridyum, plütonyum-238 2000 ° C'ye kadar çalışma sıcaklıklarına dayanabildiğinden ve yüksek mukavemetinden dolayı jeneratörde yakıt.[9]
Diğer bir kullanım, X-ışını optikleri, özellikle X-ışını teleskopları ile ilgilidir.[91] Aynaları Chandra X-ray Gözlemevi 60 iridyum tabakası ile kaplanmıştırnm kalın. Nikel, altın ve platin de test edildikten sonra iridyumun X-ışınlarını yansıtmak için en iyi seçim olduğu kanıtlandı. Birkaç atom içinde pürüzsüz olması gereken iridyum tabakası, iridyum buharı altında biriktirilerek uygulandı. yüksek vakum taban katmanında krom.[92]
İridyum kullanılır parçacık fiziği üretimi için antiprotonlar, bir çeşit antimadde. Antiprotonlar, yüksek yoğunluklu bir proton ışınının bir dönüşüm hedefiçok yüksek yoğunluklu bir malzemeden yapılması gereken. olmasına rağmen tungsten bunun yerine kullanılabilir, iridyum altında daha iyi stabilite avantajı vardır. şok dalgaları gelen ışın nedeniyle sıcaklık artışından kaynaklanır.[93]

Karbon-hidrojen bağı aktivasyonu (C – H aktivasyonu) parçalanan reaksiyonlar üzerine bir araştırma alanıdır. karbon-hidrojen bağları geleneksel olarak tepkisiz olarak kabul edilirdi. İlk rapor edilen C-H bağlarını doymuş hidrokarbonlar, 1982'de yayınlanan, organometalik iridyum kompleksleri kullandı. oksidatif ekleme hidrokarbon ile.[94][95]
İridyum kompleksleri için katalizör olarak araştırılmaktadır. asimetrik hidrojenasyon. Bu katalizörler, sentezinde kullanılmıştır. doğal ürünler ve işlevsiz alkenler gibi belirli zor substratları enantiyoseçici olarak hidrojene edebilir (iki olası iki maddeden sadece birini üretir) enantiyomerler ).[96][97]
İridyum çeşitli oluşturur kompleksler Üçlü hasatta temel ilgi alanı.[98][99][100]
Tarihi

İridyum-osmiyum alaşımları, dolma kalem uç ipuçları. İridyumun ilk büyük kullanımı 1834'te altın üzerine monte edilmiş uçlarda oldu.[9] 1944'ten beri ünlü Parker 51 dolmakaleme rutenyum ve iridyum alaşımından (% 3,8 iridyum ile) uçlu bir uç takıldı. Modern dolmakalemlerdeki uç malzemesi hala geleneksel olarak "iridyum" olarak adlandırılır, ancak içinde nadiren iridyum bulunur; gibi diğer metaller rutenyum, osmiyum, ve tungsten onun yerini almıştır.[101]
İridyum-platin alaşımı dokunma delikleri veya parçalarını havalandırın top. Bir rapora göre 1867 Paris Sergisi sergilenen parçalardan biri Johnson ve Matthey "bir Withworth silahında 3000'den fazla mermi kullanılıyor ve henüz neredeyse hiç aşınma belirtisi göstermiyor. Aktif hizmette topun havalandırma parçalarının aşınmasının neden olduğu sürekli sorun ve masrafı bilenler, takdir edeceklerdir. bu önemli adaptasyon ".[102]
Pigment iridyum siyahÇok ince bölünmüş iridyumdan oluşan, boyama için kullanılır porselen yoğun siyah; "diğer tüm porselen siyah renklerinin yanında gri göründüğü" deniyordu.[103]
Önlemler
Dökme metalik formdaki iridyum, dokularla reaksiyona girmemesi nedeniyle biyolojik olarak önemli veya sağlığa zararlı değildir; sadece 20 civarındatrilyonda parça insan dokusunda iridyum.[15] Çoğu metal gibi, ince bölünmüş iridyum tozu da tahriş edici olduğundan ve havada tutuşabileceğinden kullanımı tehlikeli olabilir.[53] İridyum bileşiklerinin toksisitesi hakkında çok az şey bilinmektedir, çünkü birincil olarak çok az kişinin onunla temasa geçmesi ve çok az miktarlarda temas kurması için nadiren kullanılmasıdır. Bununla birlikte, iridyum halojenürler gibi çözünür tuzlar, iridyum dışındaki elementlerden veya iridyumun kendisinden dolayı tehlikeli olabilir.[31] Aynı zamanda, çoğu iridyum bileşiği çözünmezdir ve bu da vücuda emilimi zorlaştırır.[15]
İridyumun bir radyoizotopu, 192
Ir, diğer radyoaktif izotoplar gibi tehlikelidir. İridyumla ilgili bildirilen tek yaralanma, kazara radyasyona maruz kalma ile ilgilidir. 192
Ir kullanılan brakiterapi.[31] Yüksek enerjili gama radyasyonu 192
Ir kanser riskini artırabilir. Dış maruz kalma yanıklara neden olabilir, radyasyon zehirlenmesi, ve ölüm. Yutulması 192Ir, mide ve bağırsakların iç yüzeylerini yakabilir.[104] 192Ir, 192 milyonIr ve 194 milyonPara yatırma eğilimindeyim karaciğer ve her ikisinden de sağlık tehlikesi oluşturabilir gama ve beta radyasyon.[46]
Notlar
- ^ İridyumun en yaygın oksidasyon durumları kalın yazılmıştır. Sağdaki sütun, her oksidasyon durumu için bir temsili bileşiği listeler.
- ^ İridyum kelimenin tam anlamıyla "gökkuşakları" anlamına gelir.
- ^ Sayacın tanımı 1983'te yeniden değiştirildi. Şu anda sayaç, ışığın bir zaman aralığında vakumda kat ettiği mesafe olarak tanımlanıyor.1⁄299,792,458 bir saniyenin.
Referanslar
- ^ Meija, Juris; et al. (2016). "Elementlerin atom ağırlıkları 2013 (IUPAC Teknik Raporu)". Saf ve Uygulamalı Kimya. 88 (3): 265–91. doi:10.1515 / pac-2015-0305.
- ^ a b c Wang, Guanjun; Zhou, Mingfei; Goettel, James T .; Schrobilgen, Gary G .; Su, Jing; Li, Haz; Schlöder, Tobias; Riedel Sebastian (2014). "Biçimsel oksidasyon durumu IX olan iridyum içeren bir bileşiğin tanımlanması". Doğa. 514 (7523): 475–477. Bibcode:2014Natur.514..475W. doi:10.1038 / nature13795. PMID 25341786. S2CID 4463905.
- ^ Lide, D. R., ed. (2005). "Elementlerin ve inorganik bileşiklerin manyetik duyarlılığı". CRC El Kitabı Kimya ve Fizik (PDF) (86. baskı). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Kimya ve Fizik El Kitabı. Boca Raton, Florida: Chemical Rubber Company Publishing. s. E110. ISBN 0-8493-0464-4.
- ^ "Periyodik Tablodaki En Yoğun Element Nedir?".
- ^ "Osmiyum ve İridyum Yoğunlukları".
- ^ Becker, Luann (2002). "Tekrarlanan Darbeler" (PDF). Bilimsel amerikalı. 286 (3): 77–83. Bibcode:2002SciAm.286c..76B. doi:10.1038 / bilimselamerican0302-76. PMID 11857903. Alındı 19 Ocak 2016.
- ^ a b c d e f g h ben j k l m n Greenwood, N. N .; Earnshaw, A. (1997). Elementlerin Kimyası (2. baskı). Oxford: Butterworth – Heinemann. sayfa 1113–1143, 1294. ISBN 978-0-7506-3365-9. OCLC 213025882.
- ^ a b c d e f g h ben j k l m n Ö Hunt, L. B. (1987). "İridyum Tarihi" (PDF). Platin Metal İnceleme. 31 (1): 32–41.
- ^ Kittel, C. (2004). Katıhal Fiziğine Giriş (7. baskı). Wiley-Hindistan. ISBN 978-81-265-1045-0.
- ^ Arblaster, J.W. (1995). "Osmium, Bilinen En Yoğun Metal". Platin Metal İnceleme. 39 (4): 164. Arşivlenen orijinal 2011-09-27 tarihinde. Alındı 2008-10-02.
- ^ Cotton, Simon (1997). Değerli Metallerin Kimyası. Springer-Verlag New York, LLC. s. 78. ISBN 978-0-7514-0413-5.
- ^ Lide, D.R. (1990). CRC El Kitabı Kimya ve Fizik (70. baskı). Boca Raton (FL): CRC Press.
- ^ Arblaster, J.W. (1989). "Osmiyum ve iridyum yoğunlukları: en son kristalografik verilerin gözden geçirilmesine dayalı yeniden hesaplamalar" (PDF). Platin Metal İnceleme. 33 (1): 14–16.
- ^ a b c d e f g h ben j Emsley, J. (2003). "İridyum". Doğanın Yapı Taşları: Elementlere A'dan Z'ye Bir Rehber. Oxford, İngiltere, İngiltere: Oxford University Press. pp.201–204. ISBN 978-0-19-850340-8.
- ^ Emsley, John (2011). Doğanın Yapı Taşları: Elementlere A-Z Rehberi (Yeni baskı). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ a b Perry, D.L. (1995). İnorganik Bileşikler El Kitabı. CRC Basın. s. 203–204. ISBN 978-1439814611.
- ^ Lagowski, J. J., ed. (2004). Kimya Temelleri ve Uygulamaları. 2. Thomson Gale. pp.250–251. ISBN 978-0028657233.
- ^ Munson, Ronald A. (Şubat 1968). "İridyum disülfür ve pirit yapısına sahip nikel diarsenit sentezi" (PDF). İnorganik kimya. 7 (2): 389–390. doi:10.1021 / ic50060a047.
- ^ Jung, D .; Demazeau, Gérard (1995). "Yüksek Oksijen Basıncı ve Perovskit Yapılı Yeni İridyum (VI) Oksitlerin Hazırlanması: Sr
2MIrO
6 (M = Ca, Mg) ". Katı Hal Kimyası Dergisi. 115 (2): 447–455. Bibcode:1995JSSCh.115..447J. doi:10.1006 / jssc.1995.1158. - ^ Gong, Y .; Zhou, M .; Kaupp, M .; Riedel, S. (2009). "Oksidasyon Durumunda İridyum ile İridyum Tetroksit Molekülünün Oluşumu ve Karakterizasyonu + VIII". Angewandte Chemie Uluslararası Sürümü. 48 (42): 7879–7883. doi:10.1002 / anie.200902733. PMID 19593837.
- ^ Gulliver, D. J .; Levason, W. (1982). "Yüksek oksidasyon durumlarında rutenyum, osmiyum, rodyum, iridyum, paladyum ve platin kimyası". Koordinasyon Kimyası İncelemeleri. 46: 1–127. doi:10.1016/0010-8545(82)85001-7.
- ^ Holleman, A. F .; Wiberg, E .; Wiberg, N. (2001). İnorganik kimya (1. baskı). Akademik Basın. ISBN 978-0-12-352651-9. OCLC 47901436.
- ^ Černý, R .; Joubert, J.-M .; Kohlmann, H .; Yvon, K. (2002). "Mg
6Ir
2H
11eyer benzeri içeren yeni bir metal hidrit IrH5−
4 ve kare piramidal IrH4−
5 hidrido kompleksleri ". Alaşım ve Bileşikler Dergisi. 340 (1–2): 180–188. doi:10.1016 / S0925-8388 (02) 00050-6. - ^ a b c d e Renner, H .; Schlamp, G .; Kleinwächter, I .; Drost, E .; Lüschow, H. M .; Tews, P .; Panster, P .; Diehl, M .; et al. (2002). "Platin grubu metaller ve bileşikler". Ullmann'ın Endüstriyel Kimya Ansiklopedisi. Wiley. doi:10.1002 / 14356007.a21_075. ISBN 978-3527306732.
- ^ Vaska, L.; DiLuzio, J.W. (1961). "Alkollerle Tepkime Yoluyla İridyumun Karbonil ve Hidrido-Karbonil Kompleksleri. Asitle Tepkime Yoluyla Hidrido Kompleksleri". Amerikan Kimya Derneği Dergisi. 83 (12): 2784–2785. doi:10.1021 / ja01473a054.
- ^ Crabtree, R. H. (1979). "Katalizdeki iridyum bileşikleri". Kimyasal Araştırma Hesapları. 12 (9): 331–337. doi:10.1021 / ar50141a005.
- ^ Crabtree, R. H. (2005). Geçiş Metallerinin Organometalik Kimyası (PDF). Wiley. ISBN 978-0471662563. OCLC 224478241. Arşivlenen orijinal (PDF) 2012-11-19 tarihinde.
- ^ Araştırma ve Geliştirme Arşivlendi 2013-11-11 de Wayback Makinesi. furuyametals.co.jp
- ^ a b c d e Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "SonraUBASE nükleer ve bozunma özelliklerinin değerlendirilmesi ", Nükleer Fizik A, 729: 3–128, Bibcode:2003NuPhA.729 .... 3A, doi:10.1016 / j.nuclphysa.2003.11.001
- ^ a b c Mager Stellman, J. (1998). "İridyum". İş Sağlığı ve Güvenliği Ansiklopedisi. Uluslararası Çalışma Örgütü. pp.63.19. ISBN 978-92-2-109816-4. OCLC 35279504.
- ^ Robinson, R .; Thoennessen, M. (2012). "Tantal, renyum, osmiyum ve iridyum izotoplarının keşfi". Atomik Veri ve Nükleer Veri Tabloları. 98 (5): 911–932. arXiv:1109.0526. Bibcode:2012ADNDT..98..911R. doi:10.1016 / j.adt.2011.09.003. S2CID 53992437.
- ^ a b Chereminisoff, N. P. (1990). Seramik ve Kompozit El Kitabı. CRC Basın. s. 424. ISBN 978-0-8247-8006-7.
- ^ Ogden, J.M. (1976). "Mısır Altın İşçiliğinde Sözde 'Platin' Kapanışlar". Mısır Arkeolojisi Dergisi. 62: 138–144. doi:10.2307/3856354. JSTOR 3856354.
- ^ Chaston, J.C. (1980). "Platinin Toz Metalurjisi" (PDF). Platin Metaller Rev. 24 (21): 70–79.
- ^ McDonald, M. (1959). "Yeni Granada'nın Platini: İspanyol Sömürge İmparatorluğu'nda Madencilik ve Metalurji". Platin Metal İnceleme. 3 (4): 140–145.
- ^ Juan, J .; de Ulloa, A. (1748). Relación histórica del viage a la América Meridional (ispanyolca'da). 1. s. 606.
- ^ Thomson, T. (1831). İnorganik Cisimlerin Kimyası Sistemi. Baldwin & Cradock, Londra; ve William Blackwood, Edinburgh. s.693.
- ^ a b Griffith, W. P. (2004). "Dört Platin Grubu Metalin İki Yüzüncü Yılı. Bölüm II: Osmium ve iridyum - keşiflerini çevreleyen olaylar". Platin Metal İnceleme. 48 (4): 182–189. doi:10.1595 / 147106704x4844.
- ^ Haftalar, M.E. (1968). Elementlerin Keşfi (7. baskı). Kimya Eğitimi Dergisi. pp.414–418. ISBN 978-0-8486-8579-9. OCLC 23991202.
- ^ Tennant, S. (1804). "Platina Çözeltisinden Sonra Kalan Siyah Tozda Bulunan İki Metal Üzerinde". Londra Kraliyet Cemiyeti'nin Felsefi İşlemleri. 94: 411–418. doi:10.1098 / rstl.1804.0018. JSTOR 107152.
- ^ Trigg, G.L. (1995). Yirminci Yüzyıl Fiziğinde Dönüm Noktası Deneyleri. Courier Dover Yayınları. s. 179–190. ISBN 978-0-486-28526-9. OCLC 31409781.
- ^ Mössbauer, R.L. (1958). "Gammastrahlung in Ir191". Zeitschrift für Physik A (Almanca'da). 151 (2): 124–143. Bibcode:1958ZPhy. 151..124M. doi:10.1007 / BF01344210. S2CID 121129342.
- ^ Waller, I. (1964). "1961 Nobel Fizik Ödülü: sunum konuşması". Nobel Dersleri, Fizik 1942–1962. Elsevier.
- ^ Scott, E.R.D .; Wasson, J. T .; Buchwald, V.F (1973). "Demir göktaşlarının kimyasal sınıflandırması - VII. Ge konsantrasyonları 25 ile 80 ppm arasında olan demirlerin yeniden incelenmesi". Geochimica et Cosmochimica Açta. 37 (8): 1957–1983. Bibcode:1973GeCoA..37.1957S. doi:10.1016/0016-7037(73)90151-8.
- ^ a b "İridyum" (PDF). İnsan Sağlığı Bilgi Sayfası. Argonne Ulusal Laboratuvarı. 2005. Arşivlenen orijinal (PDF) 4 Mart 2012. Alındı 2008-09-20.
- ^ Xiao, Z .; Laplante, A.R. (2004). "Platin grubu minerallerinin karakterizasyonu ve geri kazanımı - bir inceleme". Mineral Mühendisliği. 17 (9–10): 961–979. doi:10.1016 / j.mineng.2004.04.001.
- ^ "Irarsite: Mineral bilgileri, verileri ve yerleri". www.mindat.org.
- ^ "İridyum: İridyumun mineralojisi". www.mindat.org.
- ^ "Uluslararası Mineraloji Derneği - Yeni Mineraller, İsimlendirme ve Sınıflandırma Komisyonu". nrmima.nrm.se. Arşivlenen orijinal 2019-08-10 tarihinde. Alındı 2018-10-06.
- ^ http://www.handbookofmineralogy.org/pdfs/cuproiridsite.pdf
- ^ https://www.fmm.ru/images/8/89/NDM_2010_45_Stepanov_eng.pdf
- ^ a b c d Seymour, R. J.; O'Farrelly, J. I. (2001). "Platinum-group metals". Kirk Othmer Kimyasal Teknoloji Ansiklopedisi. Wiley. doi:10.1002/0471238961.1612012019052513.a01.pub2. ISBN 978-0471238966.
- ^ a b c Wells, Boothe (1988). "Iridium in marine organisms". Geochimica et Cosmochimica Açta. 52 (6): 1737–1739. Bibcode:1988GeCoA..52.1737W. doi:10.1016/0016-7037(88)90242-6.
- ^ a b Goldberg, Hodge; Kay, V; Stallard, M; Koide, M (1986). "Some comparative marine chemistries of platinum and iridium". Uygulamalı Jeokimya. 1 (2): 227–232. Bibcode:1986ApGC....1..227G. doi:10.1016/0883-2927(86)90006-5.
- ^ a b c d e Sawlowicz, Z (1993). "Iridium and other platinum-group elements as geochemical markers in sedimentary environments". Paleocoğrafya, Paleoklimatoloji, Paleoekoloji. 104 (4): 253–270. Bibcode:1993PPP...104..253S. doi:10.1016/0031-0182(93)90136-7.
- ^ Crocket, Macdougall; Harriss, R (1973). "Gold, palladium and iridium in marine sediments". Geochimica et Cosmochimica Açta. 37 (12): 2547–2556. Bibcode:1973GeCoA..37.2547C. doi:10.1016/0016-7037(73)90264-0.
- ^ Peucker-Ehrenbrink, B (2001). "Iridium and Osmium as Tracers of Extraterrestrial Matter in Marine Sediments". Accretion of Extraterrestrial Matter Throughout Earth's History: 163–178. doi:10.1007/978-1-4419-8694-8_10. ISBN 978-1-4613-4668-5.
- ^ Barker, J; Edward, A (1968). "Accretion rate of cosmic matter from iridium and osmium contents of deep-sea sediments". Geochimica et Cosmochimica Açta. 32 (6): 627–645. Bibcode:1968GeCoA..32..627B. doi:10.1016/0016-7037(68)90053-7.
- ^ a b Colodner, D; Edmond, J (1992). "Post-depositional mobility of platinum, iridium and rhenium in marine sediments". Doğa. 358 (6385): 402–404. Bibcode:1992Natur.358..402C. doi:10.1038/358402a0. S2CID 37386975.
- ^ a b Alvarez, L. W.; Alvarez, W .; Asaro, F .; Michel, H. V. (1980). "Extraterrestrial cause for the Cretaceous–Tertiary extinction" (PDF). Bilim. 208 (4448): 1095–1108. Bibcode:1980Sci ... 208.1095A. CiteSeerX 10.1.1.126.8496. doi:10.1126 / science.208.4448.1095. PMID 17783054. S2CID 16017767.
- ^ Hildebrand, A. R .; Penfield, Glen T .; Kring, David A .; Pilkington, Mark; Zanoguera, Antonio Camargo; Jacobsen, Stein B.; Boynton, William V. (1991). "Chicxulub Crater; a possible Cretaceous/Tertiary boundary impact crater on the Yucatan Peninsula, Mexico". Jeoloji. 19 (9): 867–871. Bibcode:1991Geo .... 19..867H. doi:10.1130 / 0091-7613 (1991) 019 <0867: CCAPCT> 2.3.CO; 2.
- ^ Frankel, C. (1999). The End of the Dinosaurs: Chicxulub Crater and Mass Extinctions. Cambridge University Press. ISBN 978-0-521-47447-4. OCLC 40298401.
- ^ Ryder, G.; Fastovsky, D. E .; Gartner, S. (1996). Dünya Tarihindeki Kretase-Üçüncül Olay ve Diğer Felaketler. Amerika Jeoloji Derneği. s. 47. ISBN 978-0-8137-2307-5.
- ^ Toutain, J.-P.; Meyer, G. (1989). "Iridium-Bearing Sublimates at a Hot-Spot Volcano (Piton De La Fournaise, Indian Ocean)". Jeofizik Araştırma Mektupları. 16 (12): 1391–1394. Bibcode:1989GeoRL..16.1391T. doi:10.1029/GL016i012p01391.
- ^ a b c d Platinum-Group Metals. ABD Jeolojik Etüt Maden Emtia Özetleri
- ^ "Iridium demand worldwide 2019".
- ^ Gilchrist, Raleigh (1943). "Platin Metaller". Kimyasal İncelemeler. 32 (3): 277–372. doi:10.1021/cr60103a002.
- ^ Ohriner, E. K. (2008). "Processing of Iridium and Iridium Alloys". Platin Metal İnceleme. 52 (3): 186–197. doi:10.1595/147106708X333827.
- ^ Hunt, L. B .; Kol, F.M. (1969). "Platin Metaller: Üretken Kaynakların Endüstriyel Kullanımlara Yönelik Bir Anketi" (PDF). Platin Metal İnceleme. 13 (4): 126–138.
- ^ Hagelüken, C. (2006). "Markets for the catalysts metals platinum, palladium, and rhodium" (PDF). Metall. 60 (1–2): 31–42. Arşivlenen orijinal (PDF) 4 Mart 2009.
- ^ "Platinum 2013 Interim Review" (PDF). Platinum Today. Johnson Matthey Plc. Alındı 2014-01-10.
- ^ Jollie, D. (2008). "Platinum 2008" (PDF). Platin. Johnson Matthey. ISSN 0268-7305. Alındı 2008-10-13.
- ^ Egorova, R. V.; Korotkov, B. V.; Yaroshchuk, E. G.; Mirkus, K. A.; Dorofeev N. A.; Serkov, A. T. (1979). "Spinnerets for viscose rayon cord yarn". Fibre Chemistry. 10 (4): 377–378. doi:10.1007/BF00543390. S2CID 135705244.
- ^ Emsley, J. (2005-01-18). "Iridium" (PDF). Visual Elements Periodic Table. Kraliyet Kimya Derneği. Alındı 2008-09-17.
- ^ a b Handley, J. R. (1986). "Increasing Applications for Iridium" (PDF). Platin Metal İnceleme. 30 (1): 12–13.
- ^ Stallforth, H.; Revell, P. A. (2000). Euromat 99. Wiley-VCH. ISBN 978-3-527-30124-9.
- ^ US 3293031A, Cresswell, Peter & Rhys, David, published 20/12/1966
- ^ Darling, A. S. (1960). "Iridium Platinum Alloys" (PDF). Platin Metal İnceleme. 4 (l): 18–26. Bibcode:1960Natur.186Q.211.. doi:10.1038/186211a0. S2CID 4211238. Alındı 2008-10-13.
- ^ Biggs, T.; Taylor, S. S.; van der Lingen, E. (2005). "The Hardening of Platinum Alloys for Potential Jewellery Application". Platin Metal İnceleme. 49 (1): 2–15. doi:10.1595/147106705X24409.
- ^ Crookes, W. (1908). "On the Use of Iridium Crucibles in Chemical Operations". Londra Kraliyet Cemiyeti Bildirileri. Series A, Containing Papers of a Mathematical and Physical Character. 80 (541): 535–536. Bibcode:1908RSPSA..80..535C. doi:10.1098/rspa.1908.0046. JSTOR 93031.
- ^ Cheung, H.; Tanke, R. S.; Torrence, G. P. (2000). "Acetic acid". Ullmann'ın Endüstriyel Kimya Ansiklopedisi. Wiley. doi:10.1002 / 14356007.a01_045. ISBN 978-3527306732.
- ^ Halmshaw, R. (1954). "The use and scope of Iridium 192 for the radiography of steel". British Journal of Applied Physics. 5 (7): 238–243. Bibcode:1954BJAP....5..238H. doi:10.1088/0508-3443/5/7/302.
- ^ Hellier, Chuck (2001). Handbook of Nondestructive Evlaluation. McGraw-Hill Şirketleri. ISBN 978-0-07-028121-9.
- ^ Warwick Üniversitesi (3 Şubat 2019). "Dinozor metal bileşiğinin üzerine parlayan ışık kanser hücrelerini öldürür". EurekAlert!. Alındı 3 Şubat 2019.
- ^ Zhang, Pingyu; et al. (2019). "Fotodinamik Kanser Tedavisi için Nucleus-Targeted Organoiridium-Albumin Konjugatı". Angewandte Chemie. 58 (8): 2350–2354. doi:10.1002 / anie.201813002. PMC 6468315. PMID 30552796.
- ^ Penzes, W. B. (2001). "Sayacın Tanımı için Zaman Çizelgesi". Ulusal Standartlar ve Teknoloji Enstitüsü. Alındı 2008-09-16.
- ^ General section citations: Recalibration of the U.S. National Prototype Kilogram, R. S. Davis, Journal of Research of the National Bureau of Standards, 90, 4 numara, Temmuz Ağustos 1985 (5.5 MB PDF Arşivlendi 2017-02-01 de Wayback Makinesi ); ve The Kilogram and Measurements of Mass and Force, Z. J. Jabbour et al., J. Res. Natl. Inst. Ayakta durmak. Technol. 106, 2001, 25–46 (3.5 MB PDF )
- ^ Höflinger, Gisela (2013-08-28). "Brief Introduction to Coating Technology for Electron Microscopy". Leica Microsystems. Leica Microsystems. Alındı 22 Nisan 2019.
- ^ Abdullah, S. Z.; Bérubé, Pierre R.; Horne, D.J. (2014). "SEM imaging of membranes: Importance of sample preparation and imaging parameters". Membran Bilimi Dergisi. 463: 113–125. doi:10.1016/j.memsci.2014.03.048.
- ^ Ziegler, E.; Hignette, O.; Morawe, Ch.; Tucoulou, R. (2001). "High-efficiency tunable X-ray focusing optics using mirrors and laterally-graded multilayers". Fizik Araştırmalarında Nükleer Aletler ve Yöntemler Bölüm A: Hızlandırıcılar, Spektrometreler, Detektörler ve İlgili Ekipmanlar. 467–468 (2002): 954–957. Bibcode:2001NIMPA.467..954Z. doi:10.1016/S0168-9002(01)00533-2.
- ^ "Face-to-Face with Jerry Johnston, CXC Program Manager & Bob Hahn, Chief Engineer at Optical Coating Laboratories, Inc., Santa Rosa, CA". Harvard-Smithsonian Center for Astrophysics; Chandra X-ray Center. 1995. Alındı 2008-09-24.
- ^ Möhl, D. (1997). "Production of low-energy antiprotons". Zeitschrift Hyperfine Interactions. 109 (1–4): 33–41. Bibcode:1997HyInt.109...33M. doi:10.1023/A:1012680728257. S2CID 118043983.
- ^ a b Janowicz, A. H.; Bergman, R. G. (1982). "Carbon-hydrogen activation in completely saturated hydrocarbons: direct observation of M + R-H → M(R)(H)". Amerikan Kimya Derneği Dergisi. 104 (1): 352–354. doi:10.1021 / ja00365a091.
- ^ a b Hoyano, J. K.; Graham, W. A. G. (1982). "Oxidative addition of the carbon-hydrogen bonds of neopentane and cyclohexane to a photochemically generated iridium(I) complex". Amerikan Kimya Derneği Dergisi. 104 (13): 3723–3725. doi:10.1021 / ja00377a032.
- ^ Källström, K; Munslow, I; Andersson, P G (2006). "Ir-catalysed asymmetric hydrogenation: Ligands, substrates and mechanism". Kimya: Bir Avrupa Dergisi. 12 (12): 3194–3200. doi:10.1002/chem.200500755. PMID 16304642.
- ^ Roseblade, S. J.; Pfaltz, A. (2007). "Iridium-catalyzed asymmetric hydrogenation of olefins". Kimyasal Araştırma Hesapları. 40 (12): 1402–1411. doi:10.1021/ar700113g. PMID 17672517.
- ^ Wang, X .; Andersson, M. R.; Thompson, M.E .; Inganäsa, O. (2004). "Electrophosphorescence from substituted poly(thiophene) doped with iridium or platinum complex". İnce Katı Filmler. 468 (1–2): 226–233. Bibcode:2004TSF...468..226W. doi:10.1016/j.tsf.2004.05.095.
- ^ Tonzetich, Zachary J. (2002). "Organic Light Emitting Diodes—Developing Chemicals to Light the Future" (PDF). Lisans Araştırma Dergisi. Rochester University. 1 (1). Alındı 2008-10-10.
- ^ Holder, E.; Langefeld, B. M. W.; Schubert, U. S. (2005-04-25). "New Trends in the Use of Transition Metal-Ligand Complexes for Applications in Electroluminescent Devices". Gelişmiş Malzemeler. 17 (9): 1109–1121. doi:10.1002/adma.200400284.
- ^ Mottishaw, J. (1999). "Notes from the Nib Works—Where's the Iridium?". PENnant. XIII (2).
- ^ Crookes, W., ed. (1867). "The Paris Exhibition". The Chemical News ve Journal of Physical Science. XV: 182.
- ^ Pepper, J. H. (1861). The Playbook of Metals: Including Personal Narratives of Visits to Coal, Lead, Copper, and Tin Mines, with a Large Number of Interesting Experiments Relating to Alchemy and the Chemistry of the Fifty Metallic Elements. Routledge, Warne ve Routledge. s.455.
- ^ "Radioisotope Brief: Iridium-192 (Ir-192)" (PDF). Radiation Emergencies. Hastalık Kontrol ve Önleme Merkezleri. 2004-08-18. Alındı 2008-09-20.
Dış bağlantılar
- İridyum -de Periyodik Video Tablosu (Nottingham Üniversitesi)
- Iridium in Encyclopædia Britannica