Bcr-Abl tirozin kinaz inhibitörü - Bcr-Abl tyrosine-kinase inhibitor - Wikipedia
Bu makalenin olması gerekiyor güncellenmiş. (Ocak 2017) |
Bcr-Abl tirozin kinaz inhibitörleri (TKI) birinci basamak tedavi çoğu hasta için Kronik miyelojen lösemi (CML). KML vakalarının% 90'ından fazlası, sözde bir oluşumla sonuçlanan bir kromozomal anormallikten kaynaklanmaktadır. Philadelphia kromozomu. Bu anormallik, 1960 yılında Peter Nowell tarafından keşfedildi.[1] ve Abelson arasındaki füzyonun bir sonucudur (Abl ) tirozin kinaz geni kromozom 9 ve kırılma noktası kümesi (Bcr ) içindeki gen kromozom 22, kimerik ile sonuçlanır onkojen (Bcr-Abl ) ve yapısal olarak aktif bir Bcr-Abl tirozin kinaz, patogenez CML. Tirozin kinazı seçici olarak inhibe etmek için bileşikler geliştirilmiştir.
2001'den önce ABD Gıda ve İlaç İdaresi (FDA) onayı imatinib, KML'nin doğal ilerleyişini değiştirecek hiçbir ilaç mevcut değildi. Sadece sitotoksik gibi ilaçlar Busulfan, hidroksiüre veya interferon -alfa (rIFN-a) kullanılmıştır. İlk Bcr-Abl TK inhibitörü, kanseri tedavi etmek için "sihirli mermi" olarak adlandırılmış olsa da ZAMAN dergisi, ikinci nesil Bcr-Abl TKI sonradan ilk direnç ortaya çıktı.[2]
Yeni direniş biçimleri şu şekilde ortaya çıkabilir: yanlış mutasyonlar Abl kinaz içinde alan adı, Bcr-Abl'nin aşırı ifadesi, transmembran üretiminin artması plazma proteinleri veya aşağıdaki gibi aşağı akış sinyalleme moleküllerinin yapıcı aktivasyonu Src ailesi kinazlar.[kaynak belirtilmeli ]
Tarih
KML'nin iyi tanımlanmış bir moleküler hedefi ve bu hedefi hedefleyen görece seçici tedavileri vardır, kanserlerin çoğu için geçerli değildir ve kemoterapiler bugün.[3] Bcr-Abl, uyuşturucu için oldukça çekici bir hedef olarak görülüyordu müdahale Bcr-Abl'den beri füzyon geni yapısal olarak aktive edilmiş bir kinazı kodlar. Tek bir kinazın ATP bağlanma bölgesini spesifik olarak hedefleyen ilaç keşfi, oldukça zorlu bir görev olarak kabul edildi çünkü bu çalışmada yüzlerce protein kinaz biliniyordu. insan genomu.[4] TKI varlığında ATP'nin bağlanması bloke edilir, fosforilasyon engellenir ve Bcr-Abl ifade eden hücreler ya seçici bir büyüme dezavantajına sahiptir ya da apoptotik hücre ölümü.[5][6]
İmatinibe karşı artan direnç ve hoşgörüsüzlük nedeniyle, Bcr-Abl tirozin kinazı inhibe edebilecek yeni ilaçlar geliştirmek için çabalar gösterildi. Bu, ikinci nesil ilaçların keşfedilmesine yol açtı. İmatinib geliştirmek için ilaç taraması kullanılırken, ikinci nesil TKİ'ler akılcı ilaç tasarımı artan bilgi nedeniyle yaklaşım yapısal biyoloji Bcr-Abl tirozin kinaz.[7]
Birinci nesil
İmatinib (STI571)
Imatinib (Gleevec) 1992'de keşfedildi[8] ve CML tedavisinde kullanılan ilk Bcr-Abl tirozin kinaz inhibitörü olduğu için birinci nesil ilaç olarak kabul edilmektedir.
Geliştirme

İmatinibin geliştirilmesinde, yapı Bcr-Abl tirozin kinaz, bilinmediği için sınırlı bir rol oynadı.[7] Bir yüksek verimli tarama kimyasal kitaplıkların Novartis adı verilen bir başlangıç molekülünü tanımlamak için yapıldı pirimidin A. Bu bileşik, kurşun bileşik ve daha sonra imatinib geliştirmek için test edildi ve değiştirildi.[9] Yerine imidazol bir benzamido grubu olan grup, bileşiğin özgüllüğü artarken, aktivite bir kinaz inhibitörü olarak aynı kaldı. Daha sonra, bir metil alt başlık eklemek orto pirimidinil-amino grubu, güç.[4]
Bağlayıcı

O zamandan beri kristalografik çalışmalar imatinibin kinaza bağlandığını ortaya çıkarmıştır. alan adı Abl'nin yalnızca alan etkin olmayan veya "kapalı" konformasyonu benimsediğinde.[10]Burası glisin zengini P bağlayıcı fosfat döngüsü (P-döngü) kıvrımlar ATP bağlanma bölgesi ve aktivasyon döngüsü, substrat bağlanma alanını tıkadığı ve enzimin katalitik aktivitesini bloke etmek için ATP fosfat bağlanma bölgesini bozduğu bir konformasyonu benimser.[11] Asp'nin değişimiPheGly N-terminal ucundaki triad aktivasyon döngüsü inhibitörler tarafından kullanılabilen bir bağlanma cebinin açığa çıkmasına neden olur.[12]
Imatinib, Abl alanına altı aracılığıyla bağlanır hidrojen bağı etkileşimler. Bu stabilize eder imatinib Bcr-Abl kompleksi ve ATP'nin bağlanma bölgesine ulaşmasını engeller.[4][8][10] Hidrojen bağları şunları içerir: piridin -N ve omurga -NH / Tanışmak -318, aminopirimidin ve yan zincir hidroksil nın-nin Thr -315, amid-NH ve yan zincir karboksilat nın-nin Glu -286, karbonil ve omurga-NH Asp -381, protonlanmış metilpiperazin omurga-karbonil atomları ile Ile -360 ve Onun -361. Ek olarak, bir dizi van der Waals etkileşimler bağlanmaya katkıda bulunur.[8] Bir hidrofobik cep şundan oluşur amino asit Ile-293 kalıntıları, Leu -298, Leu-354 ve Val -379 fenil halkası çevresinde piperazinil imatinibin -metil grubu.[10] Keşfedildiği sırada, yapısal bilginin yokluğunda, imatinibin etkileyici seçiciliği için net bir açıklama bulunamadı.[6]
Birinci nesil tedavinin KML hastalarında son derece yüksek bir yanıt oranı ve düşük bir nüks oranı elde etmesine rağmen, bazı hastalar direnç yaşar veya hoşgörüsüzlük imatinib için.[2]
İlaç direnci
İlaç direnci Bcr-Abl TKI'nin sürekli araştırma ve geliştirmesindeki ana itici güçtür. İmatinibin kullanılmaya başlanmasından kısa bir süre sonra, araştırmacılar bir dizi laboratuvar ortamında türetilmiş hücre hatları ilaca dirençli.[13] Bunu, hastalardaki imatinibe dirençli hücrelerin klinik tanımı takip etti ve bu, bu gözlemlerin arkasındaki biyolojiyi daha iyi anlama çabalarıyla sonuçlandı. KML hastalarında imatinibin terapötik cevabının değerlendirmeleri toplantıya dayanmaktadır. hematolojik, sitojenik ve moleküler kilometre taşları. Önceden tanımlanmış olarak tanımlanmış yanıtlara ulaşamayan hastalar kronolojik zaman noktaları, öncelikle tedaviye dirençli olarak tanımlanır ve daha önce hastalık gerilemesinde elde edilen kilometre taşlarını kaybedenler ikincil olarak dirençli olarak adlandırılır.[3] Bir sonuca varmadan önce şunu dikkate almak önemlidir: geçmişe dönük veriler, yüksek oranda imatinib non-uyma KML hastalarında ve bu istenmeyen klinik sonuçlara yol açabilir.[2]

Genel olarak, imatinib direnci, Bcr-Abl'ye bağımlı ve bağımsız mekanizmalara bölünebilir. Bcr-Abl bağımlı mekanizmalar arasında aşırı ifade veya amplifikasyon Bcr-Abl geninin ve nokta mutasyonları imatinib bağlanmasına müdahale eden Bcr-Abl kinaz alanı içinde. Bcr-Abl bağımsız mekanizmaları, hücre içindeki imatinib konsantrasyonunu etkileyen faktörleri içerir, örneğin ilaç akışı ve dışarı akışındaki değişiklikler ve Src kinaz ailesinin üyeleri gibi Bcr-Abl'den bağımsız yolların aktivasyonu.[2] İmatinib direnci, burada bahsedilmeyecek diğer mekanizmalar tarafından da üretilebilir, çünkü bu mekanizmaların önemi, klinik veri eksikliğinden dolayı hala bir soru olmaya devam etmektedir.
Bcr-Abl'ye bağlı direnç mekanizmaları
Bcr-Abl çoğaltma
İmatinibe karşı ilk direnç raporları, onkojen amplifikasyonu. Yani gen patojenik Bcr-Abl tirozin kinazı kodlayan, DNA dizisi, patojenin daha yüksek ekspresyonuna yol açar.[3] İmatinib dozunun arttırılması, şiddetli veya tahammül edilemez olması koşuluyla, bu tür bir direnci aşabilir. yan etkiler üretilmiyor.[2]
Bcr-Abl mutasyonu
Nokta mutasyonları Bcr-Abl proteininin kinaz alanı içinde amino asit ikamelerine neden olabilir ve imatinibin tirozin kinaz üzerindeki bağlanma bölgesini bozarak ilaca duyarlılık kaybına neden olabilir. Bu mutasyonlar normalde Bcr-Abl proteininin yapısını etkiler ve ya ilaç ile Bcr-Abl proteini arasındaki kritik temas noktalarının kesintiye uğramasına ya da konformasyonel bir değişikliğin indüksiyonuna yol açar ve bu da imatinibin bağlanamayacağı bir protein ile sonuçlanır.[2]
Mutasyon sıklıkları hastalık arttıkça artmaktadır. CML, -den ilerler kronik faz için patlama aşaması. En önemli mutasyonlar P döngüsü mutasyonlar ve T315I mutasyonu. Kinazın diğer bölgelerindeki mutasyonlar da, örneğin C-sarmal, SH2 alanı, substrat bağlama sitesi, aktivasyon döngüsü ve C terminali lob. Bu mutasyonların bazıları klinik öneme sahiptir, ancak hiçbiri P döngüsü ve T315I mutasyonları.[3]
T315I mutasyonu
T315I, önceden onaylanmış tüm Bcr-Abl inhibitörlerine karşı direnci nedeniyle benzersiz bir mutasyondur. Ponatinib.[14] Tek bir sitozin -e timin (C -> T) çift bazlı Abl geninin 944. pozisyonundaki ikame (kodon Abl proteininin '315' dizisi) amino asitle sonuçlanır (T) hreonin ile ikame edilmek (I) tekösin bu konumda - dolayısıyla 'T315I'. Bu ikame, kritik bir oksijen için gerekli molekül hidrojen bağı imatinib ve Abl kinaz arasında ve ayrıca sterik engel çoğu TKI'nin bağlanmasına.[3]Keşfedildiğinde, imatinib direnci olan 9 ileri evre KML vakasından her 6'sının bu mutasyonu taşıdığı tahmin edildi.[15] T315I, hem imatinib hem de ikinci nesil TKI'lere karşı herhangi bir mutasyonun en yüksek direncini üretir.[2] Ponatinib (Iclusig) tarafından Ariad 2013 yılında ikinci basamak CML tedavisi olarak kullanılmak üzere onaylanmıştır ve T315I mutasyona uğramış kinaza başarıyla bağlanan tek lisanslı TKI'dır.
P-döngü mutasyonları
Bcr-Abl'in yapısı iki esnek döngü içerir, ATP bağlayıcı P döngüsü ve aktivasyon döngüsü. Bu döngüler, bazal konformasyonu stabilize eden Bcr-Abl'nin aktif olmayan konformasyonunda spesifik düzenlemelere sahiptir. Bu döngülerdeki mutasyonlar, kinaz alanı imatinib bağlanması için gereken inaktif konformasyonu alamayacak şekilde ilmeklerin düzenlenmesini kararsız hale getirir. P-döngü bölgesindeki mutasyonlar en yaygın olanıdır ve tüm mutasyonların% 36-48'ini oluşturur. P-döngüsündeki Bcr-Abl mutasyonlarının, doğal Bcr-Abl ile karşılaştırıldığında imatinibe karşı 70-100 kat daha az duyarlı olduğunu gösteren klinik veriler vardır.[2]
Bcr-Abl Bağımsız direnç mekanizmaları
Çeşitli model sistemlerde görülen direnci tanımlamak için ek mekanizmalar öne sürülmüştür, ancak hiçbiri tek başına klinik direnç kaynağı olarak açıkça tanımlanmamıştır.[3]
P-glikoproteinlerin neden olduğu ilaç akışı
Hücre dizilerinde yapılan bazı araştırmalar, imatinib direncinin kısmen ekspresyondaki artıştan kaynaklanabileceğini göstermiştir. P-glikoprotein akış pompası. P-glikoprotein aktivitesini inhibe eden ajanlar kullanılarak imatinib duyarlılığı bazı durumlarda geri kazanılmıştır.[3]
Organik katyon taşıyıcısı ile ilaç ithalatı 1
İmatinibin hücrelere girişi organik bir katyon taşıyıcısına bağlıdır (OCT1 ). OCT1, içeri akışını inhibe ederek ve böylece imatinibin hücre içi biyoyararlanımını azaltarak imatinib direncinde önemli bir rol oynar.[16] OCT1'in düşük ekspresyonu, aktivitesi veya polimorfizmi olan hastalar, önemli ölçüde daha düşük hücre içi imatinib seviyelerine sahipti. Düşük OCT1 aktivitesine sahip hastaların yanıtı, önemli ölçüde doza bağımlıydı. Bu veriler, OCT1 aktivitesinin, imatinibe moleküler yanıtta önemli bir belirleyici olduğunu gösterir.[2]
Alternatif sinyal yolu aktivasyonu
Birkaç hasta grubunda, direnç, diğer sinyal yollarının, özellikle Src ailesi kinazlarının aktivasyonundan kaynaklanabilir. Src ailesi kinazları, Bcr-Abl sinyallemesinde rol oynar ve imatinibe bağlanmayan bir yapı olan Bcr-Abl'nin aktif konformasyonunu stabilize ederek imatinib direncine aracılık eder. Ayrıca, artan kanıtlar, Src ailesi kinazlarının aynı zamanda Bcr-Abl'den bağımsız imatinib direnci formlarında da rol oynadığını göstermektedir.
Çözümler
İmatinibe dirençli veya intolerans için tedavi seçenekleri CML hastalar, imatinib dozunun artırılması veya ikinci nesil ilaçların kullanılması gibi stratejiler içerebilir. İmatinib dozlarının artmasının, Bcr-Abl duplikasyonu gibi bazı imatinibe birincil direnç vakalarının üstesinden geldiği gösterilmiştir, ancak yanıt genellikle kısa etkilidir.[2] Direnç veya hoşgörüsüzlük durumunda, değişken seçenekler, farklı direnç mekanizmalarına karşı farklı fonksiyon profillerine sahip olduğundan, ikinci basamak tedavisinin seçimini yönlendirmek için Bcr-Abl mutasyonlarını test etmek yararlı olabilir.[14] İkinci nesil ilaçlar iyileştirilmiş güç ve dirençli hastalarda daha büyük başarı olasılığı.[2] Ayrıca, test etme konusunda artan bir ilgi var. hipotez Erken faz hastalarında çoklu Abl kinaz inhibitörlerinin uygulanmasının, ilaca dirençli olmanın ortaya çıkmasını geciktirmek veya önlemek için kullanılabileceği klonlar. Farklı hedefleyen iki aracının kombinasyonu yollar KML'de yer alan yanıt oranlarını önemli ölçüde artırabilir ve potansiyel olarak sağkalımı artırabilir.[17]
İkinci nesil ilaçlar
İkinci nesil ilaçların imatinibe göre daha az direnç ve intoleransa sahip olması amaçlanmaktadır. Şu anda pazarlanan ikinci nesil ilaçlar nilotinib, dasatinib, bosutinib ve ponatinib'dir.
Nilotinib (AMN107)
Geliştirme
Nilotinib yapısal olarak imatinib ile ilişkili bir fenilamino-pirimidin türevidir.[11] Abl-imatinib kompleksinin yapısına dayanarak, imatinib intoleransı ve direnci ile ilişkili ihtiyacı ele almak için geliştirilmiştir.[12][17][18] İmatinib molekülünde daha fazlasını yapmak için küçük değişiklikler yapıldı güçlü ve bir Bcr-Abl inhibitörü olarak seçicidir ve bu değişiklikler nilotinibin keşfiyle sonuçlanmıştır. Nilotinib, seçici bir Bcr-Abl kinaz inhibitörüdür.[12][17]
Nilotinib, Bcr-Abl tirozin kinazın aktivitesini inhibe etmede imatinibden 10-30 kat daha güçlüdür ve çoğalma Bcr-Abl ifade eden hücreler.[11][17][18][19] İlaç, Bcr-Abl'nin oto fosforilasyonunu etkili bir şekilde inhibe eder. Tyr -177 CML patogenezinde rol oynar.[19] Sinerjik imatinib ve nilotinib aktivitesi, birlikte uygulamayı takiben rapor edilmiştir. Bu, ilaçların hücrelerde farklı mekanizmalarla alınmasının bir sonucu olabilir: imatinib akışı OCT1'e bağlıdır, ancak nilotinib değildir. Nilotinib ayrıca, imatinibden farklı olarak dışarı akış taşıyıcı P-glikoprotein pompası için bir substrat değildir.[17][19] rağmen iki boyutlu Bu iki ilacın moleküler yapıları benzer görünebilir, açılarından farklıdırlar. mekansal yapı ve moleküler özellikler.[12]

Bağlayıcı
Nilotinib, Abl kinaz alanının etkin olmayan konformasyonuna büyük ölçüde şu yolla bağlanır: lipofilik etkileşimler ve dolayısıyla katalitik aktivitesini bloke eder.[11][17] Nilotinib, aşağıdakileri içeren dört hidrojen bağı etkileşimi yaparak kinaz alanına bağlanır. piridil -N ve Met-318'in NH omurgası, anilino -NH ve Thr-315'in yan zinciri OH'si, Glu-286'nın amido-NH ve yan zincir karboksilatı ve Asp-381'in NH omurgasına sahip amido karbonil.[12][19] Nilotinibin [4- (3-piridinil) -2-pirimidinil] anilino segmenti, ATP bağlanma sahası içindeki bir bölgenin Met-318, Phe-317 ve Thr-315 kalıntıları ile yakın bağlanma etkileşimlerine sahiptir. Bileşiğin kalan yarısı, ek bir cep içinde bağlanmak için Thr-315 bekçi kalıntısının ötesine uzanır. Nilotinibin 3-metilimidazol ve trifloro-metil grupları, Abl kinaz alanı ile önemli etkileşimler yapar. Bu gruplar ayrıca nilotinibin şeklini imatinibinkinden çok farklı kılar. Nilotinib ayrıca çok sayıda zayıf van der Waals etkileşimi yoluyla kinaza bağlanır.[12]
Direnç
Nilotinib, imatinib direnci ile ilişkili çoğu mutasyona (32/33) karşı etki göstermiştir, ancak T315I mutantı nilotinibe dirençli kalmaktadır.[11][12][17] T315I mutantına karşı etkisizliği, nilotinib üzerindeki treonin-O ve anilin-NH arasındaki H-bağı etkileşiminin kaybının ve izolösin-metil grubu ile nilotinibin 2-metilfenil fenil grubu arasındaki sterik çatışmanın bir sonucu gibi görünmektedir.[11] Öte yandan, nilotinibe direnç, çoğunlukla P-döngüsünü ve T315I'yi etkileyen sınırlı bir Bcr-Abl kinaz mutasyonları spektrumuyla ilişkilidir. Bununla birlikte, T315I dışındaki tüm mutasyonlar, nilotinib konsantrasyonunun artırılmasıyla etkili bir şekilde bastırıldı.[17] Nilotinib, imatinibden daha güçlü olmasına rağmen, Abl'ye spesifik bağlanma modunun diğer bölgeleri yeni tür ilaç direncine karşı savunmasız hale getirmesi mümkündür.[18]
Dasatinib (BMS-354825)
Geliştirme
Dasatinib bir tiazolilaminopirimidin olarak geliştirildi hidroklorür tuz. Hedeflenen bir programla keşfedildi. immünsüpresif ilaçlar ve doğal tip Bcr-Abl ifade eden hücrelere karşı imatinibe göre 325 kat daha etkilidir.[11][18] Dasatinib, Bcr-Abl ve Src ailesi kinazlarının çok hedefli bir inhibitörüdür.[11][18] Ayrıca ek aşağı akış kinazlara karşı inhibe edici aktiviteye sahiptir.[18][20]

Bağlayıcı
Dasatinib, Abl'ye imatinibe göre daha az sıkı konformasyonel gereksinimlerle bağlanır, bu nedenle imatinibe kıyasla artmış potens, ancak azaltılmış seçicilik sergiler.[18] Dasatinib, Abl kinazın hem aktif hem de aktif olmayan konformasyonunu bağlar, diğer çoğu TKI'nin yalnızca aktif forma bağlanmasının tersine.[22] Aktif konformasyonu hedefleyen bileşikler tanımlanmıştır, ancak yüzlerce insan protein kinazının tümünde bağlanma sahası çok benzerdir. Bu nedenle, aktif olmayan konformasyonlar arasındaki farklılıklar için önemli ölçüde daha büyük bir kapsam vardır, bu nedenle yüksek derecede seçici kinaz inhibitörlerini keşfetme çabaları, aktif olmayan konformasyona bağlanan moleküllere yöneliktir.[11]
Dasatinib, nilotinib ile ortak bazı yapısal unsurlara sahiptir, özellikle aminopirimidin ve karboksamid gruplar. aminotiyazol Dasatinib segmenti, Met-318 omurgası CO ve NH ile iki dişli bir H-bağlanma etkileşimi yapar ve amid-NH, Thr-315'in yan zincir oksijeni ile bir H-bağı yapar.[11]
Direnç
Dasatinib, Src ailesi kinazların bir inhibitörü olduğundan, Src ailesi kinaz aktivasyonuna bağlı direncin üstesinden gelebilir. Bcr-Abl'e imatinib ile aynı sıkı konformasyonel gerekliliklerle bağlanmadığından, T315I hariç tüm Bcr-Abl kinaz alanı mutantlarını inhibe edebilir. Dasatinib ayrıca, imatinib gibi çoklu ilaç P-glikoprotein dışarı akış pompalarının bir substratı değildir. Bu nedenle dasatinib, bazı hastalarda hem imatinib hem de nilotinib ile başarısız olduktan sonra aktif olabilir.[18] Dasatinib, imatinibden çok daha güçlü olmasına rağmen, nilotinib ile olduğu gibi, Abl'ye spesifik bağlanma modunun, yeni tür ilaç direnci verebilecek yeni savunmasız bölgelere yol açması mümkündür. Phe317'de mutasyonlar bulundu, bu yüzden bu ilaç için potansiyel bir savunmasız bölge.[18]
Bosutinib (KAYAK-606)
Geliştirme

Bosutinib 'nin yapısı bir kinolin iskele ve yapısal olarak AstraZeneca ile ilişkilidir kinazolin şablonu.[11] Src kinaza bağımlı maya taraması, bir 4-anilino-3-kinolinin karakterizasyonuna yol açtı.karbonitril bir Src inhibitörü olarak. Bu isabetin özelliklerinin ve ilgili bir bileşiğin birleşimi ve eki çözme gruplar, bosutinibin keşfine yol açtı. Bir Abl kinaz inhibitörü olduğu önerildi ve bu şekilde test edildiğinde Abl'ye karşı Src'ye göre biraz daha güçlü olduğu ortaya çıktı (IC50 1,4 nM 3,5'e kıyasla nM ).[23] Bosutinib'in aktivitesi ilk olarak 2001'de tanımlandı ve 2003'te bir Abl kinaz inhibitörü olarak açıklandı. İlk başta, bosutinibin seçici bir Src kinaz inhibitörü olduğuna inanılıyordu, ancak şimdi kinaz inhibisyon profilinin orijinal düşünülenden çok daha az kısıtlı olduğu bilinmektedir. Bosutinib Src, Abl'yi ve geniş bir yelpazede hem tirozin hem de serin-treonin kinazları inhibe eder.[23]
Direnç
Bosutinib, bazıları imatinib direncine yol açan çeşitli mutasyonları eksprese eden hücreleri inhibe etti, ancak T315 mutasyonu, bosutinibe tamamen dirençliydi.[11][23] İmatinib, nilotinib ve dasatinibin aksine, bosutinib için etkili bir substrat değildir. çoklu ilaç direnci (MDR) taşıyıcıları yabancı moleküllerin hücrelerden dışarı akışını teşvik eden. Bosutinib, bu taşıyıcı proteinleri daha yüksek konsantrasyonlarda bile inhibe eder.[23]
Ponatinib (AP24534)
ARIAD İlaç Inc., 10 Eylül 2010'da Ponatinib T315I mutasyonuna karşı etkili oral olarak aktif bir Bcr-Abl TKI, bir faz II klinik deney için onaylanmıştır.[24]
Keşfe giden yol, Ariad'in ATP rekabetçi ikili Src / Abl inhibitörlerinden biri olan AP23464'e bağlanabilir. AP23464, yapı temel ilaç tasarımı ve üç ikameli odaklanmış sentetik kitaplıklar kullanılarak tanımlandı. pürin analoglar. Madde, nanomolar ölçekte, birçok yaygın imatinibe dirençli Bcr-Abl mutasyonu dahil olmak üzere Src ve Bcr-Abl kinazları güçlü bir şekilde inhibe eder. AP23464, T315I mutasyonunu inhibe etmezken, AP24534 (ponatinib) bunu yapar.[25]
Geliştirme

Ariad, ikili Src / Abl inhibitörleri için purin çekirdekli şablonların inhibe edici olasılıklarını daha da araştırmak için oldukça güçlü ilaç kurşunu AP23464'ü kullandı. İlk olarak, Abl'nin inaktif yapısı üzerinde etkili maddeler aranırken, pürin çekirdeği üzerindeki azota bağlanan yan zincir, bir diarilamid önemli hidrojen bağları oluşturarak ve kinaz üzerindeki hidrofobik cepleri doldurarak inaktif yapıya yüksek afiniteye sahip olduğu bilinen yapı. Ayrıca, siklopentil pürin çekirdeğindeki grup, bu doğrulamada glisinden zengin bir P-halkasıyla çarpıştı ve bu nedenle molekülden çıkarıldı. Daha sonra inhibe edici aktivite üzerine in vitro testler ve in vivo oral absorpsiyon deneyleri ile daha lipofilik, amide bağlı, siklopropil purin çekirdeği üzerindeki C6 üzerindeki grubun hem tatmin edici farmakokinetik hem de etkinlik sergilediği bulunmuştur. Son olarak diarilamid yan zincirindeki imidazol uzantılarının eklenmesiyle yapılan değişiklikler, daha sonra yeni çıkan nilotinib yapısından esinlenmiştir. Bu değişiklikler AP24163 olarak adlandırılan şeyle sonuçlandı. Bu geliştirme döngüsü sırasında Ariad, T315I mutasyona uğramış Bcr-Abl kinaz ile transfekte edilmiş hücrelere karşı birkaç maddeyi test etti ve şaşırtıcı bir şekilde, AP24163'ün doğal Bcr-Abl'nin güçlü inhibisyonunun üzerinde makul inhibe edici etki gösterdiğini buldu.[26]
Bu atılımın ardından Ariad, AP24163 bileşiğinin T315I mutasyonuna karşı etkinliğini artırmak için daha fazla araştırmaya başladı. Yerleştirme T315I mutasyona uğramış Bcr-Abl kinazın ATP bağlanma bölgesine molekülün, sterik olarak daha az zorlayıcı olması nedeniyle izolösin ile beklenen sterik çarpışmanın mevcut olmadığını vinil pürin çekirdeği ve diarilamid yan zinciri arasındaki bağlantı, diğer TKI'lere kıyasla. İlk adım, sterik olarak daha az zorlayıcı bir yapı bulmaya çalışmaktı. İlk bir asetilen bağlantı test edildi, bu daha yüksek potensli ancak olumsuz farmakokinetik ile sonuçlandı. Daha sonra daha kararlı 2-butin bağlantı seçildi. Bu bağlantıyı elde etmek için bir imidazol [1,2-a] piridin çekirdeği, bir Sonogashira reaksiyon; ancak farmakokinetik hala zayıftı. AP24163 geliştirilirken, purin çekirdeğinde C8 üzerine bir siklopropan yan zincir eklenmesi, uygun farmakokinetiklerle sonuçlandı. Daha sonra birkaç farklı yan zincir test edildi, ancak en iyi sonuçlar hiçbir yan zincir olmadan elde edildi, bu da tatmin edici farmakokinetiklere sahip bir madde ile sonuçlandı, ancak şimdi T315I'ye karşı da azaltılmış potense sahip. Gücü tekrar artırmanın ilk adımı, diğer TKI'lere bakmaktı. İmatinib, Abl kinazın aktivasyon döngüsünde Ile-360 tortusunun karbonil oksijen atomu ile bir hidrojen bağı oluşturduğu gösterilen bir terminal metil piperazin grubuna sahiptir. Piperazin halkası ayrıca molekülün farmakokinetik özelliklerini daha da geliştirebilen ortak bir çözündürücü gruptur. Bu spekülasyonlar, Bcr-Abl T315I mutasyona uğramış kinaza karşı önleyici etkide iki kat artışla doğrulandı ve gümüş astar, plazma proteinlerine bağlanma Maddenin ('19a' olarak adlandırılır), aynı potensli daha küçük dozlara izin vererek azaldığı görülmüştür. '19a' hem farelerde hem de sıçanlarda iyi oral farmakokinetik sergilerken, aynı zamanda yüksek ayrılım katsayısı 6.69'da. Dolayısıyla, molekülün lipofilisitesini daha da azaltma girişimlerinde, imidazo [1,2-a] piridin çekirdeği üzerinde tek bir karbon atomunun ikamesi yapıldı; Bu, şimdi bileşik ponatinib olarak bilinen şeyle sonuçlandı.[27]

Bağlayıcı
Ponatinib ve T315I Bcr-Abl mutasyona uğramış kinazın X-ışını kristalografik analizi, imidazo [1,2b]piridazin çekirdek, enzimin adenin cebinde bulunur. Metilfenil grubu, I315'in arkasında hidrofobik bir cep kaplar. etinil bağlantı, amino asit ile uygun van der Waals etkileşimleri oluşturur ve triflorometil grubu, inaktif konformasyon kinaz tarafından indüklenen bir cebe bağlanır. Ayrıca ponatinb'in bulunduğu kinazın yapısında, ilaç ile Tyr-253 ve Phe-382 arasında ek olumlu van der Waals etkileşimleri. Menteşe bölgesinde Met-318 omurgasıyla, Asp-381'in omurgasıyla, Glu-286'nın yan zinciriyle ve Ile-360 ve His'in omurga-karbonil atomlarıyla protonlanmış metilpiperazin ile beş hidrojen bağı oluşturulur. -361.[28]
Bu yapı ile ponatinibin, muhtemelen molekülün bağlantı bölümünün doğrusallığına bağlanabilen nispeten geniş bir kinaz özgüllük profiline sahip olduğu gösterilmiştir. Bu doğrusal yapı ile ilaç, hidrofobik TK geçit tutucu kalıntıları ile sterik çarpışmalardan kaçınıyor gibi görünmektedir. Buna rağmen, hatta buna rağmen, ponatinib güçlü bir ilaçtır ve sadece Bcr-Abl TK üzerindeki bilinen mutasyonların çoğunu değil, en önemlisi T315I'yi hedef alır. Bu mutasyon, hem birinci hem de ikinci basamak tedavilerin başarısızlığına giden ortak bir yol olarak ortaya çıkmaktadır. Geliştirme aşamasındaki diğer T315I hedefleme inhibitörlerinin aksine, ponatinib, Aurora kinazlarını hedef almaz, bu da onu onlardan açıkça ayırır ve keşfinin önemini vurgular.[28]
Bafetinib (INNO-406)
Lansmanından sonra imatinib tedavisine karşı ortaya çıkan direnç ile alternatif tedavi çok arandı. Bafetinib Bcr-Abl kinazdaki çeşitli nokta mutasyonlarına karşı etkinliğe sahip, daha az yan etkiyle ve daha dar kinaz spektrumlarıyla, yani sadece Lyn ve Bcr-Abl ile imatinibden daha güçlü bir ilaç yaratma girişiminin ürünüdür.[29]
Geliştirme
Belirtilen kriterlere uyan bir madde arayışında Abl'ye bağlanan imatinibin kristal yapısı incelenmiştir. Bu, imatinibin piperazinilmetil grubuna bitişik fenil halkası etrafında hidrofobik bir cep ortaya çıkardı. Etkinliği artırmak için bu cebi kullanma girişimleri, tekli dahil olmak üzere çeşitli hidrofobik grupların eklenmesine yol açtı. floro, bromo ve kloro ikame ediciler. Son olarak, 3. pozisyondaki bir triflorometil grubunun, imatinibe göre yaklaşık 36 kat gelişme ile en iyi sonuçları verdiği bulundu. Maddenin çözünürlüğünü sürdürmek için hidrofobik bir grubun eklenmesine artık karşı konulması gerekiyordu. İmatinib-kinaz kompleksinin kristal yapısının daha yakından incelenmesi, Tyr-236'nın imatinibin piridin halkasına çok yakın olduğunu ortaya çıkardı, bu da orada daha büyük bir grup için çok az yer olduğunu veya hiç yer olmadığını düşündürdü. Bunu akılda tutarak bir daha hidrofilik piridin yerine pirimidin halkası ikame edildi ve bunun çözünürlüğü arttırırken etkinliği aynı veya hatta biraz daha fazla bıraktığı bulundu. Son olarak, imatinibin piperazin halkasının Ile-360 ve His-361 ile hidrojen bağını iyileştirmek için pirolidin ve azetidin türevleri tanıtıldı. Bu son modifikasyonlardan en umut verici madde NS-187 olarak etiketlendi.[10]
Bağlayıcı
İmatinib ve bafetinibin yapısal benzerliklerinden dolayı, Bcr-Abl'e bağlanmaları da oldukça benzerdir. Tek dikkate değer fark, triflorometil grubu ile Ile-293, Leu-298, Leu-354 ve Val-379 tarafından oluşturulan hidrofobik cep arasındaki hidrofobik etkileşimden kaynaklanmaktadır. Bu grup aynı zamanda bafetinib'in Lyn için özgüllüğüne de bağlanabilir, çünkü buradaki bağlayıcı site Bcr-Abl'dekiyle hemen hemen aynıdır.[30]
Bafetinib, hem çoğu imatinibe dirençli mutasyonlara (T315I dahil değil) hem de bazı dasatinibe dirençli mutasyonlara karşı etkili olduğu için TKI tedavisinde yerini almaktadır. Bafetinib ayrıca Bcr-Abl'ye nilotinib'den daha fazla (ancak dasatinib'den daha az) afiniteye sahiptir, ancak yalnızca Bcr-Abl ve Src ailesi kinazları Lck ve Lyn'i hedef alır; Daha az yan etki olasılığını düşündüren rakipsiz özgüllük ile.[31]
CytRx, Mayıs 2010 itibariyle lösemi tedavisi olarak faz II klinik denemede bafetinb içermektedir.[32]
1,3,4 tiadiazol türevleri - Madde 14
Tiyazol ve tiyadiazol türevleri ve bunların Bcr-Abl TK'leri inhibe etme yetenekleriyle bir miktar ilgi çekilmiştir.
Geliştirme

Bir İtalyan araştırma grubu aracılığıyla keşfedildi dijital tarama ticari olarak temin edilebilen tiadiazol türevlerinin, hem Abl hem de Src kinazlar üzerinde orta derecede inhibe edici etki sergilediği.[33] 1,3,4 tiyadiazol çekirdeği kullanılarak ve benzen halkaları üzerinde farklı gruplar veya moleküller denenerek, inhibe edici özelliklere sahip birkaç farklı madde üretildi. Çekirdeğin esnekliği, maddelerin tümü kinazın aktif formuna bağlanmasına rağmen, Abl kinazın ATP bölgesine bağlanan maddelerin bir dizi konformasyonuna izin verdi.[33] Bağlanma ile ilgili daha fazla çalışma, toluen yapısına bağlanan kükürt pozisyonunun Abl bağlanması açısından önemli bir rol oynadığını ve ayrıca nitrojenin bir tiyadiazolünden sadece birinin bir hidrojen bağı oluşturduğunu gösterdi. Ayrıca, yapının bilgisayar analizi, amid bağlı benzen-ketonun daha uygun bir tiyofen yüzük.[34] Bu analizin, Abl'in inaktif konformasyonu olan Abl ve dasatinib'in kristal yapısının karşılaştırılmasıyla yapıldığına dikkat edilmelidir, yerleştirme ve yapı analizinden elde edilen bilgi, 14. madde olarak adlandırılan bir bileşiğin tanımlanmasına yol açmıştır. Abl'e yüksek afinite ile.
Bağlayıcı
Madde 14'ün bağlanması kısmen dasatinibe benzer, madde 14'ün aminotiyazol segmenti, Met-318 omurgası CO ve NH ile bi-dentat H-bağlanma etkileşimi yapar. metoksi -benzen, Val 256, Ala 253, Lys 271 ve Ala 380 tarafından oluşturulan hidrofobik bir cebe güzelce düşer.[34] Dasatinibinkilere benzer bağlanma özellikleri tiyazol çekirdeklerinden Bcr-Abl TKI üretme olasılığının gerçek olduğunu öne sürmekle birlikte, bu araştırmanın sadece bir dasatinib analoğuna mı yoksa TK'leri inhibe etmenin yeni bir yoluna mı yol açacağı sorusu açık kalmaktadır.
Diğerleri
Rebastinib (DCC-2036) Ayrıca bir TIE-2 ve VEGFR-2 inhibitörü.[35] Lösemiler (Ph + CML With T315I Mutation) için faz 1 klinik denemesi yapılmıştır.[36] Metastatik meme kanseri için bir faz 1 klinik kombinasyon terapisi denemesindedir.[37]
Asciminib (ABL001), enzimi allosterik olarak inhibe etmek için miristoil cebini hedefleyen Abelson kinazının bir inhibitörüdür.[38] Ağustos 2020 itibariyle, CML'de (ASCEMBL) bosutinibe üstün etkinlik gösteren bir faz III çalışmasını tamamladı.
Özet
| Uyuşturucu madde | Yapısı | H-bağları | H-bağlayıcı amino asitler | Bağlayıcı onay | Keşif | 2017 itibariyle durum |
|---|---|---|---|---|---|---|
| Imatinib (STI571) | 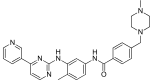 | 6 | Met-318, Thr-315, Glu-286, Asp-381, Ile-380, His-361 | Etkin değil | İlaç taraması | İlk basamak tedavi olarak pazarlandı |
| Nilotinib (AMN107) |  | 4 | Met-318, Thr-315, Glu-286, Asp-381 | Etkin değil | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanmaktadır |
| Dasatinib (BMS-345825) |  | 3 | Met-318, Thr-315 | Aktif | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanmaktadır |
| Bosutinib (KAYAK-606) |  | - | - | Etkin değil | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanmaktadır |
| Ponatinib (AP-24534) |  | 5 | Met-318, Asp-381, Glu-286, His-381, Ile-380 | Etkin değil | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanmaktadır |
| Bafetinib (INNO-406) | 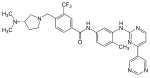 | 6 | Met-318, Thr-315, Glu-286, Asp-381, His-361, Ile-360 | Etkin değil | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanmaktadır |
Mevcut durum - re Ph + CML
Imatinib, standart bir ön cephe TKI'si olmaya devam ediyor. Nilotinib ve dasatinib de sırasıyla Haziran ve Ekim 2010'da FDA tarafından ön ilaç olarak onaylanmıştır. Bu ilaçlardan dördü, nilotinib, dasatinib, bosutinib ve ponatinib, imatinibe dirençli veya intoleran KML tedavisi için onaylanmıştır. Bu bileşikler için ilk satır veriler cesaret vericidir ve bunların bir kısmının veya tamamının gelecekte bir cephe standardı TKI olarak imatinibin yerini alabileceğini düşündürmektedir.[39]
Referanslar
- ^ Nowell, Peter; Hungerford, David (1960). "İnsan kronik granülositik lösemide bir dakikalık kromozom". Bilim. 132: 1497.
- ^ a b c d e f g h ben j k An, X .; Tiwari, A .; Sun, Y .; Ding, P .; Ashby Jr, C .; Chen, Z. (2010). "Philadelphia kromozomu pozitif kronik miyeloid löseminin tedavisinde BCR-ABL tirozin kinaz inhibitörleri: bir inceleme". Lösemi Araştırması. 34 (10): 1255–1268. doi:10.1016 / j.leukres.2010.04.016. PMID 20537386.
- ^ a b c d e f g Bixby, D., Talpaz, M. (2009). "Kronik miyeloid lösemide tirozin kinaz inhibitörlerine direnç mekanizmaları ve direncin üstesinden gelmek için yeni terapötik stratejiler". Hematoloji: 461-476.
- ^ a b c Manley, P.W., Cowan-Jacob, S.W., Buchdunger, E., Fabbro, D., Fendrich, G., Furet, P., Meyer, T. ve Zimmermann, J. (2002). "İmatinib: seçici bir tirozin kinaz inhibitörü". Avrupa Kanser Dergisi: S19-S27.
- ^ Shawver, L. K., Slamon, D. ve Ullrich, A. (2002). "Akıllı ilaçlar: Kanser tedavisinde Tirozin kinaz inhibitörleri". Kanser hücresi: 117-123.
- ^ a b Druker, B. J. ve Lydon, N. B. (2000). "Kronik miyelojenöz lösemi için bir Abl tirozin kinaz inhibitörünün geliştirilmesinden alınan dersler". Klinik Araştırma Dergisi: 3-7.
- ^ a b Buchanan, S. G. (2003) "Protein yapısı: seçici protein kinaz inhibitörlerinin keşfedilmesi". Hedefler: 101-108.
- ^ a b c Eck, M .; Manley, P. (2009). "The interplay of structural information and functional studies in kinase drug design: insights from BCR-Abl". Hücre Biyolojisinde Güncel Görüş. 21 (2): 288–295. doi:10.1016/j.ceb.2009.01.014. PMID 19217274.
- ^ Mandal, S .; Moudgil, M.; Mandal, S. (2009). "Rational drug design". Avrupa Farmakoloji Dergisi. 625 (1–3): 90–100. doi:10.1016/j.ejphar.2009.06.065. PMID 19835861.
- ^ a b c d Asaki, T.; Sugiyama, Y .; Hamamoto, T.; Higashioka, M.; Umehara, M.; Naito, H .; Niwa, T. (2006). "Design and synthesis of 3-substituted benzamide derivatives as Bcr-Abl kinase inhibitors". Biyorganik ve Tıbbi Kimya Mektupları. 16 (5): 1421–1425. doi:10.1016/j.bmcl.2005.11.042. PMID 16332440.
- ^ a b c d e f g h ben j k l Manley, P.; Cowan-Jacob, S.; Mestan, J. (2005). "Advances in the structural biology, design and clinical development of Bcr-Abl kinase inhibitors for the treatment of chronic myeloid leukaemia". Biochimica et Biophysica Açta (BBA) - Proteinler ve Proteomikler. 1754 (1–2): 3–13. doi:10.1016/j.bbapap.2005.07.040. PMID 16172030.
- ^ a b c d e f g Manley, P.; Stiefl, N.; Cowan-Jacob, S.; Kaufman, S.; Mestan, J.; Wartmann, M.; Wiesmann, M.; Woodman, R.; Gallagher, N. (2010). "Structural resemblances and comparisons of the relative pharmacological properties of imatinib and nilotinib". Biyorganik ve Tıbbi Kimya. 18 (19): 6977–6986. doi:10.1016/j.bmc.2010.08.026. PMID 20817538.
- ^ Mahon (August 1, 2000). Kan. 96 (3): 1070. Eksik veya boş
| title =(Yardım) - ^ a b Stein, B., Smith, B.D. (2010). "Treatment Options for Patients With Chronic Myeloid Leukemia Who Are Resistant to or Unable to Tolerate Imatinib". Clinical Therapeutics: 804-820.
- ^ Gorre, M.; Mohammed, M.; Ellwood, K.; Hsu, N.; Paquette, R.; Rao, P. N.; Sawyers, C. L. (2001). "Clinical Resistance to STI-571 Cancer Therapy Caused by BCR-ABL Gene Mutation or Amplification". Bilim. 293 (5531): 876–880. doi:10.1126/science.1062538. PMID 11423618. S2CID 1279564.
- ^ Thomas, J .; Wang, L .; Clark, R .; Pirmohamed, M. (2004). "Active transport of imatinib into and out of cells: implications for drug resistance". Kan. 104 (12): 3739–3745. doi:10.1182/blood-2003-12-4276. PMID 15315971.
- ^ a b c d e f g h Jabbour, E.; Cortes, J .; Kantarjian, H. (2009). "Nilotinib for the treatment of chronic myeloid leukemia: An evidence-based review". Temel Kanıt. 4: 207–213. doi:10.2147/CE.S6003. PMC 2899790. PMID 20694077.
- ^ a b c d e f g h ben Olivieri, A .; Manzione, L. (2007). "Dasatinib: a new step in molecular target therapy". Onkoloji Yıllıkları. 18 Suppl 6: vi42–vi46. doi:10.1093/annonc/mdm223. PMID 17591830.
- ^ a b c d Breccia, M.; Alimena, G. (2010). "Nilotinib: a second-generation tyrosine kinase inhibitor for chronic myeloid leukemia". Leukemia Research. 34 (2): 129–134. doi:10.1016/j.leukres.2009.08.031. PMID 19783301.
- ^ Han, L .; Schuringa, J.; Mulder, A.; Vellenga, E. (2010). "Dasatinib impairs long-term expansion of leukemic progenitors in a subset of acute myeloid leukemia cases". Hematoloji Yıllıkları. 89 (9): 861–871. doi:10.1007/s00277-010-0948-7. PMC 2908401. PMID 20387067.
- ^ Tokarski, J. S.; Newitt, J. A.; Chang, C. Y.; Cheng, J. D.; Wittekind, M.; Kiefer, S. E.; Kish, K.; Lee, F. Y.; Borzillerri, R.; Lombardo, L. J.; Xie, D .; Zhang, Y .; Klei, H. E. (2006). "The Structure of Dasatinib (BMS-354825) Bound to Activated ABL Kinase Domain Elucidates Its Inhibitory Activity against Imatinib-Resistant ABL Mutants". Kanser araştırması. 66 (11): 5790–5797. doi:10.1158/0008-5472.CAN-05-4187. PMID 16740718.
- ^ Aguilera, Dolly G (31 October 2006). "Dasatinib in chronic myeloid leukemia: a review". Terapötikler ve Klinik Risk Yönetimi. 5 (2): 281–289. doi:10.2147/tcrm.s3425. PMC 2697539. PMID 19536317.
- ^ a b c d Boschelli, F.; Arndt, K.; Gambacorti-Passerini, C. (2010). "Bosutinib: a review of preclinical studies in chronic myelogenous leukaemia". Avrupa Kanser Dergisi. 46 (10): 1781–1789. doi:10.1016/j.ejca.2010.02.032. PMID 20399641.
- ^ http://www.ariad.com
- ^ O'Hare, T.; Pollock, R.; Stoffregen, E. P.; Keats, J. A.; Abdullah, O. M.; Moseson, E. M.; Rivera, V. M.; Tang, H .; Metcalf Ca, C. A.; Bohacek, R. S.; Wang, Y .; Sundaramoorthi, R.; Shakespeare, W. C.; Dalgarno, D.; Clackson, T.; Sawyer, T. K.; Deininger, M. W.; Druker, B. J. (2004). "Inhibition of wild-type and mutant Bcr-Abl by AP23464, a potent ATP-based oncogenic protein kinase inhibitor: implications for CML". Kan. 104 (8): 2532–2539. doi:10.1182/blood-2004-05-1851. PMID 15256422. S2CID 6853673.
- ^ Huang, W .; Zhu, X .; Wang, Y .; Azam, M.; Wen, D.; Sundaramoorthi, R.; Thomas, R .; Liu, S .; Banda, G.; Lentini, S. P.; Das, S .; Xu, Q .; Keats, J.; Wang, F .; Wardwell, S.; Ning, Y .; Snodgrass, J. T.; Broudy, M. I.; Russian, K.; Daley, G.Q .; Iuliucci, J.; Dalgarno, D. C.; Clackson, T.; Sawyer, T. K.; Shakespeare, W. C. (2009). "9-(Arenethenyl)purines as dual Src/Abl kinase inhibitors targeting the inactive conformation: design, synthesis, and biological evaluation". Tıbbi Kimya Dergisi. 52 (15): 4743–4756. doi:10.1021/jm900166t. PMID 19572547.
- ^ Huang, W. S.; Metcalf, C. A.; Sundaramoorthi, R.; Wang, Y .; Zou, D.; Thomas, R. M .; Zhu, X .; Cai, L .; Wen, D. (2010). "Discovery of 3-[2-(Imidazo[1,2-b]pyridazin-3-yl)ethynyl]-4-methyl-N-{4-[(4-methylpiperazin-1-yl)methyl]-3-(trifluoromethyl)phenyl}benzamide (AP24534), a Potent, Orally Active Pan-Inhibitor of Breakpoint Cluster Region-Abelson (BCR-ABL) Kinase Including the T315I Gatekeeper Mutant". Tıbbi Kimya Dergisi. 53 (12): 4701–19. doi:10.1021 / jm100395q. PMID 20513156.
- ^ a b O'Hare, T.; Shakespeare, W.; Zhu, X .; Eide, C.; Rivera, V.; Wang, F .; Adrian, L.; Zhou, T .; Huang, W .; Xu, Q .; Metcalf Ca, C. A.; Tyner, J. W.; Loriaux, M. M.; Corbin, A. S.; Wardwell, S.; Ning, Y .; Keats, J. A.; Wang, Y .; Sundaramoorthi, R.; Thomas, M .; Zhou, D .; Snodgrass, J.; Commodore, L.; Sawyer, T. K.; Dalgarno, D. C.; Deininger, M. W. N.; Druker, B. J.; Clackson, T. (2009). "Kronik miyeloid lösemi için pan-BCR-ABL inhibitörü olan AP24534, T315I mutantını güçlü bir şekilde inhibe eder ve mutasyona dayalı direncin üstesinden gelir". Kanser hücresi. 16 (5): 401–412. doi:10.1016 / j.ccr.2009.09.028. PMC 2804470. PMID 19878872.
- ^ Kimura, S .; Naito, H .; Segawa, H.; Kuroda, J.; Yuasa, T.; Sato, K .; Yokota, A .; Kamitsuji, Y.; Kawata, E.; Ashihara, E.; Nakaya, Y.; Naruoka, H.; Wakayama, T.; Nasu, K.; Asaki, T.; Niwa, T.; Hirabayashi, K.; Maekawa, T. (2005). "NS-187, a potent and selective dual Bcr-Abl/Lyn tyrosine kinase inhibitor, is a novel agent for imatinib-resistant leukemia". Kan. 106 (12): 3948–3954. doi:10.1182/blood-2005-06-2209. PMID 16105974.
- ^ Horio, T.; Hamasaki, T.; Inoue, T .; Wakayama, T.; Itou, S.; Naito, H .; Asaki, T.; Hayase, H.; Niwa, T. (2007). "Structural factors contributing to the Abl/Lyn dual inhibitory activity of 3-substituted benzamide derivatives". Biyorganik ve Tıbbi Kimya Mektupları. 17 (10): 2712–2717. doi:10.1016/j.bmcl.2007.03.002. PMID 17376680.
- ^ Deguchi, Y.; Kimura, S .; Ashihara, E.; Niwa, T.; Hodohara, K.; Fujiyama, Y .; Maekawa, T. (2008). "Comparison of imatinib, dasatinib, nilotinib and INNO-406 in imatinib-resistant cell lines". Leukemia Research. 32 (6): 980–983. doi:10.1016/j.leukres.2007.11.008. PMID 18191450.
- ^ https://web.archive.org/web/20121017190653/http://www.cytrx.com/press_releases.html. Arşivlenen orijinal 2012-10-17 tarihinde. Alındı 2013-04-08. Eksik veya boş
| title =(Yardım) - ^ a b Radi, M.; Crespan, E.; Botta, G.; Falchi, F.; Maga, G.; Manetti, F.; Corradi, V.; Mancini, M.; Santucci, M.; Schenone, S.; Botta, M. (2008). "Discovery and SAR of 1,3,4-thiadiazole derivatives as potent Abl tyrosine kinase inhibitors and cytodifferentiating agents". Biyorganik ve Tıbbi Kimya Mektupları. 18 (3): 1207–1211. doi:10.1016/j.bmcl.2007.11.112. PMID 18078752.
- ^ a b Manetti, F.; Falchi, F.; Crespan, E.; Schenone, S.; Maga, G.; Botta, M. (2008). "N-(thiazol-2-yl)-2-thiophene carboxamide derivatives as Abl inhibitors identified by a pharmacophore-based database screening of commercially available compounds". Biyorganik ve Tıbbi Kimya Mektupları. 18 (15): 4328–4331. doi:10.1016/j.bmcl.2008.06.082. PMID 18621522.
- ^ Rebastinib
- ^ Study Safety and Preliminary Efficacy of DCC-2036 in Patients With Leukemias (Ph+ CML With T315I Mutation)
- ^ Rebastinib Plus Antitubulin Therapy With Paclitaxel or Eribulin in Metastatic Breast Cancer
- ^ https://www.novartis.com/news/media-releases/novartis-investigational-novel-stamp-inhibitor-asciminib-abl001-meets-primary-endpoint-phase-iii-chronic-myeloid-leukemia-study. Eksik veya boş
| title =(Yardım) - ^ Valent, P. (2010). "Standard treatment of Ph+ CML in 2010: how, when and where not to use what BCR/ABL1 kinase inhibitor?". Avrupa Klinik Araştırma Dergisi. 40 (10): 918–931. doi:10.1111/j.1365-2362.2010.02328.x. PMID 20597967.
