Amino asit - Amino acid

Amino asitler vardır organik bileşikler içeren amin (–NH2) ve karboksil (-COOH) fonksiyonel gruplar ile birlikte Yan zincir (R grubu) her bir amino aside özgüdür.[1][2] Anahtar elementler bir amino asidin karbon (C), hidrojen (H), oksijen (O) ve azot (N), bazı amino asitlerin yan zincirlerinde başka elementler bulunmasına rağmen. Yaklaşık 500 doğal olarak oluşan amino asit bilinmektedir (ancak genetik Kod ) ve birçok şekilde sınıflandırılabilir.[3] Temel yapısal fonksiyonel grupların konumlarına göre şu şekilde sınıflandırılabilirler: alfa- (α-), beta- (β-), gama- (γ-) veya delta- (δ-) amino asitler; diğer kategoriler ilgili polarite, pH seviye ve yan zincir grubu türü (alifatik, döngüsel olmayan, aromatik, kapsamak hidroksil veya kükürt, vb.). Şeklinde proteinler, amino asit kalıntılar ikinci en büyük bileşeni oluşturur (Su insanın en büyüğü kaslar ve diğeri Dokular.[4] Amino asitler, proteinlerdeki kalıntılar olarak rollerinin ötesinde, bir dizi işleme katılır. nörotransmiter ulaşım ve biyosentez.
İçinde biyokimya amin grubuna bağlı amino asitler (alfa-) karbon karboksil grubunun yanındaki atom özel bir öneme sahiptir. Olarak bilinirler 2-, alfa-veya α-amino asitler (genel formül H2Çoğu durumda NCHRCOOH,[a] R bir organik ikame "olarak bilinirYan zincir ");[5] genellikle "amino asit" terimi spesifik olarak bunlara atıfta bulunmak için kullanılır. 22'yi içeriyor proteinojenik ("protein oluşturan") amino asitler,[6][7][8] hangi birleşmek peptid geniş bir dizinin yapı taşlarını oluşturmak için zincirler ("polipeptitler") proteinler.[9] Bunların hepsi L-stereoizomerler ("Solak " izomerler ), birkaç olmasına rağmen D-amino asitler ("sağ elini kullanan") bakteri zarfları, olarak nöromodülatör (D-serin ) ve bazılarında antibiyotikler.[10]
Proteinojenik amino asitlerin yirmi tanesi doğrudan triplet tarafından kodlanır kodonlar içinde genetik Kod ve "standart" amino asitler olarak bilinirler. Diğer ikisi ("standart olmayan" veya "standart olmayan") selenosistein (çoğunda mevcut prokaryotlar yanı sıra çoğu ökaryotlar, ancak doğrudan kodlanmamış DNA ), ve pirolizin (sadece bazılarında bulundu Archaea ve bir bakteri ). Pirolizin ve selenosistein, varyant kodonlar aracılığıyla kodlanır; örneğin selenosistein şu şekilde kodlanır: kodonu durdur ve SECIS öğesi.[11][12][13] N-formilmetiyonin (genellikle bakterilerdeki proteinlerin ilk amino asididir, mitokondri, ve kloroplastlar ) genellikle bir form olarak kabul edilir metiyonin ayrı bir proteinojenik amino asitten ziyade. Codon–tRNA doğada bulunmayan kombinasyonlar ayrıca genetik kodu "genişletmek" ve olarak bilinen yeni proteinler oluşturur alloproteinler birleştiren proteinojenik olmayan amino asitler.[14][15][16]
Birçok önemli proteinojenik ve proteinojenik olmayan amino asit biyolojik işlevlere sahiptir. Örneğin, İnsan beyni glutamat (standart glutamik asit ) ve Gama-aminobütirik asit ("GABA", standart olmayan gama-amino asit) sırasıyla ana uyarıcı ve inhibe edici nörotransmiterler.[17] Hidroksiprolin önemli bir bileşeni bağ dokusu kolajen, sentezlendi prolin. Glisin biyosentetik bir öncüdür porfirinler kullanılan Kırmızı kan hücreleri. Karnitin kullanılır lipid taşınması. Dokuz proteinojenik amino asit "önemli "insanlar için çünkü diğerlerinden üretilemezler. Bileşikler insan vücudu tarafından ve dolayısıyla yiyecek olarak alınmalıdır. Diğerleri olabilir şartlı olarak gerekli belirli yaşlar veya tıbbi durumlar için. Esansiyel amino asitler ayrıca aşağıdakiler arasında farklılık gösterebilir: Türler.[b] Biyolojik önemi nedeniyle amino asitler beslenmede önemlidir ve yaygın olarak besin takviyeleri, gübre, besleme, ve Gıda Teknolojisi. Endüstriyel kullanımlar şunları içerir: ilaçlar, biyolojik olarak parçalanabilen plastikler, ve kiral katalizörler.
Tarih
İlk birkaç amino asit, 19. yüzyılın başlarında keşfedildi.[18][19] 1806'da Fransız kimyagerler Louis-Nicolas Vauquelin ve Pierre Jean Robiquet bir bileşiği izole etmek Kuşkonmaz bu sonradan adlandırıldı kuşkonmaz keşfedilecek ilk amino asit.[20][21] Sistin 1810'da keşfedildi,[22] monomeri olmasına rağmen, sistein, 1884 yılına kadar keşfedilmeden kaldı.[21][23] Glisin ve lösin 1820'de keşfedildi.[24] Keşfedilecek 20 ortak amino asitten sonuncusu treonin tarafından 1935'te William cumming gül, ayrıca belirleyen gerekli amino asitler ve optimum büyüme için tüm amino asitlerin minimum günlük gereksinimlerini belirledi.[25][26]
Kimyasal kategorinin birliği, Wurtz 1865'te, ancak ona özel bir isim vermedi.[27] İngilizcede "amino asit" teriminin ilk kullanımı 1898 yılına dayanmaktadır.[28] Almanca terim ise, Aminosäure, daha önce kullanıldı.[29] Proteinlerin enzimatik sindirim veya asitten sonra amino asitler verdiği bulundu. hidroliz. 1902'de, Emil Fischer ve Franz Hofmeister bağımsız olarak, proteinlerin birçok amino asitten oluştuğunu, böylece bir amino asidin amino grubu ile diğerinin karboksil grubu arasında bağların oluştuğunu ve Fischer'ın dediği doğrusal bir yapıya yol açtığını ileri sürdü "peptid ".[30]
Genel yapı
Sayfanın üst kısmında gösterilen yapıda, R temsil eder Yan zincir her bir amino aside özgü. karbon yanında atom karboksil grubu denir α – karbon. İçeren amino asitler amino grubu doğrudan alfa karbona bağlı olarak adlandırılır alfa amino asitler.[31] Bunlar, amino asitleri içerir. prolin Içeren ikincil aminler, sıklıkla "imino asitler" olarak anılırdı.[32][33][34]
İzomerizm
Alfa amino asitler, doğada bulunan en yaygın formdur, ancak yalnızca L-izomer. Alfa karbon bir kiral karbon atomu hariç glisin alfa karbon üzerinde ayırt edilemez iki hidrojen atomuna sahip olan.[35] Bu nedenle, tüm alfa amino asitler ancak glisin ikisinden birinde var olabilir enantiyomerler, aranan L veya D amino asitler (göreceli konfigürasyon), birbirlerinin ayna görüntüleri olan (Ayrıca bakınız Kiralite ). Süre L-amino asitler, içinde bulunan tüm amino asitleri temsil eder proteinler ribozomdaki çeviri sırasında, D-amino asitler, sonra enzim tarafından üretilen bazı proteinlerde bulunur. tercüme ve ulaşım endoplazmik retikulum denizde yaşayan egzotik organizmalarda olduğu gibi koni salyangozları.[36] Bunlar aynı zamanda peptidoglikan hücre duvarları bakteri[37] ve D-serine bir nörotransmiter beyinde.[38] D-amino asitler kullanılır rasemik kristalografi (proteine bağlı olarak) daha kolay ve daha sağlam protein yapısının belirlenmesine izin verebilen sentrosimetrik kristaller oluşturmak için.[39] L ve D amino asit konfigürasyonu konvansiyonu, amino asidin kendisinin optik aktivitesine değil, daha ziyade izomerinin optik aktivitesine atıfta bulunur. gliseraldehit teoride bu amino asidin sentezlenebildiği (D-gliseraldehit sağa döndürücüdür; L-gliseraldehit levorotatördür). Alternatif bir şekilde, (S) ve (R) tasarımcılar belirtmek için kullanılır mutlak konfigürasyon. Proteinlerdeki amino asitlerin neredeyse tamamı (S) α karbonda sistein olmak (R) ve glisin olmayankiral.[40] Sisteinin yan zinciri diğer amino asitlerle aynı geometrik konumda bulunur, ancak R/S terminoloji tersine çevrildi çünkü kükürt Yan zincire Cahn-Ingold-Prelog kurallarına göre daha yüksek bir öncelik veren karboksil oksijene kıyasla daha yüksek atom numarası vardır, oysa diğer birçok yan zincirdeki atomlar karboksil grubuna kıyasla onlara daha düşük öncelik verir.[41]
Yan zincirler
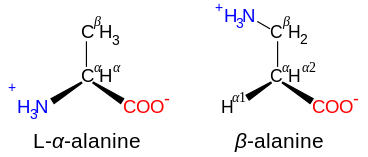
Amino asitler, nitrojen atomu karboksil grubuna bitişik karbon atomuna eklendiğinde α- olarak adlandırılır: bu durumda bileşik, N – C – CO alt yapısını içerir.2. N – C – C – CO alt yapısına sahip amino asitler2 β- amino asitler olarak sınıflandırılır. γ-Amino asitler N – C – C – C – CO alt yapısını içerir2, ve benzeri.[42]
Amino asitler genellikle şu şekilde sınıflandırılır: özellikleri yan zincirlerini dört gruba ayırın. Yan zincir, bir amino asidi zayıf asit veya a zayıf taban ve bir hidrofil yan zincir ise kutup veya a hidrofob Öyleyse polar olmayan.[35] "kollara ayrılmış zincirli amino asitler "veya BCAA, sahip olan amino asitleri belirtir. alifatik doğrusal olan yan zincirler; bunlar lösin, izolösin, ve valin. Proline sadece proteinojenik yan grubu a-amino grubuna bağlı olan ve dolayısıyla bu pozisyonda ikincil bir amin içeren tek proteinojenik amino asittir.[35] Kimyasal açıdan prolin, bu nedenle, bir imino asit, eksik olduğu için birincil amino grubu,[43] Mevcut biyokimyasal isimlendirmede hala bir amino asit olarak sınıflandırılmasına rağmen[44] ve ayrıca bir "N-alkillenmiş alfa-amino asit ".[45]
Zwitterions

Sulu çözeltide amino asitler iki şekilde bulunur (sağda gösterildiği gibi), moleküler form ve zwitterion birbirleriyle denge halinde oluştururlar. İki form pH aralığında bir arada bulunur pK1 − 2 -e pK2 + 2glisin için pH olan 0–12. İki izomerin konsantrasyonlarının oranı pH'tan bağımsızdır. Bu oranın değeri deneysel olarak belirlenemez.
Tüm amino asitler, amin ve karboksilik asit fonksiyonel grupları içerdiğinden, bunlar amfiprotik.[35] Şurada: pH = pK1 (yaklaşık 2.2) türlerin eşit konsantrasyonu olacak NH+
3CH (R) CO
2H ve NH+
3CH (R) CO−
2 ve pH = pK2 (yaklaşık 10) türlerin eşit konsantrasyonu olacak NH+
3CH (R) CO−
2 ve NH
2CH (R) CO−
2. Bunun sonucu olarak, nötr molekül ve zwitterion, biyolojik pH'da etkin olarak bulunan tek türdür.[46]
Genel olarak zwitterion konsantrasyonunun, bilinen p ile karşılaştırmalara dayanarak nötr molekül konsantrasyonundan çok daha büyük olduğu varsayılır.K değerleri aminler ve karboksilik asitler.
İzoelektrik noktası

İki p arasındaki pH değerlerindeKa değerler, zwitterion hakimdir, ancak dinamik denge küçük miktarlarda net negatif ve net pozitif iyonlarla. İki p arasındaki tam orta noktadaKa değerler, net negatifin eser miktarı ve net pozitif iyonların iz miktarı tam olarak dengelenir, böylece mevcut tüm formların ortalama net yükü sıfır olur.[47] Bu pH, izoelektrik nokta pbenyani pben = 1/2(pKa1 + pKa2). Yüklü yan zincirlere sahip amino asitler için pKa yan zincirin parçası. Bu nedenle, negatif yan zincirli aspartat veya glutamat için, pben = 1/2(pKa1 + pKa (R)), nerede pKa (R) yan zincir pKa. Sistein ayrıca p ile potansiyel olarak negatif yan zincire sahiptir.Ka (R) = 8.14, yani pben yan zincir fizyolojik pH'ta önemli ölçüde yüklenmemiş olsa bile aspartat ve glutamat için hesaplanmalıdır. Pozitif yan zincirlere sahip histidin, lizin ve arginin için, pben = 1/2(pKa (R) + pKa2). Amino asitler, elektroforezde izoelektrik noktalarında sıfır hareketliliğe sahiptir, ancak bu davranış genellikle peptitler ve proteinler için tekli amino asitlerden daha fazla kullanılır. Zwitterionlar, izoelektrik noktalarında minimum çözünürlüğe sahiptirler ve bazı amino asitler (özellikle polar olmayan yan zincirlerle), pH'ı gerekli izoelektrik noktaya ayarlayarak sudan çökeltme yoluyla izole edilebilir.
Biyokimyada oluşum ve işlevler
Proteinojenik amino asitler
Amino asitler yapısal birimlerdir (monomerler ) proteinleri oluşturan. Kısa oluşturmak için birleşirler polimer zincirler denir peptidler veya daha uzun zincirler polipeptitler veya proteinler. Bu polimerler doğrusaldır ve dalsızdır, zincirdeki her bir amino asit iki komşu amino aside bağlıdır. DNA / RNA genetik materyali tarafından kodlanan proteinleri yapma sürecine tercüme ve büyüyen bir protein zincirine amino asitlerin adım adım eklenmesini içerir. ribozim buna denir ribozom.[48] Amino asitlerin eklendiği sıra, genetik Kod bir mRNA bir şablon olan RNA organizmanın birinin kopyası genler.
Yirmi iki amino asit, doğal olarak polipeptitlere dahil edilir ve proteinojenik veya doğal amino asitler.[35] Bunlardan 20'si evrensel tarafından kodlanmıştır. genetik Kod. Kalan 2, selenosistein ve pirolizin, proteinlere benzersiz sentetik mekanizmalarla dahil edilir. Selenosistein çevrilen mRNA bir SECIS öğesi, bu da UGA kodonunun selenosisteini kodlamasına neden olur. kodonu durdur.[49] Pirolizin bazıları tarafından kullanılır metanojenik Archaea üretmek için kullandıkları enzimlerde metan. Normalde diğer organizmalarda bir durdurma kodonu olan UAG kodonu ile kodlanmıştır.[50] Bu UAG kodonunun ardından bir PYLIS aşağı akış dizisi.[51]
Farklı veri türlerini kullanan birkaç bağımsız evrimsel çalışma, Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr'nin erken genetik kodu oluşturan bir amino asit grubuna ait olabileceğini öne sürerken, Cys, Met , Tyr, Trp, His, Phe, genetik kodun sonraki eklemelerini oluşturan bir amino asit grubuna ait olabilir.[52][53][54][55]
Proteinojenik olmayan amino asitler
22 dışında proteinojenik amino asitler birçok proteinojenik olmayan amino asitler bilinmektedir. Ya proteinlerde bulunmazlar (örneğin karnitin, GABA, levotiroksin ) veya doğrudan ve standart hücresel makinelerle ayrı olarak üretilmemelidir (örneğin, hidroksiprolin ve selenometiyonin ).
Proteinlerde bulunan proteinojenik olmayan amino asitler şu şekilde oluşur: çeviri sonrası değişiklik, protein sentezi sırasında translasyondan sonra yapılan değişikliktir. Bu modifikasyonlar genellikle bir proteinin işlevi veya düzenlenmesi için gereklidir. Örneğin, karboksilasyon nın-nin glutamat daha iyi bağlanmaya izin verir kalsiyum katyonları,[56] ve kolajen hidroksiprolin içerir. hidroksilasyon nın-nin prolin.[57] Başka bir örnek, oluşumudur hipusin içinde çeviri başlatma faktörü EIF5A bir lizin kalıntısının modifikasyonu yoluyla.[58] Bu tür modifikasyonlar ayrıca proteinin lokalizasyonunu da belirleyebilir, örneğin uzun hidrofobik grupların eklenmesi bir proteinin bir proteine bağlanmasına neden olabilir. fosfolipid zar.[59]
Bazı proteinojenik olmayan amino asitler proteinlerde bulunmaz. Örnekler şunları içerir: 2-aminoizobütirik asit ve nörotransmiter Gama-aminobütirik asit. Proteinojenik olmayan amino asitler genellikle metabolik yollar standart amino asitler için - örneğin, ornitin ve sitrülin meydana gelir üre döngüsü, amino asidin bir parçası katabolizma (aşağıya bakınız).[60] Biyolojide α-amino asitlerin baskınlığına nadir bir istisna, β-amino asittir. beta alanin (3-aminopropanoik asit), bitkilerde ve mikroorganizmalarda sentezinde kullanılan pantotenik asit (B vitamini5), bir bileşeni koenzim A.[61]
D-Amino asit doğal bolluğu
Bu bölümün olması gerekiyor güncellenmiş. (Temmuz 2019) |
olmasına rağmen D-izomerler canlı organizmalarda nadirdir, gramicidin karışımından oluşan bir polipeptiddir D- ve L-amino asitler.[62] İçeren diğer bileşikler D-amino asitler tirosidin ve valinomisin. Bu bileşikler, bakteri hücre duvarlarını, özellikle de Gram pozitif bakteri. 2011 itibariyle[Güncelleme]sadece 837 D-amino asitler bulundu İsviçre-Prot analiz edilen toplam 187 milyon amino asitten veritabanı.[63]
Standart olmayan amino asitler
Doğrudan evrenselin kodonları tarafından kodlanan 20 amino asit genetik Kod arandı standart veya kanonik amino asitler. Değiştirilmiş bir metiyonin formu (N-formilmetiyonin ) genellikle bakteri, mitokondri ve kloroplastlardaki proteinlerin ilk amino asidi olarak metiyonin yerine dahil edilir. Diğer amino asitler denir standart olmayan veya kanonik olmayan. Standart olmayan amino asitlerin çoğu da proteinojenik değildir (yani translasyon sırasında proteinlere dahil edilemezler), ancak bunlardan ikisi proteinojeniktir, çünkü evrensel genetik kodda kodlanmamış bilgilerden yararlanılarak proteinlere translasyonel olarak dahil edilebilirler.
Standart olmayan iki proteinojenik amino asit, selenosistein (çoğu ökaryotta olduğu kadar ökaryotta da bulunur, ancak doğrudan DNA tarafından kodlanmamıştır) ve pirolizin (sadece bazılarında bulundu Archaea ve bir bakteri ). Bu standart olmayan amino asitlerin dahil edilmesi nadirdir. Örneğin, 25 insan proteini, birincil yapılarında selenosistein içerir,[64] ve yapısal olarak karakterize edilen enzimler (selenoenzimler), katalitik olarak selenosisteini kullanır. parça aktif sitelerinde.[65] Pirolizin ve selenosistein, varyant kodonlar aracılığıyla kodlanır. Örneğin selenosistein şu şekilde kodlanır: kodonu durdur ve SECIS öğesi.[11][12][13]
İnsan beslenmesinde

Diyetten insan vücuduna alındığında, 20 standart amino asit ya proteinleri, diğer biyomolekülleri sentezlemek için kullanılır ya da üre ve karbon dioksit bir enerji kaynağı olarak.[66] Oksidasyon yolu, amino grubunun bir transaminaz; amino grubu daha sonra üre döngüsü. Transamidasyonun diğer ürünü bir keto asit giren sitrik asit döngüsü.[67] Glukojenik amino asitler ayrıca glikoza dönüştürülebilir. glukoneogenez.[68] 20 standart amino asitten dokuzu (Onun, Ile, Leu, Lys, Tanışmak, Phe, Thr, Trp ve Val ) arandı gerekli amino asitler Çünkü insan vücudu olumsuz sentezlemek onları diğerlerinden Bileşikler normal büyüme için gereken seviyede, bu yüzden yiyeceklerden elde edilmeleri gerekir.[69][70][71] Ek olarak, sistein, tirozin, ve arginin yarı önemli amino asitler ve taurin çocuklarda yarı önemli bir aminosülfonik asit olarak kabul edilir. Bu monomerleri sentezleyen metabolik yollar tam olarak gelişmemiştir.[72][73] Gerekli miktarlar aynı zamanda bireyin yaşına ve sağlığına da bağlıdır, bu nedenle bazı amino asitler için beslenme gereksinimi hakkında genel açıklamalar yapmak zordur. Standart olmayan amino aside diyetle maruz kalma BMAA dahil olmak üzere insan nörodejeneratif hastalıklarla bağlantılı olmuştur ALS.[74][75]
• PA: fosfatidik asit
• mTOR: rapamisinin mekanik hedefi
• AMP: adenozin monofosfat
• ATP: adenozin trifosfat
• AMPK: AMP ile aktive olan protein kinaz
• PGC ‐ 1α: peroksizom proliferatör ile aktive olan reseptör gama koaktivatör-1α
• S6K1: p70S6 kinaz
• 4EBP1: ökaryotik çeviri başlatma faktörü 4E bağlayıcı protein 1
• eIF4E: ökaryotik çeviri başlatma faktörü 4E
• RPS6: ribozomal protein S6
• eEF2: ökaryotik uzama faktörü 2
• RE: direnç egzersizi; EE: dayanıklılık egzersizi
• Myo: miyofibriler; Mito: mitokondriyal
• AA: amino asitler
• HMB: β-hidroksi β-metilbütirik asit
• ↑ aktivasyonu temsil eder
• Τ engellemeyi temsil eder
Protein dışı işlevler
İnsanlarda protein olmayan amino asitlerin de önemli rolleri vardır. metabolik ara ürünler biyosentezinde olduğu gibi nörotransmiter Gama-aminobütirik asit (GABA). Diğer molekülleri sentezlemek için birçok amino asit kullanılır, örneğin:
- Triptofan nörotransmiterin bir öncüsüdür serotonin.[82]
- Tirozin (ve onun öncüsü fenilalanin), katekolamin nörotransmiterler dopamin, epinefrin ve norepinefrin ve çeşitli eser aminler.
- Fenilalanin öncüsü fenetilamin ve insanlarda tirozin. Bitkilerde çeşitli türlerin öncüsüdür. fenilpropanoidler bitki metabolizmasında önemli olan.
- Glisin öncüsü porfirinler gibi hem.[83]
- Arginin öncüsü nitrik oksit.[84]
- Ornitin ve S-adenosilmetiyonin öncüleridir poliaminler.[85]
- Aspartat, glisin, ve glutamin öncüleridir nükleotidler.[86] Bununla birlikte, diğer bol miktarda standart olmayan amino asitlerin tüm fonksiyonları bilinmemektedir.
Bazı standart olmayan amino asitler şu şekilde kullanılır: otçullara karşı savunmalar bitkilerde.[87] Örneğin, kanavanin bir analogudur arginin birçoğunda bulunan baklagiller,[88] ve özellikle büyük miktarlarda Canavalia gladiata (kılıç fasulyesi).[89] Bu amino asit, bitkileri böcekler gibi avcılardan korur ve bazı bakliyat türleri işlenmeden yenilirse insanlarda hastalığa neden olabilir.[90] Protein olmayan amino asit Mimozin özellikle baklagillerin diğer türlerinde bulunur Leucaena leucocephala.[91] Bu bileşik bir analogdur tirozin ve bu bitkilerde otlayan hayvanları zehirleyebilir.
Endüstride kullanır
Amino asitler, endüstride çeşitli uygulamalar için kullanılır, ancak ana kullanımları, hayvan yemi. Bu, bu beslemelerin toplu bileşenlerinin birçoğu, örneğin soya fasulyesi ya düşük seviyelere sahip ya da bazılarında eksik gerekli amino asitler: Bu yemlerin üretiminde lizin, metiyonin, treonin ve triptofan en önemlileridir.[92] Bu endüstride, amino asitler ayrıca bu hayvanların sağlığını veya üretimini iyileştirmek için gerekli olabilecek takviyelerden minerallerin emilimini iyileştirmek için metal katyonları şelatlamak için de kullanılır.[93]
Gıda endüstrisi özellikle amino asitlerin önemli bir tüketicisidir, glutamik asit olarak kullanılan tatlandırıcı,[94] ve aspartam (aspartilfenilalanin 1-metil ester) düşük kalorili yapay tatlandırıcı.[95] Hayvan beslenmesi için kullanılan teknolojiye benzer teknoloji, mineral emilimini iyileştirerek ve inorganik mineral takviyesinin olumsuz yan etkilerini azaltarak anemi gibi mineral eksikliklerinin semptomlarını hafifletmek için insan beslenme endüstrisinde kullanılmaktadır.[96]
Amino asitlerin şelatlama kabiliyeti, demir klorozu gibi mineral eksikliklerini düzeltmek için minerallerin bitkilere verilmesini kolaylaştırmak için tarım amaçlı gübrelerde kullanılmıştır. Bu gübreler aynı zamanda eksikliklerin oluşmasını önlemek ve bitkilerin genel sağlığını iyileştirmek için kullanılır.[97] Kalan amino asit üretimi, sentezinde kullanılır. ilaçlar ve makyaj malzemeleri.[92]
Benzer şekilde bazı amino asit türevleri ilaç endüstrisinde kullanılmaktadır. Onlar içerir 5-HTP Depresyonun deneysel tedavisi için kullanılan (5-hidroksitriptofan),[98] L-DOPA (L-dihidroksifenilalanin) için Parkinson tedavi[99] ve eflornitin inhibe eden ilaç ornitin dekarboksilaz ve tedavisinde kullanılır uyku hastalığı.[100]
Genişletilmiş genetik kod
2001 yılından bu yana, farklı fizikokimyasal ve biyolojik özelliklerle kodlamak için benzersiz bir kodon (yeniden kodlama) ve karşılık gelen bir transfer-RNA: aminoasil - tRNA-sentetaz çifti oluşturarak proteine 40 doğal olmayan amino asit eklenmiştir. keşfetmek için bir araç protein yapısı ve yeni veya geliştirilmiş proteinler oluşturmak veya işlevini yerine getirmek.[14][15]
Nullomerler
Nullomerler, teoride bir amino asidi kodlayan kodonlardır, ancak doğada bu kodonu bir başkası lehine kullanmaya karşı seçici bir önyargı vardır, örneğin bakteriler arginin kodlamak için AGA yerine CGA kullanmayı tercih eder.[101] Bu, genomda görünmeyen bazı diziler oluşturur. Bu özellikten yararlanılabilir ve kanserle mücadele eden yeni seçici ilaçlar yaratmak için kullanılabilir.[102] ve olay yeri incelemelerinden DNA örneklerinin çapraz kontaminasyonunu önlemek.[103]
Kimyasal yapı taşları
Düşük maliyetli amino asitler önemlidir hammaddeler. Bu bileşikler, kiral havuz sentezi gibi enantiyomerik olarak saf yapı taşları.[104]
Öncü olarak amino asitler araştırılmıştır kiral katalizörler asimetrik gibi hidrojenasyon reaksiyonlar, ticari uygulamalar olmamasına rağmen.[105]
Biyobozunur plastikler
Amino asitler, biyobozunur polimerlerin bileşenleri olarak kabul edilmiştir ve aşağıdaki uygulamalara sahiptir: Çevre dostu ambalaj ve tıpta ilaç teslimi ve inşaatı protez implantlar.[106] Bu tür malzemelerin ilginç bir örneği poliaspartat tek kullanımlık uygulamalara sahip olabilen suda çözünür biyolojik olarak parçalanabilir bir polimer çocuk bezi ve tarım.[107] Çözünürlüğü ve yeteneği nedeniyle Kıskaç metal iyonları, poliaspartat ayrıca biyolojik olarak parçalanabilir bir antiölçekleme ajan ve bir paslanma önleyici.[108][109] Ek olarak aromatik amino asit tirozin için olası bir yedek olarak kabul edildi fenoller gibi bisfenol A imalatında polikarbonatlar.[110]
Sentez

Kimyasal sentez
Amino asitlerin ticari üretimi genellikle, karbon kaynağı olarak glikoz kullanarak tek tek amino asitleri aşırı üreten mutant bakterilere dayanır. Bazı amino asitler, sentetik ara ürünlerin enzimatik dönüşümleri ile üretilir. 2-Aminotiyazolin-4-karboksilik asit bir endüstriyel sentezde bir ara maddedir L-sistein Örneğin. Aspartik asit amonyak ilavesiyle üretilir fumarat bir lyase kullanarak.[111]
Biyosentez
Bitkilerde azot ilk olarak organik bileşiklere asimile edilir. glutamat mitokondride alfa-ketoglutarat ve amonyaktan oluşur. Diğer amino asitler için bitkiler şunları kullanır: transaminazlar amino grubunu glutamattan başka bir alfa-keto aside taşımak için. Örneğin, aspartat aminotransferaz, glutamat ve oksaloasetatı alfa-ketoglutarata ve aspartata dönüştürür.[112] Diğer organizmalar da amino asit sentezi için transaminazları kullanır.
Standart olmayan amino asitler genellikle standart amino asitlere yapılan modifikasyonlarla oluşturulur. Örneğin, homosistein aracılığıyla oluşur transsülfürasyon yolu veya metiyoninin ara metabolit yoluyla demetilasyonu ile S-adenosilmetiyonin,[113] süre hidroksiprolin tarafından yapılmıştır çeviri sonrası değişiklik nın-nin prolin.[114]
Mikroorganizmalar ve bitkiler birçok nadir amino asidi sentezler. Örneğin, bazı mikroplar 2-aminoizobütirik asit ve lantiyonin, alaninin sülfit köprülü bir türevi. Bu amino asitlerin her ikisi de peptidik lantibiyotikler gibi alametisin.[115] Ancak bitkilerde, 1-aminosiklopropan-1-karboksilik asit bitki hormonunun üretiminde önemli bir ara ürün olan küçük bir çift ikameli siklik amino asittir etilen.[116]
Tepkiler
Amino asitler, kurucu fonksiyonel gruplardan beklenen reaksiyonlara uğrar.[117][118]
Peptit bağı oluşumu

Amino asitlerin hem amin hem de karboksilik asit grupları, amid bağları oluşturmak için reaksiyona girebildiğinden, bir amino asit molekülü diğeriyle reaksiyona girebilir ve bir amid bağı yoluyla birleşebilir. Bu polimerizasyon amino asitler, proteinleri oluşturan şeydir. Bu yoğunlaşma reaksiyonu yeni oluşan Peptit bağı ve bir su molekülü. Hücrelerde bu reaksiyon doğrudan gerçekleşmez; bunun yerine, amino asit önce bir transfer RNA molekül Ester bağ. Bu aminoasil-tRNA, bir ATP tarafından gerçekleştirilen bağımlı reaksiyon aminoasil tRNA sentetaz.[119] Bu aminoasil-tRNA, daha sonra ribozom Uzayan protein zincirinin amino grubunun ester bağı üzerindeki saldırısını katalize eden.[120] Bu mekanizmanın bir sonucu olarak, ribozomlar tarafından yapılan tüm proteinler, bulundukları yerden başlayarak sentezlenir. N-terminus ve onların C-terminus.
Bununla birlikte, tüm peptit bağları bu şekilde oluşturulmaz. Birkaç durumda, peptidler spesifik enzimler tarafından sentezlenir. Örneğin, tripeptid glutatyon oksidatif strese karşı hücrelerin savunmasının önemli bir parçasıdır. Bu peptit, serbest amino asitlerden iki adımda sentezlenir.[121] İlk adımda, gama-glutamilsistein sentetaz yoğunlaşır sistein ve glutamik asit glutamatın yan zincir karboksilinin (bu yan zincirin gama karbonu) ve sisteinin amino grubu arasında oluşan bir peptid bağı yoluyla. Bu dipeptid daha sonra yoğunlaştırılır glisin tarafından glutatyon sentetaz glutatyon oluşturmak için.[122]
Kimyada peptitler, çeşitli reaksiyonlarla sentezlenir. En çok kullanılanlardan biri katı fazlı peptit sentezi amino asitlerin aromatik oksim türevlerini aktive edilmiş birimler olarak kullanır. Bunlar, katı reçine desteğine eklenmiş büyüyen peptit zincirine sırayla eklenir.[123] Peptit kitaplıkları, ilaç keşiflerinde kullanılır. yüksek verimli tarama.[124]
Fonksiyonel grupların kombinasyonu, amino asitlerin metal-amino asit şelatları için etkili polidentat ligandları olmasına izin verir.[125]Amino asitlerin çoklu yan zincirleri de kimyasal reaksiyonlara girebilir.
Katabolizma

* Glukojenikşekillendirme kabiliyetine sahip ürünlerle glikoz tarafından glukoneogenez
* Ketojenikglikoz oluşturma özelliği olmayan ürünlerle. Bu ürünler hala kullanılabilir ketogenez veya lipid sentezi.
* Hem glukojenik hem de ketojenik ürünlere katabolize edilen amino asitler.
Amino asitler önce organellerden ve hücrelerden dışarı atılarak kan dolaşımına geçmelidir. amino asit taşıyıcıları amin ve karboksilik asit grupları tipik olarak iyonize olduğundan. Karaciğerde ve böbreklerde meydana gelen bir amino asidin bozunması genellikle şunları içerir: deaminasyon amino grubunu alfa-ketoglutarata taşıyarak glutamat. Bu süreç, genellikle sentez sırasında aminasyonda kullanılanlarla aynı olan transaminazları içerir. Birçok omurgalıda, amino grubu daha sonra üre döngüsü ve şeklinde atılır üre. Bununla birlikte, amino asit bozulması üretebilir ürik asit veya bunun yerine amonyak. Örneğin, serin dehidrataz serini piruvata ve amonyağa dönüştürür.[86] Bir veya daha fazla amino grubunun çıkarılmasından sonra, molekülün geri kalanı bazen yeni amino asitleri sentezlemek için kullanılabilir veya girilerek enerji için kullanılabilir. glikoliz ya da sitrik asit döngüsü, sağdaki resimde ayrıntılı olarak gösterildiği gibi.
Karmaşıklık
Amino asitler, iki dişli ligandlardır. geçiş metali amino asit kompleksleri.[127]
Amino asitlerin fizikokimyasal özellikleri
Ca. 20 kanonik amino asit, özelliklerine göre sınıflandırılabilir. Önemli faktörler ücretlidir, hidrofiliklik veya hidrofobiklik, boyut ve fonksiyonel gruplar.[35] Bu özellikler protein yapısı ve protein-protein etkileşimleri. Suda çözünür proteinler, hidrofobik kalıntılarına sahip olma eğilimindedir (Leu, Ile, Val, Phe, ve Trp ) proteinin ortasına gömülür, hidrofilik yan zincirler ise sulu çözücüye maruz kalır. (Unutmayın biyokimya bir kalıntı, belirli bir monomer içinde polimerik zincir bir polisakkarit, protein veya nükleik asit.) integral membran proteinleri dış halkalara sahip olma eğilimindedir hidrofobik onları bağlayan amino asitler lipit iki tabakalı. Biraz periferik membran proteinleri yüzeylerinde membrana kilitlenen bir hidrofobik amino asit parçasına sahiptir. Benzer şekilde, pozitif yüklü moleküllere bağlanması gereken proteinler, negatif yüklü amino asitlerle zengin yüzeylere sahiptir. glutamat ve aspartat negatif yüklü moleküllere bağlanan proteinler, pozitif yüklü zincirlerle zengin yüzeylere sahipken, lizin ve arginin. Örneğin, lizin ve arginin, şu açılardan oldukça zengindir: düşük karmaşıklık bölgeleri nükleik asit bağlayıcı proteinler.[55] Çeşitli var hidrofobiklik ölçekleri amino asit kalıntıları.[128]
Bazı amino asitlerin özel özellikleri vardır. sistein, bu kovalent oluşturabilir Disülfür bağları diğer sistein kalıntılarına, prolin bu formlar bir döngü polipeptit omurgasına ve glisin bu diğer amino asitlerden daha esnektir.
Ayrıca, glisin ve prolin, içlerinde oldukça zenginleştirilmiştir. düşük karmaşıklık bölgeleri ökaryotik ve prokaryotik proteinlerin tersi (az temsil edilen) ise sistein, fenilalanin, triptofan, metiyonin, valin, lösin, izolösin gibi oldukça reaktif veya kompleks veya hidrofobik amino asitler için gözlenmiştir.[55][129][130]
Pek çok protein bir dizi posttranslasyonel değişiklikler amino asit yan zincirlerine ek kimyasal gruplar bağlanır. Bazı modifikasyonlar hidrofobik üretebilir lipoproteinler,[131] veya hidrofilik glikoproteinler.[132] Bu tip modifikasyon, bir proteinin bir zara tersine çevrilebilir hedeflenmesine izin verir. Örneğin, yağ asidinin eklenmesi ve uzaklaştırılması palmitik asit bazı sinyalleme proteinlerindeki sistein kalıntıları, proteinlerin bağlanmasına ve ardından hücre zarlarından ayrılmasına neden olur.[133]
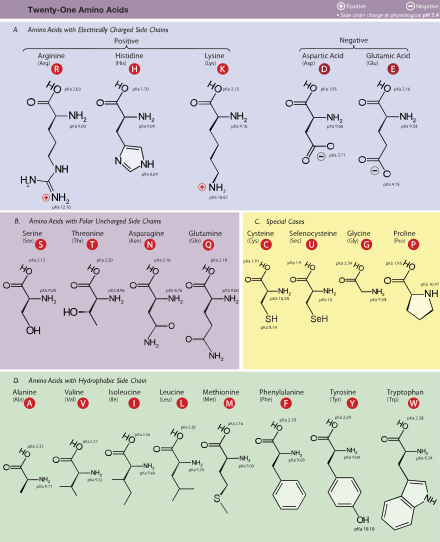
Standart amino asit kısaltmaları ve özellikleri tablosu
| Amino asit | Harf kodu | Yan zincir | Hidropati indeks[134] | Molar absorptivite[135] | Moleküler kütle | Proteinlerde bolluk (%)[136] | Standart genetik kodlama, IUPAC gösterimi | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | Sınıf | Polarite[137] | PH'ta şarj edin 7.4[137] | Dalgaboyu, λmax (nm) | Katsayı, ε (mM−1·santimetre−1) | |||||
| Alanin | Ala | Bir | Alifatik | Polar olmayan | Nötr | 1.8 | 89.094 | 8.76 | GCN | ||
| Arginin | Bağımsız değişken | R | Temel | Temel kutup | Pozitif | −4.5 | 174.203 | 5.78 | MGR, CGY (kodlama kodonları şu şekilde de ifade edilebilir: CGN, AGR) | ||
| Kuşkonmaz | Asn | N | Amide | Kutup | Nötr | −3.5 | 132.119 | 3.93 | AAY | ||
| Aspartik asit | Asp | D | Asit | Asidik polar | Olumsuz | −3.5 | 133.104 | 5.49 | GAY | ||
| Sistein | Cys | C | Sülfürik | Polar olmayan | Nötr | 2.5 | 250 | 0.3 | 121.154 | 1.38 | UGY |
| Glutamin | Gln | Q | Amide | Kutup | Nötr | −3.5 | 146.146 | 3.9 | ARABA | ||
| Glutamik asit | Glu | E | Asit | Asidik polar | Olumsuz | −3.5 | 147.131 | 6.32 | GAR | ||
| Glisin | Gly | G | Alifatik | Polar olmayan | Nötr | −0.4 | 75.067 | 7.03 | GGN | ||
| Histidin | Onun | H | Temel aromatik | Temel kutup | Olumlu,% 10 Nötr,% 90 | −3.2 | 211 | 5.9 | 155.156 | 2.26 | CAY |
| İzolösin | Ile | ben | Alifatik | Polar olmayan | Nötr | 4.5 | 131.175 | 5.49 | AUH | ||
| Lösin | Leu | L | Alifatik | Polar olmayan | Nötr | 3.8 | 131.175 | 9.68 | YUR, CUY (kodlama kodonları şu şekilde de ifade edilebilir: CUN, UUR) | ||
| Lizin | Lys | K | Temel | Temel kutup | Pozitif | −3.9 | 146.189 | 5.19 | AAR | ||
| Metiyonin | Tanışmak | M | Sülfürik | Polar olmayan | Nötr | 1.9 | 149.208 | 2.32 | AĞU | ||
| Fenilalanin | Phe | F | Aromatik | Polar olmayan | Nötr | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165.192 | 3.87 | UUY |
| Proline | Pro | P | Döngüsel | Polar olmayan | Nötr | −1.6 | 115.132 | 5.02 | CCN | ||
| Serin | Ser | S | Hidroksilik | Kutup | Nötr | −0.8 | 105.093 | 7.14 | UCN, AGY | ||
| Treonin | Thr | T | Hidroksilik | Kutup | Nötr | −0.7 | 119.119 | 5.53 | ACN | ||
| Triptofan | Trp | W | Aromatik | Polar olmayan | Nötr | −0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGG |
| Tirozin | Tyr | Y | Aromatik | Kutup | Nötr | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2.91 | UAY |
| Valin | Val | V | Alifatik | Polar olmayan | Nötr | 4.2 | 117.148 | 6.73 | SİLAH | ||
Bazı türlerde iki ek amino asit tarafından kodlanmıştır. kodonlar genellikle şu şekilde yorumlanır: kodonları durdur:
| 21. ve 22. amino asitler | 3 harfli | 1 harfli | Moleküler kütle |
|---|---|---|---|
| Selenosistein | Sn | U | 168.064 |
| Pirolizin | Pil | Ö | 255.313 |
Spesifik amino asit kodlarına ek olarak, yer tutucular, kimyasal veya kristalografik bir peptit veya proteinin analizi, bir kalıntının kimliğini kesin olarak belirleyemez. Ayrıca özetlemek için kullanılırlar korunmuş protein dizisi motifler. Benzer kalıntı kümelerini belirtmek için tek harflerin kullanımı, dejenere bazlar için kısaltma kodları.[138][139]
| Belirsiz amino asitler | 3 harfli | 1 harfli | Amino asitler dahildir | Kodonlar dahil |
|---|---|---|---|---|
| Herhangi / bilinmeyen | Xaa | X | Herşey | NNN |
| Kuşkonmaz veya aspartik asit | Asx | B | D, N | RAY |
| Glutamin veya glutamik asit | Glx | Z | E, Q | SAR |
| Lösin veya izolösin | Xle | J | Ben, L | YTR, ATH, CTY (kodlama kodonları şu şekilde de ifade edilebilir: CTN, ATH, TTR; MTY, YTR, ATA; MTY, HTA, YTG) |
| Hidrofobik | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| Aromatik | Ω | F, W, Y, H | YWY, TTY, TGG (kodlama kodonları şu şekilde de ifade edilebilir: TWY, CAY, TGG) | |
| Alifatik (aromatik değil) | Ψ | V, I, L, M | VTN, TTR (kodlama kodonları şu şekilde de ifade edilebilir: NTR, VTY) | |
| Küçük | π | P, G, A, S | BCN, RGY, GGR | |
| Hidrofilik | ζ | S, T, H, N, Q, E, D, K, R | VAN, WCN, CGN, AGY (kodlama kodonları şu şekilde de ifade edilebilir: VAN, WCN, MGY, CGP) | |
| Pozitif yüklü | + | K, R, H | ARR, CRY, CGR | |
| Negatif yüklü | − | D, E | GAN |
Kaldırıldı bazen yerine kullanılır Xaa, ancak daha az standarttır.
Ek olarak, birçok standart olmayan amino asitler belirli bir kodu var. Örneğin, çeşitli peptid ilaçları, örneğin Bortezomib ve MG132, vardır yapay olarak sentezlenmiş ve onların koruma grupları, belirli kodları olan. Bortezomib Pyz –Phe – boroLeu ve MG132 Z –Leu – Leu – Leu – al. Protein yapısının analizine yardımcı olmak için, foto-reaktif amino asit analogları mevcut. Bunlar arasında fotolösin (pLeu) ve fotometiyonin (pMet).[140]
Kimyasal analiz
Organik maddenin toplam nitrojen içeriği, esas olarak proteinlerdeki amino grupları tarafından oluşturulur. Toplam Kjeldahl Azotu (TKN ) genel olarak (atık) su, toprak, gıda, yem ve organik madde analizlerinde yaygın olarak kullanılan bir nitrojen ölçüsüdür. Adından da anlaşılacağı gibi, Kjeldahl yöntemi uygulanır. Daha hassas yöntemler mevcuttur.[141][142]
Ayrıca bakınız
Notlar
- ^ Proline bu genel formülün bir istisnasıdır. NH'den yoksundur2 grup yüzünden siklizasyon yan zincirin ve bir imino asit; özel yapılı amino asitler kategorisine girer.
- ^ Örneğin, geviş getiren hayvanlar İnekler gibi bir dizi amino asit, mikroplar içinde ilk iki mide odası.
Referanslar
- ^ Nelson DL, Cox MM (2005). Biyokimyanın İlkeleri (4. baskı). New York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ "amino asit". Cambridge Çevrimiçi Sözlükleri. Cambridge University Press. 2015. Alındı 3 Temmuz 2015.
- ^ Wagner I, Musso H (Kasım 1983). "Yeni Doğal Olarak Oluşan Amino Asitler". Angewandte Chemie International Edition İngilizce. 22 (11): 816–828. doi:10.1002 / anie.198308161.

- ^ Latham MC (1997). "Bölüm 8. Vücut bileşimi, besin, metabolizma ve enerjinin işlevleri". Gelişmekte olan dünyada insan beslenmesi. Gıda ve Beslenme Serisi - No. 29. Roma: Birleşmiş Milletler Gıda ve Tarım Örgütü.
- ^ Clark, Jim (Ağustos 2007). "Amino asitlere giriş". Chemguide. Alındı 4 Temmuz 2015.
- ^ Jakubke H, Sewald N (2008). "Amino asitler". A'dan Z'ye Peptitler: Kısa Bir Ansiklopedi. Almanya: Wiley-VCH. s. 20. ISBN 9783527621170 - Google Kitaplar aracılığıyla.
- ^ Pollegioni L, Servi S, editörler. (2012). Doğal Olmayan Amino Asitler: Yöntemler ve Protokoller. Moleküler Biyolojide Yöntemler. 794. Humana Press. s. v. doi:10.1007/978-1-61779-331-8. ISBN 978-1-61779-331-8. OCLC 756512314. S2CID 3705304.
- ^ Hertweck C (Ekim 2011). "22. Genetik Olarak Kodlanmış Amino Asit, Pirrolisinin Biyosentezi ve Yüklenmesi". Angewandte Chemie Uluslararası Sürümü. 50 (41): 9540–9541. doi:10.1002 / anie.201103769. PMID 21796749.

- ^ "Bölüm 1: Proteinler Vücudun İşçi Molekülleridir". Yaşam Yapıları. Ulusal Genel Tıp Bilimleri Enstitüsü. 27 Ekim 2011. Alındı 20 Mayıs 2008.
- ^ Michal G, Schomburg D, editörler. (2012). Biyokimyasal Yollar: Biyokimya ve Moleküler Biyoloji Atlası (2. baskı). Oxford: Wiley-Blackwell. s. 5. ISBN 978-0-470-14684-2.
- ^ a b Tjong H (2008). Protein Katlanması ve Bağlanmasına Elektrostatik Katkıların Modellenmesi (Doktora tezi). Florida Eyalet Üniversitesi. s. 1 dipnot.
- ^ a b Stewart L, Burgin AB (2005). Atta-Ur-Rahman, Springer BA, Caldwell GW (editörler). "Tüm Gen Sentezi: Gen-O-Matik Bir Gelecek". İlaç Tasarımı ve Keşifinde Sınırlar. Bentham Science Publishers. 1: 299. doi:10.2174/1574088054583318. ISBN 978-1-60805-199-1. ISSN 1574-0889.
- ^ a b Elzanowski A, Ostell J (7 Nisan 2008). "Genetik Kodlar". Ulusal Biyoteknoloji Bilgi Merkezi (NCBI). Alındı 10 Mart 2010.
- ^ a b Xie J, Schultz PG (Aralık 2005). "Genetik repertuvara amino asitler eklemek". Kimyasal Biyolojide Güncel Görüş. 9 (6): 548–554. doi:10.1016 / j.cbpa.2005.10.011. PMID 16260173.
- ^ a b Wang Q, Parrish AR, Wang L (Mart 2009). "Biyolojik çalışmalar için genetik kodu genişletmek". Kimya ve Biyoloji. 16 (3): 323–336. doi:10.1016 / j.chembiol.2009.03.001. PMC 2696486. PMID 19318213.
- ^ Simon M (2005). Acil hesaplama: biyoinformatiği vurgulamak. New York: AIP Press / Springer Science + Business Media. pp.105–106. ISBN 978-0-387-22046-8.
- ^ Petroff OA (Aralık 2002). "İnsan beyninde GABA ve glutamat". Sinirbilimci. 8 (6): 562–573. doi:10.1177/1073858402238515. PMID 12467378. S2CID 84891972.
- ^ Vickery HB, Schmidt CL (1931). "Amino asitlerin keşfinin tarihi". Chem. Rev. 9 (2): 169–318. doi:10.1021 / cr60033a001.
- ^ Hansen S (Mayıs 2015). "Die Entdeckung der proteinogenen Aminosäuren von 1805, Illinois, Paris bis 1935" (PDF) (Almanca'da). Berlin. Arşivlenen orijinal (PDF) 1 Aralık 2017.
- ^ Vauquelin LN, Robiquet PJ (1806). "The discovery of a new plant principle in Asparagus sativus". Annales de Chimie. 57: 88–93.
- ^ a b Anfinsen CB, Edsall JT, Richards FM (1972). Protein Kimyasındaki Gelişmeler. New York: Akademik Basın. pp.99, 103. ISBN 978-0-12-034226-6.
- ^ Wollaston WH (1810). "On cystic oxide, a new species of urinary calculus". Kraliyet Cemiyetinin Felsefi İşlemleri. 100: 223–230. doi:10.1098/rstl.1810.0015. S2CID 110151163.
- ^ Baumann E (1884). "Über cystin und cystein". Z Physiol Chem. 8 (4): 299–305. Arşivlenen orijinal 14 Mart 2011 tarihinde. Alındı 28 Mart 2011.
- ^ Braconnot HM (1820). "Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique". Annales de Chimie ve Physique. 2nd Series. 13: 113–125.
- ^ Simoni RD, Hill RL, Vaughan M (September 2002). "The discovery of the amino acid threonine: the work of William C. Rose [classical article]". Biyolojik Kimya Dergisi. 277 (37): E25. PMID 12218068.
- ^ McCoy RH, Meyer CE, Rose WC (1935). "Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid". Biyolojik Kimya Dergisi. 112: 283–302.
- ^ Menten, P. Dictionnaire de chimie: Une approche étymologique et historique. De Boeck, Bruxelles. bağlantı.
- ^ Harper D. "amino-". Çevrimiçi Etimoloji Sözlüğü. Alındı 19 Temmuz 2010.
- ^ Paal C (1894). "Ueber die Einwirkung von Phenyl‐i‐cyanat auf organische Aminosäuren". Berichte der Deutschen Chemischen Gesellschaft. 27: 974–979. doi:10.1002/cber.189402701205. Arşivlenen orijinal 25 Temmuz 2020.
- ^ Fruton JS (1990). "Chapter 5- Emil Fischer and Franz Hofmeister". Contrasts in Scientific Style: Research Groups in the Chemical and Biochemical Sciences. 191. Amerikan Felsefi Derneği. s. 163–165. ISBN 978-0-87169-191-0.
- ^ "Alpha amino acid". The Merriam-Webster.com Medical Dictionary. Merriam-Webster Inc.
- ^ Proline ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
- ^ Matts RL (2005). "Amino acids". Biochemistry 5753: Principles of Biochemistry. Arşivlenen orijinal 18 Ocak 2008. Alındı 3 Ocak 2015.
- ^ IUPAC, Kimyasal Terminoloji Özeti, 2. baskı. ("Altın Kitap") (1997). Çevrimiçi düzeltilmiş sürüm: (2006–) "Imino asitler ". doi:10.1351/goldbook.I02959
- ^ a b c d e f Creighton TH (1993). "Bölüm 1". Proteins: structures and molecular properties. San Francisco: W. H. Freeman. ISBN 978-0-7167-7030-5.
- ^ Pisarewicz K, Mora D, Pflueger FC, Fields GB, Marí F (May 2005). "Polypeptide chains containing D-gamma-hydroxyvaline". Amerikan Kimya Derneği Dergisi. 127 (17): 6207–6215. doi:10.1021/ja050088m. PMID 15853325.
- ^ van Heijenoort J (March 2001). "Formation of the glycan chains in the synthesis of bacterial peptidoglycan". Glikobiyoloji. 11 (3): 25R–36R. doi:10.1093/glycob/11.3.25R. PMID 11320055. S2CID 46066256.
- ^ Wolosker H, Dumin E, Balan L, Foltyn VN (July 2008). "D-Amino acids in the brain: D-serine in neurotransmission and neurodegeneration". FEBS Dergisi. 275 (14): 3514–3526. doi:10.1111/j.1742-4658.2008.06515.x. PMID 18564180.
- ^ Matthews BW (June 2009). "Rasemik kristalografi - kolay kristaller ve kolay yapılar: Neyi sevmemek?". Protein Bilimi. 18 (6): 1135–1138. doi:10.1002 / pro.125. PMC 2774423. PMID 19472321.
- ^ Hatem SM (2006). "Gas chromatographic determination of Amino Acid Enantiomers in tobacco and bottled wines". University of Giessen. Arşivlenen orijinal 22 Ocak 2009. Alındı 17 Kasım 2008.
- ^ Mitchell B (2019). Hücre ve Moleküler Biyoloji. Bilimsel e-Kaynaklar. pp. 294–29 5. ISBN 9781839474460.
- ^ "Nomenclature and Symbolism for Amino Acids and Peptides". IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. Arşivlenen orijinal 9 Ekim 2008'de. Alındı 17 Kasım 2008.
- ^ Jodidi SL (1 March 1926). "The Formol Titration of Certain Amino Acids". Amerikan Kimya Derneği Dergisi. 48 (3): 751–753. doi:10.1021/ja01414a033.
- ^ Liebecq C, ed. (1992). Biochemical Nomenclature and Related Documents (2. baskı). Portland Press. s. 39–69. ISBN 978-1-85578-005-7.
- ^ Smith AD (1997). Oxford Biyokimya ve Moleküler Biyoloji Sözlüğü. Oxford: Oxford University Press. s. 535. ISBN 978-0-19-854768-6. OCLC 37616711.
- ^ Simmons WJ, Meisenberg G (2006). Principles of medical biochemistry. Mosby Elsevier. s.19. ISBN 978-0-323-02942-1.
- ^ Fennema OR (19 June 1996). Food Chemistry 3rd Ed. CRC Basın. s. 327–328. ISBN 978-0-8247-9691-4.
- ^ Rodnina MV, Beringer M, Wintermeyer W (January 2007). "How ribosomes make peptide bonds". Biyokimyasal Bilimlerdeki Eğilimler. 32 (1): 20–26. doi:10.1016/j.tibs.2006.11.007. PMID 17157507.
- ^ Driscoll DM, Copeland PR (2003). "Mechanism and regulation of selenoprotein synthesis". Yıllık Beslenme İncelemesi. 23 (1): 17–40. doi:10.1146/annurev.nutr.23.011702.073318. PMID 12524431.
- ^ Krzycki JA (December 2005). "The direct genetic encoding of pyrrolysine". Mikrobiyolojide Güncel Görüş. 8 (6): 706–712. doi:10.1016/j.mib.2005.10.009. PMID 16256420.
- ^ Théobald-Dietrich A, Giegé R, Rudinger-Thirion J (2005). "Evidence for the existence in mRNAs of a hairpin element responsible for ribosome dependent pyrrolysine insertion into proteins". Biochimie. 87 (9–10): 813–817. doi:10.1016/j.biochi.2005.03.006. PMID 16164991.
- ^ Trifonov EN (December 2000). "Consensus temporal order of amino acids and evolution of the triplet code". Gen. 261 (1): 139–151. doi:10.1016/S0378-1119(00)00476-5.
- ^ Higgs PG, Pudritz RE (June 2009). "A thermodynamic basis for prebiotic amino acid synthesis and the nature of the first genetic code". Astrobiyoloji. 9 (5): 483–90. doi:10.1089/ast.2008.0280. PMID 19566427.
- ^ Chaliotis A, Vlastaridis P, Mossialos D, Ibba M, Becker HD, Stathopoulos C, Amoutzias GD (February 2017). "The complex evolutionary history of aminoacyl-tRNA synthetases". Nükleik Asit Araştırması. 45 (3): 1059–1068. doi:10.1093/nar/gkw1182. PMC 5388404. PMID 28180287.
- ^ a b c Ntountoumi C, Vlastaridis P, Mossialos D, Stathopoulos C, Iliopoulos I, Promponas V, et al. (Kasım 2019). "Low complexity regions in the proteins of prokaryotes perform important functional roles and are highly conserved". Nükleik Asit Araştırması. 47 (19): 9998–10009. doi:10.1093/nar/gkz730. PMC 6821194. PMID 31504783.
- ^ Vermeer C (March 1990). "Gamma-carboxyglutamate-containing proteins and the vitamin K-dependent carboxylase". Biyokimyasal Dergi. 266 (3): 625–636. doi:10.1042/bj2660625. PMC 1131186. PMID 2183788.
- ^ Bhattacharjee A, Bansal M (March 2005). "Collagen structure: the Madras triple helix and the current scenario". IUBMB Life. 57 (3): 161–172. doi:10.1080/15216540500090710. PMID 16036578.
- ^ Park MH (February 2006). "The post-translational synthesis of a polyamine-derived amino acid, hypusine, in the eukaryotic translation initiation factor 5A (eIF5A)". Biyokimya Dergisi. 139 (2): 161–169. doi:10.1093/jb/mvj034. PMC 2494880. PMID 16452303.
- ^ Blenis J, Resh MD (December 1993). "Subcellular localization specified by protein acylation and phosphorylation". Hücre Biyolojisinde Güncel Görüş. 5 (6): 984–989. doi:10.1016/0955-0674(93)90081-Z. PMID 8129952.
- ^ Curis E, Nicolis I, Moinard C, Osowska S, Zerrouk N, Bénazeth S, Cynober L (November 2005). "Almost all about citrulline in mammals". Amino asitler. 29 (3): 177–205. doi:10.1007/s00726-005-0235-4. PMID 16082501. S2CID 23877884.
- ^ Coxon KM, Chakauya E, Ottenhof HH, Whitney HM, Blundell TL, Abell C, Smith AG (August 2005). "Pantothenate biosynthesis in higher plants". Biyokimya Topluluğu İşlemleri. 33 (Pt 4): 743–746. doi:10.1042/BST0330743. PMID 16042590.
- ^ Ketchem RR, Hu W, Cross TA (September 1993). "High-resolution conformation of gramicidin A in a lipid bilayer by solid-state NMR". Bilim. 261 (5127): 1457–1460. Bibcode:1993Sci...261.1457K. doi:10.1126/science.7690158. PMID 7690158.
- ^ Khoury GA, Baliban RC, Floudas CA (Eylül 2011). "Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database". Bilimsel Raporlar. 1 (90): 90. Bibcode:2011NatSR...1E..90K. doi:10.1038/srep00090. PMC 3201773. PMID 22034591.
- ^ Kryukov GV, Castellano S, Novoselov SV, Lobanov AV, Zehtab O, Guigó R, Gladyshev VN (Mayıs 2003). "Memeli selenoproteomlarının karakterizasyonu". Bilim. 300 (5624): 1439–1443. Bibcode:2003Sci...300.1439K. doi:10.1126 / bilim.1083516. PMID 12775843.
- ^ Gromer S, Urig S, Becker K (January 2004). "The thioredoxin system—from science to clinic". Tıbbi Araştırma İncelemeleri. 24 (1): 40–89. doi:10.1002/med.10051. PMID 14595672.
- ^ Sakami W, Harrington H (1963). "Amino acid metabolism". Biyokimyanın Yıllık Değerlendirmesi. 32 (1): 355–398. doi:10.1146/annurev.bi.32.070163.002035. PMID 14144484.
- ^ Brosnan JT (April 2000). "Glutamate, at the interface between amino acid and carbohydrate metabolism". Beslenme Dergisi. 130 (4S Suppl.): 988S–990S. doi:10.1093/jn/130.4.988S. PMID 10736367.
- ^ Young VR, Ajami AM (September 2001). "Glutamine: the emperor or his clothes?". Beslenme Dergisi. 131 (9 Suppl.): 2449S–2459S, 2486S–2487S. doi:10.1093/jn/131.9.2449S. PMID 11533293.
- ^ Young VR (August 1994). "Adult amino acid requirements: the case for a major revision in current recommendations". Beslenme Dergisi. 124 (8 Suppl.): 1517S–1523S. doi:10.1093/jn/124.suppl_8.1517S. PMID 8064412.
- ^ Fürst P, Stehle P (June 2004). "What are the essential elements needed for the determination of amino acid requirements in humans?". Beslenme Dergisi. 134 (6 Suppl.): 1558S–1565S. doi:10.1093/jn/134.6.1558S. PMID 15173430.
- ^ Reeds PJ (July 2000). "İnsanlar için vazgeçilmez ve vazgeçilmez amino asitler". Beslenme Dergisi. 130 (7): 1835S-1840S. doi:10.1093 / jn / 130.7.1835S. PMID 10867060.
- ^ Imura K, Okada A (January 1998). "Amino acid metabolism in pediatric patients". Beslenme. 14 (1): 143–148. doi:10.1016/S0899-9007(97)00230-X. PMID 9437700.
- ^ Lourenço R, Camilo ME (2002). "Taurine: a conditionally essential amino acid in humans? An overview in health and disease". Nutricion Hospitalaria. 17 (6): 262–270. PMID 12514918.
- ^ Holtcamp W (March 2012). "The emerging science of BMAA: do cyanobacteria contribute to neurodegenerative disease?". Çevre Sağlığı Perspektifleri. 120 (3): A110–A116. doi:10.1289/ehp.120-a110. PMC 3295368. PMID 22382274.
- ^ Cox PA, Davis DA, Mash DC, Metcalf JS, Banack SA (January 2016). "Dietary exposure to an environmental toxin triggers neurofibrillary tangles and amyloid deposits in the brain". Bildiriler: Biyolojik Bilimler. 283 (1823): 20152397. doi:10.1098/rspb.2015.2397. PMC 4795023. PMID 26791617.
- ^ a b Brook MS, Wilkinson DJ, Phillips BE, Perez-Schindler J, Philp A, Smith K, Atherton PJ (January 2016). "Skeletal muscle homeostasis and plasticity in youth and ageing: impact of nutrition and exercise". Acta Physiologica. 216 (1): 15–41. doi:10.1111/apha.12532. PMC 4843955. PMID 26010896.
- ^ Lipton JO, Sahin M (October 2014). "The neurology of mTOR". Nöron. 84 (2): 275–291. doi:10.1016/j.neuron.2014.09.034. PMC 4223653. PMID 25374355.
Figure 2: The mTOR Signaling Pathway - ^ a b Phillips SM (May 2014). "A brief review of critical processes in exercise-induced muscular hypertrophy". Spor ilacı. 44 (Suppl. 1): S71–S77. doi:10.1007/s40279-014-0152-3. PMC 4008813. PMID 24791918.
- ^ Broadley KJ (March 2010). "The vascular effects of trace amines and amphetamines". Farmakoloji ve Terapötikler. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (Mayıs 2005). "Yeni bir GPCR ailesinden esinlenen eser aminlerde bir rönesans". Farmakolojik Bilimlerdeki Eğilimler. 26 (5): 274–281. doi:10.1016 / j.tips.2005.03.007. PMID 15860375.
- ^ Wang X, Li J, Dong G, Yue J (February 2014). "The endogenous substrates of brain CYP2D". Avrupa Farmakoloji Dergisi. 724: 211–218. doi:10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ Savelieva KV, Zhao S, Pogorelov VM, Rajan I, Yang Q, Cullinan E, Lanthorn TH (2008). Bartolomucci A (ed.). "Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants". PLOS ONE. 3 (10): e3301. Bibcode:2008PLoSO...3.3301S. doi:10.1371/journal.pone.0003301. PMC 2565062. PMID 18923670.
- ^ Shemin D, Rittenberg D (December 1946). "The biological utilization of glycine for the synthesis of the protoporphyrin of hemoglobin". Biyolojik Kimya Dergisi. 166 (2): 621–625. PMID 20276176.
- ^ Tejero J, Biswas A, Wang ZQ, Page RC, Haque MM, Hemann C, Zweier JL, Misra S, Stuehr DJ (November 2008). "Stabilization and characterization of a heme-oxy reaction intermediate in inducible nitric-oxide synthase". Biyolojik Kimya Dergisi. 283 (48): 33498–33507. doi:10.1074/jbc.M806122200. PMC 2586280. PMID 18815130.
- ^ Rodríguez-Caso C, Montañez R, Cascante M, Sánchez-Jiménez F, Medina MA (August 2006). "Mathematical modeling of polyamine metabolism in mammals". Biyolojik Kimya Dergisi. 281 (31): 21799–21812. doi:10.1074/jbc.M602756200. PMID 16709566.
- ^ a b Stryer L, Berg JM, Tymoczko JL (2002). Biyokimya (5. baskı). New York: W.H. Özgür adam. pp.693–698. ISBN 978-0-7167-4684-3.
- ^ Hylin JW (1969). "Toxic peptides and amino acids in foods and feeds". Tarım ve Gıda Kimyası Dergisi. 17 (3): 492–496. doi:10.1021/jf60163a003.
- ^ Turner BL, Harborne JB (1967). "Distribution of canavanine in the plant kingdom". Bitki kimyası. 6 (6): 863–866. doi:10.1016/S0031-9422(00)86033-1.
- ^ Ekanayake S, Skog K, Asp NG (May 2007). "Canavanine content in sword beans (Canavalia gladiata): analysis and effect of processing". Gıda ve Kimyasal Toksikoloji. 45 (5): 797–803. doi:10.1016/j.fct.2006.10.030. PMID 17187914.
- ^ Rosenthal GA (2001). "L-Canavanine: a higher plant insecticidal allelochemical". Amino asitler. 21 (3): 319–330. doi:10.1007/s007260170017. PMID 11764412. S2CID 3144019.
- ^ Hammond AC (May 1995). "Leucaena toxicosis and its control in ruminants". Hayvan Bilimleri Dergisi. 73 (5): 1487–1492. doi:10.2527/1995.7351487x. PMID 7665380.[kalıcı ölü bağlantı ]
- ^ a b Leuchtenberger W, Huthmacher K, Drauz K (November 2005). "Biotechnological production of amino acids and derivatives: current status and prospects". Uygulamalı Mikrobiyoloji ve Biyoteknoloji. 69 (1): 1–8. doi:10.1007/s00253-005-0155-y. PMID 16195792. S2CID 24161808.
- ^ Ashmead HD (1993). The Role of Amino Acid Chelates in Animal Nutrition. Westwood: Noyes Publications.
- ^ Garattini S (April 2000). "Glutamic acid, twenty years later". Beslenme Dergisi. 130 (4S Suppl.): 901S–909S. doi:10.1093/jn/130.4.901S. PMID 10736350.
- ^ Stegink LD (Temmuz 1987). "Aspartam hikayesi: bir gıda katkı maddesinin klinik testi için bir model". Amerikan Klinik Beslenme Dergisi. 46 (1 Suppl): 204–215. doi:10.1093 / ajcn / 46.1.204. PMID 3300262.
- ^ Albion Laboratories, Inc. "Albion Ferrochel Website". Alındı 12 Temmuz 2011.
- ^ Ashmead HD (1986). Foliar Feeding of Plants with Amino Acid Chelates. Park Ridge: Noyes Publications.
- ^ Turner EH, Loftis JM, Blackwell AD (March 2006). "Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan". Farmakoloji ve Terapötikler. 109 (3): 325–338. doi:10.1016/j.pharmthera.2005.06.004. PMID 16023217.
- ^ Kostrzewa RM, Nowak P, Kostrzewa JP, Kostrzewa RA, Brus R (March 2005). "Peculiarities of L-DOPA treatment of Parkinson's disease". Amino asitler. 28 (2): 157–164. doi:10.1007/s00726-005-0162-4. PMID 15750845. S2CID 33603501.
- ^ Heby O, Persson L, Rentala M (August 2007). "Targeting the polyamine biosynthetic enzymes: a promising approach to therapy of African sleeping sickness, Chagas' disease, and leishmaniasis". Amino asitler. 33 (2): 359–366. doi:10.1007/s00726-007-0537-9. PMID 17610127. S2CID 26273053.
- ^ Cruz-Vera LR, Magos-Castro MA, Zamora-Romo E, Guarneros G (2004). "Ribosome stalling and peptidyl-tRNA drop-off during translational delay at AGA codons". Nükleik Asit Araştırması. 32 (15): 4462–4468. doi:10.1093/nar/gkh784. PMC 516057. PMID 15317870.
- ^ Andy C (October 2012). "Molecules 'too dangerous for nature' kill cancer cells". Yeni Bilim Adamı.
- ^ "Lethal DNA tags could keep innocent people out of jail". Yeni Bilim Adamı. 2 Mayıs 2013.
- ^ Hanessian S (1993). "Reflections on the total synthesis of natural products: Art, craft, logic, and the chiron approach". Saf ve Uygulamalı Kimya. 65 (6): 1189–1204. doi:10.1351/pac199365061189.
- ^ Blaser HU (1992). "The chiral pool as a source of enantioselective catalysts and auxiliaries". Kimyasal İncelemeler. 92 (5): 935–952. doi:10.1021/cr00013a009.
- ^ Sanda F, Endo T (1999). "Syntheses and functions of polymers based on amino acids". Makromoleküler Kimya ve Fizik. 200 (12): 2651–2661. doi:10.1002/(SICI)1521-3935(19991201)200:12<2651::AID-MACP2651>3.0.CO;2-P.
- ^ Gross RA, Kalra B (August 2002). "Biodegradable polymers for the environment". Bilim. 297 (5582): 803–807. Bibcode:2002Sci...297..803G. doi:10.1126/science.297.5582.803. PMID 12161646.
- ^ Low KC, Wheeler AP, Koskan LP (1996). Commercial poly(aspartic acid) and Its Uses. Advances in Chemistry Series. 248. Washington DC.: Amerikan Kimya Derneği.
- ^ Thombre SM, Sarwade BD (2005). "Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review". Makromoleküler Bilim Dergisi, Bölüm A. 42 (9): 1299–1315. doi:10.1080/10601320500189604.
- ^ Bourke SL, Kohn J (April 2003). "Polymers derived from the amino acid L-tyrosine: polycarbonates, polyarylates and copolymers with poly(ethylene glycol)". Gelişmiş İlaç Teslimi İncelemeleri. 55 (4): 447–466. doi:10.1016/S0169-409X(03)00038-3. PMID 12706045.
- ^ Drauz K, Grayson I, Kleemann A, Krimmer H, Leuchtenberger W, Weckbecker C (2006). Ullmann'ın Endüstriyel Kimya Ansiklopedisi. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a02_057.pub2.
- ^ Jones RC, Buchanan BB, Gruissem W (2000). Biochemistry & molecular biology of plants. Rockville, Md: American Society of Plant Physiologists. pp.371–372. ISBN 978-0-943088-39-6.
- ^ Brosnan JT, Brosnan ME (June 2006). "The sulfur-containing amino acids: an overview". Beslenme Dergisi. 136 (6 Suppl.): 1636S–1640S. doi:10.1093 / jn / 136.6.1636S. PMID 16702333.
- ^ Kivirikko KI, Pihlajaniemi T (1998). "Collagen hydroxylases and the protein disulfide isomerase subunit of prolyl 4-hydroxylases". Enzimolojideki Gelişmeler ve Moleküler Biyolojinin İlgili Alanları. Advances in Enzymology – and Related Areas of Molecular Biology. 72. pp. 325–398. doi:10.1002/9780470123188.ch9. ISBN 9780470123188. PMID 9559057.
- ^ Whitmore L, Wallace BA (May 2004). "Analysis of peptaibol sequence composition: implications for in vivo synthesis and channel formation". Avrupa Biyofizik Dergisi. 33 (3): 233–237. doi:10.1007/s00249-003-0348-1. PMID 14534753. S2CID 24638475.
- ^ Alexander L, Grierson D (October 2002). "Ethylene biosynthesis and action in tomato: a model for climacteric fruit ripening". Deneysel Botanik Dergisi. 53 (377): 2039–2055. doi:10.1093/jxb/erf072. PMID 12324528.
- ^ Elmore DT, Barrett GC (1998). Amino acids and peptides. Cambridge, İngiltere: Cambridge University Press. pp.48 –60. ISBN 978-0-521-46827-5.
- ^ Gutteridge A, Thornton JM (November 2005). "Understanding nature's catalytic toolkit". Biyokimyasal Bilimlerdeki Eğilimler. 30 (11): 622–629. doi:10.1016/j.tibs.2005.09.006. PMID 16214343.
- ^ Ibba M, Söll D (May 2001). "The renaissance of aminoacyl-tRNA synthesis". EMBO Raporları. 2 (5): 382–387. doi:10.1093/embo-reports/kve095. PMC 1083889. PMID 11375928.
- ^ Lengyel P, Söll D (June 1969). "Mechanism of protein biosynthesis". Bakteriyolojik İncelemeler. 33 (2): 264–301. doi:10.1128/MMBR.33.2.264-301.1969. PMC 378322. PMID 4896351.
- ^ Wu G, Fang YZ, Yang S, Lupton JR, Turner ND (March 2004). "Glutathione metabolism and its implications for health". Beslenme Dergisi. 134 (3): 489–492. doi:10.1093/jn/134.3.489. PMID 14988435.
- ^ Meister A (November 1988). "Glutathione metabolism and its selective modification". Biyolojik Kimya Dergisi. 263 (33): 17205–17208. PMID 3053703.
- ^ Carpino LA (1992). "1-Hidroksi-7-azabenzotriazol. Etkili bir peptit bağlama katkısı". Amerikan Kimya Derneği Dergisi. 115 (10): 4397–4398. doi:10.1021 / ja00063a082.
- ^ Marasco D, Perretta G, Sabatella M, Ruvo M (October 2008). "Past and future perspectives of synthetic peptide libraries". Güncel Protein ve Peptit Bilimi. 9 (5): 447–467. doi:10.2174/138920308785915209. PMID 18855697.
- ^ Konara S, Gagnona K, Clearfield A, Thompson C, Hartle J, Ericson C, Nelson C (2010). "Structural determination and characterization of copper and zinc bis-glycinates with X-ray crystallography and mass spectrometry". Koordinasyon Kimyası Dergisi. 63 (19): 3335–3347. doi:10.1080/00958972.2010.514336.
- ^ Stipanuk MH (2006). Biochemical, physiological, & molecular aspects of human nutrition (2. baskı). Saunders Elsevier.
- ^ Dghaym RD, Dhawan R, Arndtsen BA (September 2001). "The Use of Carbon Monoxide and Imines as Peptide Derivative Synthons: A Facile Palladium-Catalyzed Synthesis of α-Amino Acid Derived Imidazolines". Angewandte Chemie. 40 (17): 3228–3230. doi:10.1002/(SICI)1521-3773(19980703)37:12<1634::AID-ANIE1634>3.0.CO;2-C. PMID 29712039.
- ^ Urry DW (2004). "The change in Gibbs free energy for hydrophobic association: Derivation and evaluation by means of inverse temperature transitions". Kimyasal Fizik Mektupları. 399 (1–3): 177–183. Bibcode:2004CPL...399..177U. doi:10.1016/S0009-2614(04)01565-9.
- ^ Marcotte EM, Pellegrini M, Yeates TO, Eisenberg D (Ekim 1999). "A census of protein repeats". Moleküler Biyoloji Dergisi. 293 (1): 151–60. doi:10.1006 / jmbi.1999.3136. PMID 10512723.
- ^ Haerty W, Golding GB (October 2010). Bonen L (ed.). "Low-complexity sequences and single amino acid repeats: not just "junk" peptide sequences". Genetik şifre. 53 (10): 753–62. doi:10.1139/G10-063. PMID 20962881.
- ^ Magee T, Seabra MC (April 2005). "Fatty acylation and prenylation of proteins: what's hot in fat". Hücre Biyolojisinde Güncel Görüş. 17 (2): 190–196. doi:10.1016/j.ceb.2005.02.003. PMID 15780596.
- ^ Pilobello KT, Mahal LK (June 2007). "Deciphering the glycocode: the complexity and analytical challenge of glycomics". Kimyasal Biyolojide Güncel Görüş. 11 (3): 300–305. doi:10.1016/j.cbpa.2007.05.002. PMID 17500024.
- ^ Smotrys JE, Linder ME (2004). "Palmitoylation of intracellular signaling proteins: regulation and function". Biyokimyanın Yıllık Değerlendirmesi. 73 (1): 559–587. doi:10.1146/annurev.biochem.73.011303.073954. PMID 15189153.
- ^ Kyte J, Doolittle RF (May 1982). "A simple method for displaying the hydropathic character of a protein". Moleküler Biyoloji Dergisi. 157 (1): 105–132. CiteSeerX 10.1.1.458.454. doi:10.1016/0022-2836(82)90515-0. PMID 7108955.
- ^ Freifelder D (1983). Physical Biochemistry (2. baskı). W. H. Freeman ve Şirketi. ISBN 978-0-7167-1315-9.[sayfa gerekli ]
- ^ Kozlowski LP (January 2017). "Proteome-pben: proteome isoelectric point database". Nükleik Asit Araştırması. 45 (D1): D1112–D1116. doi:10.1093/nar/gkw978. PMC 5210655. PMID 27789699.
- ^ a b Hausman RE, Cooper GM (2004). Hücre: moleküler bir yaklaşım. Washington, D.C: ASM Press. s. 51. ISBN 978-0-87893-214-6.
- ^ Aasland R, Abrams C, Ampe C, Ball LJ, Bedford MT, Cesareni G, Gimona M, Hurley JH, Jarchau T, Lehto VP, Lemmon MA, Linding R, Mayer BJ, Nagai M, Sudol M, Walter U, Winder SJ (Şubat 2002). "Modüler protein alanlarının ligandları olarak peptit motifleri için terminolojinin normalizasyonu". FEBS Mektupları. 513 (1): 141–144. doi:10.1111 / j.1432-1033.1968.tb00350.x. PMID 11911894.
- ^ IUPAC – IUB Biyokimyasal İsimlendirme Komisyonu (1972). "Amino asit dizileri için tek harfli gösterim". Saf ve Uygulamalı Kimya. 31 (4): 641–645. doi:10.1351 / pac197231040639. PMID 5080161.
- ^ Suchanek M, Radzikowska A, Thiele C (Nisan 2005). "Foto-lösin ve foto-metiyonin, canlı hücrelerdeki protein-protein etkileşimlerinin tanımlanmasına izin verir". Doğa Yöntemleri. 2 (4): 261–267. doi:10.1038 / nmeth752. PMID 15782218.
- ^ Muñoz-Huerta RF, Guevara-Gonzalez RG, Contreras-Medina LM, Torres-Pacheco I, Prado-Olivarez J, Ocampo-Velazquez RV (Ağustos 2013). "Bitkilerde nitrojen durumunu algılamak için yöntemlerin bir incelemesi: avantajlar, dezavantajlar ve son gelişmeler". Sensörler. Basel, İsviçre. 13 (8): 10823–43. doi:10.3390 / s130810823. PMC 3812630. PMID 23959242.
- ^ Martin PD, Malley DF, Manning G, Fuller L (2002). "Yakın kızılötesi spektroskopi kullanılarak tarla düzeyinde toprak organik karbonunun ve azotunun belirlenmesi". Kanada Toprak Bilimi Dergisi: 413–422. doi:10.4141 / S01-054.
daha fazla okuma
- Tymoczko JL (2012). "Protein Bileşimi ve Yapısı". Biyokimya. New York: W. H. Freeman ve şirket. s. 28–31. ISBN 9781429229364.
- Doolittle RF (1989). "Protein dizilerindeki fazlalıklar". Fasman GD'de (ed.). Protein Yapısının Tahminleri ve Protein Konformasyonunun Prensipleri. New York: Plenum Basın. s. 599–623. ISBN 978-0-306-43131-9. LCCN 89008555.
- Nelson DL, Cox MM (2000). Biyokimyanın Lehninger Prensipleri (3. baskı). Worth Yayıncıları. ISBN 978-1-57259-153-0. LCCN 99049137.
- Meierhenrich U (2008). Amino asitler ve hayatın asimetrisi (PDF). Berlin: Springer Verlag. ISBN 978-3-540-76885-2. LCCN 2008930865. 12 Ocak 2012 tarihinde orjinalinden arşivlendi.CS1 bakimi: BOT: orijinal url durumu bilinmiyor (bağlantı)
Dış bağlantılar
 İle ilgili medya Amino asit Wikimedia Commons'ta
İle ilgili medya Amino asit Wikimedia Commons'ta