Kan filmi - Blood film
| Kan filmi | |
|---|---|
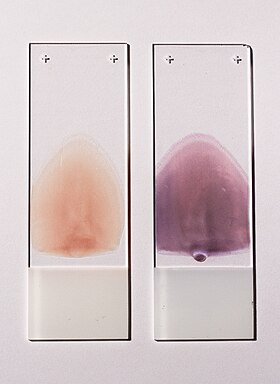 Hücresel kan elementlerinin karakterizasyonu için uygun iki itmeli tip periferik kan yayması. Sol smear boyanmamış, sağ smear Wright-Giemsa boyası ile boyanmış. | |
| ICD-9-CM | 90.5 |
| MedlinePlus | 003665 |
Bir kan filmi-veya periferik kan yayması- ince bir tabaka kan bir bardağa bulaşmış mikroskop lamı ve daha sonra çeşitli kan hücrelerinin mikroskobik olarak incelenmesine izin verecek şekilde boyandı. Araştırmada kan filmleri incelenir. hematolojik (kan) bozuklukları ve rutin olarak kan aramak için kullanılır parazitler, örneğin sıtma ve filaryazis.
Hazırlık
Kan filmleri, bir slaydın bir ucuna bir damla kan damlatılarak ve bir yayıcı sürgü kanı slaydın uzunluğu boyunca dağıtmak için. Amaç, hücrelerin sayılabilecek ve farklılaştırılabilecek kadar aralıklı olduğu, tek katman olarak adlandırılan bir bölge elde etmektir. Tek tabaka, kanı ileriye doğru çekerken yayıcı slayt tarafından oluşturulan "tüylü kenarda" bulunur.


Slayt havayla kurumaya bırakılır, ardından kan sabit slayda kısaca daldırarak metanol. Fiksatif, iyi boyama ve hücresel detayın sunumu için gereklidir. Sabitlemeden sonra slayt lekeli hücreleri birbirinden ayırmak için.
Tıbbi laboratuarlarda rutin kan analizi, genellikle lekeli kan filmleri üzerinde yapılır. Romanowsky lekeleri gibi Wright'ın lekesi, Giemsa lekesi veya Diff-Quik. Wright-Giemsa kombinasyon boyası da popüler bir seçimdir. Bu lekeler, Beyaz kan hücresi, kırmızı kan hücresi, ve trombosit anormallikler. Hematopatologlar genellikle kan bozukluklarının ayırıcı tanısına yardımcı olmak için diğer özel lekeleri kullanın.
Boyamadan sonra, tek tabaka 1000x'e kadar büyütme kullanılarak mikroskop altında görüntülendi. Bireysel hücreler incelenir ve morfolojileri karakterize edilir ve kaydedilir.[1][2]
Klinik önemi


Kan smear incelemesi genellikle bir tam kan sayımı anormal sonuçları araştırmak veya sonuçları teyit etmek için otomatik analizör güvenilmez olarak işaretledi.[3]
Kırmızı kan hücrelerinin şeklinin, boyutunun ve renginin mikroskobik incelenmesi, nedenini belirlemek için yararlıdır. anemi. Gibi bozukluklar demir eksikliği anemisi, Orak hücre anemisi, megaloblastik anemi ve mikroanjiyopatik hemolitik anemi kan filminde karakteristik anormalliklerle sonuçlanır.[2]
Farklı türlerin oranları Beyaz kan hücreleri kan yaymasından belirlenebilir. Bu bir kılavuz olarak bilinir beyaz kan hücresi farklılığı. Beyaz kan hücresi farklılığı, beyaz kan hücresi türlerinin oranlarındaki anormallikleri ortaya çıkarabilir. nötrofili ve eozinofili ve dolaşımdaki gibi anormal hücrelerin varlığı patlama hücreleri görülen Akut lösemi.[4] Beyaz kan hücrelerinin kalitatif anormallikleri, örneğin toksik granülasyon, kan yaymasında da görülebilir. Modern tam kan sayımı analizörleri otomatik bir beyaz kan hücresi diferansiyeli sağlayabilir, ancak bunların olgunlaşmamış ve anormal hücreleri ayırt etme konusunda sınırlı yetenekleri vardır, bu nedenle kan yaymasının manuel olarak incelenmesi sıklıkla endikedir.[5][6]
Kan smear incelemesi, sıtma ve sıtma gibi belirli parazit enfeksiyonları için tercih edilen tanı yöntemidir. babesiosis.[7] Nadiren, şiddetli hastalarda kan yaymasında bakteri görülebilir. sepsis.[8]
Sıtma

Sıtmanın tercih edilen ve en güvenilir teşhisi, kan filmlerinin mikroskobik incelemesidir, çünkü dört ana parazit türünün her biri ayırt edici özelliklere sahiptir. Geleneksel olarak iki tür kan filmi kullanılır.
- İnce filmler olağan kan filmlerine benzer ve türlerin tanımlanmasına izin verir, çünkü parazitin görünümü en iyi bu hazırlıkta korunur.
- Kalın filmler mikroskobun daha büyük hacimde kanı taramasına izin verin ve ince filmden yaklaşık on bir kat daha hassastır, bu nedenle kalın filmde düşük enfeksiyon seviyelerini yakalamak daha kolaydır, ancak parazitin görünümü çok daha bozuktur ve bu nedenle farklı türler çok daha zor olabilir.[9]
Deneyimli bir mikroskop, kalın filmden karşılaştıkları tüm parazitleri tespit edebilir. Dört türün tümünün erken trofozoitleri ("halka formu") özdeş göründüğünden ve türleri tek bir halka formu temelinde teşhis etmek asla mümkün olmadığından, mikroskobik teşhis zor olabilir; tür tanımlaması her zaman birkaç trofozoite dayanır.
Gelişmiş ülkelerdeki çoğu laboratuvardaki en büyük tuzak, kan örneği almakla kan filmlerini yapmak arasında çok büyük bir gecikme bırakmaktır. Kan oda sıcaklığına soğudukça erkek gametositler bölünecek ve serbest kalacaktır. mikrogametler: bunlar, aşağıdaki organizmalarla karıştırılabilecek uzun, kıvrımlı ipliksi yapılardır. Borrelia. Kan daha yüksek sıcaklıklarda tutulursa, şizonlar eritrositleri istila eden merozoitler parçalanacak ve merozoitler yanlışlıkla akolenin görünüşünü verecektir. P. falciparum. Eğer P. vivax veya P. ovale EDTA'da birkaç saat bırakılırsa, numunede asit birikmesi parazitlenmiş eritrositlerin küçülmesine neden olur ve parazit yuvarlanarak görünüşünü simüle eder. P. sıtma. Bu sorun, eğer antikoagülanlar gibi heparin veya sitrat kullanılmış. En az soruna neden olan antikoagülan EDTA. Genellikle Romanowsky boyası veya varyant boyası kullanılır. Bazı laboratuvarlar yanlışlıkla rutin hematoloji kan filmleri için yaptıklarıyla aynı boyama pH'ını kullanırlar (pH 6.8): sıtma kan filmleri pH 7.2'de boyanmalıdır, aksi takdirde Schüffner noktaları ve James'in noktaları görülmeyecektir.
İmmünokromatografik yakalama prosedürleri (hızlı teşhis testleri, örneğin sıtma antijen tespit testleri ) uygun mikroskopi uzmanlığına sahip olmayabilecek laboratuvar için mikroskopik olmayan tanı seçenekleridir.[10]
Referanslar
- ^ Denise Harmening (2009). "Bölüm 31: Hematoloji yöntemleri". Klinik Hematoloji ve Hemostazın Temelleri (5. baskı). F. A. Davis Şirketi. ISBN 978-0-8036-1732-2.
- ^ a b Mary Louise Turgeon (23 Mart 2015). "Bölüm 11: Klinik hematolojinin ilkeleri ve uygulaması". Linné & Ringsrud'un Klinik Laboratuvar Bilimi: Kavramlar, Prosedürler ve Klinik Uygulamalar (7. baskı). Elsevier Mosby. s. 321–323. ISBN 978-0-323-22545-8.
- ^ Gulati, Gene; Şarkı, Jinming; Dulau Florea, Alina; Gong, Jerald (2013). "Kan Yayma Taraması, Kan Yayması İncelemesi ve Kan Yayma İncelemesinin Amacı ve Kriterleri". Laboratuvar Tıbbı Yıllıkları. 33 (1): 1. doi:10.3343 / alm.2013.33.1.1. ISSN 2234-3806. PMC 3535191.
- ^ Choladda Vejabhuti Curry (14 Ocak 2015). "Farklı Kan Sayımı". Medscape. Alındı 12 Haziran 2019.
- ^ Buttarello, M; Plebani, M (Temmuz 2008). "Otomatik kan hücresi sayımı: son teknoloji". Amerikan Klinik Patoloji Dergisi. 130 (1): 104–16. doi:10.1309 / EK3C7CTDKNVPXVTN. PMID 18550479.
- ^ John P. Greer; Sherrie L. Perkins (Aralık 2008). "Bölüm 1: Kan ve kemik iliğinin incelenmesi". Wintrobe's Klinik Hematoloji. 1 (12. baskı). Philadelphia, PA: Lippincott Williams & Wilkins. s. 5–9. ISBN 978-0-7817-6507-7.
- ^ Jon E. Rosenblatt (2009). "Kan ve doku parazitlerine bağlı enfeksiyonların laboratuar teşhisi". Klinik Bulaşıcı Hastalıklar. 49 (7): 1103–1108. doi:10.1086/605574. PMID 19691431.
- ^ J. Gerard; E. Lebas; A. Godon; O. Blanchet; F. Genevieve; A. Mercat; M. Zandecki (2007). "Periferik kan yaymalarında serbest ve hücre içi bakteri: olumsuz prognozla ilgili nadir bir durum". Annales de biologie clinique. 65 (1): 87–91. PMID 17264045.
- ^ Warhurst DC, Williams JE (1996). "Sıtmanın laboratuar teşhisi". J Clin Pathol. 49 (7): 533–38. doi:10.1136 / jcp.49.7.533. PMC 500564. PMID 8813948.
- ^ Hempelmann E, Wilson RJ (1982). "Sıtma enzimlerinin immünopresipitasyonu". Protozooloji. 29: 637.
