Tam kan sayımı - Complete blood count
| Tam kan sayımı | |
|---|---|
 CBC ve farklı sonuçları gösteren bir çıktının önünde bir CBC örneği | |
| Eş anlamlı | Tam kan hücresi sayımı,[1] tam kan sayımı (FBC),[2] tam kan hücresi sayımı,[3] tam kan incelemesi (FBE),[2] hemogram[4] |
| MeSH | D001772 |
| MedlinePlus | 003642 |
| LOINC | CBC Kodları, Örneğin., 57021-8 |
| HCPCS-L2 | G0306 |
Bir tam kan sayımı (CBC) olarak da bilinir Tam kan sayımı (FBC), bir dizi Tıbbi laboratuvar sağlayan testler hücreler hakkında bilgi bir kişinin içinde kan. CBC, Beyaz kan hücreleri, Kırmızı kan hücreleri ve trombositler konsantrasyonu hemoglobin, ve hematokrit (kırmızı kan hücrelerinin hacim yüzdesi). kırmızı kan hücresi indeksleri kırmızı kan hücrelerinin ortalama boyutunu ve hemoglobin içeriğini gösteren, ayrıca rapor edilir ve beyaz kan hücresi farklılığı Farklı beyaz kan hücrelerini sayan, dahil edilebilir.
CBC genellikle tıbbi bir değerlendirmenin parçası olarak yürütülür ve sağlığı izlemek veya hastalıkları teşhis etmek için kullanılabilir. Sonuçlar karşılaştırılarak yorumlanır. referans aralıkları, cinsiyete ve yaşa göre değişir. Gibi koşullar anemi ve trombositopeni anormal tam kan sayımı sonuçları ile tanımlanır. Kırmızı kan hücresi indeksleri, bir kişinin anemisinin nedeni hakkında bilgi sağlayabilir. Demir eksikliği ve B12 vitamini eksikliği ve beyaz kan hücresi diferansiyelinin sonuçları tanı koymaya yardımcı olabilir viral, bakteriyel ve paraziter enfeksiyonlar ve Kan hastalıkları sevmek lösemi. Referans aralığının dışında kalan tüm sonuçlar tıbbi müdahale gerektirmez.
CBC, temel laboratuvar ekipmanı veya bir otomatik hematoloji analizörü, hangi hücreleri sayar boyutları ve yapıları hakkında bilgi toplar. Hemoglobin konsantrasyonu ölçülür ve kırmızı kan hücresi indeksleri, kırmızı kan hücreleri ve hemoglobin ölçümlerinden hesaplanır. Anormal sonuçları bağımsız olarak doğrulamak için manuel testler kullanılabilir. Örneklerin yaklaşık% 10-25'i bir kılavuz gerektirir Kan yayması gözden geçirmek,[5] kanın olduğu lekeli ve altında görüntülendi mikroskop analizör sonuçlarının hücrelerin görünümü ile tutarlı olduğunu doğrulamak ve anormallikleri aramak için. Hematokrit manuel olarak şu şekilde belirlenebilir: santrifüj kırmızı kan hücrelerinin numunesi ve oranının ölçülmesi ve otomatik cihazlara erişimi olmayan laboratuvarlarda, kan hücreleri mikroskop altında bir hemositometre.
1852'de, Karl Vierordt bir mikroskop lamı üzerine bilinen miktarda kan yaymayı ve her hücreyi saymayı içeren bir kan sayımı gerçekleştirmek için ilk prosedürü yayınladı. Hemositometrenin 1874 yılında icadı Louis-Charles Malassez kan hücrelerinin mikroskobik analizini basitleştirdi ve 19. yüzyılın sonlarında, Paul Ehrlich ve Dmitri Leonidovich Romanowsky kan yaymalarını incelemek için hala kullanılan beyaz ve kırmızı kan hücrelerini boyamak için teknikler geliştirdi. Hemoglobini ölçmek için otomatik yöntemler 1920'lerde geliştirildi ve Maxwell Wintrobe 1929'da Wintrobe hematokrit yöntemini tanıttı ve bu da onun kırmızı kan hücresi indekslerini tanımlamasına izin verdi. Kan hücresi sayımlarının otomasyonunda bir dönüm noktası, Coulter prensibi tarafından patenti alınmıştır. Wallace H. Coulter 1953'te. Coulter ilkesi, elektriksel empedans kan hücrelerini saymak ve boyutlarını ölçmek için ölçümler, birçok otomatik analizörde kullanımda kalan bir teknoloji. 1970'lerde daha fazla araştırma, optik beyaz kan hücresi diferansiyelinin otomasyonunu sağlayan hücreleri saymak ve tanımlamak için ölçümler.
Amaç

Kan, adı verilen sıvı bir kısımdan oluşur. plazma ve içeren hücresel bir bölüm Kırmızı kan hücreleri, Beyaz kan hücreleri ve trombositler.[not 1][7] Tam kan sayımı, kanın bu üç hücresel bileşenini değerlendirir. Gibi bazı tıbbi durumlar anemi veya trombositopeni, kan hücresi sayısındaki belirgin artış veya düşüşlerle tanımlanır.[8] Birçok değişiklik Organ sistemleri kanı etkileyebileceğinden, CBC sonuçları çok çeşitli koşulları araştırmak için yararlıdır. Sağladığı bilgi miktarı nedeniyle, tam kan sayımı en sık yapılanlardan biridir. Tıbbi laboratuvar testleri.[9][10][11]
CBC genellikle ekran tıbbi değerlendirmenin bir parçası olarak hastalıklar için.[12] Bir sağlık hizmeti sağlayıcısı, bir kişinin kan hücrelerini etkileyen bir hastalığı olduğundan şüphelendiğinde de çağrılır. enfeksiyon, bir kanama bozukluğu veya biraz kanserler. Anormal CBC sonuçlarına neden olabilecek bozukluklar teşhisi konmuş veya kan hücresi sayımlarını etkileyebilecek tedaviler alan kişiler, sağlıklarını izlemek için düzenli bir CBC yaptırabilir,[4][12] ve test genellikle her gün hastanede yatan kişilere yapılır.[13] Sonuçlar bir ihtiyaç olduğunu gösterebilir. kan veya trombosit transfüzyonu.[14]
Tam kan sayımının birçok alanda özel uygulamaları vardır. tıbbi uzmanlıklar. Genellikle bir kişi geçmeden önce yapılır. ameliyat anemiyi tespit etmek, trombosit seviyelerinin yeterli olmasını sağlamak ve enfeksiyon taraması yapmak,[15][16] ve ameliyattan sonra, böylece kan kaybı izlenebilir.[12][17] İçinde acil Tıp CBC, aşağıdakiler gibi çok sayıda semptomu araştırmak için kullanılır. ateş, karın ağrısı, ve nefes darlığı,[18][19][20] ve kanamayı değerlendirmek ve travma.[21][22] Hastalarda kan sayımı yakından izlenir kemoterapi veya radyasyon tedavisi kanser için, çünkü bu tedaviler kemik iliğinde kan hücrelerinin üretimini baskılar ve çok düşük seviyelerde beyaz kan hücreleri, trombositler ve hemoglobin.[23] Bazılarını alan kişiler için düzenli CBC'ler gereklidir. psikiyatrik ilaçlar, gibi klozapin ve karbamazepin, nadir durumlarda beyaz kan hücrelerinin sayısında yaşamı tehdit eden bir düşüşe neden olabilir (agranülositoz ).[24][25] Hamilelik sırasında anemi, anne ve bebeği için daha kötü sonuçlara yol açabileceğinden, tam kan sayımı rutin bir parçasıdır. doğum öncesi bakım;[26] ve yeni doğmuş bebek araştırmak için bir CBC gerekebilir sarılık veya içindeki olgunlaşmamış hücrelerin sayısını saymak için beyaz kan hücresi farklılığı bir göstergesi olabilir sepsis.[27][28]
Tam kan sayımı, hematoloji, kanla ilgili hastalıkların nedeni, prognozu, tedavisi ve önlenmesi üzerine yapılan çalışmadır.[29] CBC ve smear incelemesinin sonuçları, cihazın işleyişini yansıtmaktadır. hematopoietik sistem - organlar ve Dokular kan hücrelerinin üretimi ve geliştirilmesiyle ilgili, özellikle kemik iliği.[9][30] Örneğin, üç hücre türünün düşük bir sayısı (pansitopeni ) kan hücresi üretiminin bir kemik iliği bozukluğundan etkilendiğini gösterebilir ve kemik iliği muayenesi nedenini daha fazla araştırabilir.[31] Anormal hücreler Kan yayması gösterebilir Akut lösemi veya lenfoma,[30] Anormal derecede yüksek nötrofil veya lenfosit sayısı, bir kişinin semptomları ve kan yayması bulguları ile kombinasyon halinde, şüphe uyandırabilir. miyeloproliferatif bozukluk veya lenfoproliferatif bozukluk. CBC sonuçlarının ve kan yaymasının incelenmesi, aneminin nedenleri arasında ayrım yapmaya yardımcı olabilir. beslenme yetersizlikleri, kemik iliği bozuklukları, edinilmiş hemolitik anemiler ve kalıtsal koşullar gibi Orak hücre anemisi ve talasemi.[32][33]
referans aralıkları tam kan sayımı, görünüşte sağlıklı insanların% 95'inde bulunan sonuç aralığını temsil eder.[not 2][35] Tanım olarak, sonuçların% 5'i her zaman bu aralığın dışında kalacaktır, bu nedenle bazı anormal sonuçlar tıbbi bir sorunu belirtmek yerine doğal varyasyonu yansıtabilir.[36] Bu özellikle, bu tür sonuçlar referans aralığının biraz dışındaysa, kişinin önceki sonuçlarıyla tutarlıysa veya CBC'de başka ilgili anormallikler yoksa olasıdır.[37] Test nispeten sağlıklı bir popülasyonda yapıldığında, klinik olarak önemsiz anormalliklerin sayısı, hastalığı temsil eden sonuçların sayısını aşabilir.[38] Bu nedenle, Amerika Birleşik Devletleri, Birleşik Krallık ve Kanada'daki profesyonel kuruluşlar, ilgili tıbbi koşulları olmayan kişilerde düşük riskli ameliyatlar için ameliyat öncesi CBC testinin yapılmamasını önermektedir.[15][39][40] Hastanede yatan hastalarda hematoloji testi için tekrarlanan kan alımı, hastane kaynaklı anemi ve gereksiz transfüzyonlara neden olabilir.[38]
Prosedür
Numune, kan içeren bir tüpe kan çekilerek alınır. antikoagülan -tipik EDTA - doğallığını durdurmak için pıhtılaşma.[41] Kan genellikle bir damar, ancak bu zor olduğunda, şu kaynaklardan toplanabilir: kılcal damarlar tarafından parmak sopa veya bir topuktan kan alma bebeklerde.[42][43] Test tipik olarak otomatik bir analiz cihazında gerçekleştirilir, ancak anormal sonuçları araştırmak için kan yayma incelemesi veya manuel hematokrit testi gibi manuel teknikler kullanılabilir.[44] Hücre sayımı ve hemoglobin ölçümleri, otomatik cihazlara erişimi olmayan laboratuvarlarda manuel olarak yapılır.[45]
Otomatik
Analizörde, hücreleri eşit şekilde dağıtmak için numune karıştırılır, ardından seyreltilir ve biri kırmızı kan hücrelerini ve trombositleri saymak, diğeri beyaz kan hücrelerini saymak ve hemoglobin konsantrasyonunu belirlemek için en az iki kanala bölünür . Bazı cihazlar hemoglobini ayrı bir kanalda ölçer ve diferansiyel beyaz kan hücresi sayımları için ek kanallar kullanılabilir. retikülosit trombosit sayımı ve özel ölçümleri.[46][47][48] Hücreler bir sıvı akışında asılır ve özellikleri sensörlerden geçerken özellikleri ölçülür. akış sitometrisi.[not 3][49][52] Hidrodinamik odaklanma tek tek hücreleri izole etmek için kullanılabilir, böylece daha doğru sonuçlar elde edilebilir: seyreltilmiş numune, düşük basınçlı sıvı akışına enjekte edilir, bu da numunedeki hücrelerin tek bir dosyada sıralanmasına neden olur. laminer akış.[53][54]


Hemoglobin konsantrasyonunu ölçmek için bir reaktif yok etmek için numuneye kimyasal eklenir (Lyse kırmızı kan hücresi sayımı için kullanılandan farklı bir kanaldaki kırmızı hücreler. Hemoglobin ölçümü ile aynı kanalda beyaz kan hücresi sayımı yapan analizörlerde bu, beyaz kan hücrelerinin daha kolay sayılmasına olanak tanır.[55] Hematoloji analizörleri, hemoglobini ölçer spektrofotometri ve dayanmaktadır Doğrusal ilişki arasında emme ışık ve mevcut hemoglobin miktarı. Kimyasallar, farklı hemoglobin formlarını dönüştürmek için kullanılır. oksihemoglobin ve karboksihemoglobin, tek bir kararlı forma, genellikle siyanmethemoglobin ve kalıcı bir renk değişimi yaratmak. Belirli bir dalga boyunda ölçüldüğünde ortaya çıkan rengin absorbansı - genellikle 540 nanometre - hemoglobin konsantrasyonuna karşılık gelir.[56][57]
Sensörler, iki ana ilkeyi kullanarak numunedeki hücreleri sayar ve tanımlar: elektriksel empedans ve ışık saçılması.[58] Empedans temelli hücre sayımı, Coulter prensibi: hücreler bir sıvı taşıyan bir sıvıda asılıdır elektrik akımı ve küçük bir açıklıktan (bir açıklık) geçerken, zayıf olmaları nedeniyle akımda düşüşlere neden olurlar. elektiriksel iletkenlik. genlik of Voltaj Bir hücre açıklığı geçerken üretilen darbe, hücre tarafından yer değiştiren sıvı miktarı ve dolayısıyla hücrenin hacmi ile ilişkilidir,[59][60] toplam darbe sayısı ise numunedeki hücre sayısı ile ilişkilidir. Hücre hacimlerinin dağılımı bir histogram ve her hücre tipinin tipik boyutlarına göre hacim eşikleri ayarlanarak, farklı hücre popülasyonları tanımlanabilir ve sayılabilir.[61]
Işık saçma tekniklerinde, ışık lazer veya a tungsten-halojen lamba boyutları ve yapıları hakkında bilgi toplamak için hücre akışına yönlendirilir. Hücreler, ışının içinden geçerken ışığı farklı açılarda dağıtır, bu da kullanılarak tespit edilir. fotometreler.[62] Işının ekseni boyunca saçılan ışık miktarını ifade eden ileri saçılma esas olarak şunlardan kaynaklanır: kırınım ışık ve hücresel boyutla ilişkiliyken, yan saçılmanın (90 derecelik bir açıyla saçılan ışık) neden olduğu yansıma ve refraksiyon ve hücresel karmaşıklık hakkında bilgi sağlar.[62][63]
Radyo frekansı esaslı yöntemler empedans ile kombinasyon halinde kullanılabilir. Bu teknikler, hücreler bir açıklıktan geçerken akımdaki kesintiyi ölçmekle aynı prensip üzerinde çalışır, ancak yüksek frekans RF akımı hücrelere nüfuz eder, ortaya çıkan darbenin genliği, göreceli boyutu gibi faktörlerle ilgilidir. çekirdek çekirdeğin yapısı ve içindeki granül miktarı sitoplazma.[64][65] Boyut olarak trombositlere benzer olan küçük kırmızı hücreler ve hücresel kalıntılar trombosit sayımını etkileyebilir ve büyük trombositler doğru sayılmayabilir, bu nedenle bazı analizörler trombositleri ölçmek için ek teknikler kullanır. floresan boyama, çok açılı ışık saçılması ve monoklonal antikor etiketleme.[48]
Çoğu analizör, kırmızı kan hücrelerinin ortalama boyutunu doğrudan ölçer. ortalama hücre hacmi (MCV) ve kırmızı kan hücresi sayısını MCV ile çarparak hematokriti hesaplayın. Bazıları, kırmızı kan hücrelerinin toplam hacmini örneklenen kan hacmiyle karşılaştırarak hematokriti ölçer ve MCV'yi hematokrit ve kırmızı kan hücresi sayımından türetir.[66] Hemoglobin konsantrasyonu, kırmızı kan hücresi sayısı ve hematokrit, her kırmızı kan hücresindeki ortalama hemoglobin miktarını hesaplamak için kullanılır. ortalama korpüsküler hemoglobin (MCH); ve konsantrasyonu, ortalama korpüsküler hemoglobin konsantrasyonu (MCHC).[67] Başka bir hesaplama, kırmızı kan hücresi dağılım genişliği (RDW), standart sapma Ortalama hücre hacmi ve hücresel boyuttaki değişimi yansıtır.[68]

Reaktiflerle tedavi edildikten sonra, beyaz kan hücreleri, hacimleri bir histogram üzerinde grafiklendirildiğinde üç farklı tepe oluşturur. Bu zirveler kabaca şu nüfusa karşılık gelir: granülositler, lenfositler ve diğerleri mononükleer hücreler, tek başına hücre hacmine bağlı olarak üç bölümlü bir diferansiyelin gerçekleştirilmesine izin verir.[69][70] Daha gelişmiş analizörler, ışık saçılımı veya radyofrekans analizi gibi beş ila yedi bölümlü diferansiyel sağlamak için ek teknikler kullanır,[70] veya hücrelerin içindeki belirli kimyasalları boyamak için boyalar kullanmak - örneğin, nükleik asitler olgunlaşmamış hücrelerde daha yüksek konsantrasyonlarda bulunan[71] veya miyeloperoksidaz, bir enzim hücrelerinde bulundu miyeloid soy.[72][73] Bazofiller bir reaktifin diğer beyaz hücreleri yok ettiği ve bazofilleri sağlam bıraktığı ayrı bir kanalda sayılabilir. Bu ölçümlerden toplanan veriler analiz edilir ve bir dağılım diyagramı, her bir beyaz kan hücresi tipiyle ilişkili kümeler oluşturduğu yerde.[70][72] Diferansiyel sayımı otomatikleştirmeye yönelik bir başka yaklaşım, dijital mikroskopi yazılımının kullanılmasıdır.[74] hangi kullanır yapay zeka beyaz kan hücrelerini sınıflandırmak için fotomikrograflar kan yayması. Hücre görüntüleri, gerekirse hücreleri manuel olarak yeniden sınıflandırabilen bir insan operatöre görüntülenir.[75]
Çoğu analizörün tüm testleri tam kan sayımında çalıştırması bir dakikadan az sürer.[58] Analizörler birçok hücreyi örneklediğinden ve saydığından, sonuçlar çok kesindir.[76] Bununla birlikte, bazı anormal hücreler doğru şekilde tanımlanamayabilir, bu da aletin sonuçlarının manuel olarak incelenmesini ve aletin kategorize edemeyeceği diğer anormal hücreler aracılığıyla tanımlanmasını gerektirir.[5][77]
Bakım noktası testi
Bakım noktası testi Bir kişinin yatak başında veya bir klinikte olduğu gibi laboratuvar ortamı dışında yapılan testleri ifade eder.[78][79] Bu test yöntemi daha hızlıdır ve geleneksel yöntemlere göre daha az kan kullanır ve özel olarak eğitilmiş personel gerektirmez, bu nedenle acil durumlarda ve kaynaklara sınırlı erişime sahip alanlarda yararlıdır. Bakım noktası hematoloji testi için yaygın olarak kullanılan cihazlar şunları içerir: HemoCue, numunenin hemoglobin konsantrasyonunu ölçmek için spektrofotometri kullanan taşınabilir bir analiz cihazı ve i-STAT, kanın iletkenliğinden kırmızı kan hücrelerinin konsantrasyonunu tahmin ederek bir hemoglobin okuması elde eder.[79] Hemoglobin ve hematokrit, aşağıdakiler için tasarlanmış bakım noktası cihazlarında ölçülebilir: kan gazı testi, ancak bu ölçümler bazen standart yöntemlerle elde edilenlerle zayıf bir şekilde ilişkilendirilir.[78] Kliniklerde kullanılmak üzere tasarlanmış, tam kan sayımı ve diferansiyel sağlayabilen hematoloji analizörlerinin basitleştirilmiş versiyonları vardır.[80]
Manuel
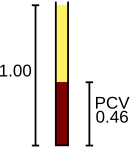
Testler, otomatik ekipman mevcut olmadığında veya analizör sonuçları daha fazla araştırmanın gerekli olduğunu gösterdiğinde manuel olarak gerçekleştirilebilir.[45] Otomatik sonuçlar, vakaların% 10-25'inde manuel kan smear incelemesi için işaretlenir; bu, analizörün düzgün şekilde sayamadığı anormal hücre popülasyonlarından kaynaklanıyor olabilir,[5] Analizör tarafından oluşturulan ve sonuçların yanlış olabileceğini gösteren dahili işaretler,[81] veya belirlenen eşiklerin dışında kalan sayısal sonuçlar.[77] Bu sorunları araştırmak için kan bir mikroskop lamı üzerine yayılır ve Romanowsky lekesi ve bir altında incelendi mikroskop.[82] Kırmızı ve beyaz kan hücrelerinin ve trombositlerin görünümü değerlendirilir ve varsa kalitatif anormallikler rapor edilir.[83] Kırmızı kan hücrelerinin görünümündeki değişiklikler, tanısal açıdan önemli bir öneme sahip olabilir - örneğin, orak hücrelerin varlığı, Orak hücre hastalığı ve çok sayıda parçalanmış kırmızı kan hücresi (şistositler ) önerebileceğinden acil soruşturma gerektirir mikroanjiyopatik hemolitik anemi.[84] Bazı iltihaplı durumlarda ve paraprotein gibi bozukluklar multipil myeloma, kandaki yüksek protein seviyeleri, kırmızı kan hücrelerinin smear üzerinde üst üste yığılmış görünmesine neden olabilir. Rouleaux.[85] Biraz paraziter hastalıklar, gibi sıtma ve babesiosis smear üzerinde etken organizmalar bularak tespit edilebilir,[86] ve trombosit sayısı, kan yaymasından tahmin edilebilir; bu, otomatik trombosit sayısının yanlış olması durumunda yararlıdır.[77]
Manuel bir beyaz kan hücresi diferansiyeli gerçekleştirmek için mikroskopist, kan yaymasında 100 hücreyi sayar ve bunları görünümlerine göre sınıflandırır; bazen 200 hücre sayılır.[87] Bu, her bir beyaz kan hücresi türünün yüzdesini verir ve bu yüzdelerin toplam beyaz kan hücresi sayısı ile çarpılmasıyla, her bir beyaz hücre türünün mutlak sayısı elde edilebilir.[88] Manuel sayım tabi örnekleme hatası otomatik analize kıyasla çok az hücre sayıldığından,[76] ancak analizcilerin yapamadığı anormal hücreleri tanımlayabilir,[72][77] benzeri patlama hücreleri akut lösemide görülür.[89] Klinik olarak önemli özellikler toksik granülasyon ve boşluk beyaz kan hücrelerinin mikroskobik incelemesinden de kesinleştirilebilir.[90]
Hematokrit, kılcal bir tüpü kanla doldurarak, santrifüjleyerek ve kırmızı kan hücrelerinden oluşan kan yüzdesini ölçerek manuel olarak gerçekleştirilebilir.[66] Bu, otomatik hematokrit sonuçlarının yanlış olmasına neden olabilecek bazı durumlarda yararlıdır. polisitemi (oldukça yüksek kırmızı kan hücresi sayısı)[66] veya şiddetli lökositoz (beyaz kan hücrelerinin kırmızı küre olarak sayılmasına neden olarak kırmızı kan hücresi ölçümlerini engelleyen, oldukça yüksek bir beyaz kan hücresi sayısı).[91]


Kırmızı ve beyaz kan hücreleri ve trombositler, bir hemositometre, belirli hacimde seyreltilmiş kanı tutan bir hazne içeren bir mikroskop lamı. Hemositometrenin odası, hücre sayımına yardımcı olmak için kalibre edilmiş bir ızgara ile oyulur. Izgarada görülen hücreler sayılır ve numunedeki hücre konsantrasyonunu elde etmek için ızgarada sayılan kare sayısından belirlenen incelenen kan hacmine bölünür.[45][92] Manuel hücre sayımları, otomatik yöntemlerle karşılaştırıldığında yoğun emek gerektirir ve yanlıştır, bu nedenle otomatik analizörlere erişimi olmayan laboratuvarlar dışında nadiren kullanılırlar.[45][92] Beyaz kan hücrelerini saymak için örnek, kırmızı kan hücrelerini parçalayan bir bileşik içeren bir sıvı kullanılarak seyreltilir. amonyum oksalat, asetik asit veya hidroklorik asit.[93] Bazen seyrelticiye beyaz kan hücrelerinin çekirdeklerini vurgulayan ve tanımlanmalarını kolaylaştıran bir leke eklenir. Bazı yöntemler kırmızı kan hücrelerini sağlam bıraksa da, manuel trombosit sayımı benzer şekilde yapılır. Bir faz kontrast mikroskobu yerine ışık mikroskobu trombositlerin tanımlanmasını kolaylaştırabilir.[94] Manuel kırmızı kan hücresi sayımı, hatalı olduğu için nadiren yapılır ve kırmızı kan hücrelerini değerlendirmek için hemoglobinometri ve manuel hematokrit gibi diğer yöntemler mevcuttur; ancak gerekliyse, salinle seyreltilmiş kanda kırmızı kan hücreleri sayılabilir.[95]
Hemoglobin, bir spektrofotometre veya kolorimetre. Hemoglobini manuel olarak ölçmek için örnek, hemoglobini serbest bırakmak için kırmızı kan hücrelerini yok eden reaktifler kullanılarak seyreltilir. Diğer kimyasallar, farklı hemoglobini tek bir forma dönüştürmek için kullanılır ve böylece kolayca ölçülebilir. Çözüm daha sonra bir ölçüme yerleştirilir küvet ve absorbans, kullanılan reaktifin tipine bağlı olan belirli bir dalga boyunda ölçülür. Absorbans ve hemoglobin konsantrasyonu arasındaki ilişkiyi belirlemek için bilinen miktarda hemoglobin içeren bir referans standardı kullanılır ve numunenin hemoglobin seviyesinin ölçülmesini sağlar.[96]
Kırsal ve ekonomik olarak dezavantajlı bölgelerde, mevcut testler ekipman ve personele erişimle sınırlıdır. Şurada: Birincil bakım Bu bölgelerdeki tesisler, testler kırmızı hücre morfolojisinin incelenmesi ve hemoglobinin manuel ölçümü ile sınırlı olabilirken, manuel hücre sayımı ve farklılıklar gibi daha karmaşık teknikler ve bazen otomatik hücre sayımı bölge laboratuvarlarında gerçekleştirilir. Bölgesel ve il hastaneleri ve akademik merkezler tipik olarak otomatik analizörlere erişime sahiptir. Laboratuvar olanaklarının bulunmadığı durumlarda, standartlaştırılmış tipte bir emici kağıt üzerine bir damla kan yerleştirilerek ve bunu bir renk skalası ile karşılaştırarak hemoglobin konsantrasyonu tahmini elde edilebilir.[97]
Kalite kontrol
Otomatik analizörlerin düzenli olması gerekir kalibre edilmiş. Çoğu üretici, korunmuş kanı tanımlanmış parametrelerle sağlar ve sonuçlar tanımlanan eşiklerin dışındaysa analizörler ayarlanır.[98] Sonuçların doğru olmaya devam etmesini sağlamak için, tipik olarak cihaz üreticisi tarafından sağlanan kalite kontrol numuneleri günde en az bir kez test edilir. Örnekler, belirli sonuçlar sağlayacak şekilde formüle edilir ve laboratuvarlar, aletin düzgün çalıştığından emin olmak için sonuçlarını bilinen değerlerle karşılaştırır.[99][100] Ticari kalite kontrol materyaline erişimi olmayan laboratuvarlar için Hintli bir düzenleyici kurum, hasta numunelerinin iki kopya halinde çalıştırılmasını ve sonuçların karşılaştırılmasını önermektedir.[101] Bir hareketli ortalama hasta numuneleri için ortalama sonuçların aralıklarla ölçüldüğü ölçüm, ek bir kalite kontrol tekniği olarak kullanılabilir. Hasta popülasyonunun özelliklerinin zaman içinde kabaca aynı kaldığını varsayarsak, ortalama sabit kalmalıdır; ortalama değerdeki büyük kaymalar cihaz sorunlarını gösterebilir.[99][100] MCHC değerleri bu bağlamda özellikle yararlıdır.[102]
Dahili analizin yanı sıra kalite kontrol sonuçları bilinen numuneler, laboratuvarlar alabilir dış kalite değerlendirmesi düzenleyici kuruluşlardan örnekler. İç kalite kontrolün amacı, analizör sonuçlarının tekrarlanabilir Belirli bir laboratuvarda, dış kalite değerlendirmesi, farklı laboratuvarlardan alınan sonuçların birbiriyle ve hedef değerlerle tutarlı olduğunu doğrular.[103] Dış kalite değerlendirme numuneleri için beklenen sonuçlar laboratuvara açıklanmaz.[104] Dış kalite değerlendirme programları, Kuzey Amerika ve Batı Avrupa'da yaygın olarak benimsenmiştir,[99] ve laboratuvarların genellikle bu programlara katılması gerekir. akreditasyon.[105] Lojistik konular, yetersiz kaynaklara sahip alanlardaki laboratuvarların dış kalite değerlendirme şemalarını uygulamalarını zorlaştırabilir.[106]
Dahil edilen testler
CBC'deki testler, hemoglobin ve hematokrit değerleriyle birlikte trombosit ve kırmızı ve beyaz kan hücrelerinin miktarlarını ölçer. Kırmızı kan hücrelerinin boyutunu ve hemoglobin içeriğini tanımlayan kırmızı kan hücresi endeksleri - MCV, MCH ve MCHC - kırmızı kan boyutlarındaki varyasyon miktarını ölçen kırmızı kan hücresi dağılım genişliği (RDW) ile birlikte rapor edilir. hücreler. Farklı beyaz kan hücrelerini numaralandıran bir beyaz kan hücresi diferansiyeli gerçekleştirilebilir ve bazen olgunlaşmamış kırmızı kan hücrelerinin (retikülositler) sayımı dahil edilir.[4][107]
Kırmızı kan hücreleri, hemoglobin ve hematokrit
| Analit | Sonuç | Normal alan |
|---|---|---|
| Kırmızı hücre sayısı | 5,5 x 1012/ L | 4.5–5.7 |
| Beyaz hücre sayısı | 9,8 x 109/ L | 4.0–10.0 |
| Hemoglobin | 123 g / L | 133–167 |
| Hematokrit | 0.42 | 0.35–0.53 |
| MCV | 76 fL | 77–98 |
| MCH | 22,4 pg | 26–33 |
| MCHC | 293 g / L | 330–370 |
| RDW | 14.5% | 10.3–15.3 |
Kırmızı kan hücreleri verir oksijen -den akciğerler dokulara ve dönüşlerinde karbon dioksit ekshale edildiği akciğerlere geri dönün. Bu işlevlere hücrelerin hemoglobini aracılık eder.[109] Analizör, sonucu 10'luk birimler halinde bildirerek kırmızı kan hücrelerini sayar6 mikrolitre kan başına hücre sayısı (× 106/ μL) veya 1012 litre başına hücre (× 1012/ L) ve ortalama boyutlarını ölçer, buna ortalama hücre hacmi ve ifade edilen Femtolitres veya kübik mikrometre.[4] Ortalama hücre hacminin kırmızı kan hücresi sayımı, hematokrit (HCT) veya kırmızı kan hücrelerinden oluşan kan yüzdesinin bir ölçümü olan paketlenmiş hücre hacmi (PCV) ile çarpılmasıyla elde edilebilir;[66] ve hematokrit doğrudan uygulandığında, ortalama hücre hacmi hematokrit ve kırmızı kan hücresi sayımından hesaplanabilir.[110][111] Kırmızı kan hücreleri parçalandıktan sonra ölçülen hemoglobin, genellikle gram / litre (g / L) veya desilitre başına gram (g / dL) birimlerinde rapor edilir.[112] Kırmızı kan hücrelerinin normal olduğunu varsayarsak, hemoglobin ve hematokrit arasında sabit bir ilişki vardır: hematokrit yüzdesi, hemoglobin değerinden yaklaşık üç kat daha büyüktür, artı veya eksi üç. Bu ilişki üç kural, CBC sonuçlarının doğru olduğunu onaylamak için kullanılabilir.[113]
Kırmızı kan hücresi sayımı, hemoglobin konsantrasyonu ve hematokritten diğer iki ölçüm hesaplanır: ortalama korpüsküler hemoglobin ve ortalama korpüsküler hemoglobin konsantrasyonu.[114][115] Bu parametreler, her kırmızı kan hücresinin hemoglobin içeriğini tanımlar. MCH ve MCHC kafa karıştırıcı olabilir; özünde MCH, kırmızı kan hücresi başına ortalama hemoglobin miktarının bir ölçüsüdür. MCHC, hemoglobin olan hücrenin ortalama oranını verir. MCH, kırmızı kan hücrelerinin boyutunu hesaba katmazken, MCHC bunu yapar.[116] Toplu olarak, MCV, MCH ve MCHC, kırmızı kan hücresi indeksleri.[114][115] Bu indekslerdeki değişiklikler kan yaymasında görülebilir: anormal derecede büyük veya küçük olan kırmızı kan hücreleri, beyaz kan hücrelerinin boyutlarına kıyasla belirlenebilir ve düşük hemoglobin konsantrasyonuna sahip hücreler soluk görünür.[117] Diğer bir parametre, kırmızı kan hücrelerinin ilk ölçümlerinden hesaplanır: kırmızı kan hücresi dağılım genişliği veya hücrelerin boyutundaki varyasyon derecesini yansıtan RDW.[118]

Anormal derecede düşük hemoglobin, hematokrit veya kırmızı kan hücresi sayısı anemiyi gösterir.[119] Anemi kendi başına bir tanı değildir, ancak kişinin kırmızı kan hücrelerini etkileyen altta yatan bir duruma işaret eder.[88] Aneminin genel nedenleri arasında kan kaybı, kusurlu kırmızı kan hücrelerinin üretimi (etkisiz eritropoeis ), kırmızı kan hücrelerinin üretiminde azalma (yetersiz eritropoeis) ve kırmızı kan hücrelerinin artmış yıkımı (hemolitik anemi ).[120] Anemi, kanın oksijen taşıma kabiliyetini azaltarak yorgunluk ve nefes darlığı gibi semptomlara neden olur.[121] Hemoglobin seviyesi, kişinin klinik durumuna bağlı olarak eşik değerlerin altına düşerse, kan nakli gerekli olabilir.[122]
Genellikle hemoglobin ve hematokritte artışa yol açan kırmızı kan hücrelerinin sayısının artması polisitemi olarak adlandırılır.[not 4][126] Dehidrasyon veya kullanımı diüretikler kırmızı hücrelere kıyasla plazma miktarını azaltarak "göreceli" bir polisitemiye neden olabilir. Mutlak polisitemi adı verilen kırmızı kan hücrelerinin sayısında gerçek bir artış, vücut kronik olarak telafi etmek için daha fazla kırmızı kan hücresi ürettiğinde ortaya çıkabilir. düşük oksijen seviyeleri gibi koşullarda akciğer veya kalp hastalığı veya bir kişi anormal derecede yüksek seviyelerde olduğunda eritropoietin (EPO), kırmızı kan hücrelerinin üretimini uyaran bir hormon. İçinde polisitemi vera, kemik iliği aşırı yüksek oranda kırmızı hücreler ve diğer kan hücreleri üretir.[127]
Kırmızı kan hücresi indekslerinin değerlendirilmesi, aneminin nedenini belirlemede yardımcı olur. MCV düşükse, anemi olarak adlandırılır mikrositik yüksek MCV'ye sahip anemi denir makrositik anemi. Düşük MCHC'li anemi denir hipokromik anemi. Anemi mevcutsa ancak kırmızı kan hücresi indeksleri normalse anemi kabul edilir. normokromik ve normositik.[117] Dönem hiperkromiyüksek bir MCHC'ye atıfta bulunarak, genellikle kullanılmaz. MCHC'nin üst referans değerinin üzerine yükselmesi nadirdir, özellikle aşağıdaki gibi durumlarda meydana gelir sferositoz orak hücre hastalığı ve hemoglobin C hastalığı.[115][128] Yüksek bir MCHC, aşağıdaki gibi koşullardan da yanlış bir sonuç olabilir: kırmızı kan hücresi aglütinasyonu (kırmızı kan hücresi sayısında yanlış bir azalmaya neden olarak MCHC'yi yükseltir)[129][130] veya çok yüksek miktarlarda lipidler kanda (hemoglobin sonucunda yanlış bir artışa neden olur).[128][131]
Mikrositik anemi tipik olarak demir eksikliği, talasemi ve kronik hastalık anemisi makrositik anemi ile ilişkili iken alkolizm, folat ve B12 eksikliği, bazı ilaçların kullanımı ve bazı kemik iliği hastalıkları. Akut kan kaybı, hemolitik anemi, kemik iliği bozuklukları ve çeşitli kronik hastalıklar, normositik kan tablosu ile anemiye neden olabilir.[115][132] MCV, laboratuvar kalite kontrolünde ek bir amaca hizmet eder. Diğer CBC parametrelerine kıyasla zaman içinde nispeten stabildir, bu nedenle MCV'deki büyük bir değişiklik, numunenin yanlış hastadan alındığını gösterebilir.[133] Düşük RDW'nin klinik önemi yoktur, ancak yüksek RDW, kırmızı kan hücresi boyutunda artmış varyasyonu temsil eder. anizositoz.[118] Anizositoz, beslenme anemisinde yaygındır. demir eksikliği anemisi ve B12 vitamini veya folat eksikliğine bağlı anemi, talasemili kişilerde normal RDW olabilir.[118] CBC sonuçlarına göre, anemiyi araştırmak için başka adımlar atılabilir. ferritin demir eksikliğinin varlığını doğrulamak için test veya hemoglobin elektroforezi teşhis etmek hemoglobinopati talasemi veya orak hücre hastalığı gibi.[134]
Beyaz kan hücreleri
|
|
Beyaz kan hücreleri enfeksiyonlara karşı savunma yapar ve Tahrik edici cevap.[136] Lökositoz adı verilen yüksek beyaz kan hücresi sayısı genellikle enfeksiyonlarda, iltihaplanmalarda ve fizyolojik stres. Miyeloproliferatif ve lenfoproliferatif bozukluklar gibi anormal kan hücrelerinin üretimini içeren hastalıklardan da kaynaklanabilir.[137] Beyaz kan hücresi sayısında azalma lökopeni enfeksiyon kapma riskinin artmasına neden olabilir,[138] kemoterapi ve radyasyon tedavisi gibi tedavilerde ve kan hücrelerinin üretimini engelleyen birçok durumda ortaya çıkar.[139] Sepsis, hem lökositoz hem de lökopeni ile ilişkilidir.[140] Toplam beyaz kan hücresi sayısı genellikle kan mikrolitresi (/ μL) veya 109 litre başına hücre (× 109/ L).[4]
Beyaz kan hücresi diferansiyelinde, farklı beyaz kan hücreleri türleri tanımlanır ve sayılır. Sonuçlar yüzde olarak ve birim hacim başına mutlak sayı olarak rapor edilir. Beş tür beyaz kan hücresi—nötrofiller, lenfositler, monositler, eozinofiller, ve bazofiller - tipik olarak ölçülür.[141] Bazı cihazlar, nötrofillerin öncülerinden oluşan bir sınıflandırma olan olgunlaşmamış granülositlerin sayısını bildirir; özellikle, promiyelositler, miyelositler ve metamiyelositler.[not 5][144] Manuel diferansiyelde tanımlanırlarsa diğer hücre türleri de rapor edilir.[145]
Farklı sonuçlar, birçok tıbbi durumun teşhisi ve izlenmesinde faydalıdır. Örneğin, yüksek nötrofil sayısı (nötrofili ) bakteriyel enfeksiyon, iltihaplanma ve miyeloproliferatif bozukluklarla ilişkilidir,[146][147] azalan sayı (nötropeni Kemoterapi gören veya belirli ilaçları alan veya kemik iliğini etkileyen hastalıkları olan kişilerde ortaya çıkabilir.[148][149] Nötropeni ayrıca bazılarından kaynaklanabilir. doğuştan bozukluklar ve çocuklarda viral veya bakteriyel enfeksiyonlardan sonra geçici olarak ortaya çıkabilir.[150] Şiddetli nötropeni ve klinik enfeksiyon belirtileri olan kişiler, potansiyel olarak yaşamı tehdit eden hastalığı önlemek için antibiyotiklerle tedavi edilir.[151]

Artan sayıda bant nötrofiller - bölümlenmiş çekirdeklerden yoksun genç nötrofiller - veya olgunlaşmamış granülositler olarak adlandırılır Sol shift ve sepsis ve bazı kan hastalıklarında ortaya çıkar, ancak gebelikte normaldir.[152][153] Yüksek lenfosit sayısı (lenfositoz ) ile ilişkilidir viral enfeksiyon[6] ve lenfoproliferatif bozukluklar sevmek kronik lenfositik lösemi;[154] yüksek monosit sayıları (monositoz ) kronik enflamatuar durumlarla ilişkilidir;[155] and the eosinophil count is often increased (eozinofili ) in parasitic infections and allergic conditions.[156] An increased number of basophils, termed bazofili, can occur in myeloproliferative disorders like Kronik miyeloid lösemi and polycythemia vera.[147] The presence of some types of abnormal cells, such as blast cells or lymphocytes with neoplastik features, is suggestive of a hematolojik malignite.[89][157]
Trombositler
Platelets play an essential role in clotting. When the wall of a kan damarı is damaged, platelets adhere to the exposed surface at the site of injury and plug the gap. Simultaneous activation of the pıhtılaşma çağlayan oluşumu ile sonuçlanır fibrin, which reinforces the platelet plug to create a stable pıhtı.[158] A low platelet count, known as thrombocytopenia, may cause bleeding if severe.[159] It can occur in individuals who are undergoing treatments that suppress the bone marrow, such as chemotherapy or radiation therapy, or taking certain drugs, such as heparin, that can induce the immune system to destroy platelets. Thrombocytopenia is a feature of many blood disorders, like acute leukemia and aplastik anemi yanı sıra bazı otoimmün hastalıklar.[160][161] If the platelet count is extremely low, a platelet transfusion may be performed.[162] Trombositoz, meaning a high platelet count, may occur in states of inflammation or trauma,[163] as well as in iron deficiency,[164] and the platelet count may reach exceptionally high levels in people with esansiyel trombositemi, a rare blood disease.[163] The platelet count can be reported in units of cells per microlitre of blood (/μL),[165] 103 cells per microlitre (× 103/μL), or 109 cells per litre (× 109/ L).[4]
The mean platelet volume (MPV) measures the average size of platelets in femtolitres. It can aid in determining the cause of thrombocytopenia; an elevated MPV may occur when young platelets are released into the bloodstream to compensate for increased destruction of platelets, while decreased production of platelets due to dysfunction of the bone marrow can result in a low MPV. The MPV is also useful for differentiating between congenital diseases that cause thrombocytopenia.[118][166] The immature platelet fraction (IPF) or reticulated platelet count is reported by some analyzers and provides information about the rate of platelet production by measuring the number of immature platelets in the blood.[167]
Diğer testler
Retikülosit sayısı

Reticulocytes are immature red blood cells, which, unlike the mature cells, contain RNA. A reticulocyte count is sometimes performed as part of a complete blood count, usually to investigate the cause of a person's anemia or evaluate their response to treatment. Anemia with a high reticulocyte count can indicate that the bone marrow is producing red blood cells at a higher rate to compensate for blood loss or hemolysis,[74] while anemia with a low reticulocyte count may suggest that the person has a condition that reduces the body's ability to produce red blood cells.[168] When people with nutritional anemia are given nutrient supplementation, an increase in the reticulocyte count indicates that their body is responding to the treatment by producing more red blood cells.[169] Hematology analyzers perform reticulocyte counts by staining red blood cells with a dye that binds to RNA and measuring the number of reticulocytes through light scattering or fluorescence analysis. The test can be performed manually by staining the blood with yeni metilen mavisi and counting the percentage of red blood cells containing RNA under the microscope. The reticulocyte count is expressed as an absolute number[168] or as a percentage of red blood cells.[170]
Some instruments measure the average amount of hemoglobin in each reticulocyte; a parameter that has been studied as an indicator of iron deficiency in people who have conditions that interfere with standard tests.[171] The immature reticulocyte fraction (IRF) is another measurement produced by some analyzers which quantifies the maturity of reticulocytes: cells that are less mature contain more RNA and thus produce a stronger fluorescent signal. This information can be useful in diagnosing anemias and evaluating red blood cell production following anemia treatment or kemik iliği nakli.[172]
Nucleated red blood cells
During their formation in bone marrow, and in the karaciğer and spleen in fetuses,[173] red blood cells contain a cell nucleus, which is usually absent in the mature cells that circulate in the bloodstream.[174] When detected, the presence of nucleated red cells, particularly in children and adults, indicates an increased demand for red blood cells, which can be caused by bleeding, some cancers and anemia.[118] Most analyzers can detect these cells as part of the differential cell count. High numbers of nucleated red cells can cause a falsely high white cell count, which will require adjusting.[175]
Diğer parametreler
Advanced hematology analyzers generate novel measurements of blood cells which have shown diagnostic significance in research studies but have not yet found widespread clinical use.[171] For example, some types of analyzers produce koordinat readings indicating the size and position of each white blood cell cluster. These parameters (termed cell population data)[176] have been studied as potential markers for blood disorders, bacterial infections and malaria. Analyzers that use myeloperoxidase staining to produce differential counts can measure white blood cells' expression of the enzyme, which is altered in various disorders.[75] Some instruments can report the percentage of red blood cells that are hypochromic in addition to reporting the average MCHC value, or provide a count of fragmented red cells (şistositler ),[171] which occur in some types of hemolytic anemia.[177] Because these parameters are often specific to particular brands of analyzers, it is difficult for laboratories to interpret and compare results.[171]
Referans aralıkları
| Ölçek | Birimler | Yetişkin | Pediatrik (4–7 years old) | Yenidoğan (0–1 days old) |
|---|---|---|---|---|
| WBC | × 109/ L | 3.6–10.6 | 5.0–17.0 | 9.0–37.0 |
| RBC | × 1012/ L |
| 4.00–5.20 | 4.10–6.10 |
| HGB | g / L |
| 102–152 | 165–215 |
| HCT | L / L |
| 0.36–0.46 | 0.48–0.68 |
| MCV | fL | 80–100 | 78–94 | 95–125 |
| MCH | sayfa | 26–34 | 23–31 | 30–42 |
| MCHC | g / L | 320–360 | 320–360 | 300–340 |
| RDW | % | 11.5–14.5 | 11.5–14.5 | yüksek[not 6] |
| PLT | × 109/ L | 150–450 | 150–450 | 150–450 |
| Nötrofiller | × 109/ L | 1.7–7.5 | 1.5–11.0 | 3.7–30.0 |
| Lenfositler | × 109/ L | 1.0–3.2 | 1.5–11.1 | 1.6–14.1 |
| Monositler | × 109/ L | 0.1–1.3 | 0.1–1.9 | 0.1–4.4 |
| Eozinofiller | × 109/ L | 0.0–0.3 | 0.0–0.7 | 0.0–1.5 |
| Bazofiller | × 109/ L | 0.0–0.2 | 0.0–0.3 | 0.0–0.7 |
The complete blood count is interpreted by comparing the output to reference ranges, which represent the results found in 95% of apparently healthy people.[35] Based on a statistical normal dağılım, the tested samples' ranges vary with gender and age. On average, adult females have lower hemoglobin, hematocrit, and red blood cell count values than males; although the difference lessens, but is still present, after menopoz.[179]
The blood of newborn babies is very different from that of older children, which is different again from the blood of adults. Newborns' hemoglobin, hematocrit, and red blood cell count are extremely high to compensate for low oxygen levels in the womb, and a high proportion of fetal hemoglobin, which is less effective at delivering oxygen to tissues than mature forms of hemoglobin, inside their red blood cells.[180][181] The MCV is also increased, and the white blood cell count is elevated with a preponderance of neutrophils.[180][182] The red blood cell count and related values begin to decline shortly after birth, reaching their lowest point at about two months of age and increasing thereafter.[183][184] The red blood cells of older infants and children are smaller, with a lower MCH, than those of adults. In the pediatric white blood cell differential, lymphocytes often outnumber neutrophils, while in adults neutrophils predominate.[180]
Other differences between populations may affect the reference ranges: for example, people living at higher altitudes have higher hemoglobin, hematocrit, and RBC results, and people of African heritage have lower white blood cell counts on average.[185] The type of analyzer used to run the CBC affects the reference ranges as well. Reference ranges are therefore established by individual laboratories based on their own patient populations and equipment.[186][187]
Sınırlamalar
Some medical conditions or problems with the blood sample may produce inaccurate results. If the sample is visibly clotted, which can be caused by poor flebotomi technique, it is unsuitable for testing, because the platelet count will be falsely decreased and other results may be abnormal.[188][189] Samples stored at room temperature for several hours may give falsely high readings for MCV,[190] because red blood cells swell as they absorb water from the plasma; and platelet and white blood cell differential results may be inaccurate in aged specimens, as the cells degrade over time.[91]

Samples drawn from individuals with very high levels of bilirubin veya lipidler in their plasma (referred to as an icteric sample or a lipemic sample, respectively)[191] may show falsely high readings for hemoglobin, because these substances change the colour and opacity of the sample, which interferes with hemoglobin measurement.[192] This effect can be mitigated by replacing the plasma with saline.[91]
Some individuals produce an antikor that causes their platelets to form clumps when their blood is drawn into tubes containing EDTA, the anticoagulant typically used to collect CBC samples. Platelet clumps may be counted as single platelets by automated analyzers, leading to a falsely decreased platelet count. This can be avoided by using an alternative anticoagulant such as sodyum sitrat veya heparin. Partial clotting of the sample due to a difficult blood draw is another cause of falsely low platelet counts.[193]
Another antibody-mediated condition that can affect complete blood count results is red blood cell agglutination. This phenomenon causes red blood cells to clump together because of antibodies bound to the cell surface.[194] Red blood cell aggregates are counted as single cells by the analyzer, leading to a markedly decreased red blood cell count and hematocrit, and markedly elevated MCV and MCHC.[53] Often, these antibodies are only active at room temperature (in which case they are called cold agglutinins ), and the agglutination can be reversed by heating the sample to 37 °C (99 °F). Samples from people with warm autoimmune hemolytic anemia may exhibit red cell agglutination that does not resolve on warming.[130]
While blast and lymphoma cells can be identified in the manual differential, microscopic examination cannot reliably determine the cells' hematopoietic lineage. This information is often necessary for diagnosing blood cancers. After abnormal cells are identified, additional techniques such as immünofenotipleme by flow cytometry can be used to identify işaretçiler that provide additional information about the cells.[195][196]
Tarih

Before automated cell counters were introduced, complete blood count tests were performed manually: white and red blood cells, and platelets were counted using microscopes.[198] The first person to publish microscopic observations of blood cells was Antonie van Leeuwenhoek,[199] who reported on the appearance of red cells in a 1674 letter to the Londra Kraliyet Cemiyeti Bildirileri;[200] Jan Swammerdam had described red blood cells some years earlier, but had not published his findings at the time. Throughout the 18th and 19th centuries, improvements in microscope technology such as akromatik lensler allowed white blood cells and trombositler to be counted in unstained samples.[201]
Fizyolog Karl Vierordt is credited with performing the first blood count.[8][202][203] His technique, published in 1852, involved aspirating a carefully measured volume of blood into a capillary tube and spreading it onto a microscope slide coated with yumurta akı. After the blood dried, he counted every cell on the slide; this process could take more than three hours to complete.[204] The hemocytometer, introduced in 1874 by Louis-Charles Malassez, simplified the microscopic counting of blood cells.[205] Malassez's hemocytometer consisted of a microscope slide containing a flattened capillary tube. Diluted blood was introduced to the capillary chamber by means of a rubber tube attached to one end, and an mercek with a scaled grid was attached to the microscope, permitting the microscopist to count the number of cells per volume of blood. 1877'de, William Gowers invented a hemocytometer with a built-in counting grid, eliminating the need to produce specially calibrated eyepieces for each microscope.[206]

1870'lerde, Paul Ehrlich developed a staining technique using a combination of an acidic and basic dye that could distinguish different types of white blood cells and allow red blood cell morfoloji to be examined.[201] Dmitri Leonidovich Romanowsky improved on this technique in the 1890s, using a mixture of eozin ve yaşlı metilen mavisi to produce a wide range of hues not present when either of the stains was used alone. This became the basis for Romanowsky staining, a technique still used to stain blood smears for manual review.[207]
The first techniques for measuring hemoglobin were devised in the late 19th century, and involved visual comparisons of the colour of diluted blood against a known standard.[203] Attempts to automate this process using spectrophotometry and kolorimetri were limited by the fact that hemoglobin is present in the blood in many different forms, meaning that it could not be measured at a single dalga boyu. In 1920, a method to convert the different forms of hemoglobin to one stable form (cyanmethemoglobin or hemiglobincyanide) was introduced, allowing hemoglobin levels to be measured automatically. The cyanmethemoglobin method remains the reference method for hemoglobin measurement and is still used in many automated hematology analyzers.[57][208][209]
Maxwell Wintrobe is credited with the invention of the hematocrit test.[66][210] In 1929, he undertook a PhD project at the University of Tulane to determine normal ranges for red blood cell parameters, and invented a method known as the Wintrobe hematocrit. Hematocrit measurements had previously been described in the literature, but Wintrobe's method differed in that it used a large tube that could be mass-produced to precise specifications, with a built-in scale. The fraction of red blood cells in the tube was measured after santrifüj to determine the hematocrit. The invention of a reproducible method for determining hematocrit values allowed Wintrobe to define the red blood cell indices.[203]

Research into automated cell counting began in the early 20th century.[209] A method developed in 1928 used the amount of light iletilen through a diluted blood sample, as measured by photometry, to estimate the red blood cell count, but this proved inaccurate for samples with abnormal red blood cells.[8] Other attempts, in the 1930s and 1940s, involved photoelectric detectors attached to microscopes, which would count cells as they were scanned; these methods were unsuccessful.[209] 1940'ların sonlarında, Wallace H. Coulter, motivated by a need for better red blood cell counting methods following the Hiroşima ve Nagazaki'nin bombalanması,[211] attempted to improve on photoelectric cell counting techniques.[not 7] His research was aided by his brother, Joseph R. Coulter, in a basement laboratory in Chicago.[60] Their results using photoelectric methods were disappointing, and in 1948, after reading a paper relating the conductivity of blood to its red blood cell concentration, Wallace devised the Coulter principle—the theory that a cell suspended in a conductive medium generates a drop in current proportional to its size as it passes through an aperture.[211]
That October, Wallace built a counter to demonstrate the principle. Owing to financial constraints, the aperture was made by burning a hole through a piece of cellophane from a cigarette package.[60][211] Wallace filed a patent for the technique in 1949, and in 1951 applied to the Deniz Araştırmaları Ofisi to fund the development of the Coulter sayacı.[211] Wallace's patent application was granted in 1953, and after improvements to the aperture and the introduction of a mercury manometre to provide precise control over sample size, the brothers founded Coulter Electronics Inc. in 1958 to market their counters. The device was initially designed for counting red blood cells, but with later modifications it proved effective for counting white blood cells.[60] Coulter counters were widely adopted by medical laboratories.[209]
The first analyzer able to produce multiple cell counts simultaneously was the Technicon SMA 4A−7A, released in 1965. It achieved this by partitioning blood samples into two channels: one for counting red and white blood cells and one for measuring hemoglobin. However, the instrument was unreliable and difficult to maintain. In 1968, the Coulter Model S analyzer was released and gained widespread use. Similarly to the Technicon instrument, it used two different reaction chambers, one of which was used for the red cell count, and one of which was used for the white blood cell count and hemoglobin determination. The Model S also determined the mean cell volume using impedance measurements, which allowed the red blood cell indices and hematocrit to be derived. Automated platelet counts were introduced in 1970 with Technicon's Hemalog-8 instrument and were adopted by Coulter's S Plus series analyzers in 1980.[212]
After basic cell counting had been automated, the white blood cell differential remained a challenge. Throughout the 1970s, researchers explored two methods for automating the differential count: digital image processing and flow cytometry. Using technology developed in the 1950s and 60s to automate the reading of Pap smear, several models of image processing analyzers were produced.[213] These instruments would scan a stained blood smear to find cell nuclei, then take a higher resolution snapshot of the cell to analyze it through dansitometri.[214] They were expensive, slow, and did little to reduce workload in the laboratory because they still required blood smears to be prepared and stained, so flow cytometry-based systems became more popular,[215][216] and by 1990, no digital image analyzers were commercially available in the United States or western Europe.[217] These techniques enjoyed a resurgence in the 2000s with the introduction of more advanced image analysis platforms using yapay sinir ağları.[218][219][220]
Early flow cytometry devices shot beams of light at cells in specific wavelengths and measured the resulting absorbance, fluorescence or light scatter, collecting information about the cells' features and allowing cellular contents such as DNA to be quantified.[221] One such instrument—the Rapid Cell Spectrophotometer, developed by Louis Kamentsky in 1965 to automate cervical cytology—could generate blood cell scattergrams using cytochemical staining techniques. Leonard Ornstein, who had helped to develop the staining system on the Rapid Cell Spectrophotometer, and his colleagues later created the first commercial flow cytometric white blood cell differential analyzer, the Hemalog D.[222][223] Introduced in 1974,[224][225] this analyzer used light scattering, absorbance and cell staining to identify the five normal white blood cell types in addition to "large unidentified cells", a classification that usually consisted of atypical lymphocytes or blast cells. The Hemalog D could count 10,000 cells in one run, a marked improvement over the manual differential.[223][226] In 1981, Technicon combined the Hemalog D with the Hemalog-8 analyzer to produce the Technicon H6000, the first combined complete blood count and differential analyzer. This analyzer was unpopular with hematology laboratories because it was labour-intensive to operate, but in the late 1980s to early 1990s similar systems were widely produced by other manufacturers such as Sysmex, Abbott, Roche ve Beckman Coulter.[227]
Notlar
- ^ Though commonly referred to as such, platelets are technically not cells: they are cell fragments, formed from the sitoplazma nın-nin megakaryositler in the bone marrow.[6]
- ^ The data used to construct reference ranges is usually derived from "normal" subjects, but it is possible for these individuals to have asymptomatic disease.[34]
- ^ In its broadest sense, the term akış sitometrisi refers to any measurement of the properties of individual cells in a fluid stream,[49][50] and in this respect, all hematology analyzers (except those using digital image processing) are flow cytometers. However, the term is commonly used in reference to light scattering and fluorescence methods, especially those involving the identification of cells using labelled antibodies that bind to cell surface markers (immünofenotipleme ).[49][51]
- ^ Bu her zaman böyle değildir. In some types of thalassemia, for example, a high red blood cell count occurs alongside a low or normal hemoglobin, as the red blood cells are very small.[123][124] Mentzer endeksi, which compares the MCV to the RBC count, can be used to distinguish between iron deficiency anemia and thalassemia.[125]
- ^ Automated instruments group these three types of cells together under the "immature granulocyte" classification,[142] but they are counted separately in the manual differential.[143]
- ^ The RDW is highly elevated at birth and gradually decreases until approximately six months of age.[178]
- ^ An apocryphal story holds that Wallace invented the Coulter counter to study particles in paints used on ABD Donanması gemiler; other accounts claim it was originally designed during the İkinci dünya savaşı to count plankton. However, Wallace never worked for the Navy, and his earliest writings on the device state that it was first used to analyze blood. The paint story was eventually retracted from documents produced by the Wallace H. Coulter Foundation.[211]
Referanslar
- ^ Tefferi, A; Hanson, CA; Inwards, DJ (2005). "How to interpret and pursue an abnormal complete blood cell count in adults". Mayo Clinic Proceedings. 80 (7): 923–936. doi:10.4065/80.7.923. ISSN 0025-6196. PMID 16212155.
- ^ a b HealthDirect (August 2018). "Full blood count". HealthDirect.gov.au. Arşivlendi 2 Nisan 2019 tarihinde orjinalinden. Alındı 8 Eylül 2020.
- ^ "Blood tests: Chronic lymphocytic leukaemia (CLL)". Birleşik Krallık Kanser Araştırmaları. 18 Eylül 2020. Arşivlendi 23 Ekim 2020'deki orjinalinden. Alındı 23 Ekim 2020.
- ^ a b c d e f Amerikan Klinik Kimya Derneği (12 August 2020). "Complete Blood Count (CBC)". Çevrimiçi Laboratuvar Testleri. Arşivlendi 18 Ağustos 2020'deki orjinalinden. Alındı 8 Eylül 2020.
- ^ a b c Smock, KJ. Chapter 1 in Greer, JP ve diğerleri, ed. (2018), sec. "Advantages and sources of error with automated hematology".
- ^ a b Turgeon, ML (2016). s. 309.
- ^ Harmening, DM (2009). s. 2–3.
- ^ a b c Yeşil, R; Wachsmann-Hogiu, S (2015). "Development, history, and future of automated cell counters". Laboratuvar Tıbbı Klinikleri. 35 (1): 1–10. doi:10.1016/j.cll.2014.11.003. ISSN 0272-2712. PMID 25676368.
- ^ a b Keohane, E ve diğerleri. (2015). s. 244.
- ^ Leach, M (2014). "Interpretation of the full blood count in systemic disease – a guide for the physician". The Journal of the Royal College of Physicians of Edinburgh. 44 (1): 36–41. doi:10.4997/JRCPE.2014.109. ISSN 1478-2715. PMID 24995446.
- ^ Marshall, WJ ve diğerleri. (2014). s. 497.
- ^ a b c Van Leeuwen, AM; Bladh, ML (2019). s. 377.
- ^ Lewandrowski, K et al. (2016). s. 96.
- ^ Amerikan Kan Bankaları Derneği (24 Nisan 2014). "Hekimlerin ve Hastaların Sorgulaması Gereken Beş Şey". Akıllıca Seçmek: bir girişimi ABIM Vakfı. Amerikan Kan Bankaları Birliği. Arşivlenen orijinal 24 Eylül 2014. Alındı 12 Temmuz 2020.
- ^ a b Lewandrowski, K et al. (2016). s. 97.
- ^ Hartman, CJ; Kavoussi, LR (2017). sayfa 4–5.
- ^ Dewan, M (2016). "Reducing unnecessary postoperative complete blood count testing in the pediatric intensive care unit". Permanente Dergisi. doi:10.7812/TPP/16-051. ISSN 1552-5767. PMC 5283785. PMID 28241909.
- ^ Walls, R et al. (2017). s. 130.
- ^ Walls, R ve diğerleri. (2017). s. 219.
- ^ Walls, R et al. (2017). s. 199.
- ^ Walls, R et al. (2017). s. 1464.
- ^ Moore, EE ve diğerleri. (2017). s. 162.
- ^ Lewis, SL et al. (2015). s. 280.
- ^ Wiciński, M; Węclewicz, MM (2018). "Clozapine-induced agranulocytosis/granulocytopenia". Hematolojide Güncel Görüş. 25 (1): 22–28. doi:10.1097/MOH.0000000000000391. ISSN 1065-6251. PMID 28984748.
- ^ Fatemi, SH; Clayton, PJ. (2016). s. 666.
- ^ Dooley, EK; Ringler, RL. (2012). s. 20–21.
- ^ Keohane, E ve diğerleri. (2015). s. 834–835.
- ^ Schafermeyer, RW ve diğerleri. (2018). s. 467–468.
- ^ Smock, KJ. Chapter 1 in Greer, JP ve diğerleri, ed. (2018), sec. "Giriş".
- ^ a b Kaushansky, K ve diğerleri. (2015). s. 11.
- ^ Kaushansky, K ve diğerleri. (2015). s. 43.
- ^ Kaushansky, K ve diğerleri. (2015). s. 42–44.
- ^ McPherson, RA; Pincus, MR (2017). s. 574.
- ^ Bain, BJ ve diğerleri. (2017). s. 8.
- ^ a b Bain, BJ ve diğerleri. (2017). s. 10.
- ^ Bain, BJ (2015). s. 213.
- ^ Keohane, E ve diğerleri. (2015). s. 245.
- ^ a b Lewandrowski, K et al. (2016). s. 96–97.
- ^ "Routine Preoperative Tests for Elective Surgery (NG45)". Ulusal Sağlık ve Bakım Mükemmelliği Enstitüsü. 5 Nisan 2016. Arşivlendi 28 Temmuz 2020'deki orjinalinden. Alındı 8 Eylül 2020.
- ^ Kirkham, KR ve diğerleri. (2016). s. 805.
- ^ Smock, KJ. Chapter 1 in Greer, JP ve diğerleri, ed. (2018), sec. "Specimen collection".
- ^ Keohane, E ve diğerleri. (2015). s. 28.
- ^ Bain, BJ et al. (2017). s. 1.
- ^ Smock, KJ. Chapter 1 in Greer, JP ve diğerleri, ed. (2018), sec. "Cell counts", "Volume of packed red cells (hematocrit)", "Leukocyte differentials".
- ^ a b c d Bain, BJ ve diğerleri. (2017). pp. 551–555.
- ^ Bain, BJ (2015). s. 29.
- ^ Dasgupta, A; Sepulveda, JL (2013). s. 305.
- ^ a b D’Souza, C; Briggs, C; Machin, SJ (2015). "Platelets: the few, the young and the active". Laboratuvar Tıbbı Klinikleri. 35 (1): 123–131. doi:10.1016/j.cll.2014.11.002. ISSN 0272-2712. PMID 25676376.
- ^ a b c Kottke-Marchant, K; Davis, B (2012). s. 8.
- ^ Shapiro, HM (2003). s. 1.
- ^ Bakke, AC (2001). "The principles of flow cytometry". Laboratuvar Tıbbı. 32 (4): 207–211. doi:10.1309/2H43-5EC2-K22U-YC6T. ISSN 1943-7730.
- ^ Kaushansky, K ve diğerleri. (2015). s. 12.
- ^ a b Bain, BJ ve diğerleri. (2017). s. 32–33.
- ^ McPherson, RA; Pincus, MR (2017). s. 44.
- ^ Bain, BJ (2015). s. 29–30.
- ^ Whitehead, RD; Mei, Z; Mapango, C; Jefferds, MED (August 2019). "Methods and analyzers for hemoglobin measurement in clinical laboratories and field settings". New York Bilimler Akademisi Yıllıkları. 1450 (1): 147–171. doi:10.1111/nyas.14124. PMC 6709845. PMID 31162693.
- ^ a b Smock, KJ. Chapter 1 in Greer, JP ve diğerleri, ed. (2018), sec. "Hemoglobin concentration".
- ^ a b Keohane, E ve diğerleri. (2015). s. 208.
- ^ Bain, BJ (2015). s. 30–31.
- ^ a b c d Graham, MD (2003). "The Coulter principle: foundation of an industry". Laboratuvar Otomasyonu Derneği Dergisi. 8 (6): 72–81. doi:10.1016/S1535-5535(03)00023-6. ISSN 1535-5535.
- ^ Keohane, E ve diğerleri. (2015). s. 208–209.
- ^ a b Bain, BJ ve diğerleri. (2017). s. 32.
- ^ Keohane, E ve diğerleri. (2015). s. 210–211.
- ^ Keohane, E ve diğerleri. (2015). s. 210.
- ^ Kottke-Marchant, K; Davis, B (2012). s. 27.
- ^ a b c d e Smock, KJ. Chapter 1 in Greer, JP ve diğerleri, ed. (2018), sec. "Volume of packed red cells (hematocrit)".
- ^ Smock, KJ. Chapter 1 in Greer JP ve diğerleri, ed. (2018), sec. "Mean corpuscular volume"; "Mean corpuscular hemoglobin"; "Mean corpuscular hemoglobin concentration"; "Red cell distribution width".
- ^ Keohane, E ve diğerleri. (2015). s. 2.
- ^ Keohane, E ve diğerleri. (2015). s. 209.
- ^ a b c Bain, BJ ve diğerleri. (2017). s. 37.
- ^ Arneth, BM; Menschikowki, M. (2015). s. 3.
- ^ a b c Smock, KJ. Chapter 1 in Greer JP ve diğerleri, ed. (2018), sec. "Leukocyte differentials".
- ^ Naeim, F ve diğerleri. (2009). s. 210.
- ^ a b Turgeon, ML (2016). s. 318.
- ^ a b Bain, BJ ve diğerleri. (2017). s. 39.
- ^ a b Smock, KJ. Chapter 1 in Greer, JP ve diğerleri, ed. (2018), sec. "Giriş"; "Cell counts".
- ^ a b c d Gulati, G; Şarkı, J; Dulau Florea, A; Gong, J (2013). "Purpose and criteria for blood smear scan, blood smear examination, and blood smear review". Annals of Laboratory Medicine. 33 (1): 1–7. doi:10.3343/alm.2013.33.1.1. ISSN 2234-3806. PMC 3535191. PMID 23301216.
- ^ a b Mooney, C; Byrne, M; Kapuya, P; Pentony, L; De la Salle, B; Cambridge, T; Foley, D (2019). "Point of care testing in general haematology". İngiliz Hematoloji Dergisi. 187 (3): 296–306. doi:10.1111/bjh.16208. ISSN 0007-1048. PMID 31578729.
- ^ a b Sireci, AN (2015). "Hematology testing in urgent care and resource-poor settings: an overview of point of care and satellite testing". Laboratuvar Tıbbı Klinikleri. 35 (1): 197–207. doi:10.1016/j.cll.2014.10.009. ISSN 0272-2712. PMID 25676380.
- ^ Bain, BJ ve diğerleri. (2017). s. 43.
- ^ Keohane, E ve diğerleri. (2015). s. 225.
- ^ Bain, BJ. (2015). s. 9–11.
- ^ Palmer, L ve diğerleri. (2015). s. 288–289.
- ^ Turgeon, ML (2016). s. 325–326.
- ^ Bain, BJ (2015). s. 98.
- ^ Bain, BJ (2015). s. 154.
- ^ Wang, SA; Hasserjian, RP (2018). s. 10.
- ^ a b Turgeon, ML (2016). s. 329.
- ^ a b d'Onofrio, G; Zini, G. (2014). s. 289.
- ^ Palmer, L et al. (2015). s. 296–297.
- ^ a b c Keohane, E ve diğerleri. (2015). s. 226.
- ^ a b Smock, KJ. Chapter 1 in Greer, JP ve diğerleri, ed. (2018), sec. "Cell counts".
- ^ Keohane, E ve diğerleri. (2017) s. 189.
- ^ Bain, BJ (2015). s. 22–23.
- ^ Keohane, E et al. (2017). s. 190–191.
- ^ Bain, BJ ve diğerleri. (2017). s. 19–22.
- ^ Bain, BJ ve diğerleri. (2017). pp. 548–552.
- ^ Keohane, E ve diğerleri. (2015). s. 46.
- ^ a b c Vis, JY; Huisman, A (2016). "Verification and quality control of routine hematology analyzers". International Journal of Laboratory Hematology. 38: 100–109. doi:10.1111/ijlh.12503. ISSN 1751-5521. PMID 27161194.
- ^ a b Kottke-Marchant, K; Davis, B (2012). s. 697–698.
- ^ Pai, S; Frater, JL (2019). "Quality management and accreditation in laboratory hematology: Perspectives from India". International Journal of Laboratory Hematology. 41 (S1): 177–183. doi:10.1111/ijlh.13017. ISSN 1751-5521. PMID 31069974.
- ^ Greer, JP (2008). s. 4.
- ^ Kottke-Marchant, K; Davis, B (2012). s. 438.
- ^ Bain, BJ ve diğerleri. (2017). s. 539–540.
- ^ Favaloro, EJ; Jennings, I; Olson, J; Van Cott, EM; Bonar, R; Gosselin, R; Meijer, P (2018). "Towards harmonization of external quality assessment/proficiency testing in hemostasis". Clinical Chemistry and Laboratory Medicine (CCLM). 0 (0). doi:10.1515/cclm-2018-0077. ISSN 1437-4331. PMID 29668440.
- ^ Bain, BJ ve diğerleri. (2017). s. 551.
- ^ Keohane, E ve diğerleri. (2015). sayfa 4–5.
- ^ Blann, A; Ahmed, N (2014). s. 106.
- ^ Turgeon, ML (2016). s. 293.
- ^ Bain, BJ ve diğerleri. (2017). sayfa 33–34.
- ^ Turgeon, ML (2016). sayfa 319–320.
- ^ Brereton, M; McCafferty, R; Marsden, K; Kawai, Y; Etzell, J; Ermens, A (2016). "Recommendation for standardization of haematology reporting units used in the extended blood count". International Journal of Laboratory Hematology. 38 (5): 472–482. doi:10.1111/ijlh.12563. ISSN 1751-5521. PMID 27565952.
- ^ Keohane, E ve diğerleri. (2015). s. 195.
- ^ a b Bain, BJ (2015). s. 22.
- ^ a b c d Keohane, E ve diğerleri. (2015). s. 196.
- ^ Schmaier, AH; Lazarus, HM (2012). s. 25.
- ^ a b Bain, BJ (2015). sayfa 73–75.
- ^ a b c d e May, JE; Marques, MB; Reddy, VVB; Gangaraju, R (2019). "Three neglected numbers in the CBC: The RDW, MPV, and NRBC count". Cleveland Clinic Journal of Medicine. 86 (3): 167–172. doi:10.3949/ccjm.86a.18072. ISSN 0891-1150. PMID 30849034.
- ^ Keohane, E ve diğerleri. (2015). s. 285.
- ^ Keohane, E ve diğerleri. (2015). s. 286.
- ^ Kaushansky, K ve diğerleri. (2015). s. 503.
- ^ Vieth, JT; Lane, DR (2014). sayfa 11-12.
- ^ Bain, BJ (2015). s. 297.
- ^ DiGregorio, RV ve diğerleri. (2014). sayfa 491–493.
- ^ Isaacs, C ve diğerleri. (2017). s. 331.
- ^ Bain, BJ (2015). s. 232.
- ^ McPherson, RA; Pincus, MR (2017). sayfa 600–601.
- ^ a b Smock, KJ. Chapter 1 in Greer, JP ve diğerleri, ed. (2018), sec. "Mean corpuscular hemoglobin concentration".
- ^ Keohane, E ve diğerleri. (2015). s. 197.
- ^ a b Kottke-Marchant, K; Davis, B (2012). s. 88.
- ^ Bain, BJ (2015). s. 193.
- ^ Bain, BJ ve diğerleri. (2017). sayfa 501–502.
- ^ Ciesla, B (2018). s. 26.
- ^ Powell, DJ; Achebe, MO. (2016). pp. 530, 537–539.
- ^ Harmening, DM (2009). s. 380.
- ^ Pagana, TJ et al. (2014). s. 992.
- ^ Walls, R et al. (2017). pp. 1480–1481.
- ^ Territo, M (January 2020). "Overview of White Blood Cell Disorders". Merck Kılavuzları Tüketici Sürümü. Arşivlendi 23 Haziran 2020'deki orjinalinden. Alındı 8 Eylül 2020.
- ^ Pagana, TJ et al. (2014). s. 991.
- ^ McCulloh, RJ; Opal, SM. Chapter 42 in Oropello, JM ve diğerleri, ed. (2016), sec. "White blood cell count and differential".
- ^ Amerikan Klinik Kimya Derneği (29 Temmuz 2020). "WBC Differential". Çevrimiçi Laboratuvar Testleri. Arşivlendi 19 Ağustos 2020'deki orjinalinden. Alındı 8 Eylül 2020.
- ^ Wang, SA; Hasserjian, RP (2018). s. 8.
- ^ Palmer, L ve diğerleri. (2015). s. 294–295.
- ^ Chabot-Richards, DS; George, TI (2015). s. 10.
- ^ Palmer, L et al. (2015). s. 294.
- ^ Turgeon, ML (2016). s. 306.
- ^ a b Kaushansky, K ve diğerleri. (2015). s. 44.
- ^ Hoffman, EJ et al. (2013). s. 644.
- ^ Porwit, A ve diğerleri. (2011). s. 247–252.
- ^ Walls, R et al. (2017). s. 1483.
- ^ Walls, R et al. (2017). sayfa 1497–1498.
- ^ Bain, BJ (2015). s. 99.
- ^ Bain, BJ et al. (2017). s. 85.
- ^ Bain, BJ ve diğerleri. (2017). s. 498.
- ^ Bain, BJ (2015). s. 243.
- ^ Porwit, A ve diğerleri. (2011). s. 256.
- ^ Palmer, L ve diğerleri. (2015). s. 298.
- ^ Turgeon, ML (2016). s. 358–360.
- ^ Kaushansky, K et al. (2015). s. 1993.
- ^ Turgeon, ML (2016). s. 315.
- ^ Walls, R et al. (2017). pp. 1486–1488.
- ^ Kaufman, RM; Djulbegovic, B; Gernsheimer, T; Kleinman, S; Tinmouth, A T.; Capocelli, KE; et al. (2015). "Trombosit transfüzyonu: AABB'den bir klinik uygulama kılavuzu". İç Hastalıkları Yıllıkları. 162 (3): 205. doi:10.7326 / M14-1589. ISSN 0003-4819. PMID 25383671.
- ^ a b Keohane, E ve diğerleri. (2015). s. 4.
- ^ Walls, R et al. (2017). s. 1489.
- ^ Gersten, T (25 August 2020). "Platelet count: MedlinePlus Medical Encyclopedia". MedlinePlus. Birleşik Devletler Ulusal Tıp Kütüphanesi. Arşivlendi 9 Eylül 2020'deki orjinalinden. Alındı 9 Eylül 2020.
- ^ Wang, SA; Hasserjian, RP (2018). s. 7.
- ^ Kaushansky, K ve diğerleri. (2015). sayfa 18–19.
- ^ a b Kaushansky, K ve diğerleri. (2015). s. 14.
- ^ Turgeon, ML (2016). sayfa 318–319.
- ^ Turgeon, ML (2016). s. 319.
- ^ a b c d Kaushansky, K ve diğerleri. (2015). s. 16.
- ^ Bain, BJ ve diğerleri. (2017). s. 42–43.
- ^ Harmening, DM (2009). sayfa 8-10.
- ^ Constantino, B; Cogionis, B (2000). "Nucleated RBCs – significance in the peripheral blood film". Laboratuvar Tıbbı. doi:10.1309/D70F-HCC1-XX1T-4ETE.
- ^ Zandecki, M et al. (2007). s. 24–25.
- ^ Virk, H; Varma, N; Naseem, S; Bihana, I; Sukhachev, D (2019). "Utility of cell population data (VCS parameters) as a rapid screening tool for acute myeloid leukemia (AML) in resource-constrained laboratories". Journal of Clinical Laboratory Analysis. 33 (2): e22679. doi:10.1002/jcla.22679. ISSN 0887-8013. PMID 30267430.
- ^ Bain, BJ (2015). s. 90.
- ^ a b Keohane, E ve diğerleri. (2015). Ön sorun.
- ^ Bain, BJ (2015). s. 211–213.
- ^ a b c Bain, BJ (2015). s. 143.
- ^ Lanzkowsky, P ve diğerleri. (2016). s. 197.
- ^ Kaushansky, K ve diğerleri. (2015). s. 99.
- ^ Kaushansky, K ve diğerleri. (2015). s. 103.
- ^ Bain, BJ (2015). s. 220.
- ^ Bain, BJ (2015). s. 214.
- ^ Bain, BJ ve diğerleri. (2017). sayfa 8-10.
- ^ Palmer, L ve diğerleri. (2015). s. 296.
- ^ Bain, BJ (2015). s. 195.
- ^ Kottke-Marchant, K; Davis, B (2012). s. 67.
- ^ Bain, BJ (2015). s. 194.
- ^ Turgeon, ML (2016). s. 91.
- ^ Kottke-Marchant, K; Davis, B (2012) pp. 80, 86–87.
- ^ Bain, BJ (2015). s. 196–197.
- ^ Rodak, BF; Carr, JH. (2013). s. 109.
- ^ Wang, SA; Hasserjian, RP (2018). s. 9.
- ^ Kottke-Marchant, K; Davis, B (2012). s. 19–20.
- ^ Bilim Müzesi, Londra. "Haemoglobinometer, United Kingdom, 1850–1950". Wellcome Koleksiyonu. Arşivlendi 29 Mart 2020 tarihli orjinalinden. Alındı 29 Mart 2020.
- ^ Keohane, E ve diğerleri. (2015). s. 1–4.
- ^ Kottke-Marchant, K; Davis, B. (2012). s. 1.
- ^ Wintrobe, MM. (1985). s. 10.
- ^ a b Kottke-Marchant, K; Davis, B. (2012). s. 3–4.
- ^ Verso, ML (May 1962). "The evolution of blood counting techniques". Read at a Meeting of the Section of the History of Medicine, First Australian Medical Congress. 8 (2): 149–158. doi:10.1017/s0025727300029392. PMC 1033366. PMID 14139094.
- ^ a b c Means, RT (2011). "It all started in New Orleans: Wintrobe, the hematocrit and the definition of normal". Amerikan Tıp Bilimleri Dergisi. 341 (1): 64–65. doi:10.1097/MAJ.0b013e3181e2eb09. ISSN 0002-9629. PMID 21191263.
- ^ Davis, JD (1995). s. 167.
- ^ Kottke-Marchant, K; Davis, B (2012). s. 4.
- ^ Davis, JD (1995). s. 168–171.
- ^ Bezrukov, AV (2017). "Romanowsky boyama, Romanowsky etkisi ve bilimsel öncelik sorusu üzerine düşünceler". Biyoteknik ve Histokimya. 92 (1): 29–35. doi:10.1080/10520295.2016.1250285. ISSN 1052-0295. PMID 28098484.
- ^ Keohane, E ve diğerleri. (2015). s. 134.
- ^ a b c d Kottke-Marchant, K; Davis, B (2012). s. 5.
- ^ Robinson, JP (2013). "Wallace H. Coulter: onlarca yıllık buluş ve keşif ". Sitometri Bölüm A. 83A (5): 424–438. doi:10.1002 / cyto.a.22296. ISSN 1552-4922. PMID 23596093.
- ^ a b c d e Graham, MD (2013). "Coulter ilkesi: Hayali kökenler". Sitometri Bölüm A. 83 (12): 1057–1061. doi:10.1002 / cyto.a.22398. ISSN 1552-4922. PMC 4237176. PMID 24151220.
- ^ Kottke-Marchant, K; Davis, B (2012). s. 6.
- ^ Groner, W (1995). sayfa 12–14.
- ^ Lewis, SM (1981). "Otomatik diferansiyel lökosit sayımı: Mevcut durum ve gelecekteki eğilimler". Blut. 43 (1): 1–6. doi:10.1007 / BF00319925. ISSN 0006-5242. PMID 7260399.
- ^ Da Costa, L (2015). s. 5.
- ^ Groner, W (1995). sayfa 12–15.
- ^ Bentley, SA (1990). "Otomatik diferansiyel beyaz hücre sayımları: kritik bir değerlendirme". Baillière Klinik Hematolojisi. 3 (4): 851–869. doi:10.1016 / S0950-3536 (05) 80138-6. ISSN 0950-3536. PMID 2271793.
- ^ Kratz, A; Lee, S; Zini, G; Riedl, JA; Hur, M; Machin, S (2019). "Hematolojide dijital morfoloji analizörleri: ICSH incelemesi ve önerileri". Uluslararası Laboratuvar Hematoloji Dergisi. doi:10.1111 / ijlh.13042. ISSN 1751-5521. PMID 31046197.
- ^ Da Costa, L (2015). s. 5–6.
- ^ McCann, SR (2016). s. 193.
- ^ Melamed, M (2001). s. 5–6.
- ^ Shapiro, HM (2003). sayfa 84–85.
- ^ a b Melamed, M. (2001). s. 8.
- ^ Picot, J ve diğerleri. (2012). s. 110.
- ^ Mansberg, HP; Saunders, AM; Groner, W (1974). "Hemalog D beyaz hücre diferansiyel sistemi". Histokimya ve Sitokimya Dergisi. 22 (7): 711–724. doi:10.1177/22.7.711. ISSN 0022-1554. PMID 4137312.
- ^ Pierre, RV (2002). s. 281.
- ^ Kottke-Marchant, K; Davis, B (2012). sayfa 8-9.
Kaynakça
- Arneth, BM; Menschikowki, M (2015). "Hematolojik analizörlerde teknoloji ve yeni floresan akış sitometrisi parametreleri". Journal of Clinical Laboratory Analysis. 29 (3): 175–183. doi:10.1002 / jcla.21747. ISSN 0887-8013. PMC 6807107. PMID 24797912.
- Bain, BJ (2015). Kan Hücreleri: Pratik Bir Kılavuz (5 ed.). John Wiley & Sons. ISBN 978-1-118-81733-9.
- Bain, BJ; Bates, I; Laffan, MA (2017). Dacie ve Lewis Pratik Hematoloji (12 ed.). Elsevier Sağlık Bilimleri. ISBN 978-0-7020-6925-3.
- Blann, A; Ahmed, N (2014). Kan Bilimi (1 ed.). Biyomedikal Bilimler Enstitüsü. s. 106. ISBN 978-1-118-35146-8.
- Chabot-Richards, DS; George, TI (2015). "Beyaz kan hücresi sayımı". Laboratuvar Tıbbı Klinikleri. 35 (1): 11–24. doi:10.1016 / j.cll.2014.10.007. ISSN 0272-2712. PMID 25676369.
- Ciesla, B (2018). Pratikte Hematoloji (3 ed.). F. A. Davis Şirketi. ISBN 978-0-8036-6825-6.
- Da Costa, L (2015). "Kan hücrelerinin dijital görüntü analizi". Laboratuvar Tıbbı Klinikleri. 35 (1): 105–122. doi:10.1016 / j.cll.2014.10.005. ISSN 0272-2712. PMID 25676375.
- Dasgupta, A; Sepulveda, JL (2013). Klinik Laboratuvarda Doğru Sonuçlar: Hata Tespiti ve Düzeltme Kılavuzu. Elsevier. ISBN 978-0-12-415858-0.
- Davis, JD (1995). "İlerleyen dönem hemositometrenin evrimi". Caduceus: Tıp ve Sağlık Bilimleri Beşeri Bilimler Dergisi. 11 (3): 164–183. PMID 8680947.
- DiGregorio, RV; Green-Hernandez, C; Holzemer, SP (2014). Birincil Bakım: Meslekler Arası Bir Perspektif (2 ed.). Springer Yayıncılık Şirketi. ISBN 978-0-8261-7148-1.
- Dooley, EK; Ringler, RL (2012). "Doğum öncesi bakım: geleceğe dokunmak". Birincil Bakım: Ofis Uygulamasında Klinikler. 39 (1): 17–37. doi:10.1016 / j.pop.2011.11.002. ISSN 0095-4543. PMID 22309579.
- Fatemi, SH; Clayton, PJ (2016). Psikiyatrinin Tıbbi Temelleri (4 ed.). Springer. ISBN 978-1-4939-2528-5.
- Greer, JP (2008). Wintrobe's Klinik Hematoloji (12 ed.). Lippincott Williams ve Wilkins. ISBN 978-0-7817-6507-7.
- Greer, JP; Arber, DA; Daha mutlu, BE; Liste, AF; RM anlamına gelir; Rodgers, GM (2018). Wintrobe's Klinik Hematoloji (14 ed.). Wolters Kluwer Health. ISBN 978-1-4963-6713-6.
- Groner, W (1995). Modern Hematoloji Analizörleri İçin Pratik Kılavuz. Wiley. ISBN 978-0-471-95712-6.
- Harmening, D (2009). Klinik Hematoloji ve Hemostazın Temelleri (5 ed.). F. A. Davis Şirketi. ISBN 978-0-8036-1732-2.
- Hartman, CJ; Kavoussi, LR (2017). Cerrahi Tekniğin El Kitabı: Gerçek Bir Cerrahın Ameliyathanede Gezinme Rehberi. Elsevier Sağlık Bilimleri. ISBN 978-0-323-51222-0.
- Hoffman, R; Benz, Jr., EJ; Silberstein, LE; Heslop, H; Anastasi, J; Weitz, J (2013). Hematoloji: Temel İlkeler ve Uygulama (6 ed.). Elsevier Sağlık Bilimleri. ISBN 978-1-4377-2928-3.
- Isaacs, C; Agarwala, S; Cheson, B (2017). Hoffman ve Abeloff'un Hematoloji-Onkoloji İncelemesi (1 ed.). Elsevier Sağlık Bilimleri. ISBN 978-0-323-44318-0.
- Kaushansky, K; Lichtman, MA; Prchal, J; Levi, MM; Basın, OW; Burns, LJ; Caligiuri, M (2015). Williams Hematoloji (9 ed.). McGraw-Hill Eğitimi. ISBN 978-0-07-183301-1.
- Keohane, E; Smith, L; Walenga, J (2015). Rodak Hematolojisi: Klinik İlkeler ve Uygulamalar (5 ed.). Elsevier Sağlık Bilimleri. ISBN 978-0-323-23906-6.
- Kirkham, KR; Wijeysundera, DN; Pendrith, C; Ng, R; Tu, JV; Boozary, AS; et al. (2016). "Preoperatif laboratuvar incelemeleri". Anesteziyoloji. 124 (4): 804–814. doi:10.1097 / ALN.0000000000001013. ISSN 0003-3022. PMID 26825151. S2CID 35916964.
- Kottke-Marchant, K; Davis, B (2012). Laboratuvar Hematoloji Uygulaması (1 ed.). John Wiley & Sons. ISBN 978-1-4443-9857-1.
- Lanzkowsky, P; Lipton, JM; Balık, JD (2016). Lanzkowsky'nin Pediatrik Hematoloji ve Onkoloji El Kitabı. Elsevier Science. ISBN 978-0-12-801674-9.
- Lewandrowski, K; Rudolf, J (2016). "Rutin Hematoloji Laboratuvarında Kullanım Yönetimi". Lewandrowski J, Sluss PM (ed.). Klinik Laboratuvarda Kullanım Yönetimi ve Diğer Yardımcı Hizmetler. Springer. doi:10.1007/978-3-319-34199-6_10. ISBN 978-3-319-34199-6.
- Lewis, SL; Dirksen, SR; Heitkempet, MM; Bucher, L; Kamera, I (2015). Medikal-Cerrahi Hemşireliği: Klinik Sorunların Değerlendirilmesi ve Yönetimi, Tek Cilt (8 ed.). Elsevier Sağlık Bilimleri. ISBN 978-0-323-29033-3.
- Marshall, WJ; Lapsley, M; Gün, A; Ayling, R (2014). Klinik Biyokimya E-Kitabı: Metabolik ve Klinik Yönler (3 ed.). Elsevier Sağlık Bilimleri. ISBN 978-0-7020-5478-5.
- McCann, SR (2016). Bir Hematoloji Tarihi: Herodot'tan HIV'e. OUP Oxford. ISBN 978-0-19-102713-0.
- McPherson, RA; Pincus, MR (2017). Henry'nin Laboratuvar Yöntemleriyle Klinik Tanı ve Yönetimi (23 baskı). Elsevier Sağlık Bilimleri. ISBN 978-0-323-41315-2.
- Melamed, M (2001). "Bölüm 1 kısa bir akış sitometrisi ve sıralama tarihi". Hücre Biyolojisinde Yöntemler. 63 bölüm A. Elsevier. sayfa 3–17. doi:10.1016 / S0091-679X (01) 63005-X. ISBN 978-0-12-544166-7. PMID 11060834.
- Moore, EE; Feliciano, DV; Mattox, KL (2017). Travma (8 ed.). McGraw-Hill Eğitimi. ISBN 978-1-260-12860-4.
- Naeim, F; Rao, PN; Grody, WW (2009). Hematopatoloji: Morfoloji, İmmünofenotip, Sitogenetik ve Moleküler Yaklaşımlar (1 ed.). Akademik Basın. ISBN 978-0-08-091948-5.
- d'Onofrio, G; Zini, G (2014). Kan Hastalıklarının Morfolojisi (2 ed.). Wiley. ISBN 978-1-118-44258-6.
- Oropello, JM; Kvetan, V; Papazlar, SM (2016). Lange Kritik Bakım. McGraw-Hill Eğitimi. ISBN 978-0-07-181726-4.
- Pagana, KD; Pagana, TJ; Pagana, TN (2014). Mosby'nin Teşhis ve Laboratuvar Test Referansı. Elsevier Sağlık Bilimleri. ISBN 978-0-323-22592-2.
- Palmer, L; Briggs, C; McFadden, S; Zini, G; Burthem, J; Rozenberg, G; Proytcheva, M; Machin, SJ (2015). "Periferik kan hücresi morfolojik özelliklerinin adlandırılmasının standardizasyonu ve derecelendirilmesi için ICSH tavsiyeleri". Uluslararası Laboratuvar Hematoloji Dergisi. 37 (3): 287–303. doi:10.1111 / ijlh.12327. ISSN 1751-5521. PMID 25728865.
- Picot, J; Guerin, CL; Le Van Kim, C; Boulanger, C (2012). "Akış sitometrisi: retrospektif, temeller ve son enstrümantasyon". Sitoteknoloji. 64 (2): 109–130. doi:10.1007 / s10616-011-9415-0. ISSN 0920-9069. PMC 3279584. PMID 22271369.
- Porwit, A; McCullough, J; Erber, WN (2011). Kan ve Kemik İliği Patolojisi (2 ed.). Elsevier Sağlık Bilimleri. ISBN 978-0-7020-4535-6.
- Pierre, RV (2002). "Periferik kan filmi incelemesi: göz sayısı lökosit diferansiyelinin ölümü". Laboratuvar Tıbbı Klinikleri. 22 (1): 279–297. doi:10.1016 / S0272-2712 (03) 00075-1. ISSN 0272-2712. PMID 11933579.
- Powell, DJ; Achebe, MO (2016). "Birinci basamak hekimi için anemi". Birincil Bakım: Ofis Uygulamasında Klinikler. 43 (4): 527–542. doi:10.1016 / j.pop.2016.07.006. ISSN 0095-4543. PMID 27866575.
- Rodak, BF; Carr, JH (2013). Klinik Hematoloji Atlası (4 ed.). Elsevier Sağlık Bilimleri. ISBN 978-1-4557-0830-7.
- Schafermeyer, RW; Tenenbein, M; Macias CJ (2018). Garip ve Schafermeyer'in Pediatrik Acil Tıbbı (5 ed.). McGraw-Hill Eğitimi. ISBN 978-1-259-86076-8.
- Shapiro, HM (2003). Pratik Akış Sitometrisi (4 ed.). John Wiley & Sons. ISBN 978-0-471-43403-0.
- Schmaier, AH; Lazarus, HM (2012). Kısa hematoloji kılavuzu (1 ed.). Wiley-Blackwell. ISBN 978-1-4051-9666-6.
- Turgeon, ML (2016). Linné & Ringsrud'un Klinik Laboratuvar Bilimi: Kavramlar, Prosedürler ve Klinik Uygulamalar (7 ed.). Elsevier Mosby. ISBN 978-0-323-22545-8.
- Van Leeuwen, AM; Bladh, ML (2019). Davis'in Hemşirelik Uygulamaları ile Kapsamlı Laboratuvar ve Teşhis Testleri El Kitabı (8 ed.). F. A. Davis Şirketi. ISBN 978-0-8036-9448-4.
- Vieth, JT; Lane, DR (2014). "Anemi". Kuzey Amerika Acil Tıp Klinikleri. 32 (3): 613–628. doi:10.1016 / j.emc.2014.04.007. ISSN 0733-8627. PMID 25060253.
- Duvarlar, R; Hockberger, R; Gausche-Tepesi, M (2017). Rosen Acil Tıp - Kavramlar ve Klinik Uygulama (9 ed.). Elsevier Sağlık Bilimleri. ISBN 978-0-323-39016-3.
- Wang, SA; Hasserjian, RP (2018). Kan ve Kemik İliği Bozukluklarının Teşhisi. Springer. ISBN 978-3-319-20279-2.
- Wintrobe, MM (1985). Bir Bilimin Çiçek Açması: Hematoloji: Bir İlham ve Çaba Öyküsü. Lea ve Febiger. ISBN 978-0-8121-0961-0.
- Zandecki, M; Genevieve, F; Gerard, J; Godon, A (Şubat 2007). "Hematoloji analizörlerinde sahte sayımlar ve sahte sonuçlar: bir inceleme. Bölüm II: beyaz kan hücreleri, kırmızı kan hücreleri, hemoglobin, kırmızı hücre indeksleri ve retikülositler". Uluslararası Laboratuvar Hematoloji Dergisi. 29 (1): 21–41. doi:10.1111 / j.1365-2257.2006.00871.x. PMID 17224005.

