Karbonil alfa ikame reaksiyonları - Carbonyl alpha-substitution reactions
Alfa ikame reaksiyonları, karbonil grubunun yanındaki pozisyonda, a pozisyonunda meydana gelir ve aşağıdakileri içerir: ikame bir α hidrojen atom tarafından elektrofil, E, ya bir Enol veya enolate iyon orta düzey.[1]
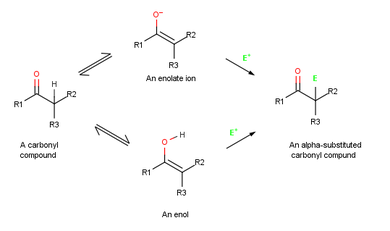
Reaksiyon mekanizması
Çünkü onların ikizi tahviller elektron zengindir, enoller nükleofiller ve elektrofillerle aynı şekilde alkenler yapmak. Ama rezonans yüzünden elektron komşuya yalnız bir elektron çifti bağışı oksijen enoller elektron açısından daha zengindir ve buna bağlı olarak alkenlerden daha reaktiftir. Aşağıdaki etenol elektrostatik potansiyel haritasında (H2C = CHOH) nasıl a karbonda önemli miktarda elektron yoğunluğu olduğu.
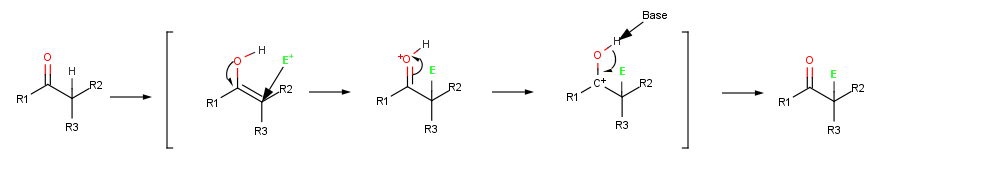
Bir alken, bir elektrofil ile reaksiyona girdiğinde, örneğin HCl, ilk ilave H+ bir ara verir katyon ve ardından Cl ile reaksiyon− bir ekleme verir ürün. Bununla birlikte, bir enol bir elektrofil ile reaksiyona girdiğinde, yalnızca ilk ekleme aşaması aynıdır. CI ile tepki vermek yerine− ilave bir ürün vermek için ara katyon OH'yi kaybeder− α-ikameli bir proton vermek için karbonil bileşiği.[1]:845
Aldehitlerin ve ketonların alfa halojenasyonu
Özellikle yaygın bir α-ikame reaksiyonu laboratuar ... halojenleşme nın-nin aldehitler ve ketonlar α pozisyonlarında Cl reaksiyonu ile2, Br2 veya ben2 asidik çözelti içinde. Brom içinde asetik asit çözücü sıklıkla kullanılır.
Dikkat çekici bir şekilde, keton halojenasyonu ayrıca biyolojik sistemler özellikle deniz yosununda, burada dibromoasetaldehit, bromoaseton 1, 1, 1-tribromoaseton ve diğer ilgili bileşikler bulunmuştur.
Halojenasyon, bir enol ara maddesinin asit katalizli oluşumu ile ilerleyen tipik bir a-ikame reaksiyonudur.[1]:846
Alfa-hidrojen atomlarının asitliği: enolat iyon oluşumu
Bir karbonil bileşiğinin α pozisyonundaki bir hidrojen zayıf asidik ve güçlü bir şekilde kaldırılabilir temel bir enolat iyonu elde etmek için. Karşılaştırırken aseton (pKa= 19.3) ile etan (pKa= 60), örneğin, komşu bir karbonil grubunun varlığı, ketonun alkan üzerindeki asitliğini 10 kat arttırır.40.
Bir soyutlama proton bir karbonil bileşiğinden, bir C-H bağı p'ye kabaca paralel yönlendirildiğinde ortaya çıkar. orbitaller karbonil grubunun. Enolat iyonunun α karbon atomu sp2- hibritlenmiştir ve komşu karbonil p orbitalleriyle örtüşen bir p orbitaline sahiptir. Böylece olumsuz şarj etmek tarafından paylaşılıyor elektronegatif oksijen atomu ve enolat iyonu ile stabilize edilir rezonans.
Karbonil bileşikleri, aynı nedenle alkanlardan daha asidiktir. karboksilik asitler alkollerden daha asidiktir. Her iki durumda da anyonlar rezonans ile stabilize edilir. Enolate iyonlar Karboksilat iyonlarından farklıdır, bununla birlikte, iki rezonans formu eşdeğer değildir - oksijen üzerindeki negatif yüke sahip form, karbon üzerindeki yüke göre enerji bakımından daha düşüktür. Bununla birlikte, rezonans stabilizasyonunun arkasındaki prensip her iki durumda da aynıdır.
Karbonil bileşikleri yalnızca zayıf asidik olduğundan, enolat iyon oluşumu için güçlü bir baza ihtiyaç vardır. Baz olarak sodyum etoksit gibi bir alkoksit kullanılırsa, proton giderme yalnızca yaklaşık% 0.1 oranında gerçekleşir çünkü aseton, etanolden (pK) daha zayıf bir asittir.a= 16). Ancak, daha güçlü bir üsse sodyum hidrit (NaH) veya lityum diizopropilamid (LDA ) kullanıldığında, bir karbonil bileşiği tamamen enolat iyonuna dönüştürülebilir. Güçlü bazın reaksiyonuyla kolayca hazırlanan lityum diizopropilamid (LDA) butillityum ile diizopropilamin, laboratuvarda karbonil bileşiklerinden enolat iyonları hazırlamak için bir baz olarak yaygın şekilde kullanılmaktadır.
Dahil olmak üzere birçok karbonil bileşiği türü aldehitler, ketonlar, esterler, tiyoesterler, asitler, ve amidler, LDA ile reaksiyona girerek enolat iyonlarına dönüştürülebilir. Bunu not et nitriller da asidiktir ve enolat benzeri anyonlara dönüştürülebilir ( nitril anyonlar Bir hidrojen atomu iki karbonil grubu tarafından kuşatıldığında, asitliği daha da artar. Β-dikarbonil bileşiklerinin bu artırılmış asitliği, her iki karbonil grubu üzerindeki negatif yükün yer değiştirmesi ile ortaya çıkan enolat iyonlarının stabilizasyonundan kaynaklanmaktadır.[1]:850
Enolat iyonlarının reaktivitesi
Enolat iyonları iki nedenden dolayı enollerden daha faydalıdır. Birincisi, saf enoller normalde izole edilemez, bunun yerine sadece kısa ömürlü ara maddeler olarak düşük konsantrasyon. Buna karşılık, saf enolat iyonlarının kararlı çözeltileri, çoğu karbonil bileşiğinden güçlü bir baz ile reaksiyona sokularak kolayca hazırlanır. İkinci olarak, enolat iyonları enollerden daha reaktiftir ve enollerin yapmadığı birçok reaksiyona uğrar. Enoller nötr iken, enolat iyonları negatif yüklüdür ve bu onları çok daha iyi nükleofiller yapar. Sonuç olarak, enolat iyonları hem laboratuar hem de biyolojik kimyada enollerden daha yaygındır.
Eşdeğer olmayan iki formun rezonans melezleri oldukları için, enolat iyonları her ikisine de vinilik olarak bakılabilir. alkoksitler (C = C- O−) veya α-ketokarbanyonlar olarak (−C-C = O). Böylece, enolat iyonları elektrofillerle oksijen veya karbon üzerinde reaksiyona girebilir. Oksijenle reaksiyon bir enol türevi verirken, karbon üzerindeki reaksiyon a-ikameli bir karbonil bileşiği verir. Her iki tür reaktivite de bilinmektedir, ancak karbon üzerine reaksiyon daha yaygındır.[1]:853
Enolat iyonlarının alkilasyonu
Belki de enolat iyonlarının en önemli tek reaksiyonu, bir alkil halojenür veya tosilat, böylece yeni bir C-C bağı oluşturur ve iki küçük parçayı daha büyük bir parçada birleştirir molekül. Alkilasyon, nükleofilik enolat iyonu, bir SN'de elektrofilik alkil halojenür ile reaksiyona girdiğinde meydana gelir.2 reaksiyon ve yerini alır gruptan ayrılmak arka saldırı ile.
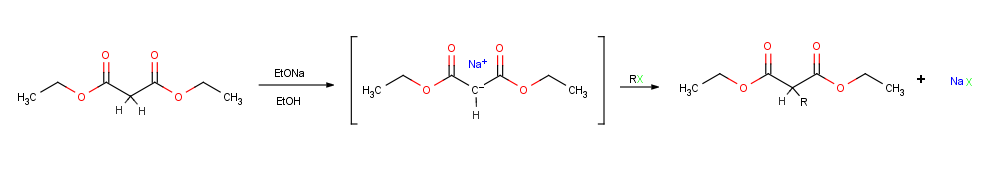
Alkilasyon reaksiyonları, tüm SN'yi etkileyen aynı kısıtlamalara tabidir.2 reaksiyonlar. Böylece, alkilleyici ajan R-X'teki ayrılan grup X, klorür, bromür, iyodür veya tosilat . Karo alkil grubu R, birincil veya metil olmalı ve tercihen müttefik veya benzilik. İkincil halojenürler zayıf tepki verir ve üçüncül halojenürler hiç tepki vermez çünkü rakip bir E2 eliminasyon Bunun yerine HX oluşur. Vinil ve aril halojenürler de reaktif değildir çünkü arka taraf yaklaşımı sterik olarak engellenir.[1]:855
