Bakır (II) nitrat - Copper(II) nitrate
 | |
 | |
| İsimler | |
|---|---|
| IUPAC adı Bakır (II) nitrat | |
| Diğer isimler Bakır nitrat | |
| Tanımlayıcılar | |
| |
3 boyutlu model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ECHA Bilgi Kartı | 100.019.853 |
PubChem Müşteri Kimliği | |
| RTECS numarası |
|
| UNII | |
CompTox Kontrol Paneli (EPA) | |
| |
| |
| Özellikleri | |
| Cu (HAYIR3)2 | |
| Molar kütle | 187.5558 g / mol (susuz) 241.60 g / mol (trihidrat) 232.591 g / mol (hemipentahidrat) |
| Görünüm | mavi kristaller higroskopik |
| Yoğunluk | 3,05 g / cm3 (susuz) 2,32 g / cm3 (trihidrat) 2,07 g / cm3 (heksahidrat) |
| Erime noktası | 114 ° C (237 ° F; 387 K) (susuz, ayrışır) 114.5 ° C (trihidrat) 26.4 ° C (heksahidrat, ayrışır) |
| Kaynama noktası | 170 ° C (338 ° F; 443 K) (trihidrat, ayrışır) |
| trihidrat:[1] 381 g / 100 mL (40 ° C) 666 g / 100 mL (80 ° C) heksahidrat:[1] 243,7 g / 100 mL (80 ° C) | |
| Çözünürlük | içinde çok çözünür hidratlar etanol, amonyak, Su; içinde çözülmez Etil asetat |
| +1570.0·10−6 santimetre3/ mol (~ 3H2Ö) | |
| Yapısı | |
| ortorombik (susuz) rhombohedral (hidratlar) | |
| Tehlikeler | |
| Ana tehlikeler | Tahriş edici, Oksitleyici |
| Güvenlik Bilgi Formu | Cu (HAYIR3)2· 3H2Ö |
| NFPA 704 (ateş elması) | |
| NIOSH (ABD sağlık maruziyet sınırları): | |
PEL (İzin verilebilir) | TWA 1 mg / m23 (Cu olarak)[2] |
REL (Önerilen) | TWA 1 mg / m23 (Cu olarak)[2] |
IDLH (Ani tehlike) | TWA 100 mg / m3 (Cu olarak)[2] |
| Bağıntılı bileşikler | |
Diğer anyonlar | Bakır (II) sülfat Bakır (II) klorür |
Diğer katyonlar | Nikel (II) nitrat Çinko nitrat |
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |
| Bilgi kutusu referansları | |
Bakır (II) nitrat, Cu (HAYIR3 )2, bir inorganik bileşik mavi oluşturan kristal katı. Susuz bakır nitrat koyu mavi-yeşil kristaller oluşturur ve yüceltmek 150-200 ° C'de bir vakumda.[3] Bakır nitrat da beş farklı hidratlar en yaygın olanları hemipentahidrat ve trihidrattır.
Bakır nitrat için sentez ve reaksiyonlar

Hidratlı bakır nitrat, susuz malzemenin hidrasyonu yoluyla veya bakır metali bir sulu çözelti nın-nin gümüş nitrat veya konsantre Nitrik asit:[4]
- Cu + 4 HNO3 → Cu (HAYIR3)2 + 2 H2O + 2 YOK2
Susuz Cu (NO3)2 bakır metal ile işlendiğinde oluşur N2Ö4:
- Cu + 2 N2Ö4 → Cu (HAYIR3)2 + 2 YOK
Hidratlanmış bakır (II) nitratlarından herhangi birinin ısıtılmasıyla dehidrasyon girişiminde bulunulması, Cu (NO3)2. 80 ° C'de hidratlar "bazik bakır nitrata" (Cu2(HAYIR3) (OH)3), 180 ° C'de CuO'ya dönüşür.[4] Bu reaktiviteden yararlanarak, bakır nitrat üretmek için kullanılabilir. Nitrik asit ayrışana kadar ısıtarak ve dumanı doğrudan suya geçirerek. Bu yöntem son adımla benzerdir. Ostwald süreci. Denklemler aşağıdaki gibidir:
- 2 Cu (HAYIR3)2 → 2 CuO + 4 YOK2 + O2
- 3 YOK2 + H2O → 2HNO3 + HAYIR
Doğal bazik bakır nitratlar, nadir bulunan mineralleri içerir Gerhardtit ve Rouaite her ikisi de Cu polimorflarıdır2(HAYIR3) (OH)3 madde.[5][6][7] Çok daha karmaşık, bazik, hidratlı ve klorür içeren doğal bir tuz, buttgenbakiit.[8][7]
Yapısı
Susuz bakır (II) nitrat
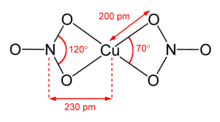
Susuz bakır (II) nitrat iki şekilde kristalize edildi solvat -Bedava polimorflar.[9][10] α- ve β-Cu (HAYIR3)2 tamamen 3D koordinasyon polimer ağlarıdır. Alfa formu, [4 + 1] koordinasyonlu yalnızca bir Cu ortamına sahiptir, ancak beta formu, biri [4 + 1] diğeri kare düzlemli olmak üzere iki farklı bakır merkeze sahiptir. Nitrometan solvat ayrıca yaklaşık 200 pm dört kısa Cu-O bağı ve 240 pm'de bir daha uzun bağ ile "[4+ 1] koordinasyonuna" sahiptir.[11] Onlar koordinasyon polimerleri, sonsuz zincir bakır (II) merkezler ve nitrat grupları ile. Gaz fazında, bakır (II) nitrat iki çift dişli nitrat ligandı içerir (sağ üstteki resme bakın).[12] Bu nedenle, katının buharlaşması "çatlama "bakır (II) nitrat molekülünü vermek için.
Hidratlı bakır (II) nitrat
Beş hidratlar rapor edilmiştir: monohidrat (Cu (NO3)2· H2Ö),[10] seskihidrat (Cu (NO3)2· 1.5H2Ö),[13] hemipentahidrat (Cu (NO3)2· 2.5H2Ö),[14] bir trihidrat (Cu (NO3)2· 3H2Ö),[15] ve bir heksahidrat ([Cu (H2Ö)6](HAYIR3)2).[16] Hekzahidrat ilginçtir çünkü Cu-O mesafelerinin tümü eşittir, Jahn-Teller distorsiyonu bu, aksi takdirde oktahedral Cu (II) komplekslerinin karakteristiğidir. Bu etkisizlik, güçlü hidrojen bağı Cu-O bağlarının esnekliğini sınırlayan.
Başvurular
Bakır (II) nitrat, çeşitli uygulamalar bulur; bunlardan en önemlisi, bakır (II) oksit olarak kullanılan katalizör çeşitli işlemler için organik Kimya. Çözümleri tekstillerde ve diğer metaller için parlatıcılarda kullanılır. Bakır nitratlar bazılarında bulunur piroteknik.[4] Genellikle okul laboratuvarlarında kimyasalları göstermek için kullanılır. voltaik hücre reaksiyonlar. Bazı seramik sırlarında ve metal patinalarda bir bileşendir.
Organik sentez
Bakır nitrat, asetik anhidrit, nitrasyon için etkili bir reaktiftir. aromatik olarak bilinen bileşikler Menke nitrasyon Metal nitratların nitrasyon için etkili reaktifler olduğunu keşfeden Hollandalı kimyagerin onuruna.[17]Kile adsorbe edilen hidratlanmış bakır nitrat, "Claycop" adı verilen bir reaktifi verir. Elde edilen mavi renkli kil, bir bulamaç olarak, örneğin oksidasyon için kullanılır. tioller -e disülfürler. Claycop ayrıca ditiyoasetalleri karbonillere dönüştürmek için kullanılır.[18] Aşağıdakilere dayalı ilgili bir reaktif Montmorillonit için yararlı olduğu kanıtlanmıştır nitrasyon aromatik bileşikler.[19]
Referanslar
- ^ a b Perrys'in Kimya Mühendisliği El Kitabı, 7. Baskı
- ^ a b c Kimyasal Tehlikeler için NIOSH Cep Rehberi. "#0150". Ulusal Mesleki Güvenlik ve Sağlık Enstitüsü (NIOSH).
- ^ Geçiş ve Sutcliffe (1968). Pratik İnorganik Kimya. Londra: Chapman ve Hall.
- ^ a b c H.Wayne Richardson "Copper Compounds" Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a07_567.
- ^ https://www.mindat.org/min-1680.html
- ^ http://www.mindat.org/min-10588.html
- ^ a b https://www.ima-mineralogy.org/Minlist.htm
- ^ https://www.mindat.org/min-811.html
- ^ Wallwork, S. C .; Addison, W. E. (1965). "Susuz nitratların kristal yapıları ve kompleksleri. Bölüm I. Bakır (II) nitratın α formu". J. Chem. Soc. 1965: 2925–2933. doi:10.1039 / JR9650002925.
- ^ a b Troyanov, S. I .; Morozov, I. V .; Znamenkov, K. O .; Yu; Korenev, M. (1995). "Yeni Bakır (II) Nitratlarının Sentezi ve X Işını Yapısı: Cu (NO3)2· H2O ve? -Cu'nun modifikasyonu (NO3)2". Z. Anorg. Allg. Kimya. 621: 1261–1265. doi:10.1002 / zaac.19956210727.
- ^ Duffin, B .; Duvar işi, S.C. (1966). "Susuz nitratların kristal yapısı ve kompleksleri. II. 1: 1 bakır (II) nitrat-nitrometan kompleksi". Açta Crystallographica. 20 (2): 210–213. doi:10.1107 / S0365110X66000434.
- ^ LaVilla, R. E .; Bauer, S.H. (1963). "Elektron Kırınımı ile Belirlenen Gaz Halindeki Bakır (II) Nitratın Yapısı". J. Am. Chem. Soc. 85 (22): 3597–3600. doi:10.1021 / ja00905a015.
- ^ Dornberger-Schiff, K .; Leciejewicz, J. (1958). "Zur Struktur des Kupfernitrates Cu (NO3)2.1.5H2Ö". Açta Crystallogr. 11: 825–826. doi:10.1107 / S0365110X58002322.
- ^ Morosin, B. (1970). "Cu'nun kristal yapısı (NO3)2.2.5H2Ö". Açta Crystallogr. B26: 1203–1208. doi:10.1107 / S0567740870003898.
- ^ J. Garaj, Sbornik Prac. Chem.-Technol. Fak. Svst., Cskosl. 1966, s. 35–39.
- ^ Zibaseresht, R .; Hartshorn, R.M. (2006). "Hexaaquacopper (II) dinitrat: Jahn-Teller distorsiyonunun yokluğu". Açta Crystallogr. E62: i19 – i22. doi:10.1107 / S1600536805041851.
- ^ Menke J.B. (1925). "Nitratlarla nitrasyon". Recueil des Travaux Chimiques des Pays-Bas. 44: 141. doi:10.1002 / recl.19250440209.
- ^ Balogh, M. "Copper (II) Nitrate – K10 Bentonite Clay" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002 / 047084289X.
- ^ Collet Christine (1990). "Killer Doğrudan Aromatik Nitrasyon". Angewandte Chemie International Edition İngilizce. 29 (5): 535–536. doi:10.1002 / anie.199005351.

