Döngüsel - Cycloaddition - Wikipedia
Bir siklokasyon bir Kimyasal reaksiyon burada "iki veya daha fazla doymamış molekül (veya aynı molekülün parçaları), bağ çokluğunda net bir azalmanın olduğu bir siklik eklenti oluşumu ile birleşir." Ortaya çıkan reaksiyon bir siklizasyon reaksiyon. Tüm döngü koşullarının çoğu değil, çoğu uyumlu ve böylece perisiklik.[1] Uyumsuz döngüsel koşullar perisiklik değildir.[2] Bir sınıf olarak toplama reaksiyonu, döngüsel koşullar, karbon-karbon bağı oluşumuna bir nükleofil veya elektrofil.
Döngü koşulları, iki notasyon sistemi kullanılarak tanımlanabilir. Daha eski ama yine de yaygın bir gösterim, reaktanlardaki atomların doğrusal düzenlemelerinin boyutuna dayanmaktadır. Kullanır parantez: (ben + j + ...) burada değişkenler, her reaktanttaki doğrusal atomların sayılarıdır. Ürün bir boyut döngüsüdür (ben + j + ...). Bu sistemde standart Diels-Alder reaksiyonu bir (4 + 2) -cycloaddition, 1,3-çift kutuplu döngü bir (3 + 2) -cycloaddition ve siklopropanasyon bir alken a (2 + 1) -cycloaddition ile bir karben.[1]
Daha yeni, IUPAC tarafından tercih edilen bir gösterim, ilk olarak Woodward ve Hoffmann, kullanır köşeli parantez sayısını belirtmek için elektronlarürünün oluşumunda karbon atomlarından ziyade rol oynar. İçinde [ben + j + ...] notasyonu, standart Diels-Alder reaksiyonu bir [4 + 2] -cycloaddition iken 1,3-dipolar cycloaddition aynı zamanda bir [4 + 2] -cycloaddition.[1]
Termal döngü koşulları ve stereokimyası
Termal döngü koşulları, reaktanların temel elektronik durumunda olduğu döngüsel koşullardır. Genellikle (4n + 2) π bir tam sayı için başlangıç materyaline katılan elektronlar. Bu reaksiyonların nedenleri yörünge simetrisi içinde yüzüstü yüzeysel veya antarafasiyal -antarafasiyal şekilde (nadir). 4'e sahip birkaç termal döngüleme örneği vardır.n π elektronlar (örneğin [2 + 2] -cycloaddition). Bunlar suprafasiyal-antarafasiyal anlamda ilerler, örneğin Keten içinde dikey dizi p orbitalleri reaksiyonun çapraz olarak ilerlemesine izin verir geçiş durumu.
Fotokimyasal döngüsel koşullar ve bunların stereokimyası
4n π elektronun katıldığı döngüsel koşullar da şu yolla gerçekleşebilir: fotokimyasal aktivasyon. Burada, bir bileşenin, HOMO (π bağlanma) LUMO (π * yapışma ). Yörünge simetrisi, reaksiyonun suprafasial-suprafasial bir tarzda ilerleyebileceği şekildedir. Bir örnek, DeMayo reaksiyonu. Başka bir örnek aşağıda gösterilmiştir, fotokimyasal dimerizasyonu tarçın asidi.[3] İki trans alkenler tepeden tırnağa ve izole izomerler arandı truxillic asitler.
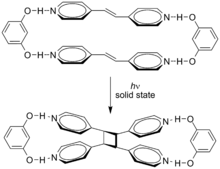
Supramoleküler etkiler bu döngüsel koşulları etkileyebilir. Döngüsel trans-1,2-bis (4-piridil) eten, resorsinol içinde katı hal % 100 olarak Yol ver.[4]
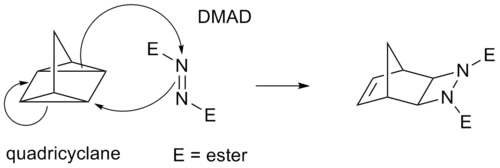
Π bağları yerine bazı döngüsel koşullar gergin siklopropan halkalar, çünkü bunlar önemli karaktere sahiptir. Örneğin, Diels-Alder reaksiyonu için bir analog, dört tekerlekli uçak -DMAD reaksiyon:
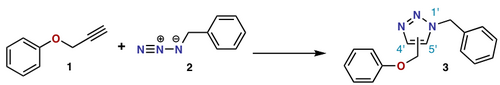
(İ + j + ...) siklokasyon gösteriminde i ve j, siklokasyonda yer alan atomların sayısını belirtir. Bu gösterimde, bir Diels-Alder reaksiyonu, bir (4 + 2) siklo-katma ve bir 1,3-dipolar eklemedir. ozonoliz bir (3 + 2) döngüsel yüklemedir. IUPAC ancak [i + j + ...] ile tercih edilen gösterim atomları değil elektronları hesaba katar. Bu gösterimde, DA reaksiyonu ve dipolar reaksiyonun her ikisi de bir [4 + 2] siklo katma haline gelir. Arasındaki reaksiyon Norbornadiene ve aktive edilmiş alkin bir [2 + 2 + 2] döngüsel yüklemedir.
Cycloaddition türleri
Diels-Alder reaksiyonları
Diels-Alder reaksiyonu belki de en önemli ve yaygın olarak öğretilen siklokasyon reaksiyonudur. Resmi olarak bu bir [4 + 2] siklo katma reaksiyonudur ve çok çeşitli formlarda mevcuttur. ters elektron talepli Diels-Alder reaksiyonu, Hexadehydro Diels-Alder reaksiyonu ve ilgili alkin trimerizasyonu. Reaksiyon aynı zamanda ters yönde de çalıştırılabilir. retro-Diels-Alder reaksiyonu.
Heteroatomları içeren reaksiyonlar bilinmektedir; I dahil ederek aza-Diels – Kızılağaç ve Imine Diels-Alder reaksiyonu.
Huisgen döngüsel koşullar
Huisgen sikloaddition reaksiyon bir (2 + 3) siklo-eklemedir.
Nitron-olefin siklo katılma
Nitron-olefin siklo ilave bir (3 + 2) döngüsel yüklemedir.
Demir katalizörlü 2 + 2 olefin siklo ilave
Demir [piridin (diimin)] katalizörleri, merkezi demir atomunun iki basit, işlevsiz olefin çift bağıyla koordine edebileceği bir redoks aktif ligand içerir. Katalizör, II oksidasyon durumundaki merkezi demir atomu ile eşleşmemiş elektronları içeren bir yapı ile demirin 0 oksidasyon durumunda olduğu bir yapı arasındaki rezonans olarak yazılabilir. Bu, ona, C-C indirgeyici eliminasyon yoluyla bir siklobütan yapısı oluşturarak bir siklizasyon reaksiyonuna girdiklerinde çift bağları bağlama esnekliği verir; alternatif olarak bir siklobuten yapısı beta-hidrojen eliminasyonu ile üretilebilir. Reaksiyonun etkinliği, kullanılan alkenlere bağlı olarak büyük ölçüde değişir, ancak rasyonel ligand tasarımı, katalize edilebilen reaksiyon aralığının genişlemesine izin verebilir.[5][6]
Şeletropik reaksiyonlar
Şeletropik reaksiyonlar döngüsel koşulların bir alt sınıfıdır. Keletropik reaksiyonların temel ayırt edici özelliği, reaktiflerden birinde, aynı atoma her iki yeni bağın yapılmasıdır. Klasik örnek şu tepkidir: kükürt dioksit Birlikte Dien.
Diğer
Diğer siklo katma reaksiyonları mevcuttur: [4 + 3] döngüsel yüklenme, [6 + 4] döngüsel yüklenme, [2 + 2] foto çevrimsel yükleme, ve [4 + 4] foto çevrimsel yükleme
Biçimsel döngüsel koşullar
Döngüsel koşullar genellikle metal katalizlidir ve kademeli olarak radikal analoglar, ancak bunlar tam anlamıyla perisiklik reaksiyonlar değildir. Bir siklokatlama yüklü veya radikal ara maddeler söz konusu olduğunda veya siklokatlama sonucu bir dizi reaksiyon adımında elde edildiğinde, bazen denir resmi döngüsel koşullar gerçek perisiklik döngüsel koşullar ile ayrım yapmak.
Döngüsel bir döngüsel [3 + 3] döngüsel koşulun bir örneği enone ve bir enamin katalize eden n-butillityum bir Leylek enamin / 1,2 ekleme kademeli reaksiyon:[7]
![Moleküller Arası Biçim [3 + 3] Döngüsel Katılma Reaksiyonu](http://upload.wikimedia.org/wikipedia/commons/thumb/2/26/3%2B3-cycloaddition.svg/600px-3%2B3-cycloaddition.svg.png)
Referanslar
- ^ a b c "cycloaddition", IUPAC Kimyasal Terminoloji Özeti, IUPAC, doi:10.1351 / goldbook.C01496, alındı 2018-10-13
- ^ "perisiklik reaksiyon", IUPAC Kimyasal Terminoloji Özeti, IUPAC, doi:10.1351 / goldbook.P04491, alındı 2018-10-13
- ^ Hein, Sara M. (Haziran 2006). "NMR Verileri Kullanılarak Fotokimyasal Perisiklik Reaksiyonun İncelenmesi". Kimya Eğitimi Dergisi. 83 (6): 940–942. Bibcode:2006JChEd..83..940H. doi:10.1021 / ed083p940.
- ^ L. R. MacGillivray; J. L. Reid; J.A. Ripmeester (2000). "Doğrusal Moleküler Şablonlar Kullanılarak Katı Halde Reaktivitenin Supramoleküler Kontrolü". J. Am. Chem. Soc. 122 (32): 7817–7818. doi:10.1021 / ja001239i.
- ^ Jordan M. Hoyt; Valeria A. Schmidt; Aaron M. Tondreau; Paul J. Chirik (2015-08-28). "Aktifleştirilmemiş alkenlerin demir katalizli moleküller arası [2 + 2] siklo-eklemeleri". Bilim. 349 (6251): 960–963. Bibcode:2015Sci ... 349..960H. doi:10.1126 / science.aac7440. PMID 26315433.
- ^ Myles W. Smith; Phil S. Baran (2015-08-28). "[2 + 2] kadar basit". Bilim. 349 (6251): 925–926. Bibcode:2015Sci ... 349..925S. doi:10.1126 / science.aac9883.
- ^ Movassaghi, Mohammad; Bin Chen (2007). "Stereoselektif İntermoleküler Biçimsel [3 + 3] Siklik Enaminlerin ve Enonların Döngüsel Katılma Reaksiyonu". Angew. Chem. Int. Ed. 46 (4): 565–568. doi:10.1002 / anie.200603302. PMC 3510678. PMID 17146819.