Eos (protein) - Eos (protein)
EosFP bir foto etkinleştirilebilir yeşil ila kırmızı floresan protein. Yeşil floresansı (516 nm) kırmızıya (581 nm) döner. UV ışınlaması Peptid omurgasındaki bir kırılmadan kaynaklanan foto indüklenmiş bir modifikasyon nedeniyle ~ 390 nm (mor / mavi ışık) kromofor.[1] Eos ilk olarak bir tetramerik protein taşlı mercanda Lobophyllia hemprichii[2]. Diğer floresan proteinler gibi Eos, füzyon proteinlerinin izlenmesi, çok renkli etiketleme ve hücre hareketinin izlenmesi gibi uygulamalara izin verir.[3] MEos2, mEos4 ve CaMPARI dahil olmak üzere belirli çalışma sistemlerinde kullanılmak üzere çeşitli Eos varyantları tasarlanmıştır.
Tarih

EosFP ilk olarak 2005 yılında büyük ölçekli bir ekran sırasında keşfedildi. PAFP'ler Taşlı mercan içindeki (foto-aktifleştirilebilir floresan proteinler) Lobophyllia hemprichii.[2] O zamandan beri başarıyla klonlandı Escherichia coli ve füzyon yapıları insan hücrelerinde kullanılmak üzere geliştirilmiştir.[2] Eos adını Yunan şafak tanrıçası.[2]
Türetilen tetramerik floresan proteinlerin aksine Anthozoan mercan, protein alt birimleri arasındaki etkileşimler nedeniyle normal hücresel işleve müdahale edebilen EosFP, dimerik ve monomerik tek nokta girişiyle varyantlar mutasyonlar.[4] Bu varyantlar, konakçı hücrede işlevi bozmadan hücresel bileşenlerin izlenmesinde başarılı olmuş ve vahşi tip Eos ile aynı fotofiziksel özellikleri korumuştur.[5]
Keşiflerinden bu yana, monomerik Eos problarının (mEos) sitozol, hücre zarı, endozomlar, prevakuolar veziküller, boşluklar, endoplazmik retikulum, golgi organları, peroksizomlar, mitokondri, invajinasyonlar, filamentli aktin ve kortikal mikrotübüller.[6] mEos füzyon proteinleri, gelişmekte olan organlardaki tek hücrelerde veya hücre gruplarında farklı renk etiketlemeye izin verir. Organeller ve veziküller arasındaki uzaysal / zamansal etkileşimlerin anlaşılması için de kullanılabilirler. MEosFP'nin iki flüoresan formu (yeşil ve kırmızı), çok renkli etiketleme için CFP, GFP, YFP ve RFP ile uyumludur.[6]
Fonksiyon
EosFP, 390 nm'lik UV ışığı ile ışınlandığında geri dönüşümsüz olarak kırmızıya (581 nm) dönüşen güçlü bir yeşil floresan (516 nm) yayar. Bu değişiklik, kromoforun yanındaki peptit omurgasındaki bir kırılma nedeniyle oluşur.[2] Bu mekanizma, proteinin lokalize etiketlenmesine izin verir ve EosFP'yi canlı hücrelerdeki protein hareketini izlemek için uygun bir araç haline getirir.[7] Kırmızı kromoforun oluşumu, peptit omurgasının bölünmesini içerir, ancak protein yapısında neredeyse hiçbir değişiklik içermez.[8]
Tek moleküle göre floresans spektroskopisi , EosFP tetramerik ve güçlü sergiler Forster rezonansı bireysel floroforlar içinde birleşme.[2] Diğer floresan proteinler gibi, Eos da çeşitli sinyalleri rapor etmek için kullanılabilir. hücreler, Dokular ve organlar karmaşık biyolojik makineleri rahatsız etmeden. Floresan proteinlerin kullanımı bir zamanlar yeşil floresan proteinle sınırlıyken (GFP ), son yıllarda birçok başka floresan protein klonlandı. Işıldayan denizanasından türetilen GFP'lerin aksine Aequorea Victoria, flüoresan proteinler Anthozoa Eos dahil olmak üzere kırmızı spektral aralıkta floresan yayar. Eos'ta ışıkla uyarılan yeşilden kırmızıya dönüşümün yeni özelliği yararlıdır çünkü canlı hücrelerdeki proteinlerin yerel olarak izlenmesine izin verir.[2] EosFP benzersizdir çünkü yayabileceği dalga boylarında büyük bir ayrıma sahiptir, bu da pik renklerin kolay tanımlanmasına olanak tanır.[5] Eos dahil tüm yeşilden kırmızıya ışıkla indüklenebilir floresan proteinler, tripeptit his-tyr-gly'den türetilen bir kromoforik birim içerir. Bu yeşilden kırmızıya dönüşüm, diğer FP'lerde olduğu gibi kimyasal oksidasyondan ziyade ışıkla tamamlanır.[5]
Yapı ve Absorbans Özellikleri
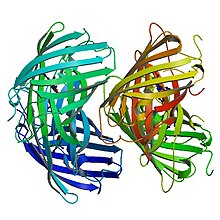
Birincil yapı
EosFP 226'dan oluşur amino asitler. 25.8 kDa'lık bir moleküler kütleye sahiptir ve pl'si 6.9'dur. Eos,% 84 özdeş kalıntıya sahiptir. Kaede, farklı bir skleraktin mercanından kaynaklanan floresan bir protein Trachyphyllia geoffroyi, ama aynı zamanda UV ışığı kullanılarak yeşilden kırmızıya yayan bir forma geri döndürülemez bir şekilde dönüştürülebilir.[8] Phe-61 ve His-62 kalıntıları hariç, kromofor ortamı ve kromoforun kendisi fotokimyasal modifikasyondan etkilenmez.[7] Yabani tip EosFP, her alt birimin GFP ile aynı β-kutu yapısına sahip olduğu dörtlü alt birim düzenlemesine sahiptir. Bu yapı, 11 telli bir namlu ve merkezi eksenin aşağısında florofor içeren sarmal içerir.
Yeşil EosFP'nin Yapısı
Anyonik formunda, yeşil kromofor 506 nm'de bir maksimum absorpsiyona ve 516 nm'de bir emisyon maksimumuna sahiptir. His-62, Tyr-63 ve Gly-64 amino asitlerinden otokatalitik olarak oluşturulur. Kromoforu hemen çevreleyen, yapısal su moleküllerinin yanı sıra yüklü veya polar amino asitlerden oluşan bir küme vardır. Kromofor düzleminin üzerinde, Glu-144, His-194, Glu-212 ve Gln-38 arasında bir hidrojen bağı etkileşimleri ağı vardır. Arg-66 ve Arg-91, yeşil Eos'un imidazolinon kısmının karbonil oksijeni ile hidrojen bağına katılır. His-62 yan zinciri kutupsuz bir ortamda yatıyor.[7] Yeşilden kırmızı forma dönüşüm, kromoforu oluşturan tripeptit HYG'nin ilk pozisyonunda bir histidinin varlığına bağlıdır. Bu histidin kalıntısı M, S, T veya L ile ikame edildiğinde, Eos yalnızca parlak yeşil ışık yayar ve artık bir foto-dönüştürülebilir floresan protein olarak işlev görmez.[2]

Red EosFP'nin Yapısı
Peptit omurgasının bölünmesiyle oluşturulan kırmızı kromofor, anyonik formunda 571 nm'de maksimum absorpsiyon ve 581 nm'de maksimum emisyona sahiptir. Bu kromofora yol açan peptit omurgasındaki kırılma, His-62 Nα ve Cα arasındadır.[5] Gözlenen kırmızı floresans, His-62 imidazol halkasının imidazolinona bağlandığı yerde kromoforun π-konjugasyonunun bir uzantısı nedeniyle oluşur. Kırmızı ve yeşil kromoforların hidrojen bağ modelleri neredeyse aynıdır.[7]
| Özellikleri[9] | |
|---|---|
| Foto dönüşüm dalga boyu | 390 nm |
| Yeşil absorbans tepe noktası | 506 nm |
| Yeşil emisyon zirvesi | 516 nm |
| Kırmızı absorbans tepe noktası | 571 nm |
| Kırmızı emisyon tepe noktası | 581 nm |
| Yeşil parlaklık * | 1,3X |
| Kırmızı parlaklık * | 0,7X |
| *Parlaklık değerleri, EGFP. | |
Fotokimyasal dönüşüm
Fotokimyasal dönüşüm, kromoforik birim ile çevresindeki kalıntılar arasındaki etkileşimler nedeniyle oluşur. Glu-212, bir proton His-62'den His-62-Na-Cα bağının bölünmesine yardımcı olur. Glu-212'nin glutamin ile değiştirilmesi foto dönüşümü önler. Düşük pH'ta, foto-dönüştürmeye katılan Eos verimi, protonlanmış formdaki moleküllerin fraksiyonu arttıkça büyük ölçüde artar. Foto dönüşüm için eylem spektrumu, Eos'un protonlanmış formunun eylem spektrumu ile yakından ilgilidir. Bu gözlemler, protonlanmış bir Tyr-63 yan zinciri de dahil olmak üzere yeşil kromoforun nötr formunun, foto dönüşüm için ağ geçidi yapısı olduğunu göstermektedir. Tyr-63 fenil yan zincirinden proton püskürtmesi, Phe-61 karbonile hidrojen bağlı His-62 imidazolden bir protonun transfer edildiği dönüşüm mekanizmasında önemli bir olaydır. Ekstra proton, His-62'nin, eleme reaksiyonunda His ve Phe arasındaki peptit bağından ayrılan bir grup oluşturan Phe-61 karbonile bir proton bağışlamasına neden olur. His-62 yan zinciri, foto uyarma sırasında protonlanır ve ayrılan gruptaki Phe-61 karbonile bir proton bağışlayarak reaksiyona yardımcı olur. Omurga ayrıldıktan sonra, His-62 ve Phe-61 arasındaki hidrojen bağı yeniden oluşturulur. His-62 diğer amino asitlerle değiştirildiğinde, EosFP foto dönüştürme yeteneğini kaybeder ve His-62'nin foto dönüştürme mekanizmasının gerekli bir bileşeni olduğuna dair kanıt sağlar.[7] Yeşil kromoforun dahili yük dağılımı, eliminasyon reaksiyonuna yardımcı olmak için foto eksitasyon sırasında değiştirilir.[5]
Spektroskopi
Hem floresans uyarma ve emisyon vahşi tip EosFP spektrumları, spektrumun kırmızı ucuna doğru eksitasyon üzerine ~ 65 nm sağa kaydırılır. Bu spektral değişikliğe, geri döndürülemez bir mekanizmada Phe-61 ve His-62 arasındaki peptit omurgasında bir kırılma ile birlikte kromoforun bir uzantısı neden olur.[1] 432 nm'de gevrek bir izosbestik noktanın varlığı da iki tür arasında bir dönüşüm olduğunu gösterir. 280 nm'de bir absorpsiyon zirvesi, aromatik amino asitler uyarma enerjilerini yeşil kromofora aktaran. kuantum verimi Eos'un yeşil yayan formunun% 0.7'si.[2] Kırmızıya kaymış türlerde, sırasıyla uyarma spektrumunda ve emisyon spektrumunda 533 nm ve 629 nm'de ana pikten ayrı belirgin vibronik yan bantlar vardır. Kırmızı eksitasyon spektrumunda, muhtemelen kırmızı floroforun FRET uyarımına bağlı olarak 502 nm'de başka bir tepe vardır.[1] Kırmızı yayan formun kuantum verimi 0,55'tir.[2]
EosFP varyantları, spektroskopik özelliklerde hemen hemen hiç fark göstermez, bu nedenle, ara yüzlerin ayrılmasından kaynaklanan yapısal modifikasyonların, florofor bağlama sahasının yapısı üzerinde çok az etkisi olması veya hiç etkisi olmaması muhtemeldir.[4]
Başvurular
Füzyon Proteinlerinin Takibi
EosFP ve onun tasarlanmış varyantları kullanılarak birçok farklı füzyon proteini oluşturulmuştur. Bu füzyon proteinleri, protein-protein etkileşimleri ve protein-DNA etkileşimleri gibi karmaşık biyolojik işlevleri korurken, canlı hücrelerdeki proteinlerin izlenmesine izin verir. Eos füzyon yapıları aşağıdakileri içerir: rekombinasyon sinyal bağlayıcı protein (RBP) ve sitokeratin.[2] Çalışmalar, ilgilenilen proteinin, söz konusu proteine bağlanmasının uygun olduğunu göstermiştir. N terminali EosFP etiketinin yanında.[3] Bu füzyon yapıları, nükleer translokasyonu görselleştirmek için kullanılmıştır. androjen reseptörleri dinamikleri hücre iskeleti ile aktin ve vinculin ve RBP ile intranükleer protein hareketi.[3]
Çok Renkli Etiketleme
EosFP, ilgilenilen proteinin işlevselliğini korurken füzyon yapılarında kullanılabildiğinden, çok renkli etiketleme çalışmaları için popüler bir seçimdir.[3] Çift renkli bir etiketleme deneyinde, mitoz, HEK293 hücreler ilk önce tübülin bağlayıcı protein ile stabil bir şekilde transfekte edildi cDNA kaynaşmış EGFP görselleştirmek için iğ aparatı. Daha sonra, mitozun başlangıcını görselleştirmek için d2EosFP'ye birleştirilmiş rekombinasyon sinyal bağlayıcı proteinin (RBP) geçici transfeksiyonu kullanıldı. Foto dönüştürme, floresan mikroskopi ile tamamlandı ve iki set arasındaki ayrımı vurguladı. kromozomlar sırasında anafaz, telofaz ve sitokinez.[4]
Gelişim Biyolojisinde Hücre Hareketinin Takibi
EosFP, embriyonik gelişim sırasında hücre hareketlerini izlemek için kullanılmıştır. Xenopus laevis. İki hücreli / erken gastrulasyon aşamasında, dimerik bir EosFP (d2EosFP) için kodlanmış başlıklı mRNA, hücrelere enjekte edildi ve floresan mikroskopisi kullanılarak lokal olarak foto dönüştürüldü.[3] Bu floresan embriyolar, nörülasyon sırasında hücre hareketinin dinamiklerini gösterdi. EosFP, notochord EosFP'nin kullanım olasılığını gösteren kader haritası deneyler.[4]
Tasarlanmış varyantlar
mEos4
EosFP'nin vahşi tip EosFP'ye göre avantajlar sunan birçok yeni monomerik versiyonu geliştirilmiştir. Howard Hughes Tıp Enstitüsü'ndeki Janelia Çiftlik Araştırma Kampüsünde bir ekip tarafından geliştirilen mEos4, EosFP'den daha yüksek fotostabilite ve daha uzun görüntüleme yeteneklerine sahiptir. Ayrıca PFA gibi kimyasal fiksatiflere karşı oldukça dayanıklıdır, gluteraldehit ve OsO4 örnekleri korumak için kullanılır. mEos4, EosFP'den daha yüksek sıcaklıklarda etkilidir, daha yüksek oranda fot dönüştürür ve hem yeşil hem de kırmızı floresan durumlarında daha yüksek bir emisyon genliğine sahiptir. MEos4 proteini uygulamaları arasında fotoaktivasyon lokalizasyon mikroskobu (PALM), korelatif ışık / elektron mikroskobu (CLEM), protein aktivitesi göstergesi ve aktivite entegrasyonu (zaman içinde protein aktivitesi için post-hoc görüntüleme) bulunur.[10]
mEos2
mEosFP, 37 santigrat derecede etkili bir şekilde katlanan başka bir monomerik Eos çeşididir. TdEos'un (tandem dimer) aşağıdaki gibi hedeflere kaynaşamadığı durumlarda: histonlar, tubulin, ara filamentler ve boşluk kavşakları ve yalnızca 30 santigrat derecede başarıyla kullanılabilen mEos (monomerik) olan mEos2, 37 santigrat derecede etkili bir şekilde katlanabilen ve diğer floresan protein dimerlerinden füzyona tolerans göstermeyen hedefleri başarılı bir şekilde etiketleyebilen tasarlanmış bir varyanttır. mEos2, WT Eos ile neredeyse aynı spektral özellikler, parlaklık, pKa, foto dönüştürme, kontrast ve olgunlaşma özelliklerini gösterir. MEos2'nin lokalizasyon hassasiyeti, diğer monomerik floresan proteinlerden iki kat daha fazladır.[10]
Campari
Ayrıca Janelia Araştırma Kampüsünde, EosFP kullanılarak CaMPARI (kalsiyumla modüle edilmiş ışıkla aktifleştirilebilir oran ölçüm entegratörü) olarak bilinen yeni bir floresan molekülü geliştirildi.[11] Kalıcı yeşilden kırmızıya dönüşüm sinyali, kalsiyuma duyarlı bir protein ile birleştirildi, kalmodulin, böylece füzyon yapısındaki renk değişikliği, kalsiyumun salınımına bağlıydı. sinirsel aktivite. CaMPARI kalıcı olarak işaretleyebilir nöronlar herhangi bir zamanda aktif olan ve aynı zamanda hedeflenebilir sinapslar.[12] Bu görselleştirme, mikroskop kullanılarak elde edilebilen sınırlı görüntünün aksine, çok sayıda beyin dokusunda mümkündür. Ayrıca, incelenen organizmanın mikroskop altında değil serbestçe hareket etmesine izin verildiğinden, karmaşık davranışlar sırasında sinirsel aktivitenin görselleştirilmesine de izin verir. Ayrıca, belirli davranış dönemlerinde nöronların gözlemlenmesine izin verir. CaMPARI, şimdiye kadar, aktif sinir devrelerini etiketlemek için kullanılmıştır. fareler, zebra balığı ve meyve sinekleri.[13]
Referanslar
- ^ a b c Ivanchenko, Sergey; Röcker, Carlheinz; Oswald, Franz; Wiedenmann, Jörg; Nienhaus, G. Ulrich (2005). "Bir Floresan İşaretleyici Protein olan EosFP'nin Hedeflenmiş Yeşil-Kırmızı Foto Dönüşümü". Biyolojik Fizik Dergisi. 31 (3–4): 249–259. doi:10.1007 / s10867-005-0174-z. ISSN 0092-0606. PMC 3456337. PMID 23345897.
- ^ a b c d e f g h ben j k Wiedenmann, Jörg; Ivanchenko, Sergey; Oswald, Franz; Schmitt, Florian; Röcker, Carlheinz; Salih, Anya; Spindler, Klaus-Dieter; Nienhaus, G. Ulrich (2004-11-09). "EosFP, UV ile indüklenebilir yeşilden kırmızıya floresan dönüşümüne sahip bir floresan işaretleyici protein". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 101 (45): 15905–15910. Bibcode:2004PNAS..10115905W. doi:10.1073 / pnas.0403668101. ISSN 0027-8424. PMC 528746. PMID 15505211.
- ^ a b c d e Wiedenmann, Jörg; Nienhaus, G Ulrich (2006). "EosFP ile canlı hücre görüntüleme ve GFP ailesinin diğer foto-aktifleştirilebilir işaret proteinleri". Proteomiklerin Uzman Değerlendirmesi. 3 (3): 361–374. doi:10.1586/14789450.3.3.361. PMID 16771707.
- ^ a b c d Nienhaus, G. Ulrich; Nienhaus, Karin; Hölzle, Angela; Ivanchenko, Sergey; Renzi, Fabiana; Oswald, Franz; Wolff, Michael; Schmitt, Florian; Röcker, Carlheinz (2006). "Işıkla dönüştürülebilir Floresan Protein EosFP: Biyofiziksel Özellikler ve Hücre Biyolojisi Uygulamaları". Fotokimya ve Fotobiyoloji. 82 (2): 351–8. doi:10.1562 / 2005-05-19-ra-533. PMID 16613485.
- ^ a b c d e Mizuno, Hideaki; Mal, Tapas Kumar; Tong, Kit I .; Ando, Ryoko; Furuta, Toshiaki; Ikura, Mitsuhiko; Miyawaki, Atsushi (2003-10-01). "Bir Floresan Proteinin Yeşilden Kırmızıya Dönüşümünde Işıkla İndüklenen Peptit Bölünmesi". Moleküler Hücre. 12 (4): 1051–1058. doi:10.1016 / S1097-2765 (03) 00393-9. PMID 14580354.
- ^ a b Mathur, Jaideep; Radhamony, Resmi; Sinclair, Alison M .; Donoso, Ana; Dunn, Natalie; Roach, Elyse; Radford, Devon; Mohaghegh, P. S. Mohammad; Logan, David C. (2010-12-01). "Bitkiler için mEosFP Tabanlı Yeşilden Kırmızıya Foto Dönüştürülebilir Alt Hücresel Problar". Bitki Fizyolojisi. 154 (4): 1573–1587. doi:10.1104 / s. 110.165431. ISSN 0032-0889. PMC 2996014. PMID 20940350.
- ^ a b c d e Nienhaus, Karin; Nienhaus, G. Ulrich; Wiedenmann, Jörg; Nar Herbert (2005-06-28). "Işıkla uyarılan protein bölünmesi ve floresan protein EosFP'nin yeşilden kırmızıya dönüşümü için yapısal temel". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 102 (26): 9156–9159. Bibcode:2005PNAS..102.9156N. doi:10.1073 / pnas.0501874102. ISSN 0027-8424. PMC 1166600. PMID 15964985.
- ^ a b Ando, Ryoko; Hama, Hiroshi; Yamamoto-Hino, Miki; Mizuno, Hideaki; Miyawaki, Atsushi (2002-10-01). "Bir floresan proteinin UV ile indüklenen yeşilden kırmızıya foto dönüşümüne dayalı bir optik işaretleyici". Ulusal Bilimler Akademisi Bildiriler Kitabı. 99 (20): 12651–12656. Bibcode:2002PNAS ... 9912651A. doi:10.1073 / pnas.202320599. ISSN 0027-8424. PMC 130515. PMID 12271129.
- ^ Lukyanov; et al. (2005). "Işıkla etkinleştirilebilir floresan proteinler". Doğa İncelemeleri Moleküler Hücre Biyolojisi. 6 (11): 885–91. doi:10.1038 / nrm1741. PMID 16167053.
- ^ a b "mEos2 ve mEos4 | Janelia Araştırma Kampüsü". www.janelia.org. Alındı 2017-11-28.
- ^ Fosque, B. F .; Sun, Y .; Dana, H .; Yang, C.-T .; Ohyama, T .; Tadross, M.R .; Patel, R .; Zlatic, M.; Kim, D. S .; Ahrens, M. B .; Jayaraman, V. (2015/02/13). "Tasarlanmış kalsiyum entegratörleri ile in vivo olarak aktif sinir devrelerinin etiketlenmesi". Bilim. 347 (6223): 755–760. doi:10.1126 / science.1260922. ISSN 0036-8075.
- ^ Perez-Alvarez, Alberto; Fearey, Brenna C .; O’Toole, Ryan J .; Yang, Wei; Arganda-Carreras, Ignacio; Lamothe-Molina, Paul J .; Moeyaert, Benjamien; Mohr, Manuel A .; Panzera, Lauren C .; Schulze, Christian; Schreiter, Eric R. (2020). "SynTagMA kullanarak sinaptik aktivitenin dondurulmuş çerçeve görüntüleme". Doğa İletişimi. 11 (1): 2464. doi:10.1038 / s41467-020-16315-4. ISSN 2041-1723.
- ^ "Yeni Floresan Protein Ateş Eden Nöronları Kalıcı Olarak İşaretler". HHMI.org. Alındı 2017-12-01.
