Hemoglobin Hopkins-2 - Hemoglobin Hopkins-2
Hemoglobin Hopkins-2 (Hb Hop-2) proteinin bir mutasyonudur hemoglobin Omurgalılarda kan yoluyla akciğerlerden vücudun kaslarına oksijen taşınmasından sorumludur. Hemoglobin Hopkins-2'deki spesifik mutasyon, iki anormal a zinciriyle sonuçlanır (insan hemoglobini, genellikle zincir olarak adlandırılan 2 α ve 2 β polipeptitlerden oluşur).[1] Mutasyon sonucu histidin 112 ile değiştiriliyor aspartik asit proteinin polipeptit dizisinde.[1] Ek olarak, mutasyona uğramış alfa zincirlerinden birinde, amino asit zincirinde iki nokta olan 114 ve 118'de ikame maddeleri vardır.[2] Bu mutasyon neden olabilir Orak hücre anemisi.[3]
Hemoglobinin ilk keşfinin ardından, iki araştırmacı Johns Hopkins Hastanesi yirminci yüzyılın ortalarında Ernest W. Smith ve J.V. Torbert, Hopkins-2 hemoglobinin mutasyonunu keşfetti.[4] Tarafından çalışmak Harvey A. Itano ve Elizabeth A. Robinson 1960 yılında, Smith'in ve Torbert'in bulgusunu doğruladı ve mutasyonda alfa lokuslarının önemini vurguladı.[5] Yirminci yüzyılın sonlarında, Hopkins'e bağlı bir başka bilim adamı ve doktor olan Samuel Charache, varyantın sağlık üzerindeki fizyolojik etkilerini inceledi.[6] Bulguları, varyantın klinik olarak hiçbir etkisi olmadığını göstermektedir.[7]
Tarih
1900'lerin ortalarında, birçok faktör hemoglobin araştırmalarına yol açtı. Baltimore, Maryland ve nihayetinde Hemoglobin Hopkins-2'nin keşfine yol açtı. İlk olarak, dahil olmak üzere yeni teknolojinin geliştirilmesi X-ışını kristalografisi ve moleküler biyoloji çalışmalarında kullanılabilen protein kimyası araştırmaları katalize etti.[8] Dahası, büyük varlığı talasemi (Hb H), Güneydoğu Asya ve Güney Çin'de, alfa geninin işlevsiz olduğu bir bozukluk olan (Hb H), araştırmacıları, eğer tedavi edilmezse, mutasyon kemik deformitelerine neden olabileceği için endişelendirdi. dalağın şişmesi, yavaşlayan büyüme oranı veya kardiyak disfonksiyon.[9][10] Bunlara ek olarak, Max Perutz 's, bir Cambridge araştırmacısı, hemoglobin temelinin keşfi üçüncül yapı 1962'de hematolojide katalize edilmiş araştırmalar.[11] Vernon Ingram'ın çevreleyen araştırma Orak hücre anemisi 1956'da hemoglobin RNA'sındaki varyantların veya mutasyonların Orak hücre hastalığı.[8][3]

Ernest W. Smith ve J.V. Norbert, Ingram'ın keşfini incelediler ve 1958'de hemoglobin Hopkins-2 mutasyonunu keşfettiler. Smith ve Torbert, Lockard Conley'de çalışan araştırma görevlileri Hematoloji Johns Hopkins Üniversitesi Araştırma Bölümü, rekombinasyonun alelik olmayan genler hemoglobin üreten genin iki varyantıyla sonuçlandı. "Normal" hemoglobin geninin varyantları, üretilen hemoglobinlerde mutasyona neden olur.[4] Başka bir deyişle, araştırmacılar iki versiyonunu keşfetti hemoglobin: [Hb-Hop2] ve S çeşitleri.[8]
Smith'in ve Torbert'in bulguları doğrulandı ve üzerine inşa edildi Harvey A. Itano ve Elizabeth A. Robinson, 1960'ta. Makalelerinde, Hemoglobinin a ve B Zincirlerinin Genetik Kontrolü, Itano ve Robinson hem alfa hem de beta sürümünün lokus hemoglobinin düzenlenmesinde rol oynar. Hemoglobini kodlayan gen üzerindeki alfa lokuslarının rekombinasyonu, hemoglobin proteininin mutasyonuna neden olur. Araştırmacılar, bu mutasyona uğramış proteini hemoglobinin Hopkins-2 varyasyonu olarak adlandırıyor.[5]
Hopkins-2 genetik mutasyonunu çevreleyen daha fazla araştırma, tıp camiasında hematolojiden farklı bir odak noktasında genel bir değişikliğe rağmen hematolojik alanda araştırma yapmaya devam eden Johns Hopkins doktorları tarafından gerçekleştirildi. Tanınmış Hopkins araştırmacısı Samuel Charache, Hopkins'te araştırma yapan birçok bilim adamından biriydi. kan ve yirminci yüzyılın sonlarında bileşenleri.[8] Charache özellikle Hopkins araştırmacısı George Dover ile yaptığı çalışmalarla tanınır; birlikte, bir tedavi seçeneği keşfettiler Orak hücre anemisi. Bununla birlikte, Charache ayrıca hemoglobin Hopkins-2 araştırmasıyla da uğraştı. Onun içinde Doğa makale, başlıklı Hopkins Hemoglobin-2'nin Klinik Çalışmaları ve Fizyolojik Özellikleri, Charache, hemoglobin varyantını çevreleyen keşiflerini duyurdu. Charache, genetiğin kendisinden ziyade varyantın fiziksel etkilerine odaklandı. Son olarak Charache, makalesinde varyantın belirgin olmadığını iddia ediyor fenotipik olarak ve insan sağlığı üzerinde fark edilemeyen veya hiç etkisi yoktur.
Hopkins'de hemoglobin ve hematoloji

Hemoglobin Hopkins-2 varyantının keşfedilmesinden önce Johns Hopkins Hastanesi'nde hematolojik çalışmalar öne çıktı. Bir altındaki hücreleri gözlemledikten sonra mikroskop, Sir William Osler, işlevsiz trombosit kavramını ülseratif endokardit gelişimine bağladı ve tromboz. Osler'in trombositlerle ilgili ilk gözlemleri, Hopkins'te ve diğer araştırma ortamlarında kan ve hematoloji çalışmalarını katalize etti.[12] Trombositler, 1865'te Max Schultze tarafından bağımsız olarak keşfedildi[13] ve G. Bizzozero, 1882.[14]
1920'den başlayarak, Johns Hopkins Hastanesi'ndeki doktorlar, Orak hücre anemisi veya orak hücre hastalığı. Hastalığı çevreleyen sonuçları güncelliğini yitirmiş olsa da, Doktorlar Taliaferro ve Huck bir gizli orak hücreli anemi formu. Orak hücre anemisi üzerine yaptıkları çalışma, Hopkins'te yapılan ilk araştırmaydı. 1940 yılında, Johns Hopkins'de tıp öğrencisi olan Irving Sherman, oksijensizleştirme orak hücre hastalarında hemoglobin oranı refraksiyon protein içinden ışık geçirildiğinde oksijensizleşmenin karakteristik özellikleri.[15] Orak hücre hastalarında hemoglobinin deoksijenasyonunun, mutasyonu taşıyanlar üzerinde ciddi etkileri vardır. Orak hücre hastalığı olanlarda bulunan hemoglobin proteinleri, insan vücudundaki organlara ve diğer dokulara oksijen taşıyamaz. Bu sonuçlanır ağrı krizleri ve hastalık kısaltılmış olarak sonuçlanır yaşam beklentisi 40–60 yıl.[16]
Ernest W. Smith ve Torbert, diğer birçok hematolojik mutasyon ve koşullara ek olarak, Hopkins Hemoglobin-2'nin keşfinin ayrılmaz bir parçasıydı.[4] İki bilim adamı, 1958'de Hemoglobinin N-Baltimore mutasyonunu tanımlamak için Hopkins'te birlikte çalıştı.[17] Hopkins-I, Jenkins, N-Memphis veya Kenwood mutasyonu olarak da anılan N-Baltimore mutasyonu, bir nokta mutasyonudur. glisin kodon, bir adenozin kodon. N-Baltimore mutasyonu, hemoglobinin C ve S mutasyonları ile ilişkilidir.[18]
Smith, Hopkins Hemoglobin-2 varyant keşfi sırasında Smith'in patronlarından biri olan Locklard Conley ile birlikte kapsamlı bir araştırma yaptı. Genellikle "Kilit" olarak anılan Lockard Conley, Johns Hopkins lisans ve Columbia eğitimli doktor. 1947'de Conley, Hopkins'teki Hematoloji Bölümünün ilk yöneticisi oldu ve 33 yıl bu pozisyonda kaldı. Oradayken kanla ilgili hastalıkları inceledi. kan pıhtılaşması ve Orak hücre anemisi ve moleküler türleri analiz etmek için makineler icat etti.[19] Spesifik olarak, o ve Smith hemoglobin varyantlarının standart hemoglobin moleküllerinden ayrılmasına izin veren bir cihaz yarattılar. Conley'in hematoloji üzerindeki etkisi, bu nedenle, yalnızca bilimsel keşif değildi; aynı zamanda hematolojik alanın genişlemesine izin veren teknolojik keşif.[20] Conley bir doktor ve profesör olarak kaldı Johns Hopkins Hastanesi 2010'daki ölümüne kadar.[19]
1950'ler ve 1960'larda önemli miktarda hematolojik araştırma tamamlanmış olmasına rağmen, bilim adamları daha ileri teknoloji geliştirilmeden daha fazla araştırmanın tamamlanıp tamamlanamayacağını sorguladılar. Nihayetinde, bu şüphe, yirminci yüzyılın ortalarında hematoloji alanında araştırma yapan bilim insanlarının daha azıyla sonuçlandı.[8] Araştırmacıların azlığına rağmen, genetik ve hemoglobin ile ilgili yeni keşifler yapıldı. Bununla birlikte, Hopkins gibi büyük tıbbi laboratuvarlarda araştırmalar devam etti.[21]
Yirminci yüzyılın ortalarında ve sonlarında, hem doktorlar George J. Dover hem de Samuel Charache, Johns Hopkins Hastanesi'nde orak hücre anemisinin patolojisini inceledi.[7] Birlikte kanser ilacı kullanarak hastalığın tedavisini uyguladılar, hidroksiüre; ilaç, ilişkili ağrılı atakları hafifletmede başarılı oldu Orak hücre anemisi, ek olarak akciğer hastalıkla ilişkili semptomlar. Dover, pediatrik hematolog ve uzman fetal hemoglobin, erişkinlerde orak hücre anemisini tedavi etmenin bir yolu olarak proteinin kullanımını başlattı.
Tıbbi çıkarımlar
Hemoglobinin Hopkins-2 varyantı vücutta bir oksijen afinitesine sahiptir, bu da Ho-2'nin daha yüksek miktarda oksijen taşıması nedeniyle vücuda yayılan oksijende bir artış olduğu anlamına gelir.[22] Ho-2 ile karşılaştırıldığında kırmızı hücre etkisi yoktur. Hemoglobin S, hücrenin şeklini oraklaşacak şekilde değiştirir. Hopkins-2 varyantı hemoglobinin oluşmasına dahil değildir orak hücreler. Orak hücre açısından Ho-2'nin fenotipik ekspresyonu eksikliği vardır, bu nedenle orak hücre ve hemoglobin Hopkins-2'ye sahip bir kişi asemptomatik olacaktır.
Genetik temel
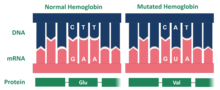
Hopkins 2 varyantı hemoglobin bir mutasyonun sonucudur. Spesifik olarak, mutasyona uğramış protein iki alfa zincirinden oluşur. Hemoglobinin Hopkins-2 varyantı için mutasyon, molekülün yüzeyinde bulunur. Ho-2 varyantı içinde, aspartik asit yerine geçer histidin alfa zincirinde 112 konumunda.[2] Dr. Max Perutz alfa 112'deki aspartik asidi incelemiş, amino asidin karboksil grubunun fenoliks hidroksil ile bir hidrojen bağı oluşturduğunu, bu da molekülün yapısını stabilize ettiğini ve oksijen afinitesini arttırdığını iddia etmiştir. Ho-2 hemoglobin, kırmızı kan hücrelerindeki oksijen eksikliğinin yerini alan yüksek oksijen seviyelerine sahiptir. Ho-2 benzerdir Hemoglobin A normal hemoglobin olan ve ayrıca iki α-zinciri içeren. Bu, hemoglobinin Hopkins-2 varyantının aşağıdaki semptomlarla nasıl ilişkili olduğuna dair bir açıklama sağlar. Orak hücre.
Hopkins-2 ayrıca özellikle Hemoglobin S ile etkileşime girebilir. Hemoglobin S en yaygın anormal hemoglobin varyantıdır. Hemoglobin S, Orak hücre kırmızı kan hücrelerinin parçalanıp anormal şekilde şekillendiği bir bozukluktur. Hemoglobin S'nin iki beta zinciri varken, hemoglobin Hopkins-2'nin iki alfa zinciri vardır. Hopkins-2, tek heterozigotlarda hemolizatların% 22'sini oluşturur; bu nedenle, bu hastalarda genin normal versiyonu vardır. Hemolizatlar, kırmızı kan hücrelerinin yok edilmesinin ürünleridir. Ho-2 ayrıca, gen hem Hopkins-2 hem de Hemoglobin S içerdiğinde, "çift" heterozigotlarda hemolizatların% 11'ini içerir.[23]
Hemoglobin varyantı Hopkins-2'nin nasıl çalıştığına dair şu anda birçok olası açıklama var. Bilim adamlarının ortaya çıkardığı bir açıklama, Ho-2'nin histidinin aspartik asit ile ikame edilmesine neden olan bir nokta mutasyonu nedeniyle oluştuğudur.[23] Diğer açıklama, histidinin aspartik asit ile yer değiştirmesini açıklayan iki α geni arasında eşit olmayan bir geçiş olduğudur.[23] Bu daha sonra kromozom yuvası Ho-2'de meydana gelen bir silinmeye yol açtı. Bu delesyon, N-terminalinin ana a-zincirinde bulunduğu ve c-terminalinin küçük a-zincirinde bulunduğu bölgeyi kaldırır.[23] N-ucunun silinmesi enzimleri etkisiz hale getirir ve belirli alanlarda zincirleri kesme kabiliyetlerini durdurur, bu da kaçınılmaz olarak zincire zarar verir.
Durum çalışmaları
Samuel Charache ve diğerleri tarafından Hemoglobin Hopkins-2 genetik mutasyonunu taşıyan bazı hastalar üzerinde vaka çalışmaları tamamlandı. Araştırmacılar, çalışmaları tamamladıktan sonra, mutasyonun birçok taşıyıcısının orak hücreye asemptomatik olduğu ve genel olarak oldukça sağlıklı olduğu sonucuna vardılar. Ortaya çıkan herhangi bir tıbbi sorunun orak hücre ile hiçbir ilişkisi yoktu. Bu çalışmalar 1970'lerde gerçekleşti.[8]
Fuller-Carr ailesi
Fuller-Carr ailesinde beş Hemoglobin Hopkins 2 taşıyıcısı ve Ho-2 ve Hemoglobin S'nin on çift heterozigotu vardı.[24] Tüm taşıyıcıların sağlığı iyiydi ve hematoloji test sonuçları normaldi. Taşıyanların dışında hemoglobin S ve Ho-2, hiçbiri anemik; ancak, üzerinde çalışılanlardan birkaçı yüksek retikülosit sayıları gösterdi.[24] Bu, kemik iliği tarafından kırmızı kan hücrelerinin üretim hızını ve kana salımını analiz eden bir kan testi ile ölçülür. Ailede semptomatik orak hücre anemisine dair herhangi bir öneri yoktu.
Bilinmeyen çocuk
Hopkins-2'nin hemoglobin varyantının taşıyıcısı olan üç yaşında bir çocuk üzerinde bir çalışma vardı. Çocukta genellikle anemide görülen hafif anemi ve retikülositoz vardı.[25] Bununla birlikte, kanda hiçbir orak hücre bulunmadı ve orak hücre ile ilgili hiçbir semptomları yoktu. Ayrıca, ortalama hacim olan azaltılmış bir ortalama korpüsküler hacim (MCV) vardı. kırmızı kan hücresi Miktar.[25]
Referanslar
- ^ a b Clegg JB, Charache S (1978). "Hemoglobin Hopkins-2'nin yapısı". Hemoglobin. 2 (1): 85–8. doi:10.3109/03630267808999194. PMID 646867.
- ^ a b Rucknagel DL, Winter WP (Kasım 1974). "İnsanda hemoglobin alfa ve beta zincirleri için yapısal genlerin kopyalanması". New York Bilimler Akademisi Yıllıkları. 241: 80–92. Bibcode:1974 NYASA.241 ... 80R. doi:10.1111 / j.1749-6632.1974.tb21868.x. PMID 4611311.
- ^ a b Bloom M (1995). Orak Hücre Hastalığını Anlamak. Amerika Birleşik Devletleri: Mississippi Üniversite Yayınları. pp.3–6. ISBN 978-0878057450.
- ^ a b c Hill RL, Swenson RT, Schwartz HC (Kasım 1960). "Hemoglobin G'de kimyasal bir anormalliğin karakterizasyonu". Biyolojik Kimya Dergisi. 235: 3182–7. PMID 13714317.
- ^ a b Itano HA, Robinson EA (Kasım 1960). "HEMOGLOBİNİN alfa ve beta ZİNCİRLERİNİN GENETİK KONTROLÜ". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 46 (11): 1492–501. Bibcode:1960PNAS ... 46.1492I. doi:10.1073 / pnas.46.11.1492. PMC 223072. PMID 16590776.
- ^ DK öner (31 Ocak 1995). Hopkins Orak Hücre Tedavisi Buldu. Baltimore Güneşi. Alındı 8 Mart, 2017.
- ^ a b Charache S, Ostertag W, von Ehrenstein G (Aralık 1971). "Hopkins-2 hemoglobinin klinik çalışmaları ve fizyolojik özellikleri". Doğa. 234 (51): 248–51. doi:10.1038 / newbio234248a0. PMID 5288820.
- ^ a b c d e f Weatherall, D.J. (2001). "Moleküler tıbba doğru; hemoglobin alanının anıları, 1960-2000". İngiliz Hematoloji Dergisi. 115 (4): 729–738. doi:10.1046 / j.1365-2141.2001.03227.x. PMID 11843803.
- ^ "Talasemi nedir?". UCSF Benioff Çocuk Hastanesi. Alındı 8 Mart, 2017.
- ^ "Belirtiler ve nedenler - Mayo Clinic". Mayo Kliniği. Alındı 2017-04-15.
- ^ Steensma DP, Shampo MA, Kyle RA (Ağustos 2015). "Max Perutz ve Hemoglobinin Yapısı". Mayo Clinic Proceedings. 90 (8): e89. doi:10.1016 / j.mayocp.2015.04.026. PMID 26250737.
- ^ Stone MJ (Ekim 2003). "William Osler'in mirası ve hematolojiye katkısı". İngiliz Hematoloji Dergisi. 123 (1): 3–18. doi:10.1046 / j.1365-2141.2003.04615.x. PMID 14510937.
- ^ Brewer DB (Mayıs 2006). "Max Schultze (1865), G. Bizzozero (1882) ve trombositin keşfi". İngiliz Hematoloji Dergisi. 133 (3): 251–8. doi:10.1111 / j.1365-2141.2006.06036.x. PMID 16643426.
- ^ Ribatti D, Crivellato E (Ekim 2007). "Giulio Bizzozero ve trombositlerin keşfi". Lösemi Araştırması. 31 (10): 1339–41. doi:10.1016 / j.leukres.2007.02.008. PMID 17383722.
- ^ "Keşif ve Biyolojik Temel". www.nslc.wustl.edu. Alındı 2017-04-15.
- ^ "Orak Hücre Hastalığı Nedir? - NHLBI, NIH". www.nhlbi.nih.gov. Alındı 2017-04-20.
- ^ Lorenzo-Medina M, De-La-Iglesia S, Ropero P, Nogueira-Salgueiro P, Santana-Benitez J (Kasım 2014). "Hemoglobin varyantlarının, yüksek performanslı bir sıvı kromatografi yöntemi kullanılarak ölçülen hemoglobin a1c değerleri üzerindeki etkileri". Diyabet Bilim ve Teknoloji Dergisi. 8 (6): 1168–76. doi:10.1177/1932296814538774. PMC 4455477. PMID 25355712.
- ^ "N-Baltimore.html". globin.bx.psu.edu. Alındı 2017-03-30.
- ^ a b "Tıbbi Arşivler - Kişisel Kağıt Koleksiyonları: C. Lockard Conley Koleksiyonu". www.medicalarchives.jhmi.edu. Alındı 2017-03-30.
- ^ "C. Lockard Lock Conley, MD (1915-2010)". www.hematology.org. 2010-04-27. Alındı 2017-03-30.
- ^ McCann S (2016). Bir Hematoloji Tarihi: Herodot'tan HIV'e. Oxford University Press. ISBN 978-0-19-102713-0.[sayfa gerekli ]
- ^ Huisman, Titus H. J, Marianne F. H. Carver ve Georgi Efremov. İnsan Hemoglobin Varyantlarının Müfredatı (1996). Augusta, GA, ABD: Orak Hücreli Anemi Vakfı, 1996. Baskı.[sayfa gerekli ]
- ^ a b c d Ostertag W, von Ehrenstein G, Charache S (Mayıs 1972). "İnsanın Hopkins-2 hemoglobininde kopyalanmış alfa zinciri genleri ve aralarında eşitsiz geçişin kanıtı". Doğa. 237 (72): 90–4. doi:10.1038 / newbio237090a0. PMID 4503919.
- ^ a b Charache S, Ostertag W, von Ehrenstein G (Mayıs 1972). "Hopkins-2 hemoglobinin klinik çalışmaları ve fizyolojik özellikleri". Doğa. 237 (72): 88–90. doi:10.1038 / newbio237088a0. PMID 4503918.
- ^ a b Steinberg, Martin H., vd. Hemoglobin bozuklukları: genetik, patofizyoloji ve klinik tedavi. Cambridge University Press, 2009.[sayfa gerekli ]
