Bulaşıcı bursal hastalık - Infectious bursal disease
Bu makale için ek alıntılara ihtiyaç var doğrulama. (Mayıs 2020) (Bu şablon mesajını nasıl ve ne zaman kaldıracağınızı öğrenin) |
| Bulaşıcı bursal hastalık virüsü | |
|---|---|
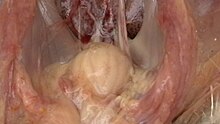 | |
| Büyütülmüş Fabricius bursa sarımsı peribursal ödemli | |
| Virüs sınıflandırması | |
| (rütbesiz): | Virüs |
| Diyar: | Riboviria |
| Krallık: | Orthornavirae |
| Şube: | incertae sedis |
| Aile: | Birnaviridae |
| Cins: | Avibirnavirüs |
| Türler: | Bulaşıcı bursal hastalık virüsü |
Bulaşıcı bursal hastalık (IBD), Ayrıca şöyle bilinir Gumboro hastalığı, bulaşıcı bursit ve bulaşıcı kuş nefrozugençlerin oldukça bulaşıcı bir hastalığıdır tavuklar ve enfeksiyöz bursal hastalık virüsünün (IBDV) neden olduğu hindiler,[1] ile karakterize edilen immünosupresyon ve ölüm oranı genellikle 3 ila 6 haftalıkken. Hastalık ilk olarak Gumboro, Delaware Diğer hastalıklara karşı artan duyarlılık ve etkili hastalıklara olumsuz müdahale nedeniyle dünya çapında kanatlı endüstrisi için ekonomik olarak önemlidir. aşılama. Son yıllarda, tavuklarda ciddi ölümlere neden olan çok öldürücü IBDV (vvIBDV) suşları Avrupa'da ortaya çıkmıştır. Latin Amerika, Güneydoğu Asya, Afrika ve Orta Doğu. Enfeksiyon, oro-fekal yolla yapılır ve etkilenen kuş, enfeksiyondan sonra yaklaşık 2 hafta boyunca yüksek düzeyde virüs salgılar. Hastalık, enfekte tavuklardan sağlıklı tavuklara yiyecek, su ve fiziksel temas yoluyla kolayca yayılır.[2]
Viroloji
IBDV bir çift sarmallı RNA virüsü iki segmentli olan genetik şifre ve cinse aittir Avibirnavirüs ailenin Birnaviridae. Virüsün iki farklı serotipi vardır, ancak yalnızca serotip 1 virüsleri kümes hayvanlarında hastalığa neden olur.[3] En az altı antijenik IBDV serotip 1'in alt tipleri şu şekilde tanımlanmıştır: laboratuvar ortamında çapraz nötrleştirme deneyi. Bu antijenik alt tiplerden birine ait virüsler, yaygın olarak varyantlar olarak bilinirler ve ticari sürülerde yüksek düzeyde maternal antikorları kırarak tavuklarda yüzde 60 ila 100'e varan ölüm oranlarına neden olduğu bildirilmiştir. Son derece hassas moleküler tekniklerin ortaya çıkmasıyla, örneğin ters transkripsiyon polimeraz zincir reaksiyonu (RT-PCR) ve kısıtlama parçası uzunluk polimorfizmi (RFLP) ile vvIBDV'yi tespit etmek, IBDV suşlarını ayırt etmek ve bu bilgileri virüsün moleküler epidemiyolojisini incelerken kullanmak mümkün hale geldi.
IBDV genomu, A ve B olmak üzere iki bölümden oluşur ve bunlar, zarfsız bir ikosahedral kapsid.[4] Genom segmenti B (2.9 kb ) varsayılan viral olan VP1'i kodlar RNA polimeraz. Daha büyük A segmenti (3.2 kb) viral proteinler VP2, VP3, VP4 ve VP5'i kodlar. Bunlar arasında, VP2 proteini önemli nötralize edici antijenik bölgeler içerir ve koruyucu immün tepkisi ortaya çıkarır ve çoğu amino asit Antijenik olarak farklı IBDV'ler arasındaki (AA) değişiklikler, VP2'nin hiperdeğişken bölgesinde kümelenmiştir. Bu nedenle, VP2'nin bu hiperdeğişken bölgesi, IBDV saptama ve suş varyasyon çalışmaları için uygulanan moleküler teknikler için açık hedeftir.
Patogenez
Klinik hastalık, 3 ila 6 haftalıkken ortaya çıkan en büyük bursal kitleye sahip kuş yaşı ile ilişkilidir. En büyük bursal kitle, çoğunlukla enfeksiyonun ana hedefi olan olgunlaşan IgM taşıyan B lenfositlerinin (lenfoblastlar) büyük bir popülasyonunun bir sonucudur. Oldukça aktif olan yaklaşık iki ila sekiz haftalık genç kuşlar Fabricius bursa hastalığa daha yatkındır. Sekiz haftadan uzun kuşlar, zorluğa karşı dirençlidir ve yüksek derecede virülan suşlarla enfekte olmadıkça klinik belirtiler göstermeyecektir.
Subklinik hastalık, üç haftadan önce enfekte olan tavuklarda görülür. Bu yaşta B-lenfoblast popülasyonu daha küçüktür ve sistemik etkiler klinik belirtiler oluşturmak için yetersizdir. Bununla birlikte, virüs daha küçük bir popülasyonu ve tek bir yerde (bursa) çoğu hücreyi yok edeceğinden, B hücresi yıkımı genellikle subklinik olarak enfekte gençlerde şiddetlidir.
Yutulduktan sonra virüs, Fabricius bursasındaki lenfoid folikülleri ve GALT (bağırsakla ilişkili lenfoid doku), CALT (konjunktiva), BALT (Bronşiyal) çekal bademcikler gibi sekonder lenfoid dokularda dolaşan B hücrelerini yok eder, Harderian bezi, vb. Akut hastalık ve ölüm nekrotizan bu virüslerin konak dokular üzerindeki etkisi. Böbrek yetmezliği, yaygın bir ölüm nedenidir. Kuş hayatta kalır ve hastalığın bu evresinden kurtulursa, bağışıklığı bozulmuş olarak kalır, bu da diğer hastalıklara karşı daha duyarlı olduğu anlamına gelir.
Klinik işaretler


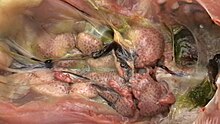

Hastalık aniden ortaya çıkabilir ve morbidite tipik olarak% 100'e ulaşır. Akut formda kuşlar secde edilir, zayıflatılır ve susuz kalır. Sulu bir ishal üretirler ve şişmiş dışkı lekeli hava deliğine sahip olabilirler. Sürünün çoğu yatıktır ve tüyleri fırfırlıdır. Ölüm oranları, ilgili suşun virülansına, yükleme dozuna, önceki bağışıklığa, eşzamanlı hastalığın varlığına ve aynı zamanda sürünün etkili bir bağışıklık tepkisi oluşturabilme yeteneğine göre değişir. Üç haftadan küçük olan çok genç tavukların immünosüpresyonu muhtemelen en önemli sonuçtur ve klinik olarak saptanamayabilir (subklinik). Ek olarak, daha az virülan suşlarla enfeksiyon açık klinik belirtiler göstermeyebilir, ancak fibrotik veya kistik foliküllerle bursal atrofisi olan ve altı haftadan önce lenfositopeni olan kuşlar, hastalığa duyarlı olabilir. fırsatçı enfeksiyon ve bağışıklığı yeterli kuşlarda genellikle hastalığa neden olmayacak ajanların neden olduğu enfeksiyondan ölebilir.
Hastalıkla enfekte olan tavuklar genellikle şu semptomlara sahiptir: diğer tavuklarda gagalama, yüksek ateş, tüyleri fırfır, titreme ve yavaş yürüme, başları yere doğru çökmüş yığınlar halinde yatar halde bulunurlar, ishal, sarı ve köpüklü dışkı, atılım güçlüğü , yeme veya iştahsızlık azaldı.
Ölüm oranı 3-4 gün içinde ölümle% 20 civarındadır. Hayatta kalanların iyileşmesi yaklaşık 7-8 gün sürer.
Anne antikorunun varlığı (civcivlere anneden geçen antikor) hastalığın ilerlemesini değiştirir. Özellikle ölüm oranları yüksek virüsün tehlikeli suşları ilk olarak Avrupa'da tespit edildi; bu türler Avustralya'da tespit edilmemiştir.[5]
Teşhis
Sürü öyküsüne, klinik belirtilere ve ölüm sonrası (nekropsi) incelemelere dayalı olarak bir ön tanı konulabilir. Bununla birlikte, kesin tanı sadece IBDV'nin spesifik tespiti ve / veya izolasyonu ve karakterizasyonu ile sağlanabilir. İmmünofloresan veya immünohistokimya anti-IBDV etiketli antikorlara dayalı testler veya Yerinde hibridizasyon, etiketli tamamlayıcı cDNA sekans probuna dayalı olarak, enfekte dokularda IBDV'nin spesifik tespiti için faydalıdır. RT-PCR (yukarıda bahsedildiği gibi), izolatların genetik olarak karşılaştırılması ve filogenetik ağaçların üretilmesi için PCR ürün dizilerinin belirlenmesi olasılığı ile VP1 kodlama geni gibi IBDV genomunun saptanması için tasarlanmıştır. Antikorları tespit etmek için agar jel çökeltme ve ELISA gibi serolojik testler, aşı tepkilerini izlemek için kullanılır ve aşılanmamış sürülerde enfeksiyon tanısı için ek bilgi olabilir.
Nekropsi muayenesi genellikle Fabricius bursasında şişme, ödem, kanama, jöle serosa transudatın varlığı ve sonunda bursal atrofi gibi değişiklikleri gösterir. İskelet kası, bağırsaklar, böbrekler ve dalakta patolojik değişiklikler, özellikle kanamalar da görülebilir.
Tedavi ve kontrol
Peri-fokal aşılama, wild-IBDV yayılmasının hızlı olması nedeniyle bir salgınla mücadelede etkili olmayabilir.
Pasif bağışıklık homolog avirulent suşlarla önceki enfeksiyonda olduğu gibi, homolog IBDV ile zorlanmaya karşı koruma sağlayabilir. Damızlık sürüler, koruyucu antikorları broyler ve piliç civcivleri gibi yavrularına transfer etmeleri için IBD'ye karşı aşılanabilir. Düşük zayıflatılmış aşı suşları, Fabricius bursasına zarar verebilir ve hassas civcivlerde immünosupresyona neden olabilir. Çiftlik ziyareti ve diğer sürülerden uzaklaşma için yeterli kısıtlama ile biyogüvenlik. Salgın sonrası hijyen önlemleri, virüs hem barınakta hem de suda uzun süre hayatta kalabildiğinden etkili olmayabilir.
Epidemiyoloji
IBD'nin doğal konakçıları tavuklar ve hindilerdir.[6]
Ayrıca bakınız
Referanslar
- ^ Castón, José R .; Rodríguez, José F .; Carrascosa José L. (2008). "Bulaşıcı Bursal Hastalık Virüsü (IBDV)". Parçalı Çift-sarmallı RNA Virüsleri: Yapı ve Moleküler Biyoloji. Caister Academic Press. ISBN 978-1-904455-21-9.
- ^ Nguyen Thi Hau (27 Ekim 2014). "Tavuklarda GUMBORO hastalığı ve önleme ve tedavi yöntemleri"
- ^ "Bulaşıcı Bursal Hastalığı: Giriş". Merck Veteriner El Kitabı. 2006. Alındı 2007-06-26.
- ^ Qin, Yao; Zheng, Shijun (14 Ocak 2017). "Bulaşıcı bursal hastalık virüsü-konak etkileşimleri: çok sayıda ve farklı işler yapan çok işlevli viral proteinler". Uluslararası Moleküler Bilimler Dergisi. 18 (1): 161. doi:10.3390 / ijms18010161. PMC 5297794. PMID 28098808.
- ^ "Bulaşıcı bursal hastalığı (veya Gumboro)". Kanatlı Hub. Alındı 2019-11-14.
- ^ Eterradossi, N .; Saif, Y.M. (2008). "Bulaşıcı bursal hastalığı". Saif, Y.M. (ed.). Kanatlı hayvan hastalıkları (12. baskı). Blackwell Publishing. s. 185-208. ISBN 9780813807188.
Dış bağlantılar
- Açıklama, hastalıklı organın fotoğrafı ile
- Ticari Broylerlerde IBD
- Bulaşıcı Bursal Hastalık
- Enfeksiyon Bursal Hastalığı, uzman tarafından incelenmiş ve yayınlanmıştır. WikiVet -de http://en.wikivet.net/Infectious_Bursal_Disease, erişim tarihi 13/09/2011
- "Gumbohatch (kuş enfeksiyöz bursal hastalığı aşısı (canlı)) EPAR". Avrupa İlaç Ajansı (EMA).
