Nesiritide - Nesiritide
 | |
| Klinik veriler | |
|---|---|
| AHFS /Drugs.com | Monografi |
| Rotaları yönetim | Sadece IV |
| ATC kodu | |
| Tanımlayıcılar | |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ChEMBL | |
| Kimyasal ve fiziksel veriler | |
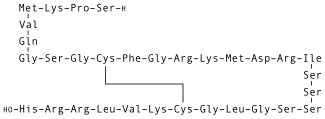
| Formül | C143H244N50Ö42S4 |
| Molar kütle | 3464.07 g · mol−1 |
| 3 boyutlu model (JSmol ) | |
| |
| |
| | |
Nesiritide (Natrecor), rekombinant 32 amino asit insanın formu B tipi natriüretik peptid normalde ventriküler miyokard tarafından üretilir. Nesiritide kolaylaştırmak için çalışıyor kardiyovasküler sıvı homeostaz karşı düzenleme yoluyla renin-anjiyotensin-aldosteron sistemi, uyarıcı siklik guanozin monofosfat, giden düz kas hücre gevşemesi.
Nesiritide'nin başlangıçta yararlı olduğuna inanılıyordu. akut dekompanse konjestif kalp yetmezliği. Amerika Birleşik Devletleri'nden onay aldı. Gıda ve İlaç İdaresi bu amaç için 2001 yılında, ilk onaylamadan sonra. Temmuz 2011'de nesiritide için bugüne kadarki en büyük çalışmanın sonuçları The New England Tıp Dergisi. Çalışma, nesiritid ve plasebo arasında mortalite veya yeniden hastaneye yatışlar üzerinde bir fark gösteremedi.[1]
Yönetim
Nesiritide sadece uygulanır intravenöz olarak, genellikle tarafından bolus ardından IV infüzyonu. Çoğu yetişkin için ve yaşlı normal doz 2mg / kg, ardından 0.01 mg / kg / dakika sürekli IV infüzyonu. Bu, maksimum 0,03 mg / kg / dakika olmak üzere her üç saatte bir artırılabilir.
Tartışma
2005 yılında, tarafından yayınlanan birkaç akademik makalenin ardından Jonathan Sackner-Bernstein[2][3][4] Nesiritide'nin etkinliği ve yan etkileri konusunda Johnson & Johnson, FDA ile görüştü ve ilaç için belirtilen planlarını değiştirdi ve etiketini revize etmeyi kabul etti.[5][6]
Kalp doktorları Cleveland Clinic ardından oybirliğiyle hastalarına ilacın reçete edilmesine izin verilmemesi yönünde oy kullandı.[6] Johnson ve Johnson, tavsiyeleri daha sonra 2011'de yayınlanan büyük ölçekli klinik araştırmayı yürütme önerisini içeren bir uzman paneli topladı.[7] Bunu takiben, Amerika Birleşik Devletleri Adalet Bakanlığı ilacın pazarlanmasına ilişkin bir soruşturma duyurdu[8] J & J'nin Scios birimine para cezası verildi.[9]
Yan etkiler
Yaygın yan etkiler şunları içerir:
- Düşük kan basıncı (Hastaların% 11'i)
- Baş ağrısı
- Mide bulantısı
- Yavaş kalp atış hızı
- Böbrek yetmezliği[10]
Daha nadir görülen yan etkiler şunlardır:
Referanslar
- ^ O'Connor CM, Starling RC, Hernandez AF, Armstrong PW, Dickstein K, Hasselblad V, vd. (Temmuz 2011). "Nesiritidin akut dekompanse kalp yetmezliği hastalarında etkisi" (PDF). New England Tıp Dergisi. 365 (1): 32–43. doi:10.1056 / NEJMoa1100171. hdl:11379/60663. PMID 21732835.
- ^ Sackner-Bernstein JD, Skopicki HA, Aaronson KD (Mart 2005). "Akut dekompanse kalp yetmezliği olan hastalarda nesiritid ile böbrek fonksiyonunun kötüleşmesi riski". Dolaşım. 111 (12): 1487–91. doi:10.1161 / 01.CIR.0000159340.93220.E4. PMID 15781736.
- ^ Sackner-Bernstein JD, Kowalski M, Fox M, Aaronson K (Nisan 2005). "Dekompanse kalp yetmezliği için nesiritid ile tedaviden sonra kısa vadeli ölüm riski: randomize kontrollü çalışmaların havuzlanmış bir analizi". JAMA. 293 (15): 1900–5. doi:10.1001 / jama.293.15.1900. PMID 15840865.
- ^ Aaronson KD, Sackner-Bernstein J (Eylül 2006). "Akut dekompanse kalp yetmezliği olan hastalarda nesiritid ile ilişkili ölüm riski". JAMA. 296 (12): 1465–6. doi:10.1001 / jama.296.12.1465. PMID 17003394.
- ^ Saul S (17 Mayıs 2005). "Natrecor'un Pazarlaması ve Başarısı" - NYTimes.com aracılığıyla.
- ^ a b Saul S (4 Mayıs 2005). "Kalp Kliniği Bir İlaç Kullanımını Sonlandırabilir veya Azaltabilir" - NYTimes.com aracılığıyla.
- ^ Herper M. "Kalp İlacı Üzerindeki J&J İçin Acı Hap" Kontrol
| url =değer (Yardım). Forbes. - ^ Saul S (21 Temmuz 2005). "ABD'nin Pazarlamaya Bakışı, Johnson & Johnson" - NYTimes.com aracılığıyla.
- ^ "Johnson & Johnson Yan Kuruluşu Scios, Kalp Yetmezliği İlacını Yanlış Markalaştırmaktan Suçlu Olduğunu İddia Etti Natrecor". www.justice.gov. 5 Ekim 2011.
- ^ "Natrecor Olumsuz Tepkiler - Epocrates Online". online.epocrates.com.
daha fazla okuma
- Noviasky JA, Kelberman M, Whalen KM, Guharoy R, Darko W (Ağustos 2003). "Bilim mi kurgu: nesiritidin birinci basamak ajan olarak kullanımı?". Farmakoterapi. 23 (8): 1081–3. doi:10.1592 / phco.23.8.1081.32882. PMC 3746126. PMID 12921256.
Dış bağlantılar
| Bu uyuşturucu madde ile ilgili makale kardiyovasküler sistem bir Taslak. Wikipedia'ya şu yolla yardım edebilirsiniz: genişletmek. |
