Peptidomimetik - Peptidomimetic
Bu makale tüm D-peptidler dışında her şey hakkında eksik bilgi (Şekil 1). (Mayıs 2019) |
Bir peptidomimetik küçük protein benzeri bir zincirdir. peptid.[1] Tipik olarak ya mevcut bir peptidin modifikasyonundan ya da peptitleri taklit eden benzer sistemler tasarlayarak ortaya çıkarlar. peptoidler ve β-peptitler. Yaklaşımdan bağımsız olarak, değiştirilen kimyasal yapı, kararlılık veya kararlılık gibi moleküler özellikleri avantajlı bir şekilde ayarlamak için tasarlanmıştır. biyolojik aktivite. Bu, mevcut peptitlerden ilaç benzeri bileşiklerin geliştirilmesinde rol oynayabilir. Bu modifikasyonlar, peptidde doğal olarak meydana gelmeyecek değişiklikleri (değiştirilmiş omurgalar ve doğal olmayanların dahil edilmesi gibi) içerir. amino asitler ). Prekürsör peptid ile benzerliklerine dayanarak, peptidomimetikler, A'nın en çok ve D'nin en az benzerliği gösterdiği dört sınıfa (A - D) gruplanabilir. A ve B Sınıfları, peptit benzeri yapı iskeletlerini içerirken, C ve D sınıfları küçük molekülleri içerir (Şekil 1).[2]
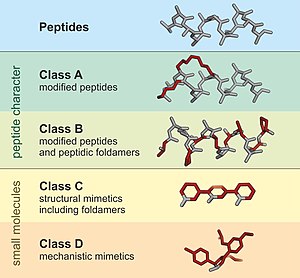
Peptidler
Klasörler
D-peptidler
Bu bölümün olması önerildi Bölünmüş başlıklı yeni bir makaleye D-peptid. (Tartışma) (Mayıs 2019) |
A D-peptid küçük bir dizi D-amino asitler. Dan beri ribozomlar L-amino asitlere özgüdür, D-peptidler organizmalarda nadiren doğal olarak oluşur ve kolayca sindirilmez veya bozunmaz. D-peptid peptidomimetikleri, yaygın olarak terapötik özelliklere sahip olan doğal L-peptidleri taklit etmek için tasarlanmış D-peptidlerdir.
D-peptidlerin özellikleri

İçine yerleştirildiğinde şiral olmayan Su, D-peptidler gibi çözücülerin yanı sıra daha büyük polipeptid D-proteinleri, benzer dizilere sahip L-peptidler ve L-proteinlerine benzer ancak aynalanmış özelliklere sahiptir. Bir L-proteini, Refakatçi veya yapısal kofaktör katlamak için D-enantiyomer protein, L-proteinine göre bir ayna görüntüsü yapısına sahip olmalıdır (Şekil 2). Bir D-enzimi, aynı diziye sahip L-enzimine kıyasla ters kiralite substratları üzerinde etki etmelidir. Benzer şekilde, bir L-peptid bağlar bir L-proteinine, bunların D-peptidi ve D-protein karşılıkları aynalı bir şekilde birbirine bağlanmalıdır.[3]
D-peptidler ayrıca onları ilaç olarak çekici kılan özelliklere sahiptir. D-peptidler midede veya hücrelerin içinde bozulmaya karşı daha az hassastır. proteoliz. D-peptit ilaçları bu nedenle ağızdan alınabilir ve daha uzun süre etkilidir. D-peptidlerin sentezlenmesi diğer birçok ilaçla karşılaştırıldığında kolaydır. Bazı durumlarda, D-peptidler düşük immünojenik tepki.[4]
D-peptitleri tasarlama yöntemleri
Ret tasarımı
Bir L-peptit, L ve D amino asitlerinden oluşturulan üç analog sekansa (Şekil 3) sahiptir: aynı sekansa sahip, ancak D-aminoasitlerden ve bir ayna konformasyonundan oluşan D-enantiyomer veya inverso-peptit; aynı L amino asit dizisinden, ancak ters sırada oluşan retro-peptid; ve ters dizide D-amino asitlerden oluşan retro-inverso veya D-retro-enantiomer peptidi.[5][6]
L-peptid ve D-enantiyomeri birbirlerinin ayna yapıları iken, L-retro-peptid D-retro-inverso-peptidin ayna görüntüsüdür. Öte yandan, L-peptid ve D- retro-inverso-peptid, karboksil ve amino grupları zıt yönlere işaret etmesine rağmen, benzer bir yan zincir düzenlemesini paylaşır. Bağlanma için ikincil bir yapıya bağlı olmayan küçük peptidler için, bir L-peptid ve onun D-retro-inverso-peptidi muhtemelen bir hedef L-proteini ile benzer bir bağlanma afinitesine sahip olacaktır.

Ayna görüntüsü faj ekranı
Faj gösterimi bir hedef proteine bağlanmak için büyük peptit kitaplıklarını taramak için bir tekniktir. Faj gösteriminde, potansiyel ilaç-peptidi kodlayan DNA dizisi, protein kaplamasının genine kaynaştırılır. bakteriyofajlar ve bir vektöre tanıtıldı. Peptide çeşitlilik şu şekilde tanıtılabilir: mutagenez. Protein kaplama peptidleri daha sonra ifade edilir ve saflaştırılır ve hareketsizleştirilmiş protein hedeflerinin bir yüzeyine uygulanır. Yüzey daha sonra bağlanmayan peptidleri uzaklaştırmak için yıkanarak uzaklaştırılırken, kalan bağlanma peptidleri ayrıştırılır.[7]
Ayna görüntüsü faj gösterimi, hedef L-proteinlerine bağlanan büyük D-peptit kitaplıklarını taramak için kullanılabilen benzer bir yöntemdir. Daha kesin olarak, D-peptidler bakteriyofajlarda ifade edilemediğinden, ayna görüntülü faj görüntüleme, önceden hareketsizleştirilmiş D-proteinlerine bağlanan L-peptitleri görüntüler. kimyasal olarak sentezlenmiş. D-peptidlerin ayna özelliklerinden dolayı, bir D-proteinine bağlanan bir L-peptidin D-enantiyomeri L-proteinine bağlanacaktır.
Bununla birlikte, ayna görüntüsü faj gösteriminin, faj gösterimi ile karşılaştırıldığında iki dezavantajı vardır. Hedef D-proteinlerinin kimyasal olarak sentezlenmesi gerekir ki bu normalde pahalı ve zaman alıcı bir süreçtir. Ayrıca, hedef proteinin katlanması için bir kofaktör veya bir şaperon gerektirmemesi gerekir, aksi takdirde kimyasal olarak sentezlenen D-proteini hedef, ayna yapısına katlanmayacaktır.

Yapısal benzerlik
İkincil yapıya sahip peptit, ters sırayla bağlanma ikincil yapı için gerekli olan birçok omurga etkileşimini kırdığından, tersine tersi ile taklit edilemez.[8] Bu peptitleri taklit etmeye yönelik bir yaklaşım, benzer (yan zincir) yapıları, aynalı bir kopyasında aramaktır. Protein Veri Bankası yapısal elemanlar için ve daha sonra bölümleri orijinal proteinde bulunan ilmeklerin geriye dönük versiyonları ile birleştirmek.[9]
Küçük moleküller
Örnekler
Peptidomimetik yaklaşımlar, kanser hücrelerini seçici olarak öldüren küçük moleküller tasarlamak için kullanılmıştır. hedefli kemoterapi adı verilen bir işlemle programlanmış hücre ölümünü indükleyerek apoptoz. Aşağıdaki iki örnek, anahtara katılan proteinleri taklit eder. Protein-protein etkileşimleri kanserdeki apoptotik yolu yeniden aktive eden ama bunu farklı mekanizmalarla yapan.
2004 yılında, Walensky ve meslektaşları, alfa sarmal sadece pro-apoptotik BH3 proteinlerini taklit eden peptid, örneğin TEKLİF ve KÖTÜ.[10] Bu molekül, doğal sarmal yapıyı bir yapı oluşturarak stabilize etmek için tasarlanmıştır. makrosikl yan zincirler arasında değil bağlama ile ilgili. Bu süreç olarak anılır peptid zımbalama, kullanır doğal olmayan makrosiklizasyonu kolaylaştırmak için amino asitler halka kapanan olefin metatezi.[11] Bu durumda, mitokondriyal apoptotik yolu spesifik olarak aktive eden zımbalanmış bir BH3 sarmalı tanımlanmıştır. düşmanca sadece BH3 proteinlerinin anti-apoptotik proteinler (örn. Bcl-2, Ayrıca bakınız içsel ve dışsal indükleyiciler apoptoz). Bu molekül insanın büyümesini bastırdı lösemi bir farede ksenograft model.[10]
Ayrıca 2004 yılında, Harran ve iş arkadaşları bir dimerik proapoptotik protein Smac'ı taklit eden küçük molekül (bkz. mitokondriyal düzenleme apoptozda).[12] Bu molekül N-terminalini taklit eder doğrusal motif Ala-Val-Pro-Ile. Benzersiz olarak, bu peptidomimetiğin dimerik yapısı, benzer bir monomere göre aktivitede belirgin bir artışa yol açtı. Bu bağlayıcı işbirliği molekülün, kaspazları yeniden aktive etmek için işlevsel olarak önemli olan Smac'ın homodimerik yapısını da taklit etme kabiliyetinden kaynaklanır.[13] Bu türden Smac mimetikleri bir dizi hassaslaştırabilir kucuk hucreli olmayan akciger kanseri geleneksel kemoterapötiklere (ör. Gemsitabin, Vinorelbin ) hem in vitro hem de fare ksenogreft modellerinde.[14]
Heterosikller genellikle peptitlerin amid bağını taklit etmek için kullanılır. Örneğin tiyazoller, doğal olarak oluşan peptitlerde bulunur ve araştırmacılar tarafından peptidin amid bağını taklit etmek için kullanılır.[15]
Ayrıca bakınız
- Apoptoz
- Beta-peptit
- Kanser
- Tıklanmış peptit polimeri
- Depsipeptid
- Genişletilmiş genetik kod
- Klasörler
- Proteinojenik olmayan amino asitler
Referanslar
- ^ Marshall GR, Ballante F (Eylül 2017). "Peptidomimetiklerin Tasarımında Sınırlayıcı Varsayımlar". İlaç Geliştirme Araştırması. 78 (6): 245–267. doi:10.1002 / ddr.21406. PMID 28875546. S2CID 5730986.
- ^ a b Pelay-Gimeno M, Glas A, Koch O, Grossmann TN (Temmuz 2015). "Protein-Protein Etkileşimlerinin İnhibitörlerinin Yapı Bazlı Tasarımı: Peptid Bağlama Epitoplarını Taklit Etme". Angewandte Chemie. 54 (31): 8896–927. doi:10.1002 / anie.201412070. PMC 4557054. PMID 26119925.
- ^ Milton RC, Milton SC, Kent SB (1992). "Bir D-enziminin toplam kimyasal sentezi: HIV-1 proteazın enantiyomerleri, karşılıklı kiral substrat spesifikliğinin kanıtını gösterir". Bilim. 256 (5062): 1445–1448. doi:10.1126 / science.1604320. PMID 1604320.
- ^ Welch BD, VanDemark AP, Heroux A, Hill CP, Kay MS (Ekim 2007). "HIV-1 girişinin güçlü D-peptid inhibitörleri". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 104 (43): 16828–33. Bibcode:2007PNAS..10416828W. doi:10.1073 / pnas.0708109104. PMC 2040420. PMID 17942675.
- ^ Guichard G, Benkirane N, Zeder-Lutz G, van Regenmortel MH, Briand JP, Muller S (Ekim 1994). "Retro-inverso-peptidomimetiklerle doğal L-peptitlerin antijenik taklidi". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 91 (21): 9765–9. Bibcode:1994PNAS ... 91.9765G. doi:10.1073 / pnas.91.21.9765. PMC 44897. PMID 7937888.
- ^ Cardó-Vila M, Giordano RJ, Sidman RL, Bronk LF, Fan Z, Mendelsohn J, Arap W, Pasqualini R (Mart 2010). "Kombinasyonel peptit seçiminden ilaç prototipine (II): epidermal büyüme faktörü reseptör yolunu hedefleme". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 107 (11): 5118–23. Bibcode:2010PNAS..107.5118C. doi:10.1073 / pnas.0915146107. PMC 2841862. PMID 20190183.
- ^ Wiesehan K, Willbold D (Eylül 2003). "Ayna görüntüsü faj gösterimi: aynayı hedefleyen". ChemBioChem. 4 (9): 811–5. doi:10.1002 / cbic.200300570. PMID 12964153. S2CID 34014107.[ölü bağlantı ]
- ^ Lacroix E, Viguera AR, Serrano L (Nisan 1998). "Protein dizilerini geriye doğru okumak". Katlama ve Tasarım. 3 (2): 79–85. doi:10.1016 / S1359-0278 (98) 00013-3. PMID 9565752.
- ^ Garton M, Nim S, Stone TA, Wang KE, Deber CM, Kim PM (Şubat 2018). "Tüm PDB'nin ayna görüntüsünü kullanarak biyoaktif sarmal peptitlerin oldukça kararlı D-amino asit analoglarını üretme yöntemi". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 115 (7): 1505–1510. doi:10.1073 / pnas.1711837115. PMC 5816147. PMID 29378946.
- ^ a b Walensky LD, Kung AL, Escher I, Malia TJ, Barbuto S, Wright RD, Wagner G, Verdine GL, Korsmeyer SJ (Eylül 2004). "Apoptozun in vivo olarak hidrokarbonla zımbalanmış bir BH3 sarmalı tarafından aktivasyonu". Bilim. 305 (5689): 1466–70. Bibcode:2004Sci ... 305.1466W. doi:10.1126 / science.1099191. PMC 1360987. PMID 15353804.
- ^ Blackwell HE, Grubbs RH (1998). "Halka Kapanış Metateziyle Kovalent Olarak Çapraz Bağlı Peptit Helislerinin Yüksek Etkili Sentezi". Angewandte Chemie Uluslararası Sürümü. 37 (23): 3281–3284. doi:10.1002 / (SICI) 1521-3773 (19981217) 37:23 <3281 :: AID-ANIE3281> 3.0.CO; 2-V. PMID 29711420.
- ^ Li L, Thomas RM, Suzuki H, De Brabander JK, Wang X, Harran PG (Eylül 2004). "Küçük bir molekül Smac taklidi, TRAIL- ve TNFalpha aracılı hücre ölümünü güçlendirir". Bilim. 305 (5689): 1471–4. Bibcode:2004Sci ... 305.1471L. doi:10.1126 / bilim.1098231. PMID 15353805. S2CID 58926089.
- ^ Chai J, Du C, Wu JW, Kyin S, Wang X, Shi Y (Ağustos 2000). "Smac / DIABLO tarafından apoptotik aktivasyonun yapısal ve biyokimyasal temeli". Doğa. 406 (6798): 855–62. Bibcode:2000Natur.406..855C. doi:10.1038/35022514. PMID 10972280. S2CID 4385614.
- ^ Greer RM, Peyton M, Larsen JE, Girard L, Xie Y, Gazdar AF, Harran P, Wang L, Brekken RA, Wang X, Minna JD (Aralık 2011). "SMAC mimetik (JP1201), küçük hücreli olmayan akciğer kanserlerini, IAP'ye bağımlı ancak TNF-α'dan bağımsız bir şekilde çoklu kemoterapi ajanlarına duyarlı hale getirir". Kanser araştırması. 71 (24): 7640–8. doi:10.1158 / 0008-5472.CAN-10-3947. PMC 3382117. PMID 22049529.
- ^ Mak JY, Xu W, Fairlie DP (2015/01/01). Peptidomimetikler I (PDF). Heterosiklik Kimyada Konular. 48. Springer Berlin Heidelberg. s. 235–266. doi:10.1007/7081_2015_176. ISBN 978-3-319-49117-2.
