Tip VI salgı sistemi - Type VI secretion system - Wikipedia
tip VI salgı sistemi (T6SS) geniş bir yelpazede kullanılan moleküler makinedir. Gram negatif proteinleri içeriden taşımak için bakteri türleri (sitoplazma veya sitozol ) hücre zarfı boyunca bitişik bir hedef hücreye bir bakteri hücresi. Sıklıkla T6SS'nin 2006 yılında, kolera, Vibrio cholerae, T6SS genlerinin bir protein ihraç cihazını kodladığını gösteren ilk çalışma, aslında 2004 yılında balık patojeni tarafından protein salgılanması üzerine bir çalışmada yayınlandı. Edwardsiella tarda.[1][2][3]
O zamandan beri, Tip VI sekresyon sistemleri, tüm proteobakteriyellerin dörtte birinde bulundu. genomlar hayvanların, bitkilerin ve insanların patojenlerinin yanı sıra toprak, çevresel veya deniz bakterileri dahil.[4] Tip VI salgılanmasının ilk çalışmalarının çoğu, yüksek organizmaların patogenezindeki rolüne odaklanırken, şimdi esas olarak bakteriler arası antagonizmde işlev gördüğü bilinmektedir.[3]
Yapı ve mekanizma

T6SS'nin bir ters faj bakteri hücre yüzeyinden dışa doğru uzanır. Üç alt kompleks halinde bir araya gelen 14 proteinden oluşur: faj kuyruğu benzeri bir tübül, faj taban plakası benzeri bir yapı ve hücre zarfı kapsayan membran kompleksi. Bu üç alt kompleks, proteinleri bakteri hücresi zarfı boyunca ve bir kasılma mekanizması aracılığıyla bir hedef hücreye taşımak için birlikte çalışır.[5]

Faj kuyruğu benzeri
T6SS'nin faj kuyruğu benzeri bileşeni, montaj ve demontaj döngülerine maruz kalan dinamik bir boru şekilli yapıdır. 600 nm uzunluğa kadar olabilir ve elektron mikrograflarında bakteri sitoplazması boyunca uzanan görselleştirilmiştir.[6] Tübüller, hemolizin birlikte düzenlenmiş proteinin (Hcp) üst üste dizilmiş heksamerik halkalarından oluşturulmuş bir tüpün etrafında bir kılıf olarak düzenlenmiş olan TssA ve TssB (VipA / VipB) proteinlerinin tekrar eden birimlerinden oluşur.[7][8] Hcp tüpünün ucunda, faj kuyruğu sivri uç benzeri protein VgrG'nin bir trimerini oturur ve bu, daha sonra sivri bir PAAR alanı içeren protein ile kapatılır.[9] Kılıfın büzülmesinin, Hcp tüpünü, VgrG'yi ve ilgili substratları bakteri hücresinin dışına ittiği düşünülmektedir, burada VgrG / PAAR sivri uç, komşu hücrenin zarının penetrasyonunu kolaylaştırır. Tübül yapısı, tübül tabanına oturan ATP-bozucu protein ClpV'nin etkisiyle sökülebilir.[8]
Taban plakası
T6SS'nin faj kuyruğu benzeri tübülü, bakteriyofaj taban plakalarına benzer bir yapı üzerinde toplanır. TssE, TssF, TssG ve TssK proteinlerinden oluşur. Taban plakası ve faj kuyruğu benzeri kompleks, bakteriyel sitoplazmada etkileşime girer ve daha sonra membran kompleksi tarafından hücre zarfına alınır.[5]
Zar
T6SS membran kompleksi, aparatın hücresel membrana sabitlenmesinden sorumludur ve faj kuyruğu benzeri tübülün büzülmesiyle substratların itildiği kanalı sağlar.[5] Bu büyük (1,7 md) kompleks, TssJ, TssM ve TssL içeren bir heterotrimerin 10 etkileşimli biriminden oluşur. İç zardan Gram negatif bakteri hücre zarfının dış zarına uzandığına ve iris benzeri benzersiz bir mekanizma ile açılan ve kapanan bir kanal oluşturduğuna inanılıyor.[10]
Substrat tanıma
Diğer salgı sistemlerinin substratlarının (genel salgı yolu veya salgılama sistemleri III ve IV gibi) aksine, T6SS'nin herhangi bir evrensel olarak tanımlayıcı özelliğe sahip olduğu bilinmemektedir. Bunun yerine, aparatın iki yapısal bileşeninden biri aracılığıyla salgılanmak üzere tanınır ve seçilirler. Bir substrat sınıfı, bir Hcp heksamerin gözeneği içinde bağlanır.[11] Bu etkileşimin yokluğunda substratlar kararsız olduğundan, substratların geçtiği pasif bir tübül görevi gören Hcp yerine substrat-Hcp komplekslerinin birlikte salgılandığı düşünülmektedir. İkinci sınıf substratların üyeleri, faj kuyruğu sivri protein VgrG ile etkileşim yoluyla sekresyon için hedeflenir. Bu substratlar genellikle modüler proteinlerdir, örneğin Rhs toksinleri, bir ucunda VgrG ile etkileşim için PAAR alanına sahip olanlar.[12] Bir VgrG ve bir substratın her ikisinin de aynı proteinin parçası olduğu durumlar da vardır.[kaynak belirtilmeli ]
Anti-ökaryotik
T6SS'nin atasal işlevi bakterileri hedef alıyor gibi görünse de, ökaryotik hücreleri hedeflemek için evrimleşen bir avuç sistem tanımlanmıştır. Genel olarak, bu ökaryot hedefleme sistemleri hastalığa neden olmaya dahil olur. Örneğin hücre içi patojen Francisella tularensis bir T6SS aktivitesinin fagozomlardan kaçmasını ve makrofajların sitoplazmasında replike olmasını gerektirir.[13] Salgılanan proteinlerin kolaylaştırdığı mekanizma F. tularensis virülans hala bilinmemektedir. T6SS Vibrio cholerae hem bakteriyel hem de ökaryotik hücreleri hedefleyebilen ikili bir role sahiptir.[14] Salgıladığı en az bir substrat, hücre iskeleti protein aktinini çapraz bağlayarak işlev gören ökaryotik hücre hedeflemesi için uzmanlaşmıştır.[15] Burkholderia pseudomallei ve Edwardsiella tarda ökaryotik hedeflemeye adanmış görünen bir T6SS'ye sahip diğer iki organizmadır. Bitki patojeninin T6SS'si Xanthomonas citri onu yırtıcı amipten korur Dictyostelium discoideum.[16]
Antibakteriyel
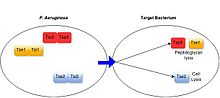
Fırsatçı patojenler dahil olmak üzere çok çeşitli Gram-negatif bakterilerin antibakteriyel T6SS'lere sahip olduğu gösterilmiştir. Pseudomonas aeruginosa,[17] insan bağırsağında yaşayan zorunlu ortak türler (Bakteroidler spp.),[18] ve bitki ile ilişkili bakteriler gibi Agrobacterium tumefaciens.[19] Bu sistemler, salgılanan substratlarının işlevi yoluyla antibakteriyel aktivite uygular.[3] Tüm karakterize edilen bakteriyel hedefleme T6SS proteinleri, hedef hücreleri öldürerek veya büyümesini önleyerek toksin görevi görür. T6SS substratları tarafından sergilenen hedef hücrelere yönelik toksisite mekanizmaları çeşitlidir, ancak tipik olarak hücre duvarının amidaz veya glikohidrolaz aktivitesi yoluyla degradasyonu, lipaz aktivitesi veya gözenek oluşumu yoluyla hücre zarlarının bozulması, DNA'nın bölünmesi dahil olmak üzere yüksek düzeyde korunmuş bakteriyel yapıların hedeflenmesini içerir. ve temel metabolit NAD + 'nın bozunması.[3][20] T6SS-pozitif bakteri türleri, salgılanan her bir toksine özgü bağışıklık proteinleri üreterek T6SS aracılı kendi ve akraba hücrelere karşı zehirlenmeyi önler. Bağışıklık proteinleri, genellikle aktif bölgelerinde toksin proteinlerine bağlanarak işlev görür ve böylece aktivitelerini bloke eder.[21][3]
Yönetmelik
GacS / Rsm sistemi
Bazı araştırmalar T6SS'nin düzenlemesine gitti. iki bileşenli sistemler. İçinde P. aeruginosa GacS / Rsm iki bileşenli sistemin tip VI salgılama sistemi düzenlemesinde yer aldığı gözlemlenmiştir. Bu sistem ifadesini düzenler Rsm küçük düzenleyici RNA molekülleri ve ayrıca biyofilm oluşumu. GacS / Rsm yolağı stimülasyonu üzerine, Rsm moleküller, mRNA bağlayıcı protein RsmA'nın inhibisyonuna yol açar. RsmA, T6SS gen ekspresyonu için ribozom bağlama sahasının yakınındaki sekanslara bağlanan translasyonel bir inhibitördür. Bu düzeydeki düzenleme, aynı zamanda P. fluorescens ve P. syringae.[22][23]
Çekirdek algılama
Yetersayı algılamanın T6SS'yi düzenlediği çeşitli örnekler vardır. İçinde Vibrio cholerae T6SS çalışmalarında, serotip O37 yüksek vas gen ifadesi. Öte yandan O139 ve O1 serotipleri, belirgin şekilde düşük vas gen ifadesi. İfade farklılıklarının yetersayı algılama seviyelerindeki farklılıklara atfedilebileceği öne sürülmüştür. İçinde Vibrio cholerae, autoinducer-1 (AI-1) sinyalleri LuxQ, a sensör kinaz. LuxQ, daha sonra baskılayan bir DNA bağlayıcı protein olan LuxO'ya etki eden LuxU'yu etkinleştirir. HapR gen ifadesi. HapR'nin, LuxO delesyonlarının güçlü indüksiyonla sonuçlandığı düşünülmektedir. vas gen ekspresyonu ve dolayısıyla T6SS ekspresyonu, T6SS'nin çekirdek algılama tarafından bir şekilde düzenlendiğini gösterir.[24] Bununla birlikte, LuxO delesyonlarına sahip O1 suşları, O37 suşuna kıyasla hala nispeten hareketsiz T6SS'ye sahipti, bu da ek faktörlerin de dahil olduğunu düşündürdü.[25]
Ayrıca bakınız
Referanslar
- ^ Rao PS, Yamada Y, Tan YP, Leung KY (2004). "Edwardsiella tarda patogenezi için gerekli olan yeni virülans belirleyicilerini tanımlamak için proteomiklerin kullanımı". Mol Microbiol. 53 (2): 573–86. doi:10.1111 / j.1365-2958.2004.04123.x. PMID 15228535.CS1 bakım: birden çok isim: yazarlar listesi (bağlantı)
- ^ Hood RD, Peterson SB, Mougous JD (Mart 2017). "Çarpıcı Altınlardan Çarpıcı Altına: Tip VI Salgılamanın Bakterileri Hedeflediğini Keşfetmek". Hücre Konakçı ve Mikrop. 21 (3): 286–289. doi:10.1016 / j.chom.2017.02.001. PMC 6404758. PMID 28279332.
- ^ a b c d e Russell AB, Peterson SB, Mougous JD (Şubat 2014). "Tip VI salgı sistemi efektörleri: amacı olan zehirler". Doğa Yorumları. Mikrobiyoloji. 12 (2): 137–48. doi:10.1038 / nrmicro3185. PMC 4256078. PMID 24384601.
- ^ Boyer F, Fichant G, Berthod J, Vandenbrouck Y, Attree I (Mart 2009). "Bakteriyel tip VI salgılama sistemini siliko analizinde geniş bir genom ile incelemek: mevcut mikrobiyal genomik kaynaklardan ne öğrenilebilir?". BMC Genomics. 10 (104): 104. doi:10.1186/1471-2164-10-104. PMC 2660368. PMID 19284603.
- ^ a b c Cianfanelli FR, Monlezun L, Coulthurst SJ (Ocak 2016). "Nişan Al, Yükle, Ateş Et: Tip VI Salgılama Sistemi, Bakteriyel Bir Nanoweapon". Mikrobiyolojideki Eğilimler. 24 (1): 51–62. doi:10.1016 / j.tim.2015.10.005. PMID 26549582.
- ^ Basler M, Pilhofer M, Henderson GP, Jensen GJ, Mekalanos JJ (Şubat 2012). "Tip VI salgısı dinamik bir kontraktil faj kuyruğu benzeri yapı gerektirir". Doğa. 483 (7388): 182–6. doi:10.1038 / nature10846. PMC 3527127. PMID 22367545.
- ^ Brunet YR, Hénin J, Celia H, Cascales E (Mart 2014). "Tip VI salgı ve bakteriyofaj kuyruk tüpleri ortak bir montaj yolunu paylaşır". EMBO Raporları. 15 (3): 315–21. doi:10.1002 / emb.201337936. PMC 3989698. PMID 24488256.
- ^ a b Bönemann G, Pietrosiuk A, Diemand A, Zentgraf H, Mogk A (Şubat 2009). "VipA / VipB tübüllerinin ClpV aracılı diş açma ile yeniden modellenmesi, tip VI protein sekresyonu için çok önemlidir". EMBO Dergisi. 28 (4): 315–25. doi:10.1038 / emboj.2008.269. PMC 2646146. PMID 19131969.
- ^ Bönemann G, Pietrosiuk A, Diemand A, Zentgraf H, Mogk A (Şubat 2009). "VipA / VipB tübüllerinin ClpV aracılı diş açma ile yeniden modellenmesi, tip VI protein sekresyonu için çok önemlidir". EMBO Dergisi. 28 (4): 315–25. doi:10.1038 / emboj.2008.269. PMC 2646146. PMID 19131969.
- ^ Durand E, Nguyen VS, Zoued A, Logger L, Péhau-Arnaudet G, Aschtgen MS, Spinelli S, Desmyter A, Bardiaux B, Dujeancourt A, Roussel A, Cambillau C, Cascales E, Fronzes R (Temmuz 2015). "Tip VI salgı membran çekirdek kompleksinin biyojenez ve yapısı". Doğa. 523 (7562): 555–60. doi:10.1038 / nature14667. PMID 26200339.
- ^ Silverman JM, Agnello DM, Zheng H, Andrews BT, Li M, Catalano CE, Gonen T, Mougous JD (Eylül 2013). "Hemolizin çekirdek düzenlemeli protein, ihraç edilen bir reseptör ve tip VI sekresyon substratlarının şaperonudur". Moleküler Hücre. 51 (5): 584–93. doi:10.1016 / j.molcel.2013.07.025. PMC 3844553. PMID 23954347.
- ^ Shneider MM, Buth SA, Ho BT, Basler M, Mekalanos JJ, Leiman PG (Ağustos 2013). "PAAR-tekrar proteinleri, tip VI sekresyon sistemi artışını keskinleştirir ve çeşitlendirir". Doğa. 500 (7462): 350–353. doi:10.1038 / nature12453. PMC 3792578. PMID 23925114.
- ^ Nano FE, Schmerk C (Haziran 2007). "Francisella patojenite adası". New York Bilimler Akademisi Yıllıkları. 1105: 122–37. doi:10.1196 / yıl. 1409.000. PMID 17395722.
- ^ Dong TG, Ho BT, Yoder-Himes DR, Mekalanos JJ (Şubat 2013). "T6SS'ye bağımlı efektör ve bağışıklık proteinlerinin Tn-seq ile tanımlanması Vibrio cholerae". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 110 (7): 2623–8. doi:10.1073 / pnas.1222783110. PMC 3574944. PMID 23362380.,
- ^ Pukatzki S, Ma AT, Revel AT, Sturtevant D, Mekalanos JJ (Eylül 2007). "Tip VI sekresyon sistemi, faj kuyruğu sivri uç benzeri bir proteini aktin ile çapraz bağladığı hedef hücrelere yerleştirir". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 104 (39): 15508–13. doi:10.1073 / pnas.0706532104. PMC 2000545. PMID 17873062.,
- ^ Bayer-Santos E, Lima LD, Ceseti LM, Ratagami CY, de Santana ES, da Silva AM, Farah CS, Alvarez-Martinez CE (Nisan 2018). "Xanthomonas citri T6SS, Dictyostelium predasyonuna karşı dirence aracılık eder ve bir ECF σ faktörü ve aynı kökenli Ser / Thr kinaz tarafından düzenlenir ". Çevresel Mikrobiyoloji. 20 (4): 1562–1575. doi:10.1111/1462-2920.14085. PMID 29488354.
- ^ Hood RD, Singh P, Hsu F, Güvener T, Carl MA, Trinidad RR, Silverman JM, Ohlson BB, Hicks KG, Plemel RL, Li M, Schwarz S, Wang WY, Merz AJ, Goodlett DR, Mougous JD (Ocak 2010 ). "Tip VI salgı sistemi Pseudomonas aeruginosa bakterilere toksini hedefliyor ". Hücre Konakçı ve Mikrop. 7 (1): 25–37. doi:10.1016 / j.chom.2009.12.007. PMC 2831478. PMID 20114026.
- ^ Russell AB, Wexler AG, Harding BN, Whitney JC, Bohn AJ, Goo YA, Tran BQ, Barry NA, Zheng H, Peterson SB, Chou S, Gonen T, Goodlett DR, Goodman AL, Mougous JD (Ağustos 2014). "Bacteroidetes'teki tip VI sekresyonla ilişkili bir yol, bakteriler arası antagonizmaya aracılık eder". Hücre Konakçı ve Mikrop. 16 (2): 227–236. doi:10.1016 / j.chom.2014.07.007. PMC 4136423. PMID 25070807.
- ^ Ma LS, Hachani A, Lin JS, Filloux A, Lai EM (Temmuz 2014). "Agrobacterium tumefaciens Planta'da bakteriler arası rekabet için silah olarak tip VI salgılama DNaz efektörlerinin bir süper ailesini kullanır ". Hücre Konakçı ve Mikrop. 16 (1): 94–104. doi:10.1016 / j.chom.2014.06.002. PMC 4096383. PMID 24981331.
- ^ Whitney JC, Quentin D, Sawai S, LeRoux M, Harding BN, Ledvina HE, Tran BQ, Robinson H, Goo YA, Goodlett DR, Raunser S, Mougous JD (Ekim 2015). "Bakteriler arası bir NAD (P) (+) glikohidrolaz toksini, hedef hücrelere teslim için uzama faktörü Tu gerektirir". Hücre. 163 (3): 607–19. doi:10.1016 / j.cell.2015.09.027. PMC 4624332. PMID 26456113.
- ^ Ho BT, Dong TG, Mekalanos JJ (Ocak 2014). "Bir öldürmeye bakış: bakteriyel tip VI salgı sistemi". Hücre Konakçı ve Mikrop. 15 (1): 9–21. doi:10.1016 / j.chom.2013.11.008. PMC 3936019. PMID 24332978.
- ^ Mougous JD, Cuff ME, Raunser S, Shen A, Zhou M, Gifford CA, Goodman AL, Joachimiak G, Ordoñez CL, Lory S, Walz T, Joachimiak A, Mekalanos JJ (Haziran 2006). "Bir virülans lokusu Pseudomonas aeruginosa bir protein salgılama aparatını kodlar ". Bilim. 312 (5779): 1526–30. doi:10.1126 / science.1128393. PMC 2800167. PMID 16763151.
- ^ Kayıtlar AR, Gross DC (Temmuz 2010). "Sensör kinazları RetS ve LadS, Pseudomonas syringae tip VI sekresyonunu ve virülans faktörlerini düzenler". Bakteriyoloji Dergisi. 192 (14): 3584–96. doi:10.1128 / JB.00114-10. PMC 2897360. PMID 20472799.
- ^ Kayıtlar AR, Gross DC (Temmuz 2010). "Sensör kinazlar RetS ve LadS, Pseudomonas syringae tip VI sekresyonunu ve virülans faktörlerini düzenler". Bakteriyoloji Dergisi. 192 (14): 3584–96. doi:10.1128 / JB.00114-10. PMC 2897360. PMID 20472799.
- ^ Silverman JM, Brunet YR, Cascales E, Mougous JD (2012). "Tip VI salgı sisteminin yapısı ve düzenlenmesi". Mikrobiyolojinin Yıllık İncelemesi. 66: 453–72. doi:10.1146 / annurev-micro-121809-151619. PMC 3595004. PMID 22746332.
