Arbusküler mikoriza - Arbuscular mycorrhiza


Bir arbusküler mikoriza (çoğul Mikorizalar, diğer adıyla. endomikoriza) bir tür mikoriza içinde ortak mantar (AM mantarlarıveya AMF) kortikal hücreler of kökler bir vasküler bitki şekillendirme arbuscules. (Karıştırılmamalıdır ektomikoriza veya ericoid mikoriza.)
Arbusküler mikorizalar, benzersiz yapıların, arbusüllerin oluşumu ve veziküller filumun mantarları tarafından Glomeromycota. AM mantarları bitkilerin yakalanmasına yardımcı olur besinler gibi fosfor, kükürt, azot ve mikro besinler topraktan. Arbusküler mikorizal simbiyoz gelişiminin, toprağın bitkiler tarafından ilk kolonizasyonunda ve vasküler bitkilerin evriminde çok önemli bir rol oynadığına inanılmaktadır.[1] Endomikoriza oluşturmayan bitkileri listelemenin, yapanlara göre daha hızlı olduğu söyleniyor.[2] Bu ortakyaşam mantarlar ve bitkiler arasında bulunan son derece gelişmiş karşılıklı bir ilişkidir, bilinen en yaygın bitki simbiyozu,[3] ve AMF% 80 oranında bulunur vasküler bitki bugün var olan aileler.[4]
Mikorizal araştırmalardaki muazzam ilerlemeler fizyoloji ve ekoloji son 40 yılda[ne zaman? ] ekosistemde AMF'nin birden fazla rolünün daha iyi anlaşılmasına yol açtı. Tutkal benzeri proteinin önemli katkısı bir örnek glomalin toprak yapısına (aşağıya bakınız). Bu bilgi insan çabalarına uygulanabilir. ekosistem yönetimi, ekosistem restorasyonu, ve tarım.
Mikorizal simbiyozun evrimi
Paleobiyoloji
Her ikisi de paleobiyolojik ve moleküler kanıtlar AM'nin en az 460 milyon yıl önce ortaya çıkan eski bir simbiyoz olduğunu gösteriyor. AM simbiyozu, kara bitkileri arasında her yerde bulunur, bu da mikorizaların mevcut kara bitkilerinin ilk atalarında mevcut olduğunu düşündürür. Bitkilerle olan bu olumlu ilişki, kara bitkilerinin gelişimini kolaylaştırmış olabilir.[3]
Rhynie çört alt Devoniyen AM mantarlarının gözlendiği en eski kara bitkilerinin fosillerini verdi.[6] Mikorizal mantar içeren fosilleşmiş bitkiler silika içinde muhafaza edildi.
Erken Devoniyen karasal floranın gelişimini gördü. Aşağı Devoniyen'den (400 m. Yıl önce) Rhynie çörtünün bitkilerinin, günümüzün veziküllerine ve sporlarına benzeyen yapılar içerdiği bulundu. Glomus Türler. Kolonize fosil kökleri, Aglaophyton majör ve Rhynia vasküler bitki özelliklerine sahip eski bitkiler olan ve Briyofitler ilkel ile protostelik rizomlar.[6]
İntraradikal miselyum kök hücre içi boşluklarında gözlendi ve ince duvar hücrelerinde palisade benzeri ince duvar hücrelerinde arbusüller gözlendi parankim. Fosil arbusküller, mevcut AMF'ninkilere çok benziyor.[6] Arbusulüller içeren hücrelerin kalınlaşmış duvarları vardır ve bunlar aynı zamanda mevcut kolonize hücrelerde de gözlenir.
Mikorizalar Miyosen günümüzdekine çok benzeyen veziküler bir morfoloji sergilemektedir. Glomerales. Bu korunmuş morfoloji, hem modern hem de Miyosen mutualizmlerinde bitki konakçıları tarafından sağlanan besinlerin hazır mevcudiyetini yansıtabilir.[7] Ancak, sinyal verme süreçlerinin etkinliğinin muhtemelen Miyosen'den beri evrimleştiği ve bunun fosil kayıtlarında tespit edilemediği söylenebilir. Sinyalleme süreçlerinin ince ayarı, aralarında koordinasyonu ve besin alışverişini iyileştirecektir. ortakyaşlar hem mantarların hem de bitki simbiyotlarının uygunluğunu arttırırken.
Bitkiler ile arbusküler mikorizal mantarların ataları arasındaki ilişkinin doğası tartışmalıdır. İki hipotez şunlardır:
- Mikorizal simbiyoz, bir parazit karşılıklı yarar sağlayan bir ilişkiye dönüşen etkileşim.
- Mikorizal mantarlar, saprobik endosimbiyotik hale gelen mantarlar.[6]
Rhynie Chert'te hem saprotroflar hem de biyotroflar bulundu, ancak her iki hipotezi de destekleyen çok az kanıt var.
Konakçı hücrelerde istilaya bir yanıt gözlemlenmesine rağmen, parazitik mantarların istilanın hemen ardından konakçı hücreleri öldürmediğini gösteren bazı fosil kanıtları vardır. Bu yanıt, simbiyoz için gerekli kimyasal sinyalleşme süreçlerine dönüşmüş olabilir.[6]
Her iki durumda da, simbiyotik bitki-mantar etkileşiminin, mantarların bitkiden besinleri aldığı bir ilişkiden, bitki ve mantarların besin alışverişinde bulundukları bir simbiyotik ilişkiye dönüştüğü düşünülmektedir.
Moleküler kanıt
Mikorizal simbiyoza olan ilginin artması ve karmaşık moleküler tekniklerin geliştirilmesi, genetik kanıtların hızla gelişmesine yol açmıştır. Wang et al. (2010), düzen ile iletişimde yer alan bitki genlerini araştırdı. Glomales mantar ortakları (DMI1, DMI3, IPD3).[8][9] Bu üç gen, modern kara bitkilerinin tüm ana sınıflarından sıralanabilir. ciğerotları, en temel grup ve üç genin filogenisi, o zamanki kara bitki filogenileriyle aynı fikirde olduğunu kanıtladı. Bu, mikorizal genlerin kara bitkilerinin ortak atasında mevcut olması gerektiği ve bitkiler karada kolonileştiğinden beri dikey olarak miras alınmış olmaları gerektiği anlamına gelir.[8]
AM mantarları ve siyanobakteri ortakyaşamı?
AM mantarlarının, muhtemelen simbiyoz ile ilişkili sRNA işleme mekanizmasının bakteri tipi çekirdek enzimine (ribonükleaz III) sahip olduğu ortaya çıkmıştır. yatay gen transferi siyanobakteriyel atadan.[10] AM mantarlarının içindeki bu genetik fosil bulgusu, AM mantarları ile siyanobakteriyel atalar arasındaki yakın ilişki hipotezini gündeme getiriyor. Aynı zamanda, Geosiphon-Nostoc simbiyozu daha önce rapor edilmişti.[11]
AM mantarlarında sirkadiyen saat evrimi?
Şaşırtıcı bir şekilde, ortamı ışıktan veya sıcaklık dalgalanmasından uzak olan bitki kökünün yeraltı ortağı olarak uzun süredir evrimleşmelerine rağmen, AMF, fungal sirkadiyen osilatörün aktivasyonu ile sirkadiyen saati hala korumuştur.frq) mavi ışıkla, sirkadiyen mantar modeline benzer şekilde Neurospora crassa.[12] Sirkadiyen saatin ve çıktı genlerinin kanıtlanmış korunumu R. düzensiz AM simbiyozunun mantar partnerinde sirkadiyen saatler çalışmasının kapısını açar. Karakteristik AMF frq aynı araştırma ile gen [12] İlk mi frq Dikarya dış grubunu tanımlayan gen frq mantar alemindeki gen evrimi, daha önce araştırılandan çok daha eskidir.
Fizyoloji
Presimbiyoz
Presimbiyoz olarak bilinen kök kolonizasyonundan önce AM mantarlarının gelişimi üç aşamadan oluşur: spor çimlenmesi, hif büyümesi, konak tanıma ve apressorium oluşumu.
Spor çimlenmesi
AM mantar sporları, kalın duvarlı çok çekirdekli dinlenme yapılardır.[14] Sporlar bitki yokluğunda deneysel koşullar altında filizlendiğinden, sporun çimlenmesi bitkiye bağlı değildir. laboratuvar ortamında ve toprakta. Bununla birlikte, çimlenme oranı konakçı kökü ile artırılabilir Eksüdalar.[15] Toprak matriksi, sıcaklık, karbondioksit konsantrasyonu, pH ve fosfor konsantrasyonunun uygun koşulları verildiğinde AM mantar sporları filizlenir.[14]
Hif büyümesi
AM'nin büyümesi hif toprak yoluyla, olarak bilinen konakçı kök sızıntıları tarafından kontrol edilir. Strigolaktonlar ve toprak fosfor konsantrasyonu.[16]Topraktaki düşük fosfor konsantrasyonları, hif büyümesini ve dallanmayı artırmanın yanı sıra, hif dallanma yoğunluğunu kontrol eden bileşiklerin bitkiden dışarı sızmasına neden olur.[15][17]
1 mM'lik fosfor ortamında büyüyen AM mantar hiphalarının dallanması önemli ölçüde azalmıştır, ancak germ tüpünün uzunluğu ve toplam hif büyümesi etkilenmemiştir. 10 mM fosfor konsantrasyonu hem hif büyümesini hem de dallanmayı inhibe etti. Bu fosfor konsantrasyonu, doğal toprak koşullarında oluşur ve bu nedenle mikorizal kolonizasyonun azalmasına katkıda bulunabilir.[17]
Ev sahibi tanıma
Fosforlu ve fosforsuz sıvı bir ortamda büyütülen AMF konakçı bitkilerden kök salgılarının, hif büyümesini etkilediği gösterilmiştir. Sporları Gigaspora margarita konakçı bitki sızıntılarında büyütüldü. Fosfordan yoksun köklerden gelen eksüdalarda yetişen mantar hifleri, yeterli fosfor verilen bitkilerden eksüdalarda yetişenlere kıyasla daha fazla büyüdü ve üçüncül dallar üretti. Büyümeyi destekleyen kök sızıntıları düşük konsantrasyonda eklendiğinde, AM mantarları dağınık uzun dallar üretti. Eksüdaların konsantrasyonu arttıkça, mantarlar daha sıkı kümelenmiş dallar üretti. En yüksek konsantrasyonlu arbusullarda, fosfor değişiminin AMF yapıları oluştu.[17]
Konakçı bitkilerin sızıntılarına verilen bu kemotaksik mantar tepkisinin, düşük fosforlu topraklarda konakçı kök kolonizasyonunun etkinliğini arttırdığı düşünülmektedir.[15] Mantarların uygun bir bitki konakçı bulmak için toprağı verimli bir şekilde keşfetmesi için bir uyarlamadır.[17]
Arbusküler mikorizal mantarların konakçıya özgü sergilediğine dair daha fazla kanıt kemotaksis, potansiyel bir konakçı bitkinin köklerine doğru hif büyümesini mümkün kılan sporlar: Glomus mosseae konakçı bitkinin, konakçı olmayan bitkilerin ve ölü konakçı bitkinin köklerinden sadece hiphaya geçirgen bir zarla ayrıldı. Konakçı bitki ile yapılan muamelede, mantarlar zarı geçti ve her zaman kökün 800 um içinde ortaya çıktı, ancak konakçı olmayan bitkiler ve ölü bitkilerle yapılan muamelelerde değil.[18]
Moleküler teknikler, arbusküler mikorizalar ve bitki kökleri arasındaki sinyal yollarını anlamak için kullanılmıştır. 2003 yılında AM'nin kolonileştirmek için potansiyel konakçı bitki köklerinden eksüdaların varlığında nasıl fizyolojik değişikliklere uğradığı gösterildi. Konakçı bitki kökü eksüdaları, spor karbon bileşiklerinin solunumu için gerekli olan AM mantar genlerini tetikler ve açar. Deneylerde, 10 genin transkripsiyon hızı, maruziyetten yarım saat sonra ve 1 saat sonra daha da yüksek bir oranda arttı. 4 saat maruz kaldıktan sonra AM, morfolojik büyüme ile yanıt verir. O zamandan izole edilen genler, mitokondriyal aktiviteye ve enzim üretimine dahil olur. O ile ölçülen mantar solunum hızı2 Tüketim oranı, kök salgılarına maruz kaldıktan 3 saat sonra% 30 artmıştır, bu da konakçı bitki kökü sızıntılarının AMF spor mitokondriyal aktivitesini uyardığını göstermektedir. Etkili büyüme için spor enerjisini ve potansiyel bir konakçı bitkiden sinyalleri aldıktan sonra hif dallanmasını koruyan bir mantar düzenleme mekanizmasının parçası olabilir.[19]
Appressorium
Arbusküler mikorizal mantar hiphaları, bir konakçı bitkinin kökü ile karşılaştığında, apressorium veya kök epidermisinde "enfeksiyon yapısı" oluşur. Bu yapıdan hifler konağın içine girebilir. parankim korteks.[20] AM, apressoria'yı oluşturmak için bitkiden kimyasal sinyale ihtiyaç duymaz. AM mantarları, "hayalet" hücrelerin hücre duvarlarında bir görüntü oluşturabilir. protoplast mantarlar ve bitki konakçı arasındaki sinyali ortadan kaldırmak için kaldırılmıştır. Bununla birlikte, hif, hücrelere daha fazla nüfuz etmedi ve kök korteksine doğru büyümedi, bu da, apressoria oluştuktan sonra daha fazla büyüme için simbiyotlar arasında sinyalin gerekli olduğunu gösterir.[15]
Ortak yaşam
Mantar, parankimin içine girdikten sonra, adı verilen bitki ile besin alışverişi için oldukça dallı yapılar oluşturur. arbuscules.[20] Bunlar, arbusküler mikorizal mantarın ayırt edici yapılarıdır. Arbuscüller, fosfor, karbon, su ve diğer besin maddelerinin değişim bölgeleridir.[14] İki form vardır: Paris tip büyümesi ile karakterizedir hif bir hücreden diğerine; ve Arum tip bitki hücreleri arasındaki boşlukta hiflerin büyümesi ile karakterizedir.[21] Arasında seçim Paris yazın ve Arum tür, esas olarak ev sahibi bitki ailesi tarafından belirlenir, ancak bazı aileler veya türler her iki türü de yapabilir.[22][23]
Konakçı bitki, hücreler arası hif proliferasyonu ve kavisli oluşum üzerinde bir kontrol uygular. Bitkinin yoğunlaşması var. kromatin bitkinin artan transkripsiyonunu gösterir. DNA arbuscule içeren hücrelerde.[20] Arbusulleri barındırmak için bitki konak hücresinde büyük modifikasyonlar gereklidir. boşluklar küçültmek ve diğer hücresel organeller çoğalmak. Bitki hücresi hücre iskeleti arbusküller etrafında yeniden düzenlenir.
Kolonize edilmiş konakçı bitki kökünden kaynaklanan diğer iki tür hif vardır. Kolonizasyon gerçekleştiğinde, kısa ömürlü koşucu hifleri bitki kökünden toprağa doğru büyür. Bunlar, bitkiye verilen fosfor ve mikro besinleri alan hiflerdir. AM mantar hifleri, yüksek bir yüzey-hacim oranına sahiptir ve bu da, soğurma yeteneklerini bitki köklerinden daha büyük kılar.[24] AMF hifleri ayrıca köklerden daha incedir ve köklere erişilemeyen toprağın gözeneklerine girebilir.[25] Dördüncü tip AMF hifleri köklerden büyür ve diğer konakçı bitki köklerini kolonize eder. Dört tür hif morfolojik olarak farklıdır.[14]
Besin alımı ve değişimi
AM mantarları zorunlu ortakyaşamlar. Sınırlı saprobik yeteneği ve karbon beslenmesi için bitkiye bağlıdır.[26] AM mantarları, bitki ev sahibinin fotosentezinin ürünlerini şu şekilde alır: altıgenler.
Bitkiden mantarlara karbon transferi, arbusküller veya intraradikal hiphalar yoluyla gerçekleşebilir.[27] AM tarafından heksozlardan ikincil sentez intraradikalde meydana gelir. miselyum. Miselyumun içinde heksoz, Trehaloz ve glikojen. Trehaloz ve glikojen, hızla sentezlenebilen ve parçalanabilen ve hücre içi şeker konsantrasyonlarını tamponlayabilen karbon depolama formlarıdır.[27] Intraradikal heksoz oksidatife girer pentoz fosfat yolu üreten pentoz nükleik asitler için.
Lipid biyosentez ayrıca intraradikal miselyumda meydana gelir. Lipidler daha sonra depolanır veya depolanabilecekleri veya metabolize edilebilecekleri ekstra radikal hiflere aktarılır. Lipitlerin heksozlara parçalanması. glukoneogenez, ekstraradikal miselyumda oluşur.[27] Bitkiden mantarlara taşınan karbonun yaklaşık% 25'i ekstra radikal hipalarda depolanır.[28] Konakçı bitkinin karbonunun% 20'ye kadarı AM mantarlarına aktarılabilir.[27] Bu, ev sahibi fabrikanın önemli karbon yatırımını temsil etmektedir. mikorizal ağ yer altı organik karbon havuzuna katkı.
Bitkinin AM mantarlarına karbon tedarikini artırmak, fosfor alımını ve mantarlardan bitkiye transferini artırır. [29] Aynı şekilde, fosfor alımı ve transferi azaltılır. fotosentat mantarlara verilen miktar azalır. AMF türleri, bitkiye fosfor sağlama yeteneklerinde farklılık gösterir.[30] Bazı durumlarda, arbusküler mikorizalar, nispeten yüksek miktarda karbon alırken çok az fosfor sağlayan zayıf simbiyotlardır.[30]
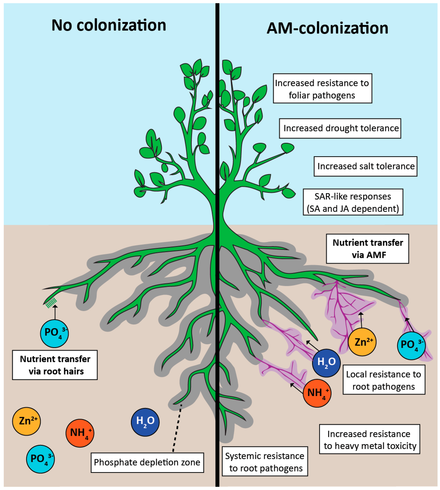
Mikorizaların bitkiler üzerindeki ana faydası, özellikle fosfor olmak üzere besin maddelerinin alımının artmasına bağlanmıştır. Bunun nedeni toprakla temas halinde artan yüzey alanı, besin maddelerinin mikorizaya artan hareketi, değiştirilmiş bir kök ortamı ve artan depolama olabilir.[25] Mikorizalar fosfor alımında bitki köklerinden çok daha verimli olabilir. Fosfor köke veya difüzyon yoluyla hareket eder ve hif, difüzyon için gereken mesafeyi azaltır, böylece alımı artırır. Mikorizaya akan fosfor oranı, kök tüylerinin altı katına kadar çıkabilir.[25] Bazı durumlarda, fosfor alımının rolü tamamen mikorizal ağ tarafından üstlenilebilir ve bitkinin tüm fosforu hif kökenli olabilir.[30] Rolü hakkında daha az şey biliniyor arbusküler mikorizal sistemde nitrojen beslenmesi ve ortakyaşam ve topluluk üzerindeki etkisi. Bu karmaşık etkileşimin mekanizmalarının aydınlatılmasında önemli ilerlemeler kaydedilmiş olsa da, yapılacak daha çok araştırma bulunmaktadır.
Mikorizal aktivite, içinde bulunan fosfor konsantrasyonunu artırır. rizosfer. Mycorrhizae kök bölgesini düşürür pH NH'nin seçici alımı ile4+ (amonyum -ions) ve H'yi serbest bırakarak+ iyonlar. Azalan toprak pH'ı, fosfor çökeltilerinin çözünürlüğünü artırır. Hifal NH4+ alımı da artırır azot Toprağın iç yüzeyleri amonyumu emip difüzyon yoluyla dağıtırken bitkiye akar.[28]
Ekoloji
Biyocoğrafya
Arbusküler mikorizal mantarlar, mineral topraklarda büyüyen bitkilerde en sık görülür ve besin maddesi eksikliği olan substratlarda büyüyen bitkiler için son derece önemlidir. volkanik toprak ve kumul ortamları. AM mantar popülasyonları, yüksek çeşitliliğe sahip bitki topluluklarında en yüksektir. tropikal yağmur ormanları ve birçok potansiyel konakçı bitkiye sahip oldukları ve geniş bir konakçı yelpazesini kolonileştirme yeteneklerinden yararlanabilecekleri ılıman otlaklar.[31] Çok kurak veya besin açısından zengin topraklarda daha düşük bir mikorizal kolonizasyon insidansı vardır. Mikorizalar, su habitatları; bununla birlikte, su ile tıkanmış toprakların bazı türlerde kolonizasyonu azalttığı gösterilmiştir.[31]Arbuscular mikorizal mantarlar bitki türlerinin% 80'inde bulunur [32] ve Antarktika hariç tüm kıtalarda incelendi.[33][34] Biyocoğrafyası glomeromycota dağılma sınırlamasından etkilenir,[35] iklim gibi çevresel faktörler,[33] toprak serisi ve toprak pH'ı,[34] toprak besinleri [36] ve bitki topluluğu.[33][37] 2000 yılına ait kanıtlar, AM mantarlarının konakçı türleri konusunda uzman olmadığını öne sürse de,[38] 2002 yılı itibariyle yapılan çalışmalar, en azından bazı mantar taksonlarının ev sahibi uzmanlar olduğunu göstermiştir.[39]
Bitki topluluklarına tepki
Mikorizal mantarların özgüllüğü, konakçı aralığı ve kolonizasyon derecesi, bir kök ve sistem içindeki mantarlar arasındaki etkileşimlerin karmaşıklığı nedeniyle sahada analiz etmek zordur. Arbusküler mikorizal mantarların, mantar gibi potansiyel AM konakçı bitki türlerinin kolonizasyonu için özgüllük sergilediğini gösteren net bir kanıt yoktur. patojenler ev sahibi bitkileri için.[31] Bu, ilgili zıt seçici basınçtan kaynaklanıyor olabilir.
Patojenik ilişkilerde, konakçı bitki kolonizasyonu engelleyen mutasyonlardan yararlanırken, karşılıklı bir simbiyotik ilişkide bitki, AMF tarafından kolonizasyona izin veren mutasyondan yararlanır.[31] Bununla birlikte, bitki türleri, belirli AM mantarlarının kolonizasyonunun kapsamı ve bağımlılığı bakımından farklılık gösterir ve bazı bitkiler isteğe bağlı olabilir. mikotroflar diğerleri zorunlu mikotroflar olabilir.[31] Son zamanlarda mikorizal durum, bitki dağılımlarıyla ilişkilendirildi,[40] zorunlu mikorizal bitkiler daha sıcak ve daha kuru habitatları işgal ederken, fakültatif mikorizal bitkiler daha geniş habitat aralıklarını işgal eder.
Aynı AM mantarlarının birçok bitki türünü kolonileştirme kabiliyetinin ekolojik sonuçları vardır. Farklı türlerin bitkileri yeraltında ortak bir miselyal ağa bağlanabilir.[31] Bir bitki, farklı türlerden başka bir bitkinin mineral alımı için kullanabileceği miselyal ağın kurulması için fotosentat karbonu sağlayabilir. Bu, arbusküler mikorizaların yer altı içi ve türler arası bitki etkileşimlerini dengeleyebildiğini gösterir.[31]
Glomeromycota mantarları bitki köklerinin içinde yaşadıkları için, bitki konakçılarından önemli ölçüde etkilenebilir ve karşılığında bitki topluluklarını da etkiler. Bitkiler, fotosentat karbonlarının% 30'unu AM mantarlarına tahsis edebilir. [41] ve karşılığında AM mantarları bitki fosforunun ve nitrojenin% 80'ine kadarını elde edebilir.[32] AM mantar topluluklarının çeşitliliği, bitki çeşitliliği ile olumlu bir şekilde ilişkilendirilmiştir.[42] bitki verimliliği[43] ve otçul.[44] Arbusküler mikorizal mantarlar, yerel bitki topluluğu ile küçük ölçekli etkileşimlerden etkilenebilir. Örneğin, bir fokal bitkinin etrafındaki bitki mahallesi AM mantar topluluklarını değiştirebilir.[45] sahalarda fabrika kurulum sırası gibi.[46]
AM mantarları ve bitki istilası
Bitki türlerinin istilası sırasında, AM mantar topluluğu ve biyokütle büyük ölçüde değiştirilebilir. Vakaların çoğunda AM mantar biyokütlesi ve çeşitliliği istilalarla azalır.[47][48][49] Bununla birlikte, bazı mikotrofik bitki türleri, istila sırasında AM mantar çeşitliliğini gerçekten artırabilir.[50]
İstilacı bitki türlerinin mikorizal durumu genellikle bölgeler arasında değişiklik gösterir. Örneğin, Birleşik Krallık ve Orta Avrupa'da son zamanlarda istilacı bitkiler beklenenden daha sık zorunlu olarak mikorizaldir,[40][51] Kaliforniya'daki istilacı bitkilerin ise beklenenden daha az mikorizal olduğu bulunmuştur.[52]
AM mantarları ve diğer bitki simbiyotları arasındaki etkileşimler
Bir bitki konakçı içindeki tüm ortakyaşamlar, genellikle tahmin edilemeyen şekillerde etkileşime girer. Bir 2010 meta-analizi, hem AM mantarları hem de dikey olarak iletilen endofitler tarafından kolonize edilen bitkilerin, genellikle bu ortakyaşarlar tarafından bağımsız olarak kolonize edilen bitkilerden daha büyük olduğunu gösterdi.[53] Bununla birlikte, bu ilişki içeriğe bağlıdır çünkü AM mantarları, konakçı bitkisinin yapraklarında yaşayan mantar endofitleri ile sinerjik olarak etkileşime girebilir.[54][55] veya düşmanca.[56][57][58] AM mantarları arasında benzer etkileşim aralıkları oluşabilir ve ektomikorizal mantarlar ve koyu bölmeli endofitler.[59]
Çevresel gradyanlara tepki
Arbusküler mikorizal mantarlar birçok çevresel gradyanlar. Donma ve kurumaya toleranslarının AM mantar taksonları arasında değiştiği bilinmektedir.[60] AM mantarları daha yüksek toprak besin maddesi ve nem konsantrasyonlarında daha az yaygın ve çeşitli hale gelir,[61] Muhtemelen her iki bitkinin de AM mantarlarına daha az karbon tahsis etmesi ve AM mantarlarının kaynaklarını bu çevresel koşullarda intraradikal hiflere yeniden tahsis etmesi nedeniyle.[62] Uzun vadede, bu çevresel koşullar, bitki konakçıları, AM mantarları ve yerel toprak besin konsantrasyonları arasında yerel adaptasyon yaratabilir.[63] AM bileşimi, genellikle bitki türlerinin bileşimi tarafından yönlendirilen dağ tepelerinde, alçak rakımlara göre daha az çeşitlilik gösterir.[64]
AM mantarlarının, abiyotik çevresel faktörlere karşı bitki toleransını iyileştirdiği gösterilmiştir. tuzluluk. Tuz stresini azaltır ve bitki büyümesi ve üretkenliğine fayda sağlar.[65]
Rizosfer ekolojisi
rizosfer bir kök sisteminin hemen yakınındaki toprak bölgesidir.
Arbuscular mikorizal simbiyoz, topraktaki diğer organizmaların topluluğunu ve çeşitliliğini etkiler. Bu, doğrudan eksüdaların salınmasıyla veya dolaylı olarak bitki türlerindeki ve bitki eksüdalarının türü ve miktarındaki bir değişiklikle görülebilir.[66]
Mikoriza çeşitliliğinin, potansiyel birliktelik sayısı arttıkça bitki türü çeşitliliğini artırdığı gösterilmiştir. Baskın arbusküler mikorizal mantarlar, mikorizal olmayan bitkilerin simbiyoz oluşturdukları topraklarda istilasını önleyebilir ve mikorizal konaklarını teşvik edebilir.[67]
Son araştırmalar, AM mantarlarının, tanımlanamayan bir difüzyon faktörü saldığını göstermiştir. myc faktörüetkinleştiren nodülasyon faktörü indüklenebilir gen MtEnod11. Bu, ortakyaşam ile simbiyoz oluşturmada rol oynayan genin aynısıdır. nitrojen sabitleme, rizobiyal bakteriler (Kosuta et al. 2003). Toprakta rizobyum bakterileri bulunduğunda, simbiyoz oluşumunda rol oynayan kimyasal sinyallerin konsantrasyonundaki artışa bağlı olarak mikorizal kolonizasyon artar (Xie et al. 2003). Nod faktörlerine benzer moleküller, AM mantarlarından izole edildi ve MtEnod11'i, lateral kök oluşumunu indüklediği ve mikorlaşmayı arttırdığı gösterildi.[68] Etkili mikorizal kolonizasyon da nodülasyonlar mikorizal baklagillerde simbiyotik nitrojen fiksasyonu.[28]
Arbusküler mikorizal kolonizasyonun ve türlerin kapsamı, rizosferdeki bakteri popülasyonunu etkiler.[69] Bakteriyel türler, karbon bileşiği kök sızıntıları için rekabet etme yeteneklerinde farklılık gösterir. Mevcut AM mikorizal kolonizasyonu nedeniyle kök eksüdalarının ve mantar eksüdalarının miktarında veya bileşiminde meydana gelen bir değişiklik, rizosferdeki bakteri topluluğunun çeşitliliğini ve bolluğunu belirler.[66]
AM mantarlarının bitki kökü ve sürgün büyümesi üzerindeki etkisi, rizosfer bakterileri üzerinde de dolaylı etkiye sahip olabilir. AMF, hif ağının büyümesi ve dejenerasyonu yoluyla rizosfere önemli miktarda karbon katkıda bulunur. AM mantarlarının bitki türlerinin rizosferin bakteriyel bileşimi üzerindeki spesifik etkisine aracılık etmede önemli bir rol oynayabileceğini gösteren kanıtlar da vardır.[66]
Glomeromycota ve küresel iklim değişikliği
Küresel iklim değişikliği, AM mantar topluluklarını ve AM mantarları ile bitki konakçıları arasındaki etkileşimleri etkilemektedir. Organizmalar arasındaki etkileşimlerin küresel iklim değişikliğine tepkilerini etkileyeceği genel olarak kabul edilmekle birlikte, bu etkileşimlerin sonucunu gelecekteki iklimlerde tahmin etme yeteneğimizden yoksundur.[70] Son meta-analizlerde, AM mantarlarının kuraklık koşullarında bitki biyokütlesini artırdığı ve simüle edilmiş nitrojen biriktirme çalışmaları altında bitki biyokütlesini azalttığı bulunmuştur.[71][72] Arbusküler mikorizal mantarların, yüksek atmosferik CO2'ye yanıt olarak biyokütlelerini artırdığı gösterilmiştir. [73]
Arbusküler mikorizadan yoksun bitkiler
Hardal ailesinin üyeleri (Brassicaceae ), örneğin lahana, karnabahar, kanola ve kramp köklerinde arbusküler mikorizal mantar oluşturmayın.[74]
Arbusküler mikorizal mantarların moleküler genetik analizleri
Son on yılda moleküler genetik teknolojiler ve araçlarda olağanüstü ilerlemeler oldu. Bu gelişmeler, mikrobiyal ve mikorizal ekolojistlerin, topluluklarda ve ekosistemlerde bireyler olarak arbusküler mikorizal (AM) mantarların ekolojik ve evrimsel rolleri hakkında yeni ve heyecan verici sorular sormalarına olanak tanır. AM mantarlarının genetik analizleri, multilocus genotipleme kullanılarak tekli sporların genetik yapısını keşfetmek için kullanılmıştır.[75] AM mantar çeşitliliği ve çoklu otlak topluluklarında adaptasyon,[76] Glomeromycota filumunda tanımlanan moleküler çeşitliliği büyük ölçüde artıran AM mantar çeşitliliğinin küresel bir araştırmasına kadar.[77]
Moleküler genetikteki tüm son gelişmeler, mikrobiyal toplulukların çok daha ince ve işlevsel ölçeklerde ve potansiyel olarak önceki yöntemlerden daha fazla güvenle analiz edilmesine açıkça izin vermektedir. Topraktan spor ekstraksiyonunun klasik AM mantar tanımlama yöntemi ve daha fazla spor morfolojik analizi[78] AM mantarlarının çeşitli stratejileri ve biçimleri nedeniyle karmaşık konularla doludur, örneğin, belirli türlerde sporlaşma eksikliği, mevsimsellik, yüksek kültürlenemezlik, olası yanlış tanımlama (insan hatası) ve çok çekirdekli sporların yeni kanıtları[79] ve klonal AM türleri içinde yüksek genetik çeşitlilik.[80] Bu çeşitli problemler nedeniyle, geçmişte araştırmacılar muhtemelen herhangi bir noktada veya yerde mevcut olan AM mantar topluluklarının gerçek bileşimini yanlış temsil etmişlerdir. Ek olarak, geleneksel ekstraksiyon, kültür ve mikroskobik tanımlama yöntemlerini izleyerek, bitki-AM simbiyotik etkileşimleri ve mekanizmalarını ekolojik veya ekosistem işleviyle ilişkilendirmeye çalışırken muhtemelen en önemli olan aktif / işleyen AM mantar popülasyonlarını belirlemenin bir yolu yoktur. Bu, özellikle AM mantarları tarafından kolonize edilmiş köklerin yüzdesini belirleyebilen kök kolonizasyon analizleri için geçerlidir. Bu analizle ilgili en büyük sorun, aynı anda bir hedef bitki ile ilişkili olarak birden fazla AM mantar türü içeren tarla topraklarındadır (bkz. Ekoloji AM). İlişkili mantar simbiyontlarının tanımlanması, moleküler yöntemler kullanılmadan imkansızdır. AM mantar topluluklarının genetik analizi, son on yılda çok fazla ilerleme kaydetmiş olsa da, metodoloji henüz tam olarak rafine edilmemiştir. Aşağıda, AM mantarlarının moleküler genetik analizlerinde kullanılan yöntemlerin yanı sıra araştırma uygulamaları, gelecekteki yönler ve bazı problemlerine genel bir bakış bulunmaktadır.
Yöntemlere genel bakış
DNA / RNA
Topraktan ve kök örneklerinden elde edilen AM mantarlarının genetik analizleri, ekolojik veya filogenetik soruları yanıtlamak için uygulanabilirlikleri açısından farklılık gösterir. DNA analizleri, AM mantarlarını tanımlamak için çeşitli nükleer belirteçler kullanır ve nükleerin farklı bölgelerini temsil eder. ribozomal operon (18S rRNA ) tüm ökaryotik organizmalarda bulunur. Bu belirteçleri kullanan AM mantarlarının DNA analizi 1990'ların başında başladı.[81] ve bugün geliştirilmeye devam edilmektedir. Küçük alt birim (SSU) rRNA geni, dahili kopyalanmış aralayıcı (ONUN ) geni ve büyük alt birim (LSU) rRNA geni şu anda kullanılan en yaygın DNA belirteçleridir. SSU bölgesi ekolojik çalışmalarda en sık kullanılmıştır,[82] ITS ve LSU bölgeleri ise ağırlıklı olarak Glomeromycota filumunun taksonomik yapılarında kullanılmıştır.[83]
Genel prosedür
Tüm moleküler genetik analizlerin ilk adımı, bir numunenin hazırlanması ve / veya korunmasıdır. AM mantarları söz konusu olduğunda, örnekler tipik olarak AM sporları, hifler ve / veya çeşitli AM kolonizasyon yapılarını içerecek toprak veya kökler şeklinde gelir. Numunenin korunması istenen analize (DNA veya RNA) bağlı olarak değişecektir. DNA analizi için, numuneler ya hemen işlenmeli ya da nükleik asit ekstraksiyonundan önce dondurulmalıdır. RNA analizi için örnekler kriyojenik olarak dondurulmuş (-196 ° C) toplandıktan hemen sonra veya bir RNA stabilizasyonu ve koruma reaktifinde (örn. RNAlater) saklanır. Bir sonraki adım, istenen nükleik asitleri numuneden ekstrakte etmektir; bu, çeşitli yayınlanmış ekstraksiyon yöntemleri kullanılarak veya ticari olarak temin edilebilen birçok DNA / RNA ekstraksiyon kitinden biri kullanılarak manuel olarak gerçekleştirilebilir. RNA'nın kararsız doğası nedeniyle, tamamlayıcı DNA sentezi (cDNA ) bir şablon olarak ekstrakte edilmiş RNA kullanılarak daha fazla analiz için gerçekleştirilir. AM mantarlarının moleküler genetik sıralama yöntemlerinin çoğu için, hedef DNA / RNA / cDNA'nın toplam miktarını artırmak için bir PCR adımı gereklidir. AM mantarlarının analizi için önerilen birçok PCR koşulu vardır ve en erişilebilir olanlardan bazıları aşağıda kısaca özetlenmiştir.
PCR yöntemleri
Öpik ve ark. 2009:[84]
- Reaksiyon karışımı:
- 20 ul Qiagen HotStarTaq Ana karışım
- Her bir primerden 0.23 μM (NS31 ve AM1, aşağıdaki AM mantarına özgü primerler hakkında daha fazla bilgi)
- 2 ul şablon DNA
- PCR:
- Bir MWG AG Biotech Primus 96 Plus termocycler üzerinde çalıştırın
- 99 ° C'de 15 dakika
- 42 ° C'de 30 saniyelik 5 döngü
- 72 ° C'de 60 saniye
- 92 ° C'de 45 saniye
- 65 ° C'de 30 saniyelik 35 döngü
- 72 ° C'de 60 saniye
- 92 ° C'de 45 saniye
- 65 ° C'de 30 saniye
- 72 ° C'de 10 dakika
- PCR ürünleri daha sonra aşağıdakilerle ayrılır: jel elektroforezi 0.5 x% 1.5 agaroz jelde TBE
- Ayrılan PCR ürünleri daha sonra Qiagen QIAquick Jel Ekstraksiyon kiti kullanılarak saflaştırıldı
Krüger ve ark. 2009:[85]
- Reaksiyon karışımı:
- 0,02 U ul−1 Füzyon polimeraz
- 1.5 mM MgCl ile 1X Phüzyon tamponu2
- Her dNTP'den 200 μM
- Her primerden 0,5 μM: SSUmAf-LSUmAr ve SSUmCf-LSUmBr
- PCR:
- Termal döngü bir Eppendorf Mastercycler Gradient'de yapıldı
- 99 ° C'de 5 dakikalık ilk denatürasyon
- 99 ° C'de 40 döngü 10 saniyelik denatürasyon
- 60 ° C'de 30 saniye tavlama
- 72 ° C'de 1 dakika uzama
- 10 dakikalık son uzama
- PCR ürününü görselleştirmek için% 1 üzerine yükleyinagaroz jel 220 V'ta 1x sodyum borat tamponu ile ve etidyum bromür (1 μg ml−1)
Arbusküler mikorizal mantarlar için primer seçimi
Arbusküler mikorizal mantarların genetik analiziyle ilgili bir zorluk, ideal, kapsamlı ve tekrarlanabilir primerler veya primer setlerinin seçilmesidir.[86] Şu anda, ideal olarak tür düzeyinde tanımlama için bir örnekteki AM mantar topluluklarını tanımlamak için genetik dizilemede kullanılan dört yaygın AM mantar spesifik belirteç / primer bulunmaktadır. Bu sekans markörleri, 18S bölgesindeki nükleer ribozomal RNA (rRNA) için tasarlanmıştır ve tek tek veya bazı kombinasyonlarda kullanılır.[87] Kısmi küçük alt birim (SSU), kısmi büyük alt birim (LSU) ve dahili kopyalanmış aralayıcı (ITS1, 5.8S, ITS2), AMF'nin genetik dizilemesi için kullanılan bölgelerdir. Additionally, there are 'primer sets' that incorporate a combination of these different regions into one target primer for AMF, these include the "Krüger[85] " and the "Redecker[88]" primers. The "Krüger" primer utilizes the partial SSU, the ITS, and the partial LSU regions, while the "Redecker" primer utilizes the partial SSU and the ITS.
Currently, there is no consensus as to which primers or primer sets, being used with varying degrees of success, repeatability and species-level resolution, are best for molecular genetic analysis of AMF. Additionally, the current advances and coming changes in genetic sequencing technology, e.g. Sanger, to 454 Pyrosequencing, için Illumina HiSeq/MiSeq, can force researchers to only use certain primers. The large size of the "Krüger" (~1500bp) and "Redecker" (~900bp) primer sets prohibit use with newer sequencing technology (e.g. Illumina MiSeq) as opposed to 454 pyrosequencing that is capable of these long read lengths. Though Roche Diagnostics has announced the discontinuation of the 454 platform for 2016,[89] it is still commonly used in genetic analyses. Perhaps new 'all-inclusive' AM specific primers should be created to support the new technologies for as descriptive a molecular analysis from the "Kruger" primer set using 454 pyrosqeuncing, as shown below. The reverse may also be true, where molecular technologies should be developed with both long read lengths (which would allow for large primer sets) as well as sequencing depth.
Kohout et al.[86] present a study using all of the aforementioned primers/primer sets on identical plant samples using 454 sequencing analysis. Results of their experiment are summarized below.
- "Kruger" primers yielded relatively higher diversity parameters than other comparable primers (LSU, ITS2)
- "Kruger" primers showed significantly higher Shannon diversity measures than did SSU primer
- "Redecker" primers yielded the most different, but maybe most descriptive community composition of all primers tested. This may be explained by the ability of the "Redecker" primers to find less abundant AMF lineages such as the Claroideoglomeraceae or the Paraglomeraceae
- LSU primers had a strong bias towards Glomeraceae, excluding other families
- SSU primers had a bias towards Glomeraceae and underestimated the presence of different families within the Glomeromycota, including the Claroideoglomeraceae, Diversisporaceae and Paraglomeraceae
| Aile | MOTUs from SSU | MOTUs from LSU | MOTUs from ITS2 | MOTUs from "Kruger" | MOTUs from "Redecker" |
|---|---|---|---|---|---|
| Glomeraceae | 14 | 19 | 17 | 21 | 8 |
| Claroideoglomeraceae | 1 | 2 | 2 | 3 | 5 |
| Archaeosporales | 1 | 1 | 1 | 1 | 2 |
| Diversisporaceae | 1 | 0 | 2 | 3 | 2 |
| Paraglomeraceae | 0 | 0 | 0 | 0 | 2 |
| Acaulosproraceae | 0 | 0 | 1 | 1 | 1 |
MOTU = Molecular operational taxonomic unit, synonymous with OTU or phylotype.
qPCR and qRT-PCR
Real-time PCR or quantitative PCR (qPCR), is becoming a well-established method to quickly amplify and simultaneously quantify targeted AM fungal DNA from biological samples (plant roots or soils). Fairly recent developments in qPCR markers allow researchers to explore the relative abundance of AM fungal species within roots in greenhouse experiments as well as in the field to identify local AM fungal communities.
qPCR markers for arbuscular mycorrhizal fungi will consist of AM specific primers and fluorescently labeled hydrolysis probes. These AM specific primers (discussed above) can be chosen by the researcher and this decision is typically guided by the question at hand, resources available, and willingness to troubleshoot in the lab.
Mikroarray
DNA mikrodizi analysis is currently being used in AM fungal research to simultaneously measure the expression of many genes from target species or experimental samples. The most common tool or method is to use functional gene array (FGA) technology, a specialized microarray that contains probes for genes that are functionally important in microbial processes such as carbon, nitrogen or phosphorus cycling. FGAs have the ability to simultaneously examine many functional genes.[90] This technique is typically used for general analysis of functional microbial genes, but when complemented with genetic sequencing, inferences can be made about the connection between fungal community composition and microbial functionality.
PLFA /NLFA
Specific organismal chemical signatures can be used to detect biomass of more cryptic organisms, such as AM fungi or soil bacteria. Lipids, more specifically phospholipids and neutral lipids, contain fatty acids connected to a glycerol backbone. The fatty acid composition of organisms varies, and the proportions of specific fatty acids can be organism specific. For example, in AM fungi the proportion of the fatty acids, 16:1ω5 and 18:1ω7, in the phospholipid portion account for approximately 58% of total fatty acid composition.[91] The fatty acid, 16:1ω5 is the most commonly used acid to characterize AM fungi in soils and can be used as a strong indicator of mycelial biomass in soil sample.[91]
Neutral lipid fatty acid analysis of AM fungi is typically looked upon as a method to indicate energy storage, but most importantly, the ratio of NLFA (16:1ω5) to PLFA (16:1ω5) can potentially be used to indicate nutritional status of AM fungi in soils. Energy is mainly stored in AM fungi as neutral lipids in storage structures like spores and vesicles. Because of this NLFA correlates quite well with the number of spores in a given volume of soil.[91] The ratio of NLFA concentration to PLFA concentration (active mycelia) can then give the proportion of carbon allocated to storage structures (spores, measured as NLFA).
Problems with lipid fatty acid analyses include the incomplete specificity of fatty acids to AM fungi, the species- or genera-specific variation in fatty acid composition can complicate analysis in systems with multiple AM fungal species (e.g. field soil), the high background levels of certain fatty acid concentration in soils, and that phospholipids are correlated to an organism's membrane area, and the surface to volume ratio can vary widely between organisms such as bacteria and fungi.[92] More work must be done to identify the efficacy of this method in field soils with many genera and species of AM fungi to discern the methods ability to discriminate between many varying fatty acid compositions.
Future research directions with AM fungi
An exciting prospect for future analysis of AM fungi is the use of stable isotope probes. Stable isotope probing (Yudumlamak ) is a technique that can be used to determine the active metabolic function of individual taxa within a complex system of microbes. This level of specificity, linking microbial function and phylogenetics, has not been achieved previously in microbial ecology. This method can also be used independently of classical culture methods in microbial ecology, allowing for yerinde analysis of functional microbes. Application of sequencing of single nucleus from spores of AM fungi has also been developed recently and also circumvents the need of culture methods.[93]
Stable Isotope Probing (SIP)
SIP, more explicitly DNA/RNA-based SIP, uses stable-isotope enriched substrates, such as 13C, 15N, or H218O, and then analyzes the 'labeled' markers using species specific DNA or RNA markers.[94] The analysis of labeled DNA is performed by separating unlabeled and labeled DNA on a cesium chloride gradient formed in an ultra centrifuge.[95] Because all microbial organisms are capable of importing water into their cells, the use of H218O stable isotope probing is a very exciting new method that can shed light on questions microbial ecologists and biologists have struggled with answering for years, in particular, what are the aktif microbial organisms in my system? H218O, or heavy water method will target all organisms that are actively growing, and induce little influence on growth itself. This would be especially true with most greenhouse experiments with arbuscular mycorrhizas because plants must be watered anyway, and water does not directly select for organisms with specific metabolic pathways,[95] as would happen when using 13C ve15N.
Little has been done with this method in arbuscular mycorrhizal experiments, but if proven to work in a controlled experiment, and with further refinement of DNA/RNA fungal community analyses techniques, this may be a viable option to very specifically determine the actively growing portion of AM fungal species across growing seasons, with different plant hosts or treatments, and in the face of climate change.
sRNA and sRNA processing mechanism to understand AM symbiosis
sRNAs have been reported to take crucial role in the crosstalk between host and symbiont.[96] sRNAs processing mechanism is thus, important for understanding AM symbiosis. It seems that AM fungi have their unique features to have bacterial type core enzyme as well as the large number of Argonaute proteins in their sRNA processing system (or RNAi system).[10] sRNA and sRNA processing mechanism research is also exciting topic to understand AM fungi symbiosis.
Fitoremediasyon
Disturbance of native plant communities in çölleşme -threatened areas is often followed by degradation of physical and biological soil properties, soil structure, nutrient availability, and organic matter. When restoring disturbed land, it is essential to replace not only the above ground vegetation but also biological and physical soil properties.[97]
A relatively new approach to restoring land is to inoculate soil with AM fungi when reintroducing vegetation in ecological restoration projects (phytoremediation). It has enabled host plants to establish themselves on degraded soil and improve soil quality and health.[98] Soils' quality parameters were significantly improved long-term when a mixture of indigenous arbuscular mycorrhizal fungi species was introduced compared to noninoculated soil and soil inoculated with a single exotic species of AM fungi.[97] The benefits were increased plant growth, increased phosphorus uptake [99] and soil nitrogen content, higher organik maddelerden toprak content, and soil aggregation, attributed to higher legume nodulation in the presence of AM fungi, better water infiltration, and soil aeration due to soil aggregation.[97] Native strains of AM fungi enhance the extraction of heavy metal(s) from the polluted soils and make the soil healthy and suitable for crop production.[100]
Tarım
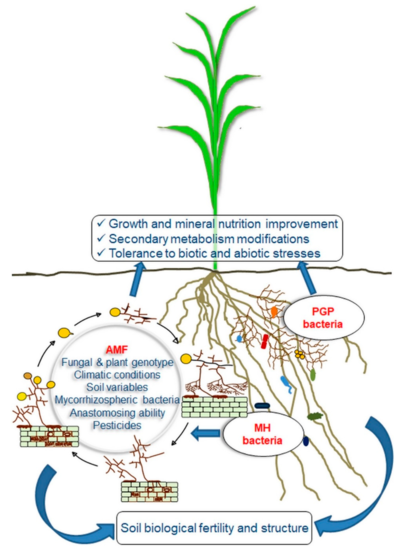
on plant performance and soil fertility
On the right: mycorrhizal helper (MH) and plant growth promoting (PGP) bacteria synergistically interacting with AMF.[101]
Many modern agronomic practices are disruptive to mycorrhizal symbiosis. There is great potential for low-input agriculture to manage the system in a way that promotes mycorrhizal symbiosis.
Conventional agriculture practices, such as toprak işleme, heavy fertilizers and mantar ilaçları, poor crop rotations, and selection for plants that survive these conditions, hinder the ability of plants to form symbiosis with arbuscular mycorrhizal fungi.
Most agricultural crops can perform better and are more productive when well-colonized by AM fungi. AM symbiosis increases the phosphorus and micronutrient uptake and growth of their plant host (George et al. 1992).
Management of AM fungi is especially important for organic and low-input agriculture systems where soil phosphorus is, in general, low, although all Tarım Ekosistemleri can benefit by promoting arbuscular mycorrhizae establishment.
Some crops that are poor at seeking out nutrients in the soil are very dependent on AM fungi for phosphorus uptake. Örneğin, keten, which has poor chemotaxic ability, is highly dependent on AM-mediated phosphorus uptake at low and intermediate soil phosphorus concentrations (Thingstrup et al. 1998).
Proper management of AMF in the agroecosystems can improve the quality of the soil and the productivity of the land. Agricultural practices such as reduced tillage, low phosphorus fertilizer usage, and perennialized cropping systems promote functional mycorrhizal symbiosis.
Toprak işleme
Toprak işleme reduces the inoculation potential of the soil and the efficacy of mycorrhizaes by disrupting the extraradical hyphal network (Miller et al. 1995, McGonigle & Miller 1999, Mozafar et al. 2000).
By breaking apart the soil macro structure, the hyphal network is rendered non-infective (Miller et al. 1995, McGonigle & Miller 1999). The disruption of the hyphal network decreases the absorptive abilities of the mycorrhizae because the surface area spanned by the hyphae is greatly reduced. This, in turn, lowers the phosphorus input to the plants that are connected to the hyphal network (Figure 3, McGonigle & Miller 1999).
In reduced-tillage system, heavy phosphorus fertilizer input may not be required as compared to heavy-tillage systems. This is due to the increase in mycorrhizal network, which allows mycorrhizae to provide the plant with sufficient phosphorus (Miller et al. 1995).
Phosphorus fertilizer
The benefits of AMF are greatest in systems where inputs are low. Heavy usage of phosphorus fertilizer can inhibit mycorrhizal colonization and growth.
As the soil's phosphorus levels available to the plants increases, the amount of phosphorus also increases in the plant's tissues, and carbon drain on the plant by the AM fungi symbiosis become non-beneficial to the plant (Grant 2005).
A decrease in mycorrhizal colonization due to high soil-phosphorus levels can lead to plant deficiencies in other micronutrients that have mycorrhizal-mediated uptake such as copper (Timmer & Leyden 1980).
Perennialized cropping systems
Cover crops are grown in the fall, winter, and spring, covering the soil during periods when it would commonly be left without a cover of growing plants.
Mycorrhizal cover crops can be used to improve the mycorrhizal inoculum potential and hyphal network (Kabir and Koide 2000, Boswell et al.1998, Sorensen et al. 2005).
Since AM fungi are biotrophic, they are dependent on plants for the growth of their hyphal networks. Growing a cover crop extends the time for AM growth into the autumn, winter, and spring. Promotion of hyphal growth creates a more extensive hyphal network. The mycorrhizal colonization increase found in cover crops systems may be largely attributed to an increase in the extraradical hyphal network that can colonize the roots of the new crop (Boswell et al. 1998). The extraradical mycelia are able to survive the winter, providing rapid spring colonization and early season symbiosis (McGonigle and Miller 1999). This early symbiosis allows plants to tap into the well-established hyphal network and be supplied with adequate phosphorus nutrition during early growth, which greatly improves the crop yield.
Toprak kalitesi
Restoration of native AM fungi increases the success of ecological restoration project and the rapidity of soil recovery.[97] AM fungi enhance toprak agrega kararlılığı is due to the production of extraradical hyphae and a soil protein known as glomalin.
Glomalin-related soil proteins (GRSP) have been identified using a monoklonal antikor (Mab32B11) raised against crushed AMF spores. It is defined by its extraction conditions and reaction with the antibody Mab32B11.
There is other circumstantial evidence to show that glomalin is of AM fungal origin. When AM fungi are eliminated from soil through incubation of soil without host plants, the concentration of GRSP declines. A similar decline in GRSP has also been observed in incubated soils from forested, afforested, and agricultural land[102] and grasslands treated with fungicide.[103]
Glomalin is hypothesized to improve soil aggregate water stability and decrease toprak erozyonu. A strong correlation has been found between GRSP and soil aggregate water stability in a wide variety of soils where organic material is the main binding agent, although the mechanism is not known.[103] The protein glomalin has not yet been isolated and described, and the link between glomalin, GRSP, and arbuscular mycorrhizal fungi is not yet clear.[103]
Ayrıca bakınız
- Mikoriza
- Ektomikoriza
- Ericoid mikoriza
- Mycorrhizae and changing climate
- Mycorrhizal fungi and soil carbon storage
- Prototaxites
Referanslar
- ^ Brundrett, M.C. (2002). "Coevolution of roots and mycorrhizas of land plants". Yeni Fitolog. 154 (2): 275–304. doi:10.1046/j.1469-8137.2002.00397.x.
- ^ Barbour, M.G.; Burk, J.H.; Pitts, W.D. (1980). Terrestrial plant ecology. Frontiers in Physics. Benjamin / Cummings Yayıncılık Şirketi. s.118. ISBN 978-0-8053-0540-1.
- ^ a b Simon, L .; Bousquet, J .; Levesque, C.; Lalonde, M. (1993). "Origin and diversification of endomycorrhizal fungi and coincidence with vascular land plants". Doğa. 363 (6424): 67–69. Bibcode:1993Natur.363...67S. doi:10.1038/363067a0. S2CID 4319766.
- ^ Schüßler, A.; et al. (2001). "A new fungal phylum, the Glomeromycota: phylogeny and evolution". Mycol. Res. 105 (12): 1413–1421. doi:10.1017/S0953756201005196.
- ^ Jacott, C.N., Murray, J.D. and Ridout, C.J. (2017) "Trade-offs in arbuscular mycorrhizal symbiosis: disease resistance, growth responses and perspectives for crop breeding". Agronomi, 7(4): 75. doi:10.3390/agronomy7040075.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ a b c d e Remy, W.; Taylor, T.; Hass, H .; Kerp, H. (1994). "Four hundred-million-year-old vesicular arbuscular mycorrhizae". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 91 (25): 11841–11843. Bibcode:1994PNAS...9111841R. doi:10.1073/pnas.91.25.11841. PMC 45331. PMID 11607500.
- ^ Kar, R.K.; Mandaokar, B.D.; Kar, R. (2005). "Mycorrhizal fossil fungi from the Miocene sediments of Mirozam, Northeast India". Güncel Bilim. 89: 257–259.
- ^ a b Wang, B .; Yeun, L.H.; Xue, Y .; Liu, Y .; Ane, J.M.; Qiu, Y.L. (2010). "Presence of three mycorrhizal genes in the common ancestor of land plants suggests a key role of mycorrhizas in the colonization of land by plants". Yeni Fitolog. 186 (2): 514–525. doi:10.1111/j.1469-8137.2009.03137.x. hdl:2027.42/78704. PMID 20059702.
- ^ Ané, JM; et al. (Kasım 2002). "Genetic and cytogenetic mapping of DMI1, DMI2, and DMI3 genes of Medicago truncatula involved in Nod factor transduction, nodulation, and mycorrhization". Moleküler Bitki-Mikrop Etkileşimleri. 15 (11): 1108–18. doi:10.1094/MPMI.2002.15.11.1108. PMID 12423016.
- ^ a b Lee, Soon-Jae; Kong, Mengxuan; Harrison, Paul; Hijri, Mohamed (2018), "Conserved Proteins of the RNA Interference System in the Arbuscular Mycorrhizal Fungus Rhizoglomus irregulare Provide New Insight into the Evolutionary History of Glomeromycota", Genom Biyolojisi ve Evrim, 10 (1): 328–343, doi:10.1093/gbe/evy002, PMC 5786227, PMID 29329439
- ^ Alexopolous C, Mims C, Blackwell M. 2004. Introductory mycology, 4th ed . Hoboken (NJ): John Wiley and Sons.
- ^ a b Lee, SJ., Kong, M., Morse, D. et al. Expression of putative circadian clock components in the arbuscular mycorrhizal fungus Rhizoglomus irregulare. Mycorrhiza (2018) https://doi.org/10.1007/s00572-018-0843-y
- ^ Marleau J, Dalpé Y, St-Arnaud M, Hijri M (2011). "Spore development and nuclear inheritance in arbuscular mycorrhizal fungi". BMC Evrimsel Biyoloji. 11: 51. doi:10.1186/1471-2148-11-51. PMC 3060866. PMID 21349193.CS1 bakimi: birden çok ad: yazarlar listesi (bağlantı)
- ^ a b c d Wright S.F. (2005). "Management of Arbuscular Mycorrhizal Fungi". In R.W. Zobel; S.F. Wright (editörler). Roots and Soil Management: Interactions between roots and the soil. USA: American Society of Agronomy. pp. 183–197.
- ^ a b c d Douds, D.D. and Nagahashi, G. 2000. Signalling and Recognition Events Prior to Colonisation of Roots by Arbuscular Mycorrhizal Fungi. In Current Advances in Mycorrhizae Research. Ed. Podila, G.K., Douds, D.D. Minnesota: APS Press. Pp 11–18.
- ^ Akiyama K; Matsuzaki K; Hayashi H (2005). "Bitki seskiterpenleri, arbusküler mikorizal mantarlarda hif dallanmasına neden olur". Doğa. 435 (7043): 824–827. Bibcode:2005 Natur.435..824A. doi:10.1038 / nature03608. PMID 15944706. S2CID 4343708.
- ^ a b c d Nagahashi, G; Douds, D. D .; Abney, G.D. (1996). "Phosphorus amendment inhibits hyphal branching of VAM fungus Gigaspora margarita directly and indirectly through its effect on root exudation". Mikoriza. 6 (5): 403–408. doi:10.1007/s005720050139. S2CID 36014515.
- ^ Sbrana, C.; Giovannetti, M. (2005). "Chemotropism in the arbuscular mycorrhizal fungus Glomus mosseae". Mikoriza. 15 (7): 539–545. doi:10.1007/s00572-005-0362-5. PMID 16133246. S2CID 23648484.
- ^ Tamasloukht, M.; Sejalon-Delmas, N.; Kluever, A.; Jauneau, A.; Roux., C.; Becard, G.; Franken, P. (2003). "Root Factors Induce Mitochondrial-Related Gene Expression and Fungal Respiration during the Developmental Switch from Asymbiosis to Presymbiosis in the Arbuscular Mycorrhizal Fungus Gigaspora rosea". Bitki Fizyolojisi. 131 (3): 1468–1478. doi:10.1104/pp.012898. PMC 166906. PMID 12644696.
- ^ a b c Gianinazzi-Pearson, V. (1996). "Plant Cell Responses to Arbuscular Mycorrhizal Fungi: Getting to the Roots of the Symbiosis". Bitki Hücresi. 8 (10): 1871–1883. doi:10.1105/tpc.8.10.1871. JSTOR 3870236. PMC 161321. PMID 12239368.
- ^ Lara Armstrong; R. Larry Peterson; Lara Armstrong; R. Larry Peterson (2002). "The Interface between the Arbuscular Mycorrhizal Fungus Glomus intraradices and Root Cells of Panax quinquefolius: A Paris-Type Mycorrhizal Association". Mikoloji. 94 (4): 587–595. doi:10.2307/3761710. JSTOR 3761710. PMID 21156532.
- ^ Yamato, Masahide (2005). "Morphological types of arbuscular mycorrhizas in pioneer woody plants growing in an oil palm farm in Sumatra, Indonesia". Mikobilim. 46: 66–68. doi:10.1007/s10267-004-0212-x. S2CID 83767351.
- ^ Matekwor, Ahulu E; Nakata, M; Nonaka, M (Mar 2005). "Arum- and Paris-type arbuscular mycorrhizas in a mixed pine forest on sand dune soil in Niigata Prefecture, central Honshu, Japan". Mikoriza. 15 (2): 129–36. doi:10.1007/s00572-004-0310-9. ISSN 0940-6360. PMID 15290409. S2CID 25476630.
- ^ Tuomi, J.; Kytoviita, M.; Hardling, R. (2001). "Cost efficiency of nutrient acquisition of mycorrhizal symbiosis for the host plant". Oikos. 92: 62–70. doi:10.1034/j.1600-0706.2001.920108.x.
- ^ a b c Bolan, N.S. (1991). "A critical review of the role of mycorrhizal fungi in the uptake of phosphorus by plants". Bitki ve Toprak. 134 (2): 189–207. doi:10.1007/BF00012037. S2CID 44215263.
- ^ Harley, J.L., Smith, S.E., 1983. Mycorrhizal Symbiosis. Akademik Basın: Londra.
- ^ a b c d Pfeffer, P.; Douds D.; Becard, G.; Shachar-Hill, Y. (1999). "Carbon Uptake and the Metabolism and Transport of Lipids in an Arbuscular Mycorrhiza". Bitki Fizyolojisi. 120 (2): 587–598. doi:10.1104 / s.120.2.587. PMC 59298. PMID 10364411.
- ^ a b c Hamel, C. (2004). "Impact of arbuscular mycorrhiza fungi on N and P cycling in the root zone". Kanada Toprak Bilimi Dergisi. 84 (4): 383–395. doi:10.4141/S04-004.
- ^ H. Bücking and Y.Shachar-Hill (2005). Phosphate uptake, transport and transfer by the arbuscular mycorrhizal fungus Glomus intraradices is stimulated by increased carbohydrate availability New Phytologist 165:899–912
- ^ a b c Smith, S .; Smith, A .; Jakobsen, I. (2003). "Mycorrhizal Fungi Can Dominate Phosphate Supply to Plants Irrespective of Growth Responses". Bitki Fizyolojisi. 133 (1): 16–20. doi:10.1104/pp.103.024380. PMC 1540331. PMID 12970469.
- ^ a b c d e f g Smith, S.E., Read D.J. Mycorrhizal Symbiosis. 2002. Academic Press: London.
- ^ a b Smith, Read, Sally, DJ (2008). Mycorrhizal symbiosis. New York: Akademik Basın.
- ^ a b c Opik, M; Vanatoa A; Vanatoa E; Moora M; Davidson J; Kalwij JM; Reier U; Zobel M (2010). "The online database MaarjAM reveals global and ecosystemic distribution patterns in arbuscular mycorrhizal fungi (Glomeromycota)". Yeni Fitolog. 188 (1): 233–241. doi:10.1111/j.1469-8137.2010.03334.x. PMID 20561207.
- ^ a b Kivlin, Stephanie; Christine V. Hawkes; Kathleen K. Treseder (2011). "Global diversity and distribution of arbuscular mycorrhizal fungi". Toprak Biyolojisi ve Biyokimyası. 43 (11): 2294–2303. doi:10.1016/j.soilbio.2011.07.012.
- ^ Lekberg, Y; Koide RT; Rohr JR; Aldirch-Wolfe L; Morton JB (2007). "Role of niche restrictions and dispersal in the composition of arbuscular mycorrhizal fungal communities". Journal of Ecology. 95: 95–100. doi:10.1111/j.1365-2745.2006.01193.x.
- ^ Leff, Jonathan W.; Jones, Stuart E.; Prober, Suzanne M .; Barberán, Albert; Borer, Elizabeth T.; Firn, Jennifer L.; Harpole, W. Stanley; Hobbie, Sarah E.; Hofmockel, Kirsten S. (2015-09-01). "Consistent responses of soil microbial communities to elevated nutrient inputs in grasslands across the globe". Ulusal Bilimler Akademisi Bildiriler Kitabı. 112 (35): 10967–10972. Bibcode:2015PNAS..11210967L. doi:10.1073/pnas.1508382112. ISSN 0027-8424. PMC 4568213. PMID 26283343.
- ^ Allen, EB; Allen MF; Helm DJ; Trappe JM; Molina R; Rincon E (1995). "Patterns and regulation of mycorrhizal plant and fungal diversity". Bitki ve Toprak. 170: 47–62. doi:10.1007/bf02183054. S2CID 25097125.
- ^ Klironomos, John (2000). Host-specificity and functional diversity among arbuscular mycorrhizal fungi. Halifax, Canada: Microbial Biosystems: New Frontiers. Proceedings of the 8th International Symposium on Microbial Ecology. Atlantic Canada Society for Microbial Ecology. pp. 845–851.
- ^ Husband, R; Herre EA; Turner SL; Gallery R; Young JPW (2002). "Molecular diversity of arbuscular mycorrhizal fungi and patterns of associations over time and space in a tropical forest" (PDF). Moleküler Ekoloji. 11 (12): 2669–2678. doi:10.1046/j.1365-294x.2002.01647.x. PMID 12453249.
- ^ a b Hempel, Stefan; Gotzenberger L; Kuhn I; Michalski SG; Rillig M; Zobel M; Moora M (2013). "Mycorrhizas in the Central European flora – relationships with plant life history traits and ecology". Ekoloji. 94 (6): 1389–1399. doi:10.1890/12-1700.1. PMID 23923502.
- ^ Drigo, B; Pijl, AS; Duyts, H; Kielak, AM; Gamper, HA; Houtekamer, MJ; Boschker, HTS; Bodelier, PLE; Whiteley, AS; Veen, JAV; Kowalchuk, GA (2010). "Shifting carbon flow from roots into associated microbial communities in response to elevated atmospheric CO2". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 107 (24): 10938–10942. Bibcode:2010PNAS..10710938D. doi:10.1073/pnas.0912421107. PMC 2890735. PMID 20534474.
- ^ van der Heijden, MG; Boller AT; Wiemken A; Sanders IR (1998). "Different arbuscular mycorrhizal fungi species are potential determinants of plant community structure". Ekoloji. 79 (6): 2082–2091. doi:10.1890/0012-9658(1998)079[2082:damfsa]2.0.co;2.
- ^ van der Heijden, MGA; Bardgett RD; Van Straalen NM (2008). "The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems". Ekoloji Mektupları. 11 (3): 296–310. doi:10.1111/j.1461-0248.2007.01139.x. PMID 18047587.
- ^ Vannette, RL; Rasmann S (2012). "Arbuscular mycorrhizal fungi mediate below-ground plant–herbivore interactions: a phylogenetic study". Fonksiyonel Ekoloji. 26 (5): 1033–1042. doi:10.1111/j.1365-2435.2012.02046.x.
- ^ Haumann, N; Hawkes CV (2009). "Plant neighborhood control of arbuscular mycorrhizal community composition". Yeni Fitolog. 183 (4): 1188–1200. doi:10.1111/j.1469-8137.2009.02882.x. PMID 19496954.
- ^ Hausmann, N; Hawkes CV (2010). "Order of plant host establishment alters the composition of arbuscular mycorrhizal communities". Ekoloji. 91 (8): 2333–23343. doi:10.1890/09-0924.1. PMID 20836455.
- ^ Batten, KM; Skow KM; Davies KF; Harrison SP (2006). "Two invasive plants alter soil microbial community composition in serpentine grasslands". Biyolojik İstilalar. 8 (2): 217–230. doi:10.1007/s10530-004-3856-8. S2CID 24969103.
- ^ Hawkes, CV; Belnap J; D'Antonio C; Firestone M (2006). "Arbuscular mycorrhizal assemblages in native plant roots change in the presence of invasive exotic grasses". Bitki ve Toprak. 281 (1–2): 369–380. doi:10.1007/s11104-005-4826-3. S2CID 16801874.
- ^ Kivlin, Stephanie; Christine V. Hawkes (2011). "Differentiating between effects of invasion and diversity: impacts of aboveground plant communities on belowground fungal communities". Yeni Fitolog. 189 (2): 526–535. doi:10.1111/j.1469-8137.2010.03494.x. PMID 20958304.
- ^ Lekberg, Y; Gibbons SM; Rosendahl S; Ramsey PW (2013). "Severe plant invasions can increase mycorrhizal fungal abundance and diversity". ISME Dergisi. 7 (7): 1424–1433. doi:10.1038/ismej.2013.41. PMC 3695300. PMID 23486251.
- ^ Fitter, AH (2005). "Darkness visible: reflections on underground ecology" (PDF). Journal of Ecology. 93 (2): 231–243. doi:10.1111/j.0022-0477.2005.00990.x.
- ^ Pringle, A; Bever, JD; Gardes, M; Parrent, JL; Rillig, MC; Klironomos, JN (2009). "Mycorrhizal symbioses and plant invasions". Ekoloji, Evrim ve Sistematiğin Yıllık Değerlendirmesi. 40: 699–715. doi:10.1146/annurev.ecolsys.39.110707.173454.
- ^ Larimer, AL; Bever JD; Clay K (2010). "The interactive effects of plant microbial symbionts: a review and meta-analysis". Ortak yaşam. 51 (2): 139–148. doi:10.1007/s13199-010-0083-1. S2CID 11569239.
- ^ Novas, MV; Iannone LJ; Godeas AM; Cabral D (2009). "Positive association between mycorrhiza and foliar endophytes in a Poa bonariensis". Mikolojik İlerleme. 8: 75–81. doi:10.1007/s11557-008-0579-8. S2CID 2206235.
- ^ Larimer, AL; Bever JD; Clay K (2012). "Consequences of simultaneous interactions of fungal endophytes and arbuscular mycorrhizal fungi with a shared host grass". Oikos. 121 (12): 2090–2096. doi:10.1111/j.1600-0706.2012.20153.x.
- ^ Omacini, M; Eggers T; Bonkowski M; Gange AC; Jones TH (2006). "Leaf endophytes affect mycorrhizal status and growth of co-infected and neighboring plants". Fonksiyonel Ekoloji. 20 (2): 226–232. doi:10.1111/j.1365-2435.2006.01099.x.
- ^ Mack, KML; Rudgers JA (2008). "Balancing multiple mutualists: asymmetric interactions among plants, arbuscular mycorrhizal fungi, and fungal endophytes". Oikos. 117 (2): 310–320. CiteSeerX 10.1.1.722.4169. doi:10.1111/j.2007.0030-1299.15973.x.
- ^ Liu, QH; Parsons AJ; Xue H; Fraser K; Ryan GD; Newman JA; Rasmussen S (2011). "Competition between foliar Neotyphodium lolii endophytes and mycorrhizal Glomus spp. fungi in Lolium perenne depends on resource supply and host carbohydrate content". Fonksiyonel Ekoloji. 25 (4): 910–920. doi:10.1111/j.1365-2435.2011.01853.x. hdl:10214/3316.
- ^ Reininger, V; Sieber TN (2012). "Mycorrhiza reduces adverse effects of dark septate endophytes (DSE) on growth of conifers". PLOS ONE. 7 (8): 1–10. Bibcode:2012PLoSO...742865R. doi:10.1371/journal.pone.0042865. PMC 3416760. PMID 22900058.
- ^ Klironomos, JN; Hart MM; Gurney JE; Moutoglis P (2001). "Interspecific differences in the tolerance of arbuscular mycorrhizal fungi to freezing and drying". Kanada Botanik Dergisi. 79 (10): 1161–1166. doi:10.1139/cjb-79-10-1161.
- ^ Auge, RM (2001). "Water relations, drought and vesicular-arbuscular mycorrhizal symbiosis". Mikoriza. 11: 3–42. doi:10.1007/s005720100097. S2CID 29379395.
- ^ Johnson, NC; Rowland DL; Corkidi L; Egerton-Warburton LM; Allen EB (2003). "Nitrogen enrichment alters mycorrhizal allocation at five mesic to semiarid grasslands". Ekoloji. 84 (7): 1895–1908. doi:10.1890/0012-9658(2003)084[1895:neamaa]2.0.co;2.
- ^ Johnson, NC; Wilson GWT; Bowker MA; Wilson JA; Miller RM (2010). "Resource limitation is a driver of local adaptation in mycorrhizal symbioses". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 107 (5): 2093–2098. Bibcode:2010PNAS..107.2093J. doi:10.1073/pnas.0906710107. PMC 2836645. PMID 20133855.
- ^ Gai, JP; Tian H; Yang FY; Christie P; Li XL; Klironomos JN (2012). "Arbuscular mycorrhizal fungal diversity along a Tibetan elevation gradient". Pedobiyoloji. 55 (3): 145–151. doi:10.1016/j.pedobi.2011.12.004.
- ^ Porcel, R; Aroca, R; Ruiz-Lozano, JM (2012). "stress alleviation using arbuscular mycorrhizal fungi. A review". Sürdürülebilir Kalkınma için Agronomi. 32: 181–200. doi:10.1007/s13593-011-0029-x. S2CID 8572482.
- ^ a b c Marschner, P.; Timonen, S. (2004). "Interactions between plant species and mycorrhizal colonization on the bacterial community composition in the rhizosphere". Applied Soil Ecology. 28: 23–36. doi:10.1016/j.apsoil.2004.06.007.
- ^ Eriksson, A. (2001). "Arbuscular mycorrhizae in relation to management history, soil nutrients and plant diversity". Bitki Ekolojisi. 155 (2): 129–137. doi:10.1023/A:1013204803560. S2CID 42097761.
- ^ "Lipochitooligosaccharides Stimulating Arbuscular Mycorrhizal Symbiosis". Arşivlenen orijinal 2012-08-05 tarihinde.
- ^ Schrey, Silvia D.; et al. (2012). "Production of fungal and bacterial growth modulating secondary metabolites is widespread among mycorrhiza-associated streptomycetes". BMC Mikrobiyoloji. 12 (1): 164. doi:10.1186/1471-2180-12-164. PMC 3487804. PMID 22852578.
- ^ Van der Putten, WH (2012). "Climate change, Aboveground-belowground interactions and species' range shifts". Ekoloji, Evrim ve Sistematiğin Yıllık Değerlendirmesi. 43: 365–383. doi:10.1146/annurev-ecolsys-110411-160423. hdl:20.500.11755/0f7d61b9-e435-4da3-b3d6-3ca115bdbdb5.
- ^ Worchel, Elise; Giauque, Hannah E.; Kivlin, Stephanie N. (2013). "Fungal symbionts alter plant drought response". Mikrobiyal Ekoloji. 65 (3): 671–678. doi:10.1007/s00248-012-0151-6. PMID 23250115. S2CID 122731.
- ^ Kivlin, SN; Emery SM; Rudgers JA (2013). "Fungal symbionts alter plant response to global change". Amerikan Botanik Dergisi. 100 (7): 1445–1457. doi:10.3732/ajb.1200558. PMID 23757444.
- ^ Treseder, KK (2004). "A meta-analysis of mycorrhizal responses to nitrogen, phosphorus, and atmospheric CO2 in field studies". Yeni Fitolog. 164 (2): 347–355. doi:10.1111/j.1469-8137.2004.01159.x.
- ^ Glomalin. "Hiding Place for a Third of the World's Stored Soil Carbon". Agricultural Research Journal.
- ^ Stukenbrock, Eva; Rosendahl, Soren (2005). "Clonal diversity and population genetic structure of arbuscular mycorrhizal fungi ( Glomus spp.) studied by multilocus genotyping of single spores". Moleküler Ekoloji. 14 (3): 743–752. doi:10.1111/j.1365-294x.2005.02453.x. PMID 15723666.
- ^ Baoming, Ji; et al. (2013). "Patterns of diversity and adaptation in Glomeromycota from three prairie grasslands". Moleküler Ekoloji. 22 (9): 2573–2587. doi:10.1111/mec.12268. PMID 23458035.
- ^ Opik, Maarja; et al. (2013). "Global sampling of plant roots expands the described molecular diversity of arbuscular mycorrhizal fungi". Mikoriza. 23 (5): 411–430. doi:10.1007/s00572-013-0482-2. PMID 23422950. S2CID 17162006.
- ^ Johnson, Nancy; Zak, D.R.; Tilman, D .; Pfleger, F.L (1991). "Dynamics of vesicular arbuscular mycorrhizae during old field succession". Oekoloji. 86 (3): 349–358. Bibcode:1991Oecol..86..349J. doi:10.1007/bf00317600. PMID 28312920. S2CID 31539360.
- ^ Marleau, Julie; Dalpé, Y.; St-Arnaud, M.; Hijri, M. (2011). "Spore development and nuclear inheritance in arbuscular mycorrhizal fungi". BMC Evrimsel Biyoloji. 11 (1): 51. doi:10.1186/1471-2148-11-51. PMC 3060866. PMID 21349193.
- ^ Ehinger, Martine O.; Daniel Croll; Alexander M. Koch; Ian R. Sanders (2012). "Significant genetic and phenotypic changes arising from clonal growth of a single spore of an arbuscular mycorrhizal fungus over multiple generations". Yeni Fitolog. 196 (3): 853–861. doi:10.1111/j.1469-8137.2012.04278.x. PMID 22931497.
- ^ Simon, L; Lalonde, M.; Bruns, T.D (1992). "Specific amplification of 18S fungal ribosomal genes from vesicular-arbuscular endomycorrhizal fungi colonizing roots". Appl. Environ. Mikrobiyol. 58 (1): 291–295. doi:10.1128/AEM.58.1.291-295.1992. PMC 195206. PMID 1339260.
- ^ Helgason, Thorunn; Fitter, A.H.; Young, J.P.W (1999). "Molecular diversity of arbuscular mycorrhizal fungi colonising Hyacinthoides non-scripta (bluebell) in a seminatural woodland" (PDF). Moleküler Ekoloji. 8 (4): 659–666. doi:10.1046/j.1365-294x.1999.00604.x.
- ^ Redecker, Dirk; Arthur Schüßler; Herbert Stockinger; Sidney L. Stürmer; Joseph B. Morton; Christopher Walker (2013). "An evidence-based consensus for the classification of arbuscular mycorrhizal fungi (Glomeromycota)". Mikoriza. 23 (7): 515–531. doi:10.1007/s00572-013-0486-y. PMID 23558516. S2CID 16495856.
- ^ Opik, Maarja; Metsis, M.; Daniell, T. J.; Zobel, M.; Moora, M. (2009). "Large-scale parallel 454 sequencing reveals host ecological group specificity of arbuscular mycorrhizal fungi in a boreonemoral forest". Yeni Fitolog. 184 (2): 424–437. doi:10.1111/j.1469-8137.2009.02920.x. PMID 19558424.
- ^ a b Krüger, Manuela; Stockinger, Herbert; Krüger, Claudia; Schüßler, Arthur (2009). "DNA-based species level detection of Glomeromycota: one PCR primer set for all arbuscular mycorrhizal fungi". Yeni Fitolog. 183 (1): 212–223. doi:10.1111/j.1469-8137.2009.02835.x. PMID 19368665.
- ^ a b Kohout, Petr; et al. (Ocak 2014). "Comparison of commonly used primer sets for evaluating arbuscular mycorrhizal fungal communities: Is there a universal solution?". Toprak Biyolojisi ve Biyokimyası. 68: 482–493. doi:10.1016/j.soilbio.2013.08.027.
- ^ Stockinger, Herbert; Kruger, Manuela; Schüßler, Arthur (2010). "DNA barcoding of arbuscular mycorrhizal fungi". Yeni Fitolog. 187 (2): 461–474. doi:10.1111/j.1469-8137.2010.03262.x. PMID 20456046.
- ^ Redecker, Dirk (2000). "Specific PCR primers to identify arbuscular mycorrhizal fungi within colonized roots". Mikoriza. 10 (2): 73–80. doi:10.1007/s005720000061. S2CID 11726603.
- ^ "Six Years After Acquisition, Roche Quietly Shutters 454". Bio-IT Dünyası. 16 Ekim 2013. Alındı 13 Mart 2014.
- ^ He, Zhili; Joy D. VAN NOSTRAND; Ye DENG; Jizhong ZHOU (2011). "Development and applications of functional gene microarrays in the analysis of the functional diversity, composition, and structure of microbial communities". Ön. Environ. Sci. Müh. Çin. 5 (1): 1–20. doi:10.1007/s11783-011-0301-y.
- ^ a b c Olsson, Pal Axel (1999). "Signature fatty acids provide tools for determination of the distribution and interactions of mycorrhizal fungi in soil". FEMS Mikrobiyoloji Ekolojisi. 29 (4): 303–310. doi:10.1111/j.1574-6941.1999.tb00621.x.
- ^ J., Schnürer; Clarholm, M.; Rosswall, T (1985). "Microbial biomass and activity in an agricultural soil with different organic matter contents". Toprak Biyolojisi ve Biyokimyası. 17 (5): 611–618. doi:10.1016/0038-0717(85)90036-7.
- ^ Montoliu-Nerin, Merce; Sánchez-Garcia, Marisol; Bergin, Claudia; Grabherr, Manfred; Ellis, Barbara; Kutschera, Verena Esther; Kierczak, Marcin; Johannesson, Hanna; Rosling, Anna (2020-01-28). "Building de novo reference genome assemblies of complex eukaryotic microorganisms from single nuclei". Bilimsel Raporlar. 10 (1): 1303. doi:10.1038/s41598-020-58025-3. ISSN 2045-2322. PMC 6987183. PMID 31992756.
- ^ Dumont, Marc G .; Murrell, Colin J. (2005). "Stable isotope probing – linking microbial identity to function". Doğa İncelemeleri Mikrobiyoloji. 3 (6): 499–504. doi:10.1038/nrmicro1162. PMID 15886694. S2CID 24051877.
- ^ a b Schwartz, Egbert (2007). "Characterization of growing microorganisms in soil by stable isotope probing with H218O". Uygulamalı ve Çevresel Mikrobiyoloji. 73 (8): 2541–2546. doi:10.1128/AEM.02021-06. PMC 1855593. PMID 17322324.
- ^ Formey D, et al. 2016. Regulation of small RNAs and corresponding targets in Nod factor-induced Phaseolus vulgaris root hair cells. Int J Mol Sci . 176:887.
- ^ a b c d Jeffries, P.; Gianinazzi, S.; Perotto, S.; Turnau, K.; Barea, J. (2003). "The Contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility". Toprak Biyolojisi ve Verimliliği. 37: 1–16. doi:10.1007/s00374-002-0546-5. S2CID 20792333.
- ^ Akhtar, Ovaid; Mishra, Rani; Kehri, Harbans Kaur (2019-03-01). "Arbuscular Mycorrhizal Association Contributes to Cr Accumulation and Tolerance in Plants Growing on Cr Contaminated Soils". Ulusal Bilimler Akademisi Bildirileri, Hindistan Bölüm B: Biyolojik Bilimler. 89 (1): 63–70. doi:10.1007/s40011-017-0914-4. ISSN 2250-1746. S2CID 46007322.
- ^ Fillion, M.; Brisson, J.; Guidi W.; Labrecque, M. (2011). "Increasing phosphorus removal in willow and poplar vegetation filters using arbuscular mycorrhizal fungi". Ekolojik Mühendislik. 37 (2): 199–205. doi:10.1016/j.ecoleng.2010.09.002.
- ^ Akhtar, Ovaid; Kehri, Harbans Kaur; Zoomi, Ifra (2020-09-15). "Arbuscular mycorrhiza ve Aspergillus terreus aşılaması, kompost tadilatı ile birlikte, Cr zengini teknosolün arazi koşullarında Solanum lycopersicum tarafından fitoremediasyonunu geliştirir". Ekotoksikoloji ve Çevre Güvenliği. 201: 110869. doi:10.1016 / j.ecoenv.2020.110869. ISSN 0147-6513. PMID 32585490.
- ^ Giovannini, L., Palla, M., Agnolucci, M., Avio, L., Sbrana, C., Turrini, A. and Giovannetti, M. (2020) "Arbuscular mycorrhizal fungi and associated microbiota as plant biostimulants: research strategies for the selection of the best performing inocula". Agronomi, 10(1): 106. doi:10.3390/agronomy10010106.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Rillig, M.; Ramsey, P.; Morris, S .; Paul, E. (2003). "Glomalin, an arbuscular-mycorrhizal fungal soil protein, responds to land-use change". Bitki ve Toprak. 253 (2): 293–299. doi:10.1023/A:1024807820579. S2CID 11007821.
- ^ a b c Rillig, M. (2004). "Arbuscular mycorrhizae, glomalin and soil aggregation". Kanada Toprak Bilimi Dergisi. 84 (4): 355–363. doi:10.4141/S04-003.
Notlar
- Boswell, E. P.; R.T. Koide; D.L. Shumway; H.D. Addy. (1998). "Winter Wheat cover cropping, VA mycorrhizal fungi and maize growth and yield". Tarım, Ekosistemler ve Çevre. 67: 55–65. doi:10.1016/S0167-8809(97)00094-7.
- Bücking H.; Shachar-Hill Y. (2005). "Phosphate uptake, transport and transfer by arbuscular mycorrhizal fungus is increased by carbohydrate availability". Yeni Fitolog. 165 (3): 889–912. doi:10.1111/j.1469-8137.2004.01274.x. PMID 15720701.
- George E., K. Haussler, S.K. Kothari, X.L. Li and H. Marshner,1992 Contribution of Mycorrhizal Hyphae to Nutrient and Water Uptake of Plants. In Mycorrhizas in Ecosystems, ed., D.J. Read, D.H. Lewis, A.H. Fitter, I.J. İskender. United Kingdom: C.A.B. International, pp. 42–47.
- Grant, C.; Bitman, S.; Montreal, M.; Plenchette, C.; Morel, C. (2005). "Soil and fertilizer phosphorus: effects on plant supply and mycorrhizal development". Kanada Bitki Bilimi Dergisi. 85: 3–14. doi:10.4141/P03-182.
- Kosuta, S.; Chabaud, M.; Lougnon, G.; Gough, C.; Denarie, J.; Barker, D.; Bacard, G. (2003). "A Diffusible Factor from Arbuscular Mycorrhizal Fungi Induces Symbiosis-Specific MtENOD11 Expression in Roots of Medicago truncatula". Bitki Fizyolojisi. 131 (3): 952–962. doi:10.1104/pp.011882. PMC 166861. PMID 12644648.
- Kabir, Z.; R.T. Koide (2000). "The effect of dandelion or a cover crop on mycorrhiza inoculum potential, soil aggregation and yield of maize". Tarım, Ekosistemler ve Çevre. 78 (2): 167–174. doi:10.1016/S0167-8809(99)00121-8.
- McGonigle, T.P.; M.H. Miller (1999). "Winter survival of extraradical hyphae and spores of arbuscular mycorrhizal fungi in the field". Applied Soil Ecology. 12: 41–50. doi:10.1016/S0929-1393(98)00165-6.
- Miller, M.H.; McGonigle T.P.; Addy, H.D. (1995). "Functional ecology if vesicular arbuscular mycorrhizas as influenced by phosphate fertilization and tillage in an agricultural ecosystem". Biyoteknolojide Eleştirel İncelemeler. 15 (3–4): 241–255. doi:10.3109/07388559509147411.
- Mozafar, A.; Anken, T.; Ruh, R.; Frossard, E. (2000). "Toprak işleme yoğunluğu, Mikorizal ve mikorizal olmayan mantarlar ve mısır, buğday ve kanolada besin konsantrasyonları". Agronomi Dergisi. 92 (6): 1117–1124. doi:10.2134 / agronj2000.9261117x.
- Sorensen, J.N .; J Larsen; I. Jakobsen (2005). "Pırasada mikoriza oluşumu ve besin konsantrasyonu (Allium porrum) önceki mahsulle ilgili olarak ve yüksek P topraklarında örtü mahsulü yönetimi ". Bitki ve Toprak. 273 (1–2): 101–114. doi:10.1007 / s11104-004-6960-8. S2CID 30777851.
- Thingstrup, I .; G. Rubaek; E. Sibbensen; I. Jakobsen (1999). "Keten (Linum usitatissimum L.) tarladaki yüksek toprak P seviyelerine değil, orta seviyede büyüme ve P alımı için arbusküler mikorizal mantarlara bağlıdır ". Bitki ve Toprak. 203: 37–46. doi:10.1023 / A: 1004362310788. S2CID 27345855.
- Timmer, L .; Leyden, R. (1980). "Mikorizal enfeksiyonun ekşi portakal fidelerinde fosforun neden olduğu bakır eksikliği ile ilişkisi". Yeni Fitolog. 85: 15–23. doi:10.1111 / j.1469-8137.1980.tb04443.x.
- Xie, Z .; Staehelin, C .; Vierheilig, H .; Weimken, A .; Jabbouri, S .; Broughton W .; Vogeli-Lange, R .; Thomas B. (1995). "Rhizobial Nodülasyon Faktörleri, Nodüle Edici ve Nodüle Olmayan Soya Fasulyelerinin Mikorizal Kolonizasyonunu Uyarıyor". Bitki Fizyolojisi. 108 (4): 1519–1525. doi:10.1104 / s.108.4.1519. PMC 157531. PMID 12228558.
