Aryne - Aryne
Arynes[1] veya Benzinler[2] yüksek derecede reaktif türlerdir. aromatik halka ikisinin kaldırılmasıyla ikameler. En yaygın arynes orto ancak meta- ve para-arinler de bilinmektedir.[3][4][5] Ö-Arynes gerginlik örnekleridir alkinler.
Bağlanmak Öarılar
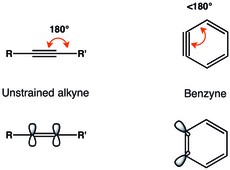
Benzinin alkin temsili en yaygın karşılaşılanıdır. o-Arynes veya 1,2-didehidroarenler genellikle gergin üçlü bağa sahip olarak tanımlanır.[6]

Üçlü bağ üzerindeki geometrik kısıtlamalar orto-benzin, düzlem içi p-orbitallerinin örtüşmesinin azalmasına ve dolayısıyla daha zayıf üçlü bağa neden olur.[7] Benzin içindeki üçlü bağın titreşim frekansı Radziszewski tarafından 1846 cm olarak belirlendi.−1,[8] yaklaşık 2150 cm titreşim frekansı ile gerilmemiş alkindekinden daha zayıf bir üçlü bağ olduğunu gösterir−1. Yine de, orto-benzin, büyük singlet-triplet aralığı ve alkin benzeri reaktiviteden görüldüğü gibi, biradikalden çok gerilmiş bir alkin gibidir.[3]
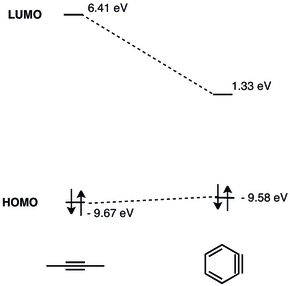
LUMO Arinin% 'si, LUMO'su gerilmemiş alkinlerden çok daha düşüktür, bu da onu nükleofillerin HOMO'su için daha iyi bir enerji eşleşmesi yapar. Bu nedenle benzin, elektrofilik karaktere sahiptir ve nükleofillerle reaksiyona girer.[9] Benzinin ayrıntılı bir MO analizi 1968'de sunuldu.[10]
Nesil Öarılar
Aşırı reaktiviteleri nedeniyle aryneler oluşturulmalıdır. yerinde. Diğerinin tipik reaktif ara ürünler, benzin tuzağa düşürülmeli, aksi takdirde Dimerizeler -e bifenilen.
Benzin için erken yollar dahil dehidrohalojenasyon nın-nin aril halojenürler:
Bu tür reaksiyonlar, güçlü baz ve yüksek sıcaklıklar gerektirir. Orto-disübstitüe edilmiş arenler, daha hafif koşullar altında benzinlerin öncüleri olarak hizmet eder. Benzyne, 2-bromoflorobenzenin magnezyum tarafından dehalojenasyonu ile üretilir.[11] Antranilik asit diazotizasyon ve nötrleştirme ile 2-diazoniobenzen-1-karboksilata dönüştürülebilir. Patlayıcı olmasına rağmen,[12] bu zwitteriyonik tür benzinin uygun ve ucuz bir öncüsüdür.[13]

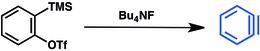
Başka bir yöntem, trimetilsililaril'e dayanmaktadır. triflakalar.[14] Trimetilsilil grubunun florür yer değiştirmesi triflatın ortadan kaldırılmasına ve benzinin salınmasına neden olur:
Bir hexadehydro Diels-Alder reaksiyonu (HDDA) 1,3-diyne ve alkinin siklo-katılmasını içerir.[15]

N-aminasyon 1H-benzotriazol ile hidroksilaminÖ-Sülfonik asit ile neredeyse kantitatif verimde benzine oksitlenebilen bir ara ürün üretir kurşun (IV) asetat.[16]

Reaksiyonları Öarılar
Düşük sıcaklıklarda bile arinler son derece reaktiftir. Reaktiviteleri üç ana sınıfa ayrılabilir: (1) nükleofilik eklemeler, (2) perisiklik reaksiyonlar ve (3) bağ ekleme.
Arinlere nükleofilik ilaveler
Bazik nükleofiller ile muamele edildikten sonra, aril halojenürler alfa'yı ayrılan gruba deprotonat eder ve sonuç dehidrohalojenasyon. İzotop değişim çalışmaları, aril florürler ve bazen aril klorürler için, eliminasyon olayının iki aşamada, protondan arındırma ve ardından nükleofilin çıkarılması şeklinde ilerlediğini gösterir. Bu nedenle, işlem resmi olarak alifatik bileşiklerin E1cb mekanizmasına benzer. Öte yandan, aril bromürler ve iyodürler, genellikle uyumlu bir eş düzlemli E2 mekanizmasıyla ortadan kaldırılır gibi görünmektedir.[17][18] Elde edilen benzin, genellikle nükleofilik ekleme ve protonlama yoluyla ilave ürünleri oluşturur. Benzin ara ürününün oluşturulması, reaksiyondaki yavaş adımdır.[19]

"Arin birleştirme" reaksiyonları, farmasötik endüstrisinde, tarımda ve birçok metal katalizli dönüşümde ligand olarak değerli olan bifenil bileşiklerinin oluşumuna izin verir.[20]

Metal-aren ürünü başka bir arene de eklenerek zincir büyümesi polimerizasyonu. Kullanma bakır (I) siyanür ilk arine eklenecek olan başlatıcı olarak yaklaşık 100 aren birimine kadar içeren polimerler elde edildi.[21]
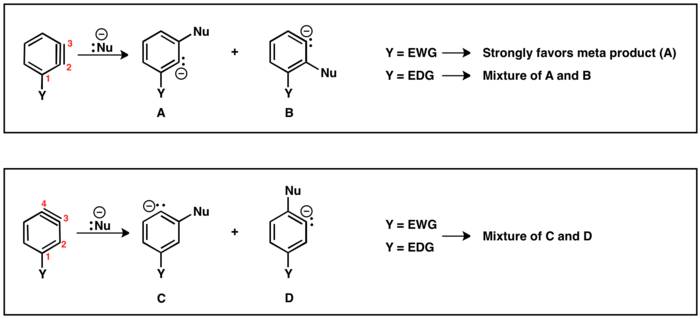
Ayrılan grup (LG) ve ikame edici (Y) karşılıklı olarak orto veya para olduğunda, sadece bir benzin ara ürünü mümkündür. Bununla birlikte, LG Y'ye meta olduğunda, o zaman rejiyokimyasal sonuçlar (A ve B) mümkündür. Y elektron çekiyorsa, HB H'den daha asidiktirBir rejyoizomer B'nin üretilmesiyle sonuçlanır. Benzer şekilde, Y elektron vericiyse, rejyoizomer A üretilir, çünkü şu andan itibaren HBir daha asidik protondur.

İkame edici (Y) ile benzinin iki olası rejyoizomeri vardır: üçlü bağ C2 ile C3 arasında veya C3 ile C4 arasında konumlandırılabilir. Ayrılan gruba orto ikame ediciler, C2 ve C3 arasında üçlü bağa yol açacaktır. Para Y ve LG, C3 ve C4 arasında üçlü bağ olan bölgesel izomere yol açacaktır. Meta ikame edicisi, yukarıda tarif edildiği gibi her iki rejyoizomeri de sağlayabilir. C2 ve C3 arasında yer alan üçlü bağ durumunda, elektron çeken (EWG) ikame ediciler, örn. CF3, nükleofil ilavesini karbanyonu EWG'ye mümkün olduğunca yakın yerleştirmek için yönlendirecektir. Bununla birlikte, elektron veren (EDG) ikame ediciler, ör. CH3, ürünler arasında çok az seçicilik sağlayacaktır. C3 ve C4 arasında üçlü bağın bulunduğu bölgesel izomerde ikame edicinin nükleofil ilavesi üzerindeki etkisi azalır ve para ve meta ürünlerin karışımları sıklıkla elde edilir.[19]
Arynlerin perisiklik reaksiyonları
Benzyne, bifenilen oluşturmak için hızlı dimerizasyona uğrar. Benzine giden bazı yollar, bu müteakip reaksiyonun özellikle hızlı ve yüksek verimine yol açar.[13][16] Trimerizasyon verir trifenilen.[22]
Benzinler geçebilir [4+2] siklizasyon reaksiyonları. Varlığında üretildiğinde antrasen, Triptiken Sonuçlar.[11] Bu yöntemde, benzin ve furan arasındaki Diels-Alder reaksiyonunun uyumlu mekanizması aşağıda gösterilmiştir. Diğer benzin [4 + 2] döngüsel koşulların aşamalı bir mekanizma ile ilerlediği düşünülmektedir.

Klasik bir örnek, sentezidir 1,2,3,4-tetrafenilnaftalen.[23] Tetrabromobenzen ile tepki verebilir butillityum ve Furan bir tetrahidroantrasen oluşturmak için[24]

Arynlerin [4 + 2] siklo-eklemeleri genel olarak doğal ürün toplam sentezine uygulanmıştır. Bununla birlikte, bu tür bir yaklaşımın ana sınırlaması, furan ve siklopentadien gibi kısıtlanmış dienlerin kullanılması gereğidir.[14] 2009 yılında Buszek ve arkadaşları arin [4 + 2] -cycloaddition kullanarak herbisindol A'yı sentezlediler.[25] 6,7-indolin, kompleks tetrasiklik ürün elde etmek için siklopentadien ile [4 + 2] siklo-katılmaya uğrar.

Benzinler, geniş bir alken aralığı ile [2 + 2] siklo koşullandırmaya tabi tutulur. Benzinin elektrofilik doğası nedeniyle, elektron veren ikame ediciler taşıyan alkenler bu reaksiyon için en iyi sonucu verir.[26]
Önemli yan ürün oluşumundan dolayı, arin [2 + 2] kimyası, doğal ürün toplam sentezinde nadiren kullanılır.[14] Yine de birkaç örnek mevcuttur. 1982'de, Stevens ve arkadaşları, bir arin ve bir keten asetal arasında [2 + 2] siklo-katılmayı kullanan bir taksodion sentezini bildirdi.[27]

Mori ve meslektaşları, tayvaninler C'nin toplam sentezinde arin ve diyne'nin paladyum katalizli [2 + 2 + 2] -kosiklizasyonunu gerçekleştirdiler.[28]

Arynelerin bağ ekleme reaksiyonları
Arin σ-bağı ekleme reaksiyonunun ilk örneği, 1973'teki mellein sentezidir.[29]

Diğer dehidrobenzenler
Benzin 1,2-didehidrobenzen ise, iki izomer daha mümkündür: 1,3-didehidrobenzen ve 1,4-didehidrobenzen.[3] Enerjileri silikoda sırasıyla 106, 122 ve 138 kcal / mol (444, 510 ve 577 kJ / mol).[30] 1,2- ve 1,3- izomerleri tekli temel durumlara sahipken 1,4-benzin için boşluk daha küçüktür.

1,2-, 1,3- ve 1,4-didehidrobenzenlerin karşılıklı dönüşümü incelenmiştir.[30][31] 1,2- ila 1,3-didehidrobenzen dönüşümünün piroliz (900 ° C) fenil ikame edilmiş arin öncülleri[30] Aşağıda gösterildiği gibi. Benzin dönüşümü için son derece yüksek sıcaklıklar gereklidir.

1,4-Didehidroarenler
Klasik 1,4-didehidrobenzen deneylerinde, 300 ° C'ye ısıtma, [1,6-D2] -Bir [3,2-D2] ile kolayca dengeye gelir -B, ancak dengelenmiyor C veya D. Döteryum atomlarının oluşması için eşzamanlı göçü Bve hiçbirinin C veya D sadece döngüsel ve simetrik bir ara-1,4-didehidrobenzen varlığı ile açıklanabilir.[32]

1,4-didehidrobenzen için iki durum önerildi: tekli ve üçlü, enerjide daha düşük tekli durum.[33][34] Üçlü durum, etkileşmeyen iki radikal merkezi temsil eder ve bu nedenle, hidrojenleri fenil radikaliyle aynı oranda soyutlamalıdır. Bununla birlikte, singlet durumu, üçlüden daha stabilize edilmiştir ve bu nedenle, hidrojen ayrılması için geçiş durumunu oluşturmak için stabilize edici enerjinin bir kısmı kaybedilecek ve bu da daha yavaş hidrojen soyutlamasına yol açacaktır. Chen, enediyne ilaç adaylarının seçiciliğini artırmak için büyük tekli-üçlü enerji boşluklarına sahip 1,4-didehidrobenzen analoglarının kullanımını önerdi.[35]
Tarih
Arynes için ilk kanıt Stoermer ve Kahlert'in çalışmalarından geldi. 1902'de 3-bromobenzofuranın etanol içinde bazla işlenmesi üzerine 2-etoksibenzofuran oluştuğunu gözlemlediler. Bu gözleme dayanarak, bir arin ara maddesini öne sürdüler.[36]

Wittig et al. florobenzen ve fenillityum reaksiyonunda bifenili vermek için zvitteriyonik ara maddeyi çağırdı.[37][38][39] Bu hipotez daha sonra doğrulandı.[40][41][42][43][44]
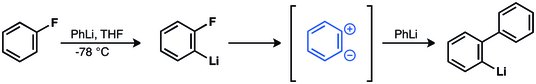
1953'te 14C etiketleme deneyleri, benzinin aracılık için güçlü destek sağlamıştır.[40] John D. Roberts et al. klorobenzen-1- reaksiyonunun14C ve potasyum amid, eşit miktarda anilin verdi. 14C-1 ve C-2'de C birleşmesi.

Wittig ve Pohmer, benzinin [4 + 2] siklo katma reaksiyonlarına katıldığını buldu.[45]
Benzinin varlığına dair ek kanıtlar spektroskopik çalışmalardan geldi.[3] Benzyne, "moleküler bir kapta" gözlenmiştir.[46]
2015 yılında, tek bir arin molekülü görüntülendi STM.[47]
m-Benzyne ilk kez 1990'larda peroksi ester 1,3-C gibi 1,3-disübstitüe benzen türevlerinden üretildiğinde gösterildi.6H4(Ö2C (O) CH3)2.[3]
Yenilikler p-benzynes 1960'larda geldi, Bergman döngüselleşmesi.[32] Bu tema, enediyne "sitostatikler" in keşfedilmesiyle güncel hale geldi. kalikeamisin 1,4-didehidrobenzen üreten.[48]
Toplam sentezde benzin örnekleri
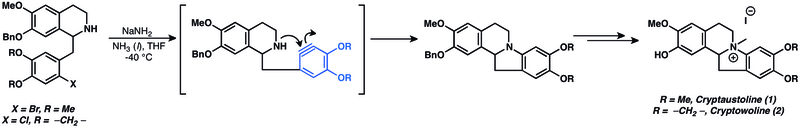
Arynes ara ürün olarak kullanılarak çeşitli doğal ürünler hazırlanmıştır.[14] Arinlere nükleofilik ilaveler, doğal ürün toplam sentezinde yaygın olarak kullanılmaktadır. Aslında, arinlerin nükleofilik ilaveleri, arin kimyasının bilinen en eski uygulamalarından bazılarıdır.[14] Kriptaustoline (1) ve kriptowolin (2) sentezinde denenen arine nükleofilik ekleme kullanıldı.[49]
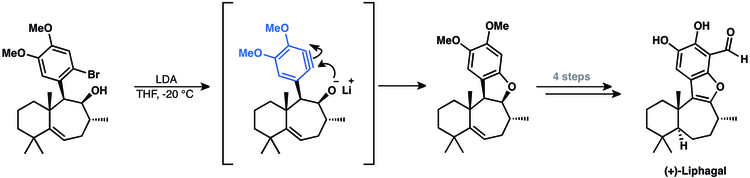
Tetrasiklik meroterpenoid (+) - lifagalin sentezi, bir arin ara maddesini içeriyordu.[50] Yaklaşımları, doğal ürünün son halkasını kapatmak için bir arin siklizasyonu kullandı.[14]
Arynlerin çok bileşenli reaksiyonları, 1,2-ikame edilmiş arenlerin hızlı oluşumuna izin veren güçlü dönüşümlerdir. Potansiyel kullanımlarına rağmen, doğal ürün sentezinde çok bileşenli arin reaksiyonlarının örnekleri azdır.[14] Dehidroaltenuen B'nin sentezinde dört bileşenli bir arin birleştirme reaksiyonu kullanılmıştır.[51]

Ayrıca bakınız
- Arin kimyasının daha fazla örnek kullanımı: trisiklobutabenzen, metilsiklophane içinde, Geçiş metal benzin kompleksi
- Piridin eşdeğeri piridin
Referanslar
- ^ IUPAC, Kimyasal Terminoloji Özeti, 2. baskı. ("Altın Kitap") (1997). Çevrimiçi düzeltilmiş sürüm: (2006–) "Aryne ". doi:10.1351 / goldbook.A00465
- ^ IUPAC, Kimyasal Terminoloji Özeti, 2. baskı. ("Altın Kitap") (1997). Çevrimiçi düzeltilmiş sürüm: (2006–) "Benzinler ". doi:10.1351 / goldbook.B00634
- ^ a b c d e Hans Henning Wenk, Michael Winkler, Wolfram Sander (2003). "Bir Asırlık Aryne Kimyası". Angew. Chem. Int. Ed. 42 (5): 502–528. doi:10.1002 / anie.200390151. PMID 12569480.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ IUPAC, Kimyasal Terminoloji Özeti, 2. baskı. ("Altın Kitap") (1997). Çevrimiçi düzeltilmiş sürüm: (2006–) "Dehidroarenler ". doi:10.1351 / goldbook.D01574
- ^ IUPAC Altın Kitap "benzinler" için giriş "tanımlar"m-benzyne "ve"p1,3- ve 1,4-didehidrobenzen için hatalı terimler olarak -benzin "
- ^ Anslyn, E. V .; Dougherty, D.A .: Modern Fiziksel Organik Kimya, Üniversite Bilim Kitapları, 2006, s612.
- ^ Gampe, C. M .; Carreira, E.M. (2012). "Doğal Ürün Sentezinde Arynes ve Cyclohexyne". Angew. Chem. Int. Ed. Engl. 51 (16): 3766–78. doi:10.1002 / anie.201107485. PMID 22422638.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ Radziszewski, J. G .; Hess, Jr. B. A .; Zahradnik, R. (1992). "O-Benzyne'in Kızılötesi Spektrumu: Deney ve Teori". J. Am. Chem. Soc. 114: 52. doi:10.1021 / ja00027a007.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ Gilchrist, T.L.Ek C: Üç Bağlı Fonksiyonel Grupların Kimyası, Bölüm 1. Patai, S .; Rappaport, Z. Eds., John Wiley & Sons, New York, 1983
- ^ Hoffmann, R .; Imamura, A .; Hehre, W. J. (1968). "Benzinler, dehidro-konjüge moleküller ve araya giren bir dizi sigma bağıyla ayrılan orbitallerin etkileşimi". J. Am. Chem. Soc. 90 (6): 1499. doi:10.1021 / ja01008a018.
- ^ a b Wittig, Georg (1959). "Triptycene". Org. Synth. 39: 75. doi:10.15227 / orgsyn.039.0075.
- ^ Sullivan, John M. (1971-06-01). "Benzendiazonyum-2-karboksilat hidroklorürün hazırlanması sırasında patlama". Kimya Eğitimi Dergisi. 48 (6): 419. Bibcode:1971JChEd..48..419S. doi:10.1021 / ed048p419.3. ISSN 0021-9584.
- ^ a b Logullo, Francis M .; Seitz, Arnold M .; Friedman, Lester (1968). "Benzendiazonyum-2-Karboksilat ve Bifenilen (Benzendiazonyum, Ö-karboksi-, hidroksit, iç tuz) ". Org. Synth. 48: 12. doi:10.15227 / orgsyn.048.0012.
- ^ a b c d e f g Tadross, P. M .; Stoltz, B.M. (2012). "Doğal Ürün Toplam Sentezinde Arynes'in Kapsamlı Tarihi". Chem. Rev. 112 (6): 3550–3577. doi:10.1021 / cr200478h. PMID 22443517.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ Hoye, T. R .; Baire, B .; Niu, D .; Willoughby, P. H .; Woods, B.P. (2012). "Hexadehydro-Diels-Alder reaksiyonu". Doğa. 490 (7419): 208. Bibcode:2012Natur.490..208H. doi:10.1038 / nature11518. PMC 3538845. PMID 23060191.
- ^ a b Campbell, C.D .; C.W. Rees (1969). "Reaktif ara maddeler. Bölüm I. 1- ve 2-aminobenzotriazol'ün sentezi ve oksidasyonu". J. Chem. Soc. C. 1969 (5): 742–747. doi:10.1039 / J39690000742.
- ^ Panar Manuel (1961). Nükleofilik Aromatik Yer Değiştirmenin Eliminasyon-Ekleme Mekanizması. Pasadena, CA: California Institute of Technology (Doktora Tezi). sayfa 4–5.
- ^ H., Lowry, Thomas (1987). Organik kimyada mekanizma ve teori. Richardson, Kathleen Schueller (3. baskı). New York: Harper & Row. pp.643. ISBN 0060440848. OCLC 14214254.
- ^ a b Anslyn, E. V .; Dougherty, D.A. Modern Fiziksel Organik Kimya. Üniversite Bilim Kitapları, 2006
- ^ Diemer, V .; Begaut, M .; Leroux, F. R .; Colobert, F. Avro. J. Org. Chem. 2011, 341
- ^ Mizukoshi, Yoshihide; Mikami, Koichiro; Uchiyama, Masanobu (2015). "Elusive Poly'nin Kolayca Sentezlenmesini Sağlayan Aryne Polimerizasyonu (orto-arilen) s ". J. Am. Chem. Soc. 137 (1): 74–77. doi:10.1021 / ja5112207. PMID 25459083.
- ^ Heaney, H .; Millar, I.T. (1960). "Trifenilen". Organik Sentezler. 40: 105.; Kolektif Hacim, 5, 1973, s. 1120
- ^ "1,2,3,4-Tetrafenilnaftalin". Organik Sentezler. 46: 107. 1966. doi:10.15227 / orgsyn.046.0107.
- ^ "1,2,4,5-Tetrabromobenzenin bir 1,4-Nenzadiyne Eşdeğeri olarak Kullanımı: Anti- ve Syn-1,4,5,8-tetrahidroantrasen 1,4: 5,8-diepoksitler". Organik Sentezler. 75: 201. 1998. doi:10.15227 / orgsyn.075.0201.
- ^ Buszek, K. R .; Brown, N .; Kuo, D. (2009). "(±) -cis-Trikentrin A ve (±) -Herbindol A'nın Intermolecular Indol Aryne Cycloaddition yoluyla Kısa Toplam Sentezi". Org. Mektup. 11: 201. doi:10.1021 / ol802425m. PMC 2723800. PMID 19055375.
- ^ Pellissier, H .; Santelli, M. Dörtyüzlü, 2003; 59, 701
- ^ Stevens, R. V .; Bisacchi, G. S. J. Org, Chem. 1982; 47, 2396
- ^ Sato, Y .; Tamura, T .; Mori, M. Angew. Chem. Int. Ed. 2004; 43, 2436
- ^ Guyot, M .; Molho, D. Tetrahedron Lett. 1973; 14, 3433
- ^ a b c Blake, M.E .; Bartlett, K. L .; Jones, M. Jr (2003). "Bir Fenil Grubunun 1,2-Kayması Yoluyla o-Benzine Dönüşümü A m-Benzin". J. Am. Chem. Soc. 125 (21): 6485–90. doi:10.1021 / ja0213672. PMID 12785789.
- ^ Polishchuk, A. L .; Bartlett, K. L .; Friedman, L. A .; Jones, M. Jr (2004). "Bir Fenil Grubunun 1,2-Kayması Yoluyla p-Benzyne'den m-Benzine Dönüşümü. Benzyne Kaskatının Tamamlanması". J. Phys. Org. Kimya. 17 (9): 798–806. doi:10.1002 / poc.797.
- ^ a b Richard R. Jones; Robert G. Bergman (1972). "p-Benzyne. Termal izomerizasyon reaksiyonunda bir ara ürün olarak üretim ve 1,4-benzendil yapısı için tuzak kanıtı". J. Am. Chem. Soc. 94 (2): 660–661. doi:10.1021 / ja00757a071.
- ^ Clauberg, H .; Minsek, D. W .; Chen, P. (1992). "Tekli karbenlerin C3H2. .DELTA.Hf kütle ve fotoelektron spektroskopisi, tekli üçlü boşlukları ile toplamadan sapmaktadır". J. Am. Chem. Soc. 114: 99. doi:10.1021 / ja00027a014.
- ^ Blush, J. A .; Clauberg, H .; Kohn, D. W .; Minsek, D. W .; Zhang, X .; Chen, P. (1992). "Radikaller, karbenler ve çiftadikallerin fotoiyonizasyon kütlesi ve fotoelektron spektroskopisi". Acc. Chem. Res. 25 (9): 385. doi:10.1021 / ar00021a001.
- ^ Chen, P (1996). "Diradical tabanlı Hidrojen Soyutlama Ajanlarının Tasarımı". Angew. Chem. Int. Ed. Engl. 35 (1314): 1478. doi:10.1002 / anie.199614781.
- ^ Stoermer, R .; Kahlert, B. (1902). "Ueber das 1- ve 2-Brom-cumaron". Berichte der Deutschen Chemischen Gesellschaft. 35 (2): 1633–1640. doi:10.1002 / cber.19020350286.
- ^ Wittig, G .; Pieper, G .; Fuhrmann, G. (1940). "Über die Bildung von Diphenyl aus Fluorbenzol ve Fenil-lityum (IV. Mitteil. Über Austauschreaktionen mit Phenyl-lithium)". Berichte der Deutschen Chemischen Gesellschaft (A ve B Serisi). 73 (11): 1193–1197. doi:10.1002 / cber.19400731113.
- ^ Wittig, Georg (1942). "Fenil-lityum, der Schlüssel zu einer neuen Chemie metallorganischer Verbindungen". Die Naturwissenschaften. 30 (46–47): 696–703. doi:10.1007 / BF01489519.
- ^ Wittig, G (1954). "Fortschritte auf dem Gebiet der organischen Aniono-Chemie". Angewandte Chemie. 66: 10–17. doi:10.1002 / ange.19540660103.
- ^ a b Roberts, John D. (1953). "Klorobenzen-1-C14'ün Potasyum Amid1 ile Reaksiyonunda Yeniden Düzenleme". Amerikan Kimya Derneği Dergisi. 75 (13): 3290–3291. doi:10.1021 / ja01109a523.
- ^ Roberts, John D. (1956). "Halobenzenes 1 Aminasyon Mekanizması". Amerikan Kimya Derneği Dergisi. 78 (3): 601–611. doi:10.1021 / ja01584a024.
- ^ Roberts, John D. (1956). "İkame Edilmiş Halobenzenlerin Aminasyonlarında Yönelim 1". Amerikan Kimya Derneği Dergisi. 78 (3): 611–614. doi:10.1021 / ja01584a025.
- ^ Modern Arilasyon Yöntemleri. Lutz Ackermann 2009 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim tarafından düzenlenmiştir. ISBN 978-3-527-31937-4
- ^ Heaney, H. (1962). "Benzyne ve İlgili Ara Maddeler". Kimyasal İncelemeler. 62 (2): 81–97. doi:10.1021 / cr60216a001.
- ^ Wittig, G .; Pohmer, L. Angew. Chem. 1955; 67(13), 348.
- ^ Warmuth, R .; Yoon (2001). "Yarı kanser ve kimyada son gelişmeler". Acc. Chem. Res. 34 (2): 96. doi:10.1021 / ar980082k. PMID 11263868.
- ^ Yüzeyde; Pérez, E. Guitián; Peña, L.Gross (2015). "Atomik kuvvet mikroskobu ile arinlerin yüzey üzerinde üretimi ve görüntülenmesi". Doğa Kimyası. 7 (8): 623–8. Bibcode:2015NatCh ... 7..623P. doi:10.1038 / nchem.2300. PMID 26201737.
- ^ Galm, U; Hager, MH; Van Lanen, SG; Ju, J; Thorson, JS; Shen, B (Şubat 2005). "Antitümör antibiyotikler: bleomisin, enediynes ve mitomisin". Kimyasal İncelemeler. 105 (2): 739–58. doi:10.1021 / cr030117g. PMID 15700963.
- ^ Kametani, T .; Ogasawara, K. J. J. Chem. Soc., C 1967, 2208
- ^ Day, J. J .; McFadden, R. M .; Virgil, S. C .; Kolding, H .; Alleva, J. L .; Stoltz, B.M. (2011). "(+) - lifagalin katalitik enantiyoselektif toplam sentezi". Angew. Chem. Int. Ed. 50 (30): 6814–8. doi:10.1002 / anie.201101842. PMC 3361906. PMID 21671325.
- ^ Soorukram, D .; Qu, T .; Barrett, A.G.M. (2008). "Dört Bileşenli Benzin Bağlanma Reaksiyonları: Dehidroaltenuen B'nin Kısa Bir Toplam Sentezi". Org. Mektup. 10 (17): 3833–3835. doi:10.1021 / ol8015435. PMID 18672878.CS1 Maint: yazar parametresini kullanır (bağlantı)
Dış bağlantılar
 İle ilgili medya Arynes Wikimedia Commons'ta
İle ilgili medya Arynes Wikimedia Commons'ta
