Aza-Cope yeniden düzenlenmesi - Aza-Cope rearrangement - Wikipedia
Yeniden düzenlemeler, özellikle katılabilecek olanlar kademeli reaksiyonlar, gibi aza-Cope yeniden düzenlemeleriyüksek pratik ve kavramsal öneme sahiptir. organik Kimya basit başlangıç malzemelerinden hızla yapısal karmaşıklık oluşturma kabiliyetleri nedeniyle. Aza-Cope yeniden düzenlemeleri, heteroatom versiyonlarının örnekleridir. Yeniden düzenleme, ki bu [3,3] -sigmatropik yeniden düzenleme iki arasındaki tek ve çift bağları değiştiren müttefik bileşenleri. Woodward-Hoffman kurallarına uygun olarak, termal aza-Cope yeniden düzenlemeleri üst düzeyde ilerler.[1] Aza-Cope yeniden düzenlemeleri genellikle molekül içindeki nitrojenin konumuna göre sınıflandırılır (şekle bakın):

Bir aza-Cope yeniden düzenlemesinin ilk örneği, her yerde bulunan katyonik 2-aza-Cope yeniden düzenlenmesi yeniden düzenlemenin kolay doğası nedeniyle, Cope yeniden düzenlemesinden 100-200 ° C daha düşük sıcaklıklarda gerçekleşir.[2] Bu yeniden düzenlemenin kolay doğası, hem katyonik 2-aza-Cope'un doğası gereği termo nötr olması gerçeğine, yani başlangıç materyali veya ürün için hiçbir önyargı olmadığı anlamına gelir. aktivasyon bariyerini düşüren molekülde yüklü heteroatom. Daha az yaygın olan 1-aza-Cope yeniden düzenlenmesi ve 3-aza-Cope yeniden düzenlenmesi birbirlerinin mikroskobik tersi. 1- ve 3-aza-Cope yeniden düzenlemeleri, yüksek aktivasyon engellerine ve sınırlı sentetik uygulanabilirliğe sahiptir, bu da görece belirsizliklerini hesaba katar.[3][4][5]
Sentetik kullanımını maksimize etmek için, katyonik 2-aza-Cope yeniden düzenlemesi normal olarak yeniden düzenlemenin bir tarafına doğru termodinamik bir önyargı ile eşleştirilir. En yaygın ve sentetik olarak yararlı strateji, bir Mannich siklizasyonu ile katyonik 2-aza-Cope yeniden düzenleme ve bu makalenin çoğunun konusudur. Bu tandem aza-Cope / Mannich reaksiyonu, hafif reaksiyon koşulları, diastereo seçicilik ve geniş sentetik uygulanabilirliği ile karakterize edilir. Asil ikameli maddelere kolay erişim sağlar. pirrolidinler gibi doğal ürünlerde yaygın olarak bulunan bir yapı alkaloidler, ve özellikle striknin ve crinine olmak üzere bir kaçının sentezinde kullanılmıştır.[6] Larry E. Overman ve iş arkadaşları bu reaksiyonla ilgili kapsamlı araştırmalar yaptı.[1]
Katyonik 2-aza-Cope yeniden düzenlenmesi

En uygun şekilde 2-azonia- [3,3] -sigmatropik yeniden düzenleme olarak adlandırılan katyonik 2-aza-Cope yeniden düzenlemesi, Larry E. Overman ve çalışma arkadaşları tarafından kapsamlı bir şekilde incelenmiştir. Düzenlemeyi gerçekleştirmek için gereken hafif koşullar ve bunun yanı sıra özellikle alkaloid sentezindeki birçok sentetik uygulaması nedeniyle aza-Cope yeniden düzenlemelerinin en kapsamlı çalışılanıdır. Termodinamik olarak, genel 2-aza-Cope yeniden düzenlemesinin bir ürün eğilimi yoktur, çünkü kopan ve oluşan bağlar, Cope yeniden düzenlemesine benzer şekilde reaksiyonun her iki yönünde de eşdeğerdir. İyonik nitrojen heteroatomunun varlığı, katyonik 2-aza-Cope yeniden düzenlemesinin daha kolay yeniden düzenlenmesi Cope yeniden düzenlemesine kıyasla. Bu nedenle, genellikle bir termodinamik lavabo bir yeniden düzenleme ürününü saptırmak için.[1]
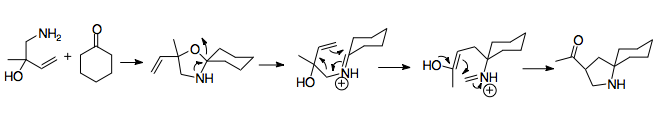
1950'de Horowitz ve Geissman, 2-aza-Cope yeniden düzenlemesinin ilk örneğini bildirdi; bu, bir sentezleme girişiminde başarısızlıkla sonuçlanan şaşırtıcı bir sonuçtur. amino alkol.[2] Ürün büyük olasılıkla Cope yeniden düzenlemesinin bir nitrojen analoğuyla üretildiği için bu keşif, yeniden düzenlemenin temel mekanizmasını tanımladı. Bir allilbenzilaminin (A) formik asit ve formaldehit ile muamelesi bir amino alkole (B) yol açar. Amino alkol, katyonik 2-aza-Cope yeniden düzenlemesine (D) giren asit (C) ilavesiyle bir imine dönüşür. Su, iminyum iyonunu bir amine (E) hidrolize eder. Bu başlangıç malzemesinin sadece formaldehit ile işlenmesi, amin grubunun alkilasyonunun, yeniden düzenlemenin hızlı kolaylığının bir kanıtı olan katyonik 2-aza-Cope yeniden düzenlemesinden sonra gerçekleştiğini gösterdi.[2]

Tamamen hidrokarbon Cope yeniden düzenlemesi için daha katı olanların aksine, gerçekleştirilen reaksiyonun ılımlı ısıtma koşullarından dolayı, bu heteroatomik Cope yeniden düzenlemesi, yeniden düzenlemede bir nitrojen üzerinde pozitif bir yüke sahip olmanın, etkinleştirme bariyerini önemli ölçüde azalttığı hipotezini ortaya çıkardı. yeniden düzenleme.[2]
Reaksiyon mekanizması
Pozitif yüklü nitrojen nedeniyle hız ivmesi

Aza-Cope yeniden düzenlemeleri, Woodward-Hoffman kuralları üstünkörü olarak ilerlemek için. Bununla birlikte, hiçbir zaman açıkça çalışılmamış olsalar da, Overman ve çalışma arkadaşları, temel katalize edilmiş oxy-Cope yeniden düzenleme, yüklü atom sigmatropik yeniden düzenlemeyi tamamen uyumlu bir reaksiyon mekanizmasından (Cope yeniden düzenlemesinde beklendiği gibi), alilik bağı zayıflatan alilik parça üzerindeki pozitif yükün yer değiştirmesi nedeniyle kısmi diradikal / çift kutuplu karaktere doğru bozar. Bu, bağın kopması için azaltılmış bir aktivasyon bariyeri ile sonuçlanır. Dolayısıyla katyonik-aza-Cope yeniden düzenlemesi, Cope yeniden düzenlemesi gibi daha uyumlu işlemlerden daha hızlı ilerler.[6][7]
Geçiş durumu ve stereokimya
Katyonik 2-aza-Cope yeniden düzenlemesi, bir sandalye geçiş durumu için yüksek tercihinden kaynaklanan yüksek stereospesifikliği ile karakterize edilir. Bu yeniden düzenlemenin stereospesifikliğini araştırırken, Overman ve arkadaşları klasik Doering ve Roth deneylerine benzer bir mantık kullandılar.[8] Cope yeniden düzenlemesinin bir sandalye konformasyonu tercih ettiğini gösterdi.[9] Pirolizidin öncüleri üzerinde katyonik 2-aza-Cope / Mannich reaksiyonunu kullanarak, E-alkenlerden cis ikame edicilere sahip pirolizidinlerin ve Z-alkenlerden trans ikame edicilere sahip pirolizidinlerin büyük ölçüde tercih edildiğini gösterdiler, bu sonuçlar sandalye geçiş durumunun göstergesi oldu. Bir tekne geçiş durumu etkin olsaydı, tersi sonuçlar elde edilirdi (aşağıdaki resimde ayrıntılı olarak verilmiştir).[9] Pek çok reaksiyonda olduğu gibi, Z-enolatın dönüşümü, enolat ve halka arasındaki 1,3 diaxial sterik etkileşimlerden ve ikame edicilerin yarı ekvatoral konumlandırmayı tercih etmesinden dolayı daha düşük seçicilik sağlar. Bu, Z-enolat dönüşümü için gereken daha yüksek sıcaklıkları açıklamaya yardımcı olur.[6][9]Tekne geçiş durumu, katyonik-2-aza-Cope yeniden düzenlemesi tarafından, Cope yeniden düzenlemesine göre daha az tercih edilir: Cope yeniden düzenlemesinin bir tekne geçiş durumunda olduğu benzer durumlarda, aza-Cope yeniden düzenlemesi sandalyede devam eder geometri.[1][6][10] Bu sonuçlar, geçiş durumunun kinetik kontrol altında olduğunu ileri süren hesaplamalı kimya sonuçlarıyla uyumludur.[11]

Belirgin bir şekilde, bu stereokimyasal deneyler, katyonik 2-aza-Cope yeniden düzenlemesinin (ve ayrıca Mannich siklizasyonunun), enol veya iminyum tatomerizasyonundan daha hızlı gerçekleştiğini ima eder. Olmasaydı, bu hızlı reaksiyonun kolaylığını vurgulayan anlamlı bir stereokimya gözlemlenmezdi.[1]
Stereokimya için ek hususlar
Aza-Cope / Mannich reaksiyonu, halka genişleyen uyarılar, genellikle hacimli ikame edicileri yarı ekvatoral olarak yerleştiren en uygun sandalye konformasyonu tarafından dikte edilen stereokimyayı izler. Vinil ve amin bileşenleri, bir halka üzerine takıldıklarında ya senkron ya da anti ilişkilere sahip olabilir. Bu ilişki tipik olarak amin ikame edicisi tarafından dikte edilir: hacimli ikame ediciler syn aza-Cope öncüllerine yol açar. Süre anti vinil ve amin ikame edicileri genellikle sadece bir tercih edilen geçiş durumuna sahiptir, bu da cis kaynaşmış bir halka sistemine yol açar, syn ikame edicilerin tercih edilen ürünü değişebilir, çözücülerle sterik etkileşimler veya büyük N-ikame edicilerle dikte edilebilir, bu da hacimli ikame ediciler ve değişebilir geçiş durumu.[12][13]
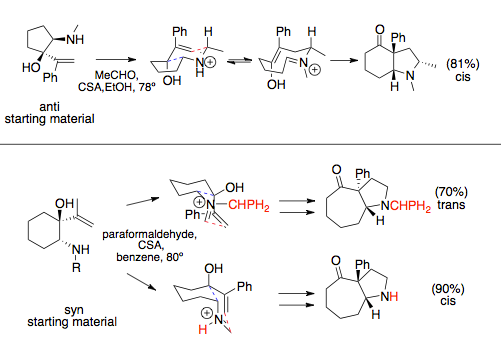
Halka genişleyen annülasyona, yani amino alkollerin ve eterlerin kondansasyonuna katılmayan basit aza-Cope / Mannich reaksiyonları için bağ rotasyonu, Mannich siklizasyonundan daha hızlı gerçekleşir ve rasemik ürünler gözlenir.[14] Bu, amin üzerinde şiral bir yardımcı ikame edici kullanılarak önlenebilir. Halkalara bağlı reaksiyonlar bu bağ rotasyonlarına giremez.[1]

Bir yeniden düzenleme ürününü önyargılı hale getirmek için olası termodinamik lavabolar
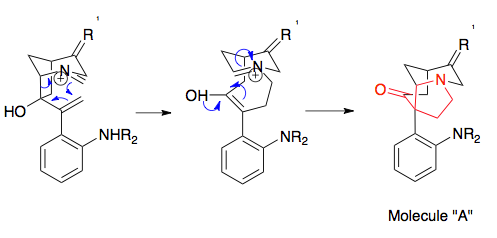
Horowitz ve Geissman'ın ilk örneği katyonik 2-aza-Cope yeniden düzenlemesi ile birleşmek için olası bir termodinamik çöküşü gösterir, burada ürün, aril konjugasyonu yoluyla fenil ikame edicisi tarafından önyargılıdır, ardından iminyumun hidrolizi ile yakalanır. Bir ürünü etkilemenin diğer yöntemleri arasında, ikame edilmiş karbonlar üzerinde daha kararlı olan ikame edicilerin kullanılması, halka suşunun serbest bırakılması (örneğin, yeniden düzenlemeyi siklopropan açıklığı ile eşleştirerek), molekül içi yakalama (resimde) ve yeniden düzenlemeyi Mannich döngüselleştirme ile eşleştirme.[1][15]

Aza-Cope / Mannich Reaksiyonu
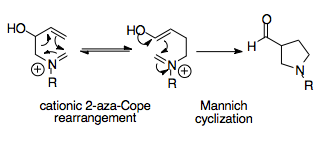
Aza-Cope / Mannich reaksiyonu, basit başlangıç malzemelerinden kompleks siklik moleküller oluşturabildiği için sentetik olarak güçlü bir reaksiyondur. Bu ardışık reaksiyon, bir yeniden düzenleme ürününe doğru termodinamik bir önyargı sağlar, çünkü Mannich siklizasyonu geri döndürülemezdir ve ürünü, bir asil ikamelidir. pirolidin halka, yeniden düzenlemeden daha kararlı.[1][16]
İlk aza-Cope / Mannich reaksiyonu
Overman ve arkadaşları, uygun bir termodinamik lavabo eklenebilirse katyonik 2-aza-Cope yeniden düzenlemesinin potansiyel olarak sentetik olarak güçlü olabileceğini fark ettiler. Mantıkları, başlangıç malzemesine bir nükleofilik ikame, yani yalnızca yeniden düzenlemeden sonra etki eden ve bir Enol iminyum iyonuna saldırmak için hazırlanmıştır.
Reaksiyonun bu ilk raporu, aldehitler ve aza-Cope / Mannich reaksiyon ürünü bir asil ikameli pirolidin halkası olan bir amino alkol oluşturan 2-alkoksi-3-butenaminler arasındaki bir reaksiyondu. Bu basit prosedür yalnızca birkaç saat boyunca hafif bir ısıtma içeriyordu. Önemli bir şekilde, aza-Cope / Mannich reaksiyonu mükemmel verimle tek bir aşamada gerçekleşir. Bu prosedür, alkolün önce metillendiği amino eterlerin (aşağıda gösterilmiştir) yoğunlaşmasına kolayca uygulanır.[16] Aza-Cope / Mannich reaksiyonu gerçekleştirildikten sonra, NaOH ilavesiyle keton oluşturulur.[16] Bu basit durumda amin, bazik ketonlardan iminyum iyonu oluşturamaz; sonraki yöntemler Ketonları reaksiyona dahil etmenin yollarını buldu.[16][17] Bu reaksiyonun faydası, daha az kararlı bir izomer oluştuğunda bile, reaksiyonun yüksek termodinamik avantajını göstererek ilerlediği gerçeğinde açıktır.[12][17]

Reaksiyon mekanizması

Reaksiyonun genel ürünü potansiyel olarak iki ayrı yolla meydana gelebilir: aza-Cope / Mannich reaksiyonu veya bir aza-Prins siklizasyonu /pinacol yeniden düzenleme. Bu mekanizmalar, aza-Cope / Mannich reaksiyonunun baskınlığını aydınlatan farklı stereokimyasal özelliklere sahiptir. Aza-Cope / Mannich reaksiyonu, [1,5] dien analogundaki her atomu sp2 hibridizasyon, etiketli R 'pozisyonunda başlangıç materyalinin stereokimyasını silerken, aza-Prins / pinakol yeniden düzenlemesi, aktif mekanizmayı ortaya çıkaran basit bir testi işaret ederek etiketli R' pozisyonunda stereokimyayı korur. "R" pozisyonundaki enantiyomerik olarak saf bir başlangıç materyali, dominant mekanizma aza-Cope / Mannich reaksiyonuysa rasemik bir ürüne yol açmalıdır; baskın mekanizma bir aza-Prins siklizasyonu / pinakol yeniden düzenlemesi ise stereokimya korunmalıdır. patika. Basit bir deney, ürünün rasemik olduğunu doğruladı ve operasyon mekanizması olarak aza-Cope Mannich reaksiyonunun açık kanıtını sağladı. Diğer deneyler, bir aza-Prins / pinakol yolunda oluşan karbenium iyonunun, ikame edicisinin pozitif yükünü stabilize etme kabiliyetinden etkileneceği ve böylece yolun reaktivitesini değiştireceği bilgisini kullanarak bunu doğruladı. Bununla birlikte, çeşitli sübstitüentlerin reaksiyonun sonucu üzerinde çok az etkiye sahip olduğu gösterildi ve yine operasyon mekanizması olarak aza-Cope Mannich reaksiyonuna işaret edildi.[14]Shanahan laboratuvarından alınan son literatür, yalnızca önemli ölçüde artmış alken nükleofilisitesi ve iminyum elektrofilisitesi ile ilişkili nadir aza-Prins / pinakol yolunu desteklemektedir.[1][6][18][19]
Aza-Cope / Mannich reaksiyonu, genellikle aşağıdaki sonuçlara göre yüksek diastereo seçicilik gösterir. katyonik 2-aza-Cope yeniden düzenlemesinin geçiş durumunu aydınlatan stereokimyasal deneyler, bu ardışık reaksiyon yolu bu deneylerin ayrılmaz bir parçası olduğu için takip eder. Yeniden düzenlemenin stereokimyası biraz daha karmaşıktır. alil ve amin ikame edicileri bir halka üzerine yerleştirilir ve dolayısıyla birbirine cis veya trans.
Aza-Cope / Mannich reaksiyonunun başlangıç materyali olan amino alkol, aynı zamanda oxy-Cope yeniden düzenleme (aşağıda), hem iyonik katılımdan kaynaklanan hız ivmesi, hem de Mannich siklizasyonunun analog enol çökme fonksiyonu ve oksi-Cope yeniden düzenlemesinde keto-enol tautomerizasyonu için.[7]

2-aza-Cope / Mannich reaksiyonunun sentetik uygulamaları
Aza-Cope / Mannich reaksiyonu genellikle sentezlemenin en verimli yoludur. pirolidin halkalar ve dolayısıyla doğal ürün toplam sentezlerinde bir dizi uygulamaya sahiptir. Diyastero seçiciliği nedeniyle, bu reaksiyon, birçok asimetrik örnekte görüldüğü gibi, asimetrik sentez araçları kataloğuna eklenmiştir. alkaloidler reaksiyon kullanılarak sentezlendi. Gördüğümüz gibi ilk aza-Cope / Mannich reaksiyonu ve reaksiyonun aydınlatılmasında stereokimya, aza-Cope / Mannich reaksiyonu oluşturmak için kullanılabilir pirolidin yüzükler ve pirolizidin yüzükler. Sentezde yararlı birçok ek halka yapısı oluşturmak için kullanılabilir, örneğin indolizidin döngüleri ve indol yüzükler.[1][7]
(-) - striknin toplam sentezi
Bu reaksiyonun faydasını gösteren klasik örnek, strikninin Overman sentezidir. Striknin doğal olarak oluşan oldukça zehirlidir alkaloit, ağaçta ve tırmanan çalı cinsinde bulunur Strychnos. Strychnine, genellikle küçük bir omurgalı böcek ilacı olarak kullanılır. İlk striknin toplam sentezi, R. B. Woodward,[20] doğal ürün sentezinde önemli bir adımı temsil ediyordu: daha önce karmaşıklığına yaklaşan hiçbir molekül sentezlenmemişti. Sonraki toplam sentezler, benzer yöntemler kullanılarak, yani bozulmuş strikninden elde edilebilen bir ara ürün kullanılarak 1980'lerin sonlarına kadar rapor edilmedi. Tüm bu sentezler zorlu koşullar kullandı. Overman sentezi, bu sorunları ortadan kaldırır ve aza-Cope / Mannich reaksiyonunun diastereo seçiciliğinden ve hafif reaksiyon koşullarından yararlanarak, strikninin ilk asimetrik toplam sentezidir. Aza-Cope / Mannich reaksiyon adımı, neredeyse kantitatif verimle ilerledi. Overman sentezi, buna göre, öncekilerden birkaç kat daha etkilidir.[20]

Overman'ın striknin sentezi, aza-Cope / Mannich yeniden düzenlemesi için gerekli olan öncüllerin hazırlanmasının yararlı bir örneğini temsil eder ve bir epoksit halka açıklığı. Yeniden düzenleme substratının sentezinin, aza-Cope / Mannich reaksiyonu için gerekli başlangıç materyallerine yol açan anahtar aşamaları, iki öncüyü bir araya getirmek için bir Stille reaksiyonunu, bir çift bağın epoksidasyonunu içeriyordu. tert-Bütil hidroperoksit, bir Wittig reaksiyonu ketonu bir alkene dönüştürmek ve bir siklizasyon aşaması. Amin alkilasyonu (gösterilmemiştir), molekülü yeniden düzenleme substratına dönüştürür. Önemli bir şekilde, bu molekül aza-Cope / Mannich reaksiyonunun enantiyomerik kesinliğini gösterir, çünkü basit bir enantiyomerik başlangıç materyali, nihai enantiyomeri belirler: strikninin enantiyomeri, başlangıç materyalinin enantiyomeri kullanılarak üretildi.[20][21]

Yeniden düzenleme substratının sentezinin derinlemesine ayrıntılarını içeren Overman sentezi ve ayrıca reaksiyonun son adımları burada ayrıntılı olarak açıklanmıştır: Overman sentezi (-) - Strychnine.
(-) - crinine sentezi
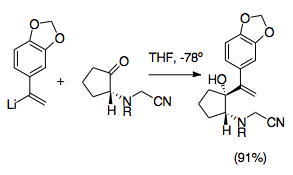
Crinine ailenin bir alkaloidi Amaryllidaceae ve asimetrik toplam sentezi, aza-Cope / Mannich reaksiyonunu kullanan ilklerden biriydi. Bu sentez, reaksiyonun en yararlı sentetik stratejilerinin birçoğundan yararlandığından, aza-Cope / Mannich reaksiyonunun geliştirilmesinde önemli bir adımı temsil eder. Bu reaksiyon, katyonik-2-aza-Cope yeniden düzenlemesinin yüksek diastereo seçiciliğinin yanı sıra siyanometil grubu sırasında amini korumak için vinillityum ek olarak ve iminyum oluşumunu teşvik etmek için ayrılan bir grup olarak, gümüş nitrat.[22]Bu sentez, birçok siyanometil grubu pirolidin ve indolizidin oluşumuna doğru sentetik olarak yararlı bir yol sağlamak.

Köprülü trisiklik alkaloidlerin sentezi
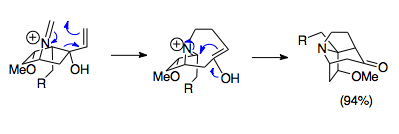
Overman ve arkadaşları, aza-Cope / Mannich reaksiyonunu kullanarak karmaşık köprülü trisiklik yapıları sentezlemek için yöntemler geliştirdiler. Bu aza-trisiklik yapılar komplekste bulunur Stemona alkaloid ailesinin yanı sıra bazıları gibi potansiyel ilaçlarda immünosupresanlar. Gösterilen örnek, bir 1-aza-bisiklo [2.2.1] heptan tuzu başlangıç malzemesini 80 ° C'de paraformaldehit ile birleştiren basit bir reaksiyondur ve pivotal aza-trisiklik yapısını oluşturur. Stemona alkaloid moleküller. Dikkat çekici bir şekilde, bu halka sisteminin steriklerinden kaynaklanan olumsuz yörünge örtüşmesine rağmen, reaksiyon% 94 verimle ilerler ve bu reaksiyonun gücünü olumsuz koşullarda bile ortaya çıkarır.[23]
Genel halka açma ve genişletme

Aza-Cope / Mannich reaksiyonu, mevcut halka döngüleri ile birleştirildiğinde, genellikle indolizidin döngüleri (bir sikloheksan halkasına bağlı bir pirolidin). Bu tipik yüzük halka burada siklopentan parçası yeniden düzenleme ile açılır ve bir pirolidin halkasına bağlı altı üyeli bir halka oluşturmak için Mannich siklizasyonuyla kapatılırken, en popüler aza-Cope / Mannich anülasyonu tek değildir. Enol ve iminyum iyonları, Mannich siklizasyonuna girmek için yeterince yakın olduğundan, yedi üyeli halka döngüleri de sentezlemek mümkündür.[22] Enol ve iminium arasında yakınlık olmamasından dolayı, bu reaksiyon kullanılarak makrosikl sentezi bildirilmemiştir.[6]Vinil oksazolidin aynı zamanda yeniden düzenleme substratları olarak da kullanılabilir. Bu yeniden düzenleme ilk olarak Vinil oksazolidin, aminobutenol tarafından sikloheksanon saldırısından, daha sonra ısı ve asit kullanılarak aza-Cope / Mannich reaksiyonuna girer (Lewis veya protic). Bu örnek kırılır ve ardından beş üyeli bir halka oluşturur. Daha karmaşık örnekler oksazolidini başka bir halkaya bağlayarak indolizidin döngülerinin oluşturulması için ek yöntemler sunar.[24]
Aza-Cope / Mannich reaksiyonunun kapsamı
Aza-Cope / Mannich reaksiyonunun diğer yöntemlere kıyasla çok sayıda avantajı vardır. Tepkimenin yumuşak koşulları eşleşmiyor: normalde 80 ° C'den yüksek olmayan hafif ısıtma, çok çeşitli çözücüler ve 1 stoikiometrik eşdeğer asit ilavesi, genellikle Kamforsülfonik asit (CSA) veya bir Lewis asidi. Pirolidin sentezine giden diğer yollar stereospesifiklik ile rekabet edemez, pirolidin türevleri içeren yapılarda geniş ölçekli uygulamalar ve olası başlangıç materyallerinin geniş kapsamı. Reaksiyon sergiler yüksek diastereo seçicilik ve sağlam, ilerliyor geçiş durumunda zayıf yörünge örtüşmesi ile karşılaşıldığında bile.[1]

Aza-Cope / Mannich reaksiyonunun avantajları, iki ana kategoriye ayrılan reaksiyon için başlangıç materyallerinin sentezi üzerine araştırmaları motive etti: amin ilavesi ve iminyum oluşumu (kırmızı ve vinil ikame maddesinin kurulumu (mavi). Reaksiyonda çok çeşitli N-ikame edicileri (R), alkil ve aril kullanılabilir ve bunlardan bazıları stereokimyasal sonuç reaksiyonun. Vinil grupları genellikle 1,1 veya 1,2-Disübstitüe olanlarla sınırlıdır (R'de ikame edicilerle vinil)1ve R1, R2 sırasıyla), geniş bir yelpazede elektronik ve sterik çeşitlilik tolere edilir.[1]
Amin ilavesi ve iminyum oluşumu
Epoksit halka açıklığı
Epoksitlerin halka suşu, bir alkol grubundan iki atom uzağa bir amin grubunun yerleştirilmesi için faydalı bir metodoloji sağlar. Epoksit ilk önce bromür nükleofilik atağıyla kırılabilir. Birincil aminler, aromatik aminler veya lityum anilitler nükleofiller olarak da kullanılabilir. Koruyucu O-metilasyon genellikle bu adımı izler ve kolayca ilerler.

Sterikler yalnızca uygun karbona (ikinci karbonun aksine terminal karbon) saldırıya izin verdiğinde, molekül içi bir nitrojenin doğrudan saldırısı etkilidir. striknin sentezi.[16][25]
Iminium iyon oluşumu
Kurulu aminden iminyum iyonu oluşturmanın en yaygın yolu, formaldehit veya paraformaldehit asit katalizli yoğunlaşma iminium oluşturmak için. Overman'ın striknin sentezi bu yöntemi belirtir.[6][25] Bazen, molekül içi karboniller kullanılır.[9] İminyum iyon oluşumu için diğer yöntemler arasında siyanometil grupları veya kullanarak karbonil öncüleri olarak oksazolidinler.

Amin alkilasyonu
Amin alkilasyonu, öncüleri imine etmek için yaygın bir yöntemi temsil eder. Doğrudan S ile amin alkilasyonuN2 reaksiyon, aminlerin aşırı alkilleşme eğiliminin yüksek olması nedeniyle başlangıç malzemelerinin üretiminde sadece ara sıra faydalıdır.[25]İndirgeyici aminasyon daha yaygın ve etkili bir alkilleme prosedürüdür, ilk aza-Cope yeniden düzenlemesinde tipik.[16][26][27]Amin alkilasyonunun en kullanışlı ve standart yöntemi, aminin bir amid bağı oluşturmasını sağlamak ve daha sonra bunu, genellikle LiAlH4.[9]
Oksazolidin kullanımı
Ketonlar ve sterik olarak engellenmiş aldehitler, amin onlarla bir iminyum iyonu oluşturamayacağından, temel aza-Cope / Mannich reaksiyonu için uygun değildir. Dehidratasyon oksazolin oluşumunu takiben tam bir asit eşdeğeri varlığında ısıtma bu sorunu aşmanın bir yolunu sunar.Overman, reaksiyon için gerekli iminyum iyonunu oluşturmak için oksizolidinlerin kullanıldığını bildirdi. Oluşum üzerine Overman, siklohekzanonların pirolidin sentezinde karbonil bileşeni için kullanılabileceğini gösterdi.[17] Bu reaksiyon, çeşitli sikloheksanon formları ile ilerledi. Asiklik bir keton ikame edildiğinde, reaksiyon düşük verimle ilerledi ve koltuk konformasyonunda elverişsiz bir bağ suşu yarattığından, sikloheksanonu çift bağlı karbonilden salıvermenin termodinamik elverişliliğini vurguladı. Bu, faydalı bir doğal ürün olan 1-azaspiro [4,5] dekan halka sisteminin en uygun yapılarından birini temsil eder.[17]
Vinil ikamenin kurulumu
Ketonların vinilleşmesi
Vinilasyon, reaksiyonun genişletilmiş işlevselliğine izin vererek ek sentetik avantajlar sunabilir.[23] Organolityum reaktifleri tipik olarak kullanılır. Çoğu zaman, nitrojene bir ikame edici veya koruyucu grup eklenir, ancak bu her zaman gerekli değildir. Reaksiyona lityum ilavesi, nitrojen ona koordinat oluşturduğundan, başlangıç materyali stereokimyası üzerinde büyük bir etkiye sahiptir. Bu koordinasyondan etkilenen başlangıç materyalleri genellikle anti aza-Cope öncüleriyle sonuçlanırken, yüksek oranda ikame edilmiş, sterik olarak engellenmiş aminler içerenler gibi olmayanlar, sin öncülleriyle sonuçlanır. Bu nedenle, nitrojen ikame edicisinin doğası yüksek önem taşımaktadır..[6][25]
Siyanometil grubu kullanımı
Siyanometil grupları, ketonun alilik vinilleşmesi sırasında bir iminyum iyonunu korumanın kolay bir yolunu temsil eder. Siyanamid gruplar ve analoglar genellikle iminyum iyonlarının oluşumunda kullanılmıştır. Tipik olarak, genellikle formaldehit ile amin alkilasyonu ile üretilen bir iminyum iyonu üzerine nükleofilik ilave ile yerleştirilirler. İminyum iyonu bu şekilde maskelenir.[28] Bir siyanometil grubunun kullanımının aza-Cope / Mannich reaksiyonunu kontrol etmek için etkili bir yol sağladığını takip eder. Siyanometil grubu, siyanür tipine benzer bir mantıkla diğer alilik analogun oluşumu sırasında 2-konumunda azotu korur. umpolung. Daha sonra, iminium iyon üretimindeki kullanımına uygun olarak, iminyum iyonunun oluşumu için iyi bir ayrılan grup sağlar.[29] Diğer gümüş ve bakır bileşikleri kullanılmış olmasına rağmen, siyanometil gruplarından iminyum iyon üretimi normalde gümüş nitrat ilavesiyle desteklenir. Bu ek adım, iminyum iyon üretiminin daha hassas kontrolüne izin verir.[6][29] Önemlisi, bu hazırlık reaksiyonları siyanometil / vinillityum etkileşimini önlemek için -78 ° C'de gerçekleştirilmelidir. Bu yöntem aynı zamanda birçok farklı olası N-ikame edicisine izin verir ve oktahidroindollerin sentezini basitleştirmek için kullanılabilir ve piroller.[1][29]

1- ve 3-aza-Cope yeniden düzenlemeleri

1- ve 3-aza-Cope yeniden düzenlemeleri, katyonik 2-aza-Cope yeniden düzenlemesininkinden nispeten çok daha yüksek olan aktivasyon enerjileri nedeniyle katyonik 2-aza-Cope yeniden düzenlemesine kıyasla belirsizdir.
1- ve 3-aza-Cope, enamin oluşumunun tersine imin oluşumuna doğru bir önyargıya sahiptir, çünkü karbon-nitrojen π-bağlanması, karbon-nitrojen σ-bağından daha güçlüdür, yani 3-aza-Cope yeniden düzenlemesi termodinamik olarak tercih edilir, 1-aza-Cope yeniden düzenlemesi değilse: imin, enerji açısından yaklaşık 10 kcal / mol daha azdır. Dolayısıyla, 3-aza Cope'un büyük aktivasyon engelleri kinetik olarak temellendirilir.[30] Hem 1 hem de 3-aza-Cope yeniden düzenlemeleri üzerine yapılan araştırmalar, aktivasyon engellerini düşürmek için iyi itici güçler bulmaya odaklanmıştır. Bu yeniden düzenlemelerin çeşitli versiyonları, sentetik kullanım için optimize edilmiştir. 1-aza-Cope yeniden düzenlenmesi normalde termodinamik itici güçlerle eşleştirilir. 3-aza-Cope yeniden düzenlemeleri, kinetik bariyeri termodinamik açıdan elverişli ürününe indirmek için genellikle katyonik olarak gerçekleştirilir.[30][31]
Bu yeniden düzenlemeler, katyonik 2-Aza-Cope yeniden düzenlemesinin mekanik mantığı. 1- ve 3-aza-Cope yeniden düzenlemelerinin her ikisi de tercihli olarak sandalye geçiş durumları yoluyla gerçekleşir (ve katyonik 2-aza-Cope yeniden düzenlemesine benzer şekilde stereokimyayı korur) ve pozitif yükün getirilmesiyle hızlandı, çünkü bu geçiş durumuna daha diradikal / çift kutuplu bir karakter verir.[31] 3-aza-Cope yeniden düzenlemesinin (ve dolayısıyla aynı geçiş durumundan geçen 1-aza-Cope yeniden düzenlemesinin), Cope yeniden düzenlemesi ve katyonik-2- ile karşılaştırıldığında geçiş durumunda daha da az aromatik karakter göstermesi beklenmektedir. aza-Cope yeniden düzenlenmesi, bu düzenlemeler için kinetik aktivasyon engellerinin üstesinden gelmek için gereken daha yüksek sıcaklıklara (Cope Yeniden Düzenlenmesi için gereken sıcaklıklara yakın, hatta daha yüksek zamanlarda, 170 ila 300 derece) katkıda bulunur.[3][31][32]
3-aza-Cope yeniden düzenlenmesi

3-aza-Cope reaksiyonu, 2-aza-Cope yeniden düzenlemesinin, Claisen yeniden düzenlemesiyle benzer ilişkisi nedeniyle tanımlanmasından kısa süre sonra keşfedildi. Aslında, ilk makalelerde, aza-Cope yeniden düzenlemesinin bu versiyonu sıklıkla, yeniden düzenlemenin yanlış bir açıklaması olan amino-Claisen yeniden düzenlemesi olarak anılır, çünkü bu, molekülde hem bir nitrojen hem de oksijenin bulunduğunu ima eder.[3] Bu yeniden düzenleme, en yaygın olarak piperidin olmak üzere karbon içeren heterosiklik halkalar oluşturmak için kullanılabilir.
Bu düzenlemenin ilk örneklerinden biri, yüklü yapıları nedeniyle ısı eklenmeden ekzotermik olarak ilerleyen amonyum tuzlarında meydana gelen yeniden düzenlemeyi fark eden Burpitt tarafından belirlendi - daha da önemlisi, tetrasübstitüe nitrojen olmadan, yeniden düzenleme ilerlemedi.[33] Bu mantığı takiben, 3-aza-Cope yeniden düzenlemesi üzerine yapılan araştırmaların çoğu, bu reaksiyonun yüklü zwitteriyonik versiyonlarına odaklanmıştır, çünkü yük dağılımı, aktivasyon bariyerini düşürmeye yardımcı olur: bazı durumlarda, yeniden düzenleme şu kadar düşük sıcaklıklarda gerçekleşebilir: 20 ° C.[30][34]

HIll ve Gilman ilk olarak 1967'de genel bir yüksüz 3-aza-Cope yeniden düzenlemesini bildirdi. Uygun şekilde ikame edilmiş enaminlerin yaratılması üzerine, yoğun ısıtma, imin ürününe neredeyse tam bir yeniden düzenleme sağladı. Bununla birlikte, bu yeniden düzenleme yolunun sınırlı faydası vardır.[35]
1-aza-Cope yeniden düzenlenmesi

The first discovered 1-aza-Cope reaction was a simple analog to the generic Cope reaction and required intense heat to overcome its large thermodynamic activation barrier; most subsequent work on the 1-aza-Cope rearrangement has thus focused on pairing the arrangement with a driving thermodynamic force to avoid these harsh reaction conditions. It has been hypothesized that the 1-aza-Cope rearrangement rate-determining transition state has partial diradical and dipolar transition state character due to the presence of the heteroatom.[4]
Fowler and coworkers have come up with a scheme that mobilizes the 1-aza-Cope rearrangement as a synthetically useful route.[3] Fowler and coworkers recognized that because the barrier for the reaction lies in the nitrogen's thermodynamic preference to stay as an imine, stabilizing the nitrogen could have a thermodynamically beneficial effect. To that end, Fowler and coworkers installed a carbonyl group on the nitrogen, hypothesizing that the lone pair of the nitrogen would be stabilized by participation in an amide bond, and that the electronegativity of this amide group would lower the LUMO of the imine group, making the transition state more favorable.[3] Using this strategy, Fowler and coworkers were able to use the 1-aza-Cope rearrangement to create piperidin ve piridin türevler. This strategy was shown to be relatively robust, allowing for the formation of products even when forced through a boat transition state, when perturbed with substituent effects, or put in competition with alternative rearrangements.[3] Also significant is the relative ease of production of the reactants, which uses a Diels-Alder reaction paired with relatively simple workup steps, allowing for syntheses using complex cycling.[3]
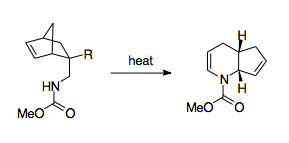
Other methods of overcoming this thermodynamic barrier include pairing it with cyclopropane ring strain release, which allows the reaction to proceed at much lower temperatures.[30][36]

Ayrıca bakınız
- Reviews by Overman[1][37] ve Siegfried Blechert.[38]
Referanslar
- ^ a b c d e f g h ben j k l m n Overman, L. E.; Humphreys, P. G.; Welmaker, G. S. (2011). "The Aza-Cope/Mannich Reaction". Organik Reaksiyonlar. 75. pp. 747–820. doi:10.1002/0471264180.or075.04. ISBN 978-0471264187.
- ^ a b c d Horowitz, R. M.; Geissman, T. A. (1950). "A Cleavage Reaction of α-Allylbenzylamines". J. Am. Chem. Soc. 72 (4): 1518–1522. doi:10.1021/ja01160a025.
- ^ a b c d e f g Chu M.; Wu P.L.; Givre S.; Fowler F.W. (1986). "The 1-AZA-Cope rearrangement". Tetrahedron Mektupları. 27 (4): 461–464. doi:10.1016/S0040-4039(00)85505-7.
- ^ a b Wu, P.L; Fowler, F. W. (1988). "The 1-aza-Cope rearrangement. 2". Organik Kimya Dergisi. 53 (26): 5998–6005. doi:10.1021/jo00261a003.
- ^ Cook G.R.; Barta N.S.; Stille J.R. (1992). "Lewis acid-promoted 3-aza-Cope rearrangement of N-alkyl-N-allyl enamines". Organik Kimya Dergisi. 57 (2): 461–467. doi:10.1021/jo00028a016.
- ^ a b c d e f g h ben Overman, L.E.; Mendelson, L. T.; Jacobsen, E. J. (1983). "Synthesis applications of aza-Cope rearrangements. 12. Applications of cationic aza-Cope rearrangements for alkaloid synthesis. Stereoselective preparation of cis-3a-aryloctahydroindoles and a new short route to Amaryllidaceae alkaloids". J. Am. Chem. Soc. 105 (22): 6629–6637. doi:10.1021/ja00360a014.
- ^ a b c Overman, L. E. (1992). "Charge as a key component in reaction design. The invention of cationic cyclization reactions of importance in synthesis". Acc. Chem. Res. 25 (8): 352–359. doi:10.1021/ar00020a005.
- ^ Doering, W.v.E.; Roth, W. R. (1962). "The overlap of two allyl radicals or a four-centered transition state in the cope rearrangement". Tetrahedron. 18 (1): 67–74. doi:10.1016/0040-4020(62)80025-8.
- ^ a b c d e Doedens, R. J.; Meier, G.P.; Overman, L.E. (1988). "Synthesis applications of cationic aza-Cope rearrangements. Part 17. Transition-state geometry of [3,3]-sigmatropic rearrangements of iminium ions". J. Org. Kimya. 53 (3): 685–690. doi:10.1021/jo00238a039.
- ^ Vogel, E.; Grimme, W.; Dinne, E. (December 1963). "Thermal Equilibrium between cis-1,2-Divinylcyclo-pentane and cis,cis-1,5-Cyclononadiene". Angewandte Chemie International Edition İngilizce. 2 (12): 739–740. doi:10.1002/anie.196307392.
- ^ Lukowski M.; Jacobs K.; Hsueh P.; Lindsay H.A; Milletti M.C. (2009). "Thermodynamic and kinetic factors in the aza-Cope rearrangement of a series of iminium cations". Tetrahedron. 65 (50): 10311–10316. doi:10.1016/j.tet.2009.10.010.
- ^ a b McCann, S. F.; Overman, L. E. (1987). "Medium Effects and the Nature of the Rate-Determining Step in Mannich-Type Cyclizations". J. Am. Chem. Soc. 109 (20): 6107–6114. doi:10.1021/ja00254a033.
- ^ Overman, L. E.; Trenkle, W. C. (1997). "Controlling Stereoselection in Aza-Cope-Mannich Reactions". Isr. J. Chem. 37: 23–30. doi:10.1002/ijch.199700005.
- ^ a b Jacobsen E. J.; Levin J.; Overman L. E. (1988). "Synthesis applications of cationic aza-Cope rearrangements. Part 18. Scope and mechanism of tandem cationic aza-Cope rearrangement-Mannich cyclization reactions". J. Am. Chem. Soc. 110 (13): 4329–4336. doi:10.1021/ja00221a037.
- ^ Marshall, J. A.; Babler, J. H. (1969). "Heterolytic fragmentation of 1-substituted decahydroquinolines". J. Org. Kimya. 34 (12): 4186–4188. doi:10.1021/jo01264a104.
- ^ a b c d e f Overman L. E.; Kakimoto, M. (1979). "Carbon-Carbon Bond Formation via Directed 2-Azonia-[3,3]-Sigmatropic Rearrangements. A New Pyrrolidine Synthesis". J. Am. Chem. Soc. 101 (5): 1310–1312. doi:10.1021/ja00499a058.
- ^ a b c d Overman L.E.; Kakimoto M.; Okawara M. (1979). "Directed 2-azonia-[3,3]-sigmatropic rearrangements. a convenient preparation of substituted 1-azaspiro[4,5]decanes". Tetrahedron Mektupları. 20 (42): 4041–4044. doi:10.1016/s0040-4039(01)86498-4.
- ^ Armstrong, A.; Shanahan, S. E. (2005). "aza-Prins-pinacol approach to 7-azabicyclo[2.2.1]heptanes and ring expansion to [3.2.1]tropanes". Org. Mektup. 7: 1335. doi:10.1021/ja00221a037.
- ^ aza-Prins-pinacol approach to 7-azabicyclo[2.2.1]heptanes and ring expansion to [3.2.1]tropanes Armstrong, A.; Shanahan, S. E. Org. Lett. 2005, 7, 1335
- ^ a b c d R. B. Woodward; M. P. Cava; W. D. Ollis; A. Hunger; H. U. Daeniker; K. Schenker (1963). "The total synthesis of strychnine". Tetrahedron. 19 (2): 247–288. doi:10.1016/S0040-4020(01)98529-1. PMID 13305562.
- ^ Knight, S.D.; Overman, L. E.; Pairaudeau, G. (1993). "Katyonik aza-Cope yeniden düzenlemelerinin sentez uygulamaları. 26. (-) - strikninin enantiyoselektif toplam sentezi". J. Am. Chem. Soc. 115 (20): 9293–9294. doi:10.1021 / ja00073a057.
- ^ a b Overman, L. E.; Sugai, s. (1985). "Total Synthesis of (−)-Crinine. Use of Tandem Cationic Aza-Cope Rearrangement/Mannich Cyclizations for the Synthesis of Enantiomerically Pure Amaryllidaceae Alkaloids". Helv. Chim. Açta. 68 (3): 745–749. doi:10.1002/hlca.19850680324.
- ^ a b Brueggemann, M.; McDonald, A. I.; Overman, L.E.; Rosen, M.D.; Schwink, L.; Scott, J.P. (2003). "Total Synthesis of (±)-Didehydrostemofoline (Asparagamine A) and (±)-Isodidehydrostemofoline". J. Am. Chem. Soc. 125 (50): 15284–15285. doi:10.1021/ja0388820. PMID 14664560.
- ^ Overman, L. E.; Shim, J. (1993). "Synthesis applications of cationic aza-Cope rearrangements. Part 25. Total synthesis of Amaryllidaceae alkaloids of the 5,11-methanomorphanthridine type. Efficient total syntheses of (−)-pancracine and (.+-.)-pancracine". Organik Reaksiyonlar. 58 (17): 4662–4672. doi:10.1021/jo00069a032.
- ^ a b c d Overman L. E.; Kakimoto, M.; Okazaki, M.E.; Meier, G.P. (1983). "Synthesis applications of aza-Cope rearrangements. 11. Carbon-carbon bond formation under mild conditions via tandem cationic aza-Cope rearrangement-Mannich reactions. A convenient synthesis of polysubstituted pyrrolidines". J. Am. Chem. Soc. 105 (22): 6622–6629. doi:10.1021/ja00360a013.
- ^ Overman, L.E.; Fukaya, C. (1980). "Stereoselective total synthesis of (.+-.)-perhydrogephyrotoxin. Synthetic applications of directed 2-azonia-[3,3]-sigmatropic rearrangements". J. Am. Chem. Soc. 102 (4): 1454–1456. doi:10.1021/ja00524a057.
- ^ Borch,R. F .; Bernstein, M. D.; Durst H. D. (1971). "Cyanohydridoborate anion as a selective reducing agent". J. Am. Chem. Soc. 93 (12): 2897–2904. doi:10.1021/ja00741a013.
- ^ Grierson D. S.; Harris, M .; Husson, H.P. (1980). "Synthesis and chemistry of 5,6-dihydropyridinium salt adducts. Synthons for general electrophilic and nucleophilic substitution of the piperidine ring system". J. Am. Chem. Soc. 102 (3): 1064–1082. doi:10.1021/ja00523a026.
- ^ a b c Overman, L. E.; Jacobsen, E. J. (1982). "The cyanomethyl group for nitrogen protection and iminium ion generation in ring-enlarging pyrrolidine annulations. A short synthesis of the amaryllidaceae alkaloid d,1-crinine". Tetrahedron Harf. 67 (51): 2741–2744. doi:10.1016/S0040-4039(00)87446-8.
- ^ a b c d http://www.chem.uky.edu/research/cammers/thesis-pdf/2.pdf
- ^ a b c Jolidon, S.; Hansen, H. J. (1997). "Untersuchungen über aromatische Amino-Claisen-Umlagerungen". Helv. Chim. Açta. 60 (2): 978–1032. doi:10.1002/hlca.19770600329.
- ^ Zahedi Ehsan; Ali-Asgari Safa; Keley Vahid (2010). "NBO and NICS analysis of the allylic rearrangements (the Cope and 3-aza-Cope rearrangements) of hexa-1,5-diene and N-vinylprop-2-en-1-amine: A DFT study". Central European Journal of Chemistry. 8 (5): 1097–1104. doi:10.2478/s11532-010-0084-1.
- ^ Brannock Kent; Burpitt Robert (1961). "Notes- The Chemistry of Isobutenylamines. II. Alkylation with Allylic and Benzyl Halides". J. Org. Kimya. 26 (9): 3576–3577. doi:10.1021/jo01067a645.
- ^ Baxter, E. W.; Labaree, D.; Ammon, H. L.; Mariano, P. S. (1990). "Formal total synthesis of deserpidine demonstrating a versatile amino-Claisen rearrangement/Wenkert cyclization strategy for the preparation of functionalized yohimbane ring systems". J. Am. Chem. Soc. 12 (21): 7682–7692. doi:10.1021/ja00177a032.
- ^ Hill, R. K.; Gilman, N. W. (1967). "A nitrogen analog of the Claisen rearrangement". Tetrahedron Mektupları. 8 (15): 1421–1423. doi:10.1016/S0040-4039(00)71596-6.
- ^ Boeckman, R.K .; Shair, M.D.; Vargas, R. J.; Stolz, L. A. (1993). "Synthetic and Mechanistic Studies of the retro-Claisen Rearrangement. 2. A Facile route to Medium-Ring Heterocycles via Rearrangement of Vinylcyclopropane- and Cyclobutanecarboxaldehydes". J. Org. Kimya. 58 (2): 1295–1297. doi:10.1021/jo00058a001.
- ^ Overman, L. E. (2009). "Molecular rearrangements in the construction of complex molecules". Tetrahedron. 65 (33): 6432–6446. doi:10.1016/j.tet.2009.05.067. PMC 2902795. PMID 20640042.
- ^ Siegfried Blechert (1989). "The Hetero-Cope Rearrangement in Organic Synthesis". Sentez. 1989 (2): 71–82. doi:10.1055/s-1989-27158.
