Kombine bisülfit kısıtlama analizi - Combined bisulfite restriction analysis - Wikipedia
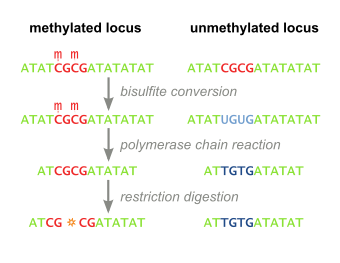
Birleşik Bisülfit Sınırlama Analizi (veya KOBRA) bir moleküler biyoloji tekniğidir. DNA metilasyonu belirli bir genomik lokustaki seviyeler DNA dizisi küçük bir genomik DNA örneğinde.[1] Teknik bir varyasyonudur bisülfit dizileme ve birleştirir bisülfit dönüşümü dayalı polimeraz zincirleme reaksiyonu ile kısıtlama sindirimi. Orijinal olarak mikro diseksiyondan çok az miktarda genomik DNA'yı güvenilir şekilde işlemek için geliştirilmiştir parafin - gömülü doku örnekleri, teknik o zamandan beri yaygın olarak kullanılmaktadır. kanser araştırması ve epigenetik çalışmalar.[2]
Prosedür
Bisülfit Tedavisi
İlgili genomik DNA ile tedavi edilir Sodyum bisülfat, metilasyona bağlı sekans farklılıklarını ortaya çıkarır. Sodyum bisülfit muamelesi sırasında, metillenmemiş sitozin kalıntılar dönüştürülür Urasil, süre metillenmiş sitozin kalıntılar etkilenmez.

PCR Amplifikasyonu

Bisülfit ile muamele edilmiş DNA daha sonra PCR amplifiye edilir, bu da başlangıçta metillenmiş pozisyonlarda sitozin tortuları ve orijinal olarak metillenmemiş pozisyonda timin tortuları (urasile dönüştürülmüş) ile sonuçlanır. Bu adımda kullanılan astarlar şunları içermez CpG siteleri (sitozin metilasyonunun ortak hedefi), bu nedenle amplifikasyon işlemi, metilasyon durumuna göre şablonlar arasında ayrım yapmaz. PCR ürünleri saflaştırılmış sonraki adımda tam sindirimi sağlamak için.
Kısıtlama Özeti
Yukarıdaki adımlar metillenmeye bağlı retansiyona veya CpG içeren kaybına yol açar. kısıtlama enzim siteleri için olanlar gibi TaqI (TCGA) ve BstUI (CGCG), sitozin kalıntısının orijinal olarak metillenmiş olup olmadığına bağlı olarak sırasıyla. Yukarıdaki adımdaki metilasyondan bağımsız amplifikasyona bağlı olarak, ortaya çıkan PCR ürünleri, CpG içeren restriksiyon enzim bölgelerini kaybetmiş veya tutmuş karışık bir fragman popülasyonu olacaktır ve bunların ilgili yüzdeleri, orijinal DNA metilasyon seviyesi ile doğrudan ilişkilendirilecektir. örnek DNA.
PCR ürünleri daha sonra bir kısıtlama enzimi (Örneğin. BstUI), orijinal olarak metillenmiş (CGCG) siteleri ayırırken, orijinal olarak metillenmemiş siteleri (TGTG) bırakacaktır. Başlangıçta metillenmesi nedeniyle tüm CpG bölgelerinin tutulmasını ve eksik bisülfit dönüşümünün kalıntısı olmamasını sağlamak için, aşağıdaki enzimlerle bir kontrol sindirimi gerçekleştirilir. Hsp92II bu, hiçbiri bisülfit dönüşümünden sonra kalmaması gereken CATG sekansını tanır (CpG olmayan metilasyonun nadir istisnası dışında) ve bu nedenle bisülfit dönüşümü tamamlandıysa bölünme meydana gelmemelidir.
Niceleme
Sindirilen parçalar daha sonra poliakrilamid jel elektroforezi sindirilmemiş tek bir büyük parçaya karşılık gelen bantların beklenen görünümü ve sindirilmiş parçalara karşılık gelen çok sayıda küçük bant. Bu bantlardaki kantitatif DNA miktarı, aşağıdaki gibi bir cihazla belirlenebilir: fosfo görüntüleyici, bundan sonra orijinal numunenin metilasyon yüzdesi şu şekilde hesaplanabilir:
Kullanım ve Uygulamalar
COBRA, DNA metilasyon değişikliklerinin taranması gibi birçok araştırmaya dayalı uygulamada yaygın olarak kullanılmıştır. gen destekleyicileri kanser çalışmalarında,[3][4] değişmiş metilasyon modellerinin tespiti baskılı genler,[5] ve memelilerde gelişme sırasında genomdaki metilasyon modellerinin karakterize edilmesi.[6][7]
Tıpta COBRA, anormal DNA metilasyonunu içeren insan hastalığını teşhis etmeye yardımcı olan bir araç olarak kullanılmıştır. Araştırmacılar COBRA'yı denatüre edici yüksek performanslı sıvı kromatografisi teşhisinde genetik damgalama bozukluk Russell-Silver sendromu nerede hipometilasyon baskılı genin H19 Hastaların% 50'ye varan kısmında hastalıktan sorumludur.[8]
Güçlü
- Basit, hızlı ve ucuz: COBRA'da, DNA metilasyon seviyeleri zahmetli alt klonlamaya gerek kalmadan kolayca ve hızlı bir şekilde ölçülür ve sıralama bisülfit dizileme ile olduğu gibi. Test basittir ve standart ucuz moleküler biyoloji reaktifleri ile yapılabilir.
- Yüksek uyumluluk: PCR ve saflaştırma adımları nedeniyle, yöntem yalnızca çok küçük miktarlarda genomik DNA ile çalışmakla kalmaz, aynı zamanda parafin ile işlenmiş örneklerde de çalışır; bunların her ikisi de diğer DNA metilasyon kantifikasyon protokollerinde sorun olabilir. Güney lekelenmesi ve metilasyona duyarlı sınırlama enzimi sindirimi ve ardından PCR.
- Nicel: Bu, metilasyona özgü PCR, nitelikseldir. COBRA ile, DNA metilasyon seviyeleri, belirli bir lokusta doğrudan ölçülebilir ve test başına daha fazla bilgi verir.
- Yüksek verimli numune işleme için ölçeklenebilirlik: COBRA ile, ilgilenilen birçok bölge, aynı restriksiyon enzimi ile sindirilmiş ayrı numunelerde paralel olarak işlenebilir. Bu, her bölgenin, lokus başına birçok klonu sıralayarak daha fazla zamana mal olacak şekilde titizlikle incelenmesi gereken bisülfit sekanslama analizinin tersidir.
- Test başına birden çok sorgu: Metilasyon durumu, tek bir sindirim testinde birden çok CpG içeren kısıtlama noktasında sorgulanabilir.
Zayıf yönler
- Tahlil mevcut kısıtlama sitelerini kullanmakla sınırlı ilgilenilen bölgede ve belirli bir kısıtlama sahası bağlamında meydana gelmeyen metilasyon test edilmeyecektir.
- Eksik sindirim PCR'den sonra enzimlerin kısıtlanmasıyla analizi karıştırabilir: eksik sindirim DNA metilasyonunun olmadığını gösterir (HpaII gibi metilasyona duyarlı bir enzimle kesiliyorsa). Ayrıca, BstUI'nin dönüştürülmemiş alanlarda kesebildiği ve metilasyon seviyelerinin fazla tahmin edilmesine yol açtığı ve bu nedenle HpaII kullanımına sıklıkla ihtiyaç duyulduğu bilinmektedir.[9]
- Karmaşık örneklerde, hücre tipi heterojenlik analizi karıştırabilir DNA dizilenmediğinden, örnekteki farklı hücrelerin dizilerindeki heterojenlik (yani CG dinükleotidinin CA veya CT'ye değiştirilmesi gibi sorgulanan bölgede kazanılmış mutasyonlara sahip olan bir tümör içindeki farklı hücre popülasyonları, sindirim eksikliğinden dolayı görünüşte metillenmiş bir bölgeye yol açan kısıtlama bölgesinin kaybıyla sonuçlanacaktır. Bu, belirli bir örnekteki DNA metilasyon seviyelerinin nicelendirilmesini çarpıtacaktır.
Alternatifler
Genel olarak, COBRA sıklıkla diğer DNA metilasyon analizleri ile birleştirilir ve sıklıkla ilgili bir lokusun ilk taramasında kullanılır. COBRA değiştirilmiş metilasyon modellerini önerirse, bisülfit dizileme gibi daha titiz, emek yoğun teknikler uygulanabilir. MeDIP. Ayrıca PacBio sıralaması, DNA metilasyonunu saptamak için kullanılabilir.
Referanslar
- ^ Xiong, Zhenggang; Laird, Peter W. (1997). "COBRA: hassas ve kantitatif bir DNA metilasyon testi". Nükleik Asit Araştırması. 25 (12): 2532–2534. doi:10.1093 / nar / 25.12.2532. PMC 146738. PMID 9171110.
- ^ Laird, Peter W. (2003). "DNA metilasyon belirteçlerinin gücü ve vaadi". Doğa Yorumları Yengeç. 3 (Nisan): 253–266. doi:10.1038 / nrc1045. PMID 12671664. Bu yazıda 2–11 Şubat tarihleri arasında 576 referans vardı. Scopus
- ^ Shen, Lanlan; et al. (2005). "MGMT Promoter Metilasyonu ve Sporadik Kolorektal Kanserde Alan Kusuru". Ulusal Kanser Enstitüsü Dergisi. 97 (18): 1330–1338. CiteSeerX 10.1.1.536.6096. doi:10.1093 / jnci / dji275. PMID 16174854.
- ^ Suter, Catherine, M .; et al. (2004). "Birden çok kanserli bireylerde MLH1'de Germline epimutasyonu". Doğa Genetiği. 36 (5): 497–501. doi:10.1038 / ng1342. PMID 15064764.
- ^ Bliek, Jet; et al. (2009). "Beckwith-Wiedemann_syndrome'da PLAGL1 ve GNAS lokusları dahil maternal olarak metillenmiş birçok imprinted bölgede hipometilasyon ve memelilerde gelişme sırasında genomdaki DNA metilasyon modellerini karakterize etme" (PDF). Avrupa İnsan Genetiği Dergisi. 17 (5): 611–618. doi:10.1038 / ejhg.2008.233. PMC 2986258. PMID 19092779.
- ^ Wernig, Marius; et al. (2007). "Fibroblastların bir pluripotent ES hücresi benzeri duruma in vitro yeniden programlanması". Doğa. 448 (7151): 318–324. Bibcode:2007Natur.448..318W. doi:10.1038 / nature05944. PMID 17554336.
- ^ Mikkelsen, Tarjei S .; et al. (2008). "Bütünleştirici genomik analiz yoluyla doğrudan yeniden programlamayı incelemek". Doğa. 454 (Temmuz): 49–56. Bibcode:2008Natur.454 ... 49M. doi:10.1038 / nature07056. PMC 2754827. PMID 18509334.
- ^ Hattori, M .; et al. (2009). "Birleşik bisülfit restriksiyon analizi-denatüre edici yüksek performanslı sıvı kromatografi testi ile Russell-Silver sendromunun teşhisi". Genetik Test ve Moleküler Biyobelirteçler. 13 (5): 623–630. doi:10.1089 / gtmb.2009.0018. PMID 19814617.
- ^ Fraga, Mario F .; Esteller, Manel (2002). "DNA Metilasyonu: Yöntemlerin ve Uygulamaların Profili". BioTeknikler. 33 (3): 633–649. doi:10.2144 / 02333rv01. PMID 12238773.

