Epoksidokosapentaenoik asit - Epoxydocosapentaenoic acid
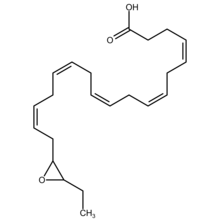
Epoksit dokosapentaenoik asitler (epoksidokosapentaenoik asitler, EDP'lerveya EpDPE'ler) 22 karbonlu düz zincirin metabolitleridir omega-3 yağ asidi, dokosaheksaenoik asit (DHA). Belirli sitokrom P450'yi (CYP) ifade eden hücre türleri epoksijenazlar metabolize etmek çoklu doymamış yağ asidi çift bağlarından birini bir epoksit. Bu metabolik yolların en iyi bilineninde, hücresel CYP epoksijenazlar, 20 karbonlu düz zinciri metabolize eder. omega-6 yağ asidi, arakidonik asit, için epoxyeicosatrienoic asitler (EET'ler); başka bir CYP epoksijenaz yolu, 20 karbonlu omega-3 yağ asidini metabolize eder, eikosapentaenoik asit (EPA) ile epoxyeicosatetraenoic asitler (EEQ'lar). CYP epoksijenazlar benzer şekilde çeşitli diğer PUFA'ları epoksitlere dönüştürür (bkz. epoksijenaz Bu epoksit metabolitlerinin çeşitli aktiviteleri vardır. Bununla birlikte, esasen hepsi hızlı bir şekilde karşılık gelenlerine dönüştürülür, ancak genel olarak çok daha az aktiftir. Vicinal (kimya) her yerde bulunan hücresel dihidroksi yağ asitleri Çözünür epoksit hidrolaz (sEH; ayrıca Epoksit hidrolaz 2 olarak adlandırılır). Sonuç olarak, EDP'ler dahil olmak üzere bu epoksitler, ebeveynlerinin veya yakındaki hücrelerin işlevini düzenleyen kısa ömürlü sinyalleme ajanları olarak çalışır. EDP'lerin (ve EEQ'ların) onları EET'lerden ayıran özel özelliği, omega-3 yağ asitlerinden türetilmeleri ve omega-3 yağ asitlerine ve omega-3 bakımından zengin gıdalara atfedilen bazı yararlı etkilerden sorumlu olmalarıdır. gibi Balık Yağı.[1]
Yapısı
EDP'ler epoksit DHA'nın eikosapentaenoik asit metabolitleri. DHA'da 6 cis vardır (bkz. Cis – trans izomerizmi ) Çift bağlar her biri 4-5, 7-8, 10-11, 13-14, 16-17 veya 19-20 karbonları arasında yer almaktadır. Sitokrom P450 epoksijenazlar, ilgili bir dokosapentaenoik asit (DPA) epoksit rejyoizomeri oluşturmak için bu çift bağlardan herhangi birine saldırır (bkz. Yapısal izomer, pozisyon izomerizmi ile ilgili bölüm (bölgesel izomerizm)). Belirli bir epoksijenaz bu nedenle DHA'yı 4,5-EDP'ye (yani 4,5-epoksi-7Z,10Z,13Z,16Z,19Z-DPA), 7,8-EDP (yani 7,8-epoksi-4Z,10Z,13Z,16Z,19Z-DPA), 10,11-EDP (yani 10,11-epoksi-4Z,7Z,13Z,16Z,19Z-DPA), 13,14-EDP (yani 13,14-epoksi-4Z,7Z,10Z,16Z,19Z-DPA), 16,17-EDP (yani 16,17-epoksi-4Z,7Z,10Z,13Z,19Z-DPA veya 19,20-EDP (yani 19,20-epoksi-4Z, 7Z,10Z,13Z,16Z-DPA. Epoksijenaz enzimleri genellikle her ikisini de oluşturur R/S enantiyomerler her bir önceki çift bağlı pozisyonda; örneğin, sitokrom P450 epoksidazlar 16,17-çift bağ pozisyonunda iki epoksit enantiyomer oluşturmak için DHA'ya saldırır, 16R,17S-EDP ve 16S,17S-EDP.[2] 4,5-EDP metaboliti kararsızdır ve genellikle hücreler tarafından oluşturulan EDP arasında saptanmaz.[3]
Üretim
PUFA'yı, özellikle araşidonik asidi epoksitlere metabolize etme yeteneklerine göre epoksijenazlar olarak sınıflandırılan sitokrom P450 (CYP) süper ailesinin enzimleri şunları içerir: CYP1A, CYP2B, CYP2C, CYP2E, CYP2J ve CYP3A alt ailesi içinde, CYP3A4. İnsanlarda, CYP2C8, CYP2C9, CYP2C19, CYP2J2 ve muhtemelen CYP2S1 izoformlar araşidonik asidi EET'lere metabolize etmekten sorumlu başlıca epoksijenazlar gibi görünmektedir (bkz. Epoxyeicosatrienoic asit # Üretim ). Genel olarak, bu aynı CYP epoksijenazları aynı zamanda DHA'yı EDP'ye metabolize eder (EPA'dan EEQ'ya; CYP2S1 henüz DHA metabolize etme yeteneği için test edilmemiştir), bunu genellikle araşidonik asidi EET'lere metabolize etme oranlarından daha yüksek oranlarda yapar. ; yani, DHA (ve EPA), CYP epoksijenazlarının birçoğu için substratlar olarak araşidonik aside göre tercih edilir görünmektedir.[4] CYP1A1, CYP1A2, CYP2C18, CYP2E1, CYP4A11, CYP4F8, ve CYP4F12 ayrıca DHA'yı EDP'lere metabolize eder.[5] CYP2C8, CYP2C18, CYP2E1, CYP2J2, VYP4A11, CYP4F8 ve CYP4F12 tercihen DHA'yı omega-6 yağ asitlerinden ayıran terminal omega-3 çift bağına saldırır ve bu nedenle DHA'yı esas olarak 19,20-EDP izomerlerine metabolize eder. CYP2C19 DHA'yı 7,8-EDP, 10,11-EDP ve 19,20-EDP izomerlerine metabolize eder[5][6] CYP2J2, DHA'yı EPA'lara, esas olarak 19,20-EPA'ya, araşidonik asidi EET'lere metabolize etme hızının iki katı oranında metabolize eder.[7] Belirtilen CYP'lere ek olarak, CYP4A11, CYP4F8, CYP4F12, CYP1A1, CYP1A2, ve CYP2E1 araşidonik asidi monohidroksi eikosatetraenoik asitlere metabolize ettikleri için CYP epoksigenaz yerine CYP monooksijenaz olarak sınıflandırılanlar (bkz. 20-Hidroksiikosatetraenoik asit ), yani 19-hidroksieikosatetraenoik asit ve / veya 20-hidroksiyeikosatetranoik asit, DHA'yı birincil olarak 19,20-EDP izomerine dönüştürmede epoksigaz aktivitesini üstlenir (bkz. epoxyeicosatrienoic asit ).[5] DHA'yı EDP'lere metabolize edebilen CYP450 epoksijenazlar, karaciğer, böbrek, kalp, akciğer, pankreas, bağırsak, kan damarları, kan lökositleri ve beyin gibi organ ve dokularda geniş çapta dağılmıştır.[8][9] Bu dokuların araşidonik asidi EET'lere metabolize ettiği bilinmektedir; DHA'yı EPD'lere metabolize ettikleri gösterilmiş veya varsayılmıştır.
EDP'ler genellikle belirli hücre tiplerinin EET'leri üreten aynı mekanizmalarla uyarılmasıyla yapılır (bkz. Epoxyeicosatrienoic asit ). Yani hücre uyarımı DHA'nın sn-2 zara bağlı hücrenin konumu fosfolipid bir eylem yoluyla havuzlar Fosfolipaz A2 -tipi enzim ve ardından salınan DHA'nın CYP450 epoksidazlar tarafından saldırısı. Omega-3 yağ asidi yönünden zengin diyetlerin tüketiminin insanlarda olduğu kadar hayvanlarda da EDP ve EEQ serum ve doku düzeylerini çarpıcı bir şekilde yükselttiği dikkate değerdir. Gerçekten de, insanlarda EDP (ve EEQ) düzeylerindeki bu artış, diyetle alınan omega-3 yağ asitlerinin neden olduğu PUFA metabolitlerinin profilindeki en belirgin değişikliktir ve en azından bazı yararlı maddelerden sorumlu olabileceği öne sürülmektedir. diyet omega-3 yağ asitlerine atfedilen etkiler.[1][10]
EDP metabolizması
EET'lere benzer (bkz. Epoxyeicosatrienoic asit ), EDP'ler hücrelerde bir sitozolik tarafından hızla metabolize edilir. çözünür epoksit hidrolaz (sEH, aynı zamanda Epoksit hidrolaz 2 [EC 3.2.2.10.] olarak da adlandırılır) karşılık gelenlerini oluşturmak için Vicinal (kimya) diol dihidroksieikosapentaenoik asitler. Böylece, sEH, 19,20-EDP'yi 19,10-dihdroxydocosapentaenoic asit'e (DPA), 16,17-EDP'yi 16,17-dihidroksi-DPA'ya, 13,14-EDP'yi 13,14-dihidroksi-DPA'ya dönüştürür, 10, 11-EDP ila 10,11-dihidroksi-DPA ve 7,8-EDP ila 7,8-dihidroksi-EDP; 4,5-EDP kararsızdır ve bu nedenle genellikle hücrelerde saptanmaz.[11] Dihidroksi-EDP ürünleri, epoksi öncüleri gibi, enantiyomer karışımlar; örneğin, sEH, 16,17-EDP'yi 16 (S),17(R) -dihidroksi-DPA ve 16 (R), 1 yıl (S) -dihidroksi-DPA.[2] Bu dihidroksi-DPA'lar tipik olarak epoksit öncülerinden çok daha az aktiftir. SEH yolu hızlı hareket eder ve EDP inaktivasyonunun açık ara en baskın yoludur; çalışması, EDP'lerin, eylemleri ebeveynleri ve yakındaki hücreler ile sınırlı olan kısa ömürlü aracılar olarak işlev görmesine neden olur. otokrin ve parakrin sırasıyla sinyalleme ajanları.[11][12][13]
SEH yoluna ek olarak, EET'lere benzer EDP'ler, fosfolipidlere açillenebilir. Asilasyon benzeri tepki; bu yol, EET'lerin eylemini sınırlamaya veya bunları gelecekteki sürümler için saklamaya hizmet edebilir.[2] Son olarak, yine EET'lere benzer şekilde, EDP'ler daha fazla metabolize edilerek inaktivasyona tabidir. Beta oksidasyon.[14]
Klinik önemi
EDP'ler neredeyse EET'ler kadar iyi çalışılmamıştır. Bu, özellikle hayvan çalışmaları için potansiyel klinik önemleri için geçerlidir. EET'lere atfedilen birçok faaliyetin bir seçimiyle karşılaştırıldığında (bkz. Epoxyeicosatrienoic asit ), bugüne kadar bildirilen hayvan çalışmaları, belirli EDP'lerin (16,17-EDP ve 19,20-EDP'nin en sık incelendiğini) bulmuştur: 1) hipertansiyonu ve ağrı algısını azaltmada EET'lerden daha güçlü; 2) Enflamasyonu baskılamada EET'lerden daha güçlü veya en azından eşit güçte; ve 3) EDP'lerin engellemesi nedeniyle EET'lere zıt hareket etmek damarlanma endotel hücre göçü, endotel hücre proliferasyonu ve insan meme ve prostat kanseri hücre hatlarının büyümesi ve metastazı, EET'ler ise bu sistemlerin her birinde uyarıcı etkilere sahiptir.[1][3][13][14] Metabolizma bölümünde belirtildiği gibi, omega-3 yağ asidi bakımından zengin diyetlerin tüketimi hayvanlarda, insanlarda ve insanlarda EDP'lerin ve EEQ'lerin serum ve doku seviyelerini dramatik bir şekilde yükseltir, PUFA metabolitlerinin profilindeki en belirgin değişikliktir. diyet omega-3 yağ asitlerinden kaynaklanır. Bu nedenle, DHA'nın EDP'lere (ve EPA'dan EEQ'lara) metabolizması, diyetle alınan omega-3 yağ asitlerine atfedilen faydalı etkilerin en azından bazılarından sorumlu olabilir.[1][10][14]
Referanslar
- ^ a b c d Fleming, ben (2014). "Vaskülatürde ve kardiyovasküler hastalıkta sitokrom P450 epoksijenaz / çözünür epoksit hidrolaz ekseninin farmakolojisi". Farmakolojik İncelemeler. 66 (4): 1106–40. doi:10.1124 / pr.113.007781. PMID 25244930.
- ^ a b c Spector, A. A .; Kim, H.Y. (2015). "Çoklu doymamış yağ asidi metabolizmasının sitokrom P450 epoksijenaz yolu". Biochimica et Biophysica Açta (BBA) - Lipitlerin Moleküler ve Hücre Biyolojisi. 1851 (4): 356–65. doi:10.1016 / j.bbalip.2014.07.020. PMC 4314516. PMID 25093613.
- ^ a b Zhang, G; Kodani, S; Hamak, B.D. (2014). "Stabilize edilmiş epoksijenlenmiş yağ asitleri iltihabı, ağrıyı, anjiyogenezi ve kanseri düzenler". Lipid Araştırmalarında İlerleme. 53: 108–23. doi:10.1016 / j.plipres.2013.11.003. PMC 3914417. PMID 24345640.
- ^ Frömel, T; Fleming, ben (2015). "Epoxyeicosatrienoic Acid-like endothelium-kaynaklı hiperpolarize faktöre ne oldu? Lipid mediyatörlerinin yeni sınıflarının tanımlanması ve bunların vasküler homeostazdaki rolleri". Antioksidanlar ve Redoks Sinyali. 22 (14): 1273–92. doi:10.1089 / ars.2014.6150. PMID 25330284.
- ^ a b c Vestfalya, C; Konkel, A; Schunck, W.H. (2011). "CYP-eikosanoidler - omega-3 yağ asitleri ve kalp hastalığı arasında yeni bir bağlantı mı?". Prostaglandinler ve Diğer Lipid Aracılar. 96 (1–4): 99–108. doi:10.1016 / j.prostaglandins.2011.09.001. PMID 21945326.
- ^ Fer, M; Dréano, Y; Lucas, D; Corcos, L; Salaün, J. P .; Berthou, F; Amet, Y (2008). "Eikosapentaenoik ve dokosaheksaenoik asitlerin rekombinant insan sitokromları P450 ile metabolizması". Biyokimya ve Biyofizik Arşivleri. 471 (2): 116–25. doi:10.1016 / j.abb.2008.01.002. PMID 18206980.
- ^ Konkel, A; Schunck, W.H. (2011). "Çoklu doymamış yağ asitlerinin biyoaktivasyonunda sitokrom P450 enzimlerinin rolü". Biochimica et Biophysica Açta (BBA) - Proteinler ve Proteomikler. 1814 (1): 210–22. doi:10.1016 / j.bbapap.2010.09.009. PMID 20869469.
- ^ Spector, A. A. (2009). "Araşidonik asit sitokrom P450 epoksijenaz yolu". Lipid Araştırma Dergisi. 50 Özel Sayı: S52–6. doi:10.1194 / jlr.R800038-JLR200. PMC 2674692. PMID 18952572.
- ^ Xu, M; Ju, W; Hao, H; Wang, G; Li, P (2013). "Sitokrom P450 2J2: Dağılım, işlev, düzenleme, genetik polimorfizmler ve klinik önemi". İlaç Metabolizması İncelemeleri. 45 (3): 311–52. doi:10.3109/03602532.2013.806537. PMID 23865864. S2CID 22721300.
- ^ a b Fischer, R; Konkel, A; Mehling, H; Blossey, K; Gapelyuk, A; Wessel, N; von Schacky, C; Dechend, R; Muller, D. N .; Rothe, M; Luft, F. C .; Weylandt, K; Schunck, W.H. (2014). "Diyet omega-3 yağ asitleri, insanlardaki eikosanoid profilini öncelikle CYP-epoksigenaz yolu aracılığıyla modüle eder". Lipid Araştırma Dergisi. 55 (6): 1150–1164. doi:10.1194 / jlr.M047357. PMC 4031946. PMID 24634501.
- ^ a b Harris, T.R .; Hamak, B.D. (2013). "Çözünür epoksit hidrolaz: Gen yapısı, ifadesi ve silinmesi". Gen. 526 (2): 61–74. doi:10.1016 / j.gene.2013.05.008. PMC 3733540. PMID 23701967.
- ^ Bellien, J; Joannides, R (2013). "İnsan sağlığı ve hastalıklarında epoxyeicosatrienoic asit yolu". Kardiyovasküler Farmakoloji Dergisi. 61 (3): 188–96. doi:10.1097 / FJC.0b013e318273b007. PMID 23011468. S2CID 42452896.
- ^ a b O, J; Wang, C; Zhu, Y; Ai, D (2016). "Çözünür epoksit hidrolaz: Metabolik hastalıklar için potansiyel bir hedef". Diyabet Dergisi. 8 (3): 305–13. doi:10.1111/1753-0407.12358. PMID 26621325.
- ^ a b c Wagner, K; Vito, S; İnceoğlu, B; Hamak, B.D. (2014). "Uzun zincirli yağ asitlerinin ve bunların epoksit metabolitlerinin nosiseptif sinyallemedeki rolü". Prostaglandinler ve Diğer Lipid Aracılar. 113-115: 2–12. doi:10.1016 / j.prostaglandins.2014.09.001. PMC 4254344. PMID 25240260.
