Flortaucipir (18F) - Flortaucipir (18F)
 | |
| Klinik veriler | |
|---|---|
| Telaffuz | flor tau 'si pir 18 F |
| Ticari isimler | Tauvid |
| Diğer isimler | 18F-AV-1451, 18F-AV-1451, 18F-T807, Flortaucipir F-18, flortaucipir F 18 (USAN BİZE) |
| Lisans verileri |
|
| Gebelik kategori |
|
| Rotaları yönetim | Damara enjekte etmek |
| ATC kodu |
|
| Hukuki durum | |
| Hukuki durum |
|
| Tanımlayıcılar | |
| |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Kimyasal ve fiziksel veriler | |
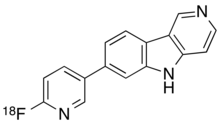
| Formül | C16H10[18F] N3 |
| Molar kütle | 262,27 g / mol |
| 3 boyutlu model (JSmol ) | |
| |
| |
Flortaucipir (18F), marka adı altında satılan Tauvid, bir radyoaktif teşhis maddesi ile kullanım için endikedir Pozitron emisyon tomografi (EVCİL HAYVAN) görüntüleme beyni imgelemek için.[1][2][3]
En yaygın yan etkiler baş ağrısı, enjeksiyon yerinde ağrı ve artmış kan basıncını içerir.[1][2]
İki protein - tau ve amiloid - ayırt edici özelliklerdir. Alzheimer hastalığı.[1] Alzheimer hastalığı olan kişilerde, beyindeki nöronların içinde patolojik tau protein formları gelişerek nörofibriler yumaklar oluşturur.[1] Flortaucipir'den sonra (18F) intravenöz olarak uygulandığında, beyindeki bu tau proteini yanlış katlanmasıyla ilişkili bölgelere bağlanır.[1] Daha sonra beyin, tau patolojisinin varlığını tanımlamaya yardımcı olmak için bir PET taramasıyla görüntülenebilir.[1]
Alzheimer hastalığının beyindeki tau patolojisi adı verilen ayırt edici bir özelliğini görüntülemeye yardımcı olmak için kullanılan ilk ilaçtır.[1]
Tıbbi kullanımlar
Flortaucipir (18F), Alzheimer hastalığı açısından değerlendirilmekte olan bilişsel bozukluğu olan yetişkinler için radyoaktif bir teşhis maddesidir.[2] Alzheimer hastalığının birincil belirteci olan kümelenmiş tau nörofibriler yumakların (NFT'ler) yoğunluğunu ve dağılımını tahmin etmek için beynin pozitron emisyon tomografisi (PET) görüntülemesi için endikedir.[1][2][3]
Flortaucipir (18F) kronik travmatik ensefalopati (CTE) için kişilerin değerlendirilmesinde kullanım için endike değildir.[1][2]
Kimya
Kimyasal olarak flortaucipir F 18, 7- (6- [F-18] floropiridin-3-il) -5H-pirido [4,3b] indoldür.[2]
Tarih
Flortaucipir (18F) Mayıs 2020'de Amerika Birleşik Devletleri'nde tıbbi kullanım için onaylandı.[1][4][5]
Flortaucipir'in güvenliği ve etkinliği (18F) görüntüleme iki klinik çalışmada değerlendirildi.[1] Her çalışmada, beş değerlendirici flortaucipir'i okudu ve yorumladı (18F) görüntüleme.[1] Değerlendiriciler klinik bilgilere kör olmuş ve görüntülemeyi pozitif veya negatif olarak yorumlamışlardır.[1]
İlk çalışma, ölümcül hasta olan ve flortaucipir yaptırmayı kabul eden 156 katılımcıyı kaydetti (18F) görüntüleme ve ölüm sonrası beyin bağış programına katılma.[1] Flortaucipirden dokuz ay içinde ölen katılımcıların 64'ünde (18F) beyin taraması, değerlendiricilerin flortaucipir okuması (18F) tarama, aynı beyindeki nörofibriler yumakların (NFT'ler) yoğunluğunu ve dağılımını değerlendiren bağımsız patologların ölüm sonrası okumaları ile karşılaştırıldı.[1] Çalışma, değerlendiricilerin flortaucipir'i (18F) görüntülerin tau patolojisi olan katılımcıları doğru değerlendirme olasılığı yüksek ve tau patolojisi olmayan katılımcıları doğru değerlendirme olasılığı ortalamadan yükseke kadar idi.[1]
İkinci çalışma, ilk çalışmayla aynı ölümcül hastalığı olan katılımcıları, artı ölümcül hastalığı olan 18 ek katılımcıyı ve Alzheimer hastalığı için değerlendirilen bilişsel bozukluğu olan 159 katılımcıyı (belirtilen hasta popülasyonu) içeriyordu.[1] Çalışma flortaucipir'in (18F) değerlendiricilerin okumaları, birbirlerinin okumalara ilişkin değerlendirmeleri ile hemfikirdir.[1] Mükemmel okuyucu sözleşmesi 1 olurken hiçbir okuyucu sözleşmesi 0 olacaktır.[1] Bu çalışmada, 241 katılımcının tamamında okuyucu anlaşması 0,87 idi.[1] Ölümden sonra teşhis edilen 82 ölümcül hasta katılımcıyı ve bilişsel bozukluğu olan 159 katılımcıyı içeren ayrı bir alt grup analizinde, okuyucu anlaşması belirtilen popülasyondaki katılımcılar için 0.90 ve ölümcül hastalar için 0.82 idi.[1]
FDA onaylı flortaucipir (18F) Amerika Birleşik Devletleri, Avustralya, Belçika, Kanada, Fransa, Japonya, Hollanda ve Polonya'da 322 tesiste gerçekleştirilen 19 denemeden 1921 katılımcının kanıtına dayanmaktadır.[3]
Flortaucipir yeteneği (18F) tau patolojisini saptamak, genellikle şiddetli demans evreleri olan katılımcılarda değerlendirildi ve bilişsel gerilemenin erken aşamalarında, incelenen terminal hastalığı olan katılımcılara göre daha düşük olabilir.[1]
Birleşik Devletler. Gıda ve İlaç İdaresi (FDA) flortaucipir (18F) öncelikli inceleme ve Tauvid'in onayını Avid Radiopharmaceuticals, Inc.'e verdi.[1]
Referanslar
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w "FDA, Alzheimer Hastalığı Yönünden Değerlendirilen Hastalarda Tau Patolojisini Görüntülemek İçin İlk İlacı Onayladı". BİZE. Gıda ve İlaç İdaresi (FDA). 28 Mayıs 2020. Alındı 28 Mayıs 2020.
 Bu makale, bu kaynaktan alınan metni içermektedir. kamu malı.
Bu makale, bu kaynaktan alınan metni içermektedir. kamu malı. - ^ a b c d e f "Tauvid (flortaucipir F 18 enjeksiyonu), intravenöz kullanım için" (PDF). BİZE. Gıda ve İlaç İdaresi (FDA). Alındı 29 Mayıs 2020.
- ^ a b c "Uyuşturucu Denemesine İlişkin Anlık Görüntü: Tauvid". BİZE. Gıda ve İlaç İdaresi (FDA). 28 Mayıs 2020. Alındı 10 Haziran 2020.
- ^ "Lilly, Alzheimer Hastalığı için Değerlendirilen Hastalarda Kullanım için TAUVID (flortaucipir F 18 enjeksiyonu) için ABD FDA Onayını Aldı". Eli Lilly (Basın bülteni). 28 Mayıs 2020. Alındı 28 Mayıs 2020 - PR Newswire aracılığıyla.
- ^ "Tauvid: FDA Onaylı İlaçlar". BİZE. Gıda ve İlaç İdaresi (FDA). Alındı 29 Mayıs 2020.
daha fazla okuma
- Pontecorvo MJ, Devous MD, Kennedy I, vd. (Haziran 2019). "Normal yaşlanma, hafif bilişsel bozukluk ve Alzheimer hastalığı demansında flortaucipir (18F) ile ilgili çok merkezli uzunlamasına bir çalışma". Beyin. 142 (6): 1723–1735. doi:10.1093 / beyin / awz090. PMC 6536847. PMID 31009046.
- Schonhaut DR, McMillan CT, Spina S, vd. (Ekim 2017). "18 F-flortaucipir tau pozitron emisyon tomografisi, yerleşik progresif supranükleer felci kontrollerden ve Parkinson hastalığından ayırır: Çok merkezli bir çalışma". Ann. Neurol. 82 (4): 622–634. doi:10.1002 / ana.25060. PMC 5665658. PMID 28980714.
Dış bağlantılar
- "Flortaucipir F18". İlaç Bilgi Portalı. ABD Ulusal Tıp Kütüphanesi.
- Klinik deneme numarası NCT03507257 "Uzunlamasına Erken Başlangıçlı Alzheimer Hastalığı Çalışma Protokolü (LEADS)" için ClinicalTrials.gov
- Klinik deneme numarası NCT02278367 "18F-AV-1451'in Klinik Değerlendirmesi" için ClinicalTrials.gov
- Klinik deneme numarası NCT02516046 "18F-AV-1451 Otopsi Çalışması" için ClinicalTrials.gov
- Klinik deneme numarası NCT03901092 "Flortaucipir F 18 PET Taraması Yorumlamasının Doğruluğunu ve Güvenilirliğini Değerlendirmek İçin Bir Okuyucu Çalışması" için ClinicalTrials.gov
