Alzheimer hastalığı - Alzheimers disease - Wikipedia
| Alzheimer hastalığı | |
|---|---|
| Diğer isimler | Alzheimer hastalığı, Alzheimer |
 | |
| Normal yaşlı bir beyin (solda) ile Alzheimer'lı bir kişinin beyninin (sağda) karşılaştırması. İkisini ayıran özelliklere dikkat çekiliyor. | |
| Telaffuz |
|
| Uzmanlık | Nöroloji |
| Semptomlar | Son olayları hatırlamada güçlük, dil ile ilgili sorunlar, yönelim bozukluğu, ruh hali[1][2] |
| Olağan başlangıç | 65 yaş üstü[3] |
| Süresi | Uzun vadeli[2] |
| Nedenleri | Çok az anladım, çok az anlamak[1] |
| Risk faktörleri | Genetik, kafa yaralanmaları, depresyon, hipertansiyon[1][4] |
| Teşhis yöntemi | Semptomlara ve bilişsel test diğer olası nedenleri dışladıktan sonra[5] |
| Ayırıcı tanı | Normal yaşlanma[1] |
| İlaç tedavisi | Asetilkolinesteraz inhibitörleri, NMDA reseptör antagonistleri (küçük fayda)[6] |
| Prognoz | Yaşam beklentisi 3-9 yıl[7] |
| Sıklık | 29,8 milyon (2015)[2][8] |
| Ölümler | 1,9 milyon (2015)[9] |
Alzheimer hastalığı (AD), aynı zamanda kısaca Alzheimer, kronik nörodejeneratif hastalık bu genellikle yavaş başlar ve zamanla giderek kötüleşir.[1][2] Vakaların% 60-70'inin sebebidir. demans.[1][2] En yaygın erken belirti son olayları hatırlamada zorluk.[1] Hastalık ilerledikçe semptomlar şunları içerebilir: dil ile ilgili sorunlar, yönelim bozukluğu (kolayca kaybolmak dahil), ruh hali, kaybı motivasyon, yönetmiyor kişisel Bakım, ve davranış sorunları.[1][2] Bir kişinin durumu azaldıkça, genellikle aileden ve toplumdan uzaklaşır.[1] Yavaş yavaş bedensel işlevler kaybolur ve sonuçta ölümle sonuçlanır.[10] İlerleme hızı değişebilse de, teşhisi takiben tipik yaşam beklentisi üç ila dokuz yıldır.[7][11]
Alzheimer hastalığının nedeni tam olarak anlaşılamamıştır.[1] Riskin yaklaşık% 70'inin bir kişinin ebeveynlerinden miras birçok ile genler genellikle dahil.[4] Diğer risk faktörleri arasında kafa yaralanmaları, depresyon, ve hipertansiyon.[1] Hastalık süreci ile ilişkilidir plaklar ve nörofibrillerin içinde beyin.[4] Olası bir teşhis, hastalığın geçmişine ve bilişsel test ile tıbbi Görüntüleme ve kan testleri diğer olası nedenleri dışlamak için.[5] İlk belirtiler genellikle normal yaşlanma ile karıştırılır.[1] Kesin tanı için beyin dokusunun incelenmesi gerekir.[4] Zihinsel ve fiziksel egzersiz ve kaçınma obezite AD riskini azaltabilir; ancak, bu tavsiyeleri destekleyen kanıtlar zayıftır.[4][12] Riski azalttığı gösterilen hiçbir ilaç veya takviye yoktur.[13]
Bazıları semptomları geçici olarak iyileştirebilse de, hiçbir tedavi ilerlemesini durdurmaz veya tersine çeviremez.[2] Etkilenen insanlar, yardım için giderek daha fazla başkalarına güveniyorlar ve genellikle BAKICI.[14] Baskılar sosyal, psikolojik, fiziksel ve ekonomik unsurları içerebilir.[14] Egzersiz programları aşağıdakiler açısından yararlı olabilir: günlük yaşam aktiviteleri ve potansiyel olarak sonuçları iyileştirebilir.[15] Davranış sorunları veya psikoz bunama nedeniyle sıklıkla tedavi edilir antipsikotikler ancak çok az fayda sağladığından ve erken ölüm riskinde artış olduğundan bu genellikle tavsiye edilmez.[16][17]
2015 itibariyle, dünya çapında yaklaşık 29,8 milyon insan AD'li vardı[8] 2020 itibariyle yaklaşık 50 milyon ile.[2] Vakaların% 4-5'inde görülmesine rağmen, çoğunlukla 65 yaşın üzerindeki kişilerde başlar. erken başlayan Alzheimer.[3] 65 yaş ve üstü insanların yaklaşık% 6'sını etkiler.[1] 2015 yılında demans yaklaşık 1,9 milyon ölümle sonuçlandı.[9] Hastalık adını Alman psikiyatrist ve patologdan almıştır. Alois Alzheimer, ilk kez 1906'da tanımlayan.[18] İçinde Gelişmiş ülkeler AD, mali açıdan en maliyetli hastalıklardan biridir.[19][20]
Belirti ve bulgular
- Yaşlanmanın hafıza üzerindeki etkileri ama AD değil
- Unutmak ara sıra şeyler
- Bazen öğeleri yanlış yerleştirmek
- Minör kısa süreli hafıza kayıp
- Tam ayrıntıları hatırlamamak
- Erken evre Alzheimer
- Unutkanlık dönemlerini hatırlamamak
- Ailenin veya arkadaşların isimlerini unutur
- Değişiklikler yalnızca yakın arkadaşlar veya akrabalar tarafından fark edilebilir
- Tanıdık olmayan durumlarda bazı karışıklıklar
- Orta evre Alzheimer
- Yakın zamanda öğrenilen bilgileri hatırlamada daha büyük zorluk
- Birçok durumda kafa karışıklığını derinleştirmek
- Uyku sorunları
- Konumlarını belirlemede sorun
- Geç dönem Alzheimer
- Zayıf düşünme yeteneği
- Konuşma sorunları
- Aynı konuşmaları tekrar eder
- Daha kötü niyetli, endişeli veya paranoyak
Hastalık seyri, ilerleyen bir modelle dört aşamaya ayrılmıştır. bilişsel ve işlevsel bozulma.

Ön demans
İlk belirtiler genellikle yanlışlıkla şunlara atfedilir: yaşlanma veya stres.[22] Detaylı nöropsikolojik test Bir kişinin klinik kriterleri karşılamasından önce sekiz yıla kadar hafif bilişsel zorlukları ortaya çıkarabilir. Teşhis AD.[23] Bu erken belirtiler en karmaşık olanı etkileyebilir günlük yaşam aktiviteleri.[24] En göze çarpan eksiklik kısa süreli hafıza Son zamanlarda öğrenilen gerçekleri hatırlamada güçlük ve yeni bilgi edinememe olarak ortaya çıkan kayıp.[23][25]
İle ince sorunlar yönetici işlevler nın-nin dikkat, planlama, esneklik ve soyut düşünme veya bozulmalar anlamsal bellek (anlamların hafızası ve kavram ilişkileri), AD'nin erken aşamalarının belirtisi olabilir.[23] İlgisizlik ve depresyon bu aşamada görülebilir, apati hastalığın seyri boyunca en kalıcı semptom olarak kalır.[26][27]Hastalığın preklinik aşaması da olarak adlandırıldı hafif bilişsel bozukluk (MCI).[25] Bu genellikle normal yaşlanma ile yaşlanma arasında bir geçiş aşaması olarak bulunur. demans. MCI çeşitli semptomlarla ortaya çıkabilir ve hafıza kaybı baskın semptom olduğunda, "amnestik MCI" olarak adlandırılır ve sıklıkla bir prodromal Alzheimer hastalığının evresi.[28]
erken
AD'li kişilerde, öğrenme ve hafızadaki artan bozulma, sonunda kesin bir tanıya yol açar. Küçük bir yüzdede, dille ilgili zorluklar, yönetici işlevler, algı (agnozi ) veya hareketlerin yürütülmesi (apraksi ) hafıza problemlerinden daha belirgindir.[29] AD, tüm bellek kapasitelerini eşit olarak etkilemez. Daha eski anılar kişinin hayatının (Bölümsel hafıza ), öğrenilen gerçekler (anlamsal bellek ), ve bilinçaltı (yemek için çatal kullanmak veya bardaktan içmek gibi şeylerin nasıl yapılacağına dair bedenin hafızası) yeni gerçekler veya anılardan daha az etkilenir.[30][31]
Dil sorunları temelde küçülme ile karakterizedir kelime bilgisi ve azaltılmış kelime akıcılık sözlü ve genel bir fakirleşmeye yol açan yazı dili.[29][32] Bu aşamada, Alzheimer hastası genellikle temel fikirleri yeterli şekilde iletebilir.[29][32][33] İcra ederken ince motor görevleri yazma, çizim veya giyinme gibi belirli hareket koordinasyonu ve planlama zorlukları (apraksi) olabilir, ancak bunlar genellikle fark edilmezler.[29] Hastalık ilerledikçe, AD'li kişiler çoğu zaman bağımsız olarak birçok görevi yerine getirmeye devam edebilir, ancak bilişsel olarak en zorlu faaliyetlerde yardıma veya denetime ihtiyaç duyabilir.[29]
Orta
Aşamalı bozulma, öznelerin günlük yaşamın en yaygın aktivitelerini gerçekleştirememesiyle sonuçta bağımsızlığı engeller.[29] Bir yetersizlik nedeniyle konuşma zorlukları belirgin hale gelir. kelimeleri hatırla sık sık yanlış kelime ikamelerine yol açan (parafaziler ). Okuma ve yazma becerileri de giderek kaybolur.[29][33] Zaman geçtikçe ve AD ilerledikçe karmaşık motor dizileri daha az koordineli hale gelir, bu nedenle düşme riski artar.[29] Bu aşamada hafıza sorunları kötüleşir ve kişi yakın akrabalarını tanıyamayabilir.[29] Uzun süreli hafıza daha önce bozulmamış olan bozulur.[29]
Davranışsal ve nöropsikiyatrik değişiklikler daha yaygın hale gelir. Ortak belirtiler gezinme, sinirlilik ve kararsız etki ağlamaya yol açan, planlanmamış patlamalar saldırganlık veya bakıma karşı direnç.[29] Gün batımı da görünebilir.[34] AD'li kişilerin yaklaşık% 30'u gelişir yanıltıcı yanlış tanımlamalar ve diğeri sanrılı semptomlar.[29] Denekler ayrıca hastalık süreçlerine ve sınırlamalarına (anosognozi ).[29] İdrarını tutamamak gelişebilir.[29] Bu semptomlar yaratır stres akrabalar ve bakıcılar için, kişiyi uzaklaştırarak azaltılabilir. Evde bakım diğerine Uzun süreli bakım tesisleri.[29][35]
ileri
Son aşamalarda hasta tamamen bakıcılara bağımlıdır.[29] Dil, basit ifadelere veya hatta tek kelimelere indirgenir ve sonunda tamamen konuşma kaybına yol açar.[29][33] Sözlü dil yeteneklerinin kaybına rağmen, insanlar çoğu zaman duygusal sinyalleri anlayabilir ve geri verebilir. Saldırganlık hala mevcut olsa da, aşırı ilgisizlik ve bitkinlik çok daha yaygın semptomlardır. Alzheimer hastalığı olan kişiler, en nihayetinde en basit görevleri bile bağımsız olarak gerçekleştiremeyeceklerdir; kas kütlesi ve hareketlilik, yatalak oldukları ve kendilerini besleyemedikleri noktaya kadar bozulur. Ölüm nedeni genellikle enfeksiyon gibi bir dış faktördür. basınç ülserleri veya Zatürre, hastalığın kendisi değil.[29]
Nedenleri
Alzheimer hastalığının anormal miktarda protein bulunduğunda ortaya çıktığına inanılıyor. amiloidler ve muhtemelen tau proteinleri beyinde oluşur ve organ hücrelerine tecavüz etmeye başlar. Sonuç plak normal işlevi ve kimyayı bozar ve önemli bir eksikliğe yol açar. nörotransmiterler ilerleyici bir beyin işlevi kaybına neden olur.[36] Gelince neden bu protein 'arızaları' her şeyden önce ortaya çıkar, nihai neden tam olarak anlaşılamamıştır ve devam eden araştırma ve spekülasyonlara tabidir.
Çoğu Alzheimer vakasının nedeni, genetik farklılıkların tespit edildiği vakaların% 1 ila% 5'i dışında hala çoğunlukla bilinmemektedir.[37][38] Birkaç rakip hipotezler hastalığın nedenini açıklamaya çalışıyor.
Genetik
Alzheimer hastalığının (ve bunun hafıza bileşenlerinin) genetik kalıtımı, ikiz ve aile çalışmalarının incelemelerine göre,% 49 ile% 79 arasında değişmektedir.[39] Vakaların yaklaşık% 0,1'i ailesel otozomal (değil cinsiyete bağlı ) baskın 65 yaşından önce başlayan kalıtım.[40] Hastalığın bu formu olarak bilinir erken başlangıçlı ailesel Alzheimer hastalığı. Otozomal dominant ailesel AD'nin çoğu, üç genden birindeki mutasyonlara atfedilebilir: amiloid öncü protein (APP) ve Presenilinler PSEN1 ve PSEN2.[41] APP ve presenilin genlerindeki çoğu mutasyon, adı verilen küçük bir proteinin üretimini artırır. Aβ 42'nin ana bileşeni olan yaşlılık plakları.[42] Mutasyonlardan bazıları, Ap42 seviyelerini yükseltmeden, yalnızca Ap42 ile diğer ana formlar arasındaki oranı (özellikle Ap40) değiştirir.[43] Otozomal dominant Alzheimer hastalığı ile ilişkili diğer iki gen, ABCA7 ve SORL1.[44]
Çoğu Alzheimer hastalığı vakası otozomal dominant kalıtım göstermez ve sporadik AD olarak adlandırılır, burada çevresel ve genetik farklılıklar şu şekilde hareket edebilir: risk faktörleri. En iyi bilinen genetik risk faktörü, ε4'ün kalıtımıdır. alel of apolipoprotein E (APOE).[45][46] AD'li kişilerin% 40 ila 80'i en az bir APOEε4 aleline sahiptir.[46] APOEε4 alleli, hastalık riskini heterozigotlarda üç kat ve homozigotlarda 15 kat artırır.[40] Birçok insan hastalığı gibi, çevresel etkiler ve genetik değiştiriciler de eksik nüfuz etme. Örneğin, belirli Nijeryalı popülasyonlar, APOEε4 dozu ile diğer insan popülasyonlarında görülen Alzheimer hastalığı insidansı veya başlangıç yaşı arasındaki ilişkiyi göstermez.[47][48] Geç başlangıçlı sporadik AD (LOAD) ile ilişki için 400'e kadar aday geni taramaya yönelik erken girişimler, düşük bir verimle sonuçlandı.[40][41] Daha güncel genom çapında ilişkilendirme çalışmaları (GWAS), genlerde riski etkiliyor gibi görünen 19 alan buldu.[49] Bu genler şunları içerir: CASS4, CELF1, FERMT2, HLA-DRB5, INPP5D, MEF2C, NME8, PTK2B, SORL1, ZCWPW1, SLC24A4, CLU, PİKALM, CR1, BIN1, MS4A, ABCA7, EPHA1, ve CD2AP.[49]
Aleller içinde TREM2 gen, Alzheimer hastalığına yakalanma riskinin 3 ila 5 kat daha yüksek olmasıyla ilişkilendirilmiştir.[50][51] Önerilen bir etki mekanizması, TREM2'deki bazı varyantlarda beyindeki beyaz kan hücrelerinin artık mevcut beta amiloid miktarını kontrol edememesidir. Birçok tek nükleotid polimorfizmleri (SNP'ler), Alzheimer ile ilişkilidir ve 2018 çalışması, AD'yi bellek, dil, görsel-uzamsal ve yönetici işlevler dahil olmak üzere 6 kategoriye ayırarak 30 SNP ekliyor.[52]
Kolinerjik hipotez
Günümüzde mevcut ilaç tedavilerinin çoğunun dayandığı en eski hipotez, kolinerjik hipotez,[53] bu, AD'nin azalmış sentezden kaynaklandığını ileri sürer. nörotransmiter asetilkolin. Kolinerjik hipotez, büyük ölçüde asetilkolin eksikliğini tedavi etmeye yönelik ilaçların çok etkili olmamasından dolayı yaygın bir destek sağlamamıştır.[54]
Amiloid hipotezi
1991 yılında amiloid hipotez hücre dışı amiloid beta (Aβ) depozit, hastalığın temel nedenidir.[55][56] Bu postülat için destek, genin bulunduğu yerden gelir. amiloid öncü protein (APP) açık kromozom 21 ile birlikte insanların trizomi 21 (Down sendromu) fazladan gen kopyası neredeyse evrensel olarak en azından 40 yaşına kadar AD'nin en erken semptomlarını sergilemektedir.[57][58] Ayrıca belirli bir izoform apolipoprotein APOE4, AD için önemli bir genetik risk faktörüdür. Apolipoproteinler beta amiloidin parçalanmasını arttırırken, bazı izoformlar bu görevde çok etkili değildir (APOE4 gibi), beyinde aşırı amiloid birikmesine yol açar.[59] Daha fazla kanıt şu bulgudan gelir: transgenik insan APP geninin bir mutant formunu ifade eden fareler, fibriler amiloid plakları ve uzamsal öğrenme eksiklikleri olan Alzheimer benzeri beyin patolojisi geliştirir.[60]
Erken insan deneylerinde amiloid plaklarını temizleyen deneysel bir aşının, demans üzerinde önemli bir etkisi olmadığı bulundu.[61] Araştırmacılar, plak olmayan A şüphesine yönlendirildiβ oligomerler (birçok monomerin kümeleri) A'nın birincil patojenik formu olarakβ. Aynı zamanda amiloid türevi yayılabilir ligandlar (ADDL'ler) olarak da adlandırılan bu toksik oligomerler, nöronlar üzerindeki bir yüzey reseptörüne bağlanır ve sinapsın yapısını değiştirerek nöronal iletişimi bozar.[62] A için bir reseptörβ oligomerler olabilir prion proteini, bağlantılı olan aynı protein Deli dana hastalığı ve ilgili insan durumu, Creutzfeldt-Jakob hastalığı, bu nedenle potansiyel olarak bunların altında yatan mekanizmayı nörodejeneratif Alzheimer hastalığı ile ilgili bozukluklar.[63]
2009'da, bu hipotez güncellendi ve beta-amiloid proteininin yakın bir akrabasının ve illa ki beta-amiloidin kendisinin değil, hastalıkta önemli bir suçlu olabileceğini düşündürdü. Hipotez, erken yaşamın hızlı büyüme aşamasında beyindeki nöronal bağlantıları eriten amiloid ile ilgili bir mekanizmanın, Alzheimer hastalığının nöronal soldurulmasına neden olmak için daha sonraki yaşamdaki yaşlanma ile ilgili süreçler tarafından tetiklenebileceğini savunuyor.[64] N-APP, peptidlerden APP'nin bir parçası N-terminal, beta-amiloid ile komşudur ve APP'den aynı enzimlerden biri tarafından ayrılır. N-APP, ölüm reseptörü 6 (DR6 olarak da bilinir) adı verilen bir nöronal reseptöre bağlanarak kendi kendini yok etme yolunu tetikler. TNFRSF21 ).[64] DR6, Alzheimer'den en çok etkilenen insan beyni bölgelerinde yüksek oranda ifade edilir, bu nedenle N-APP / DR6 yolunun yaşlanan beyin hasara neden olmak. Bu modelde beta-amiloid, sinaptik fonksiyonu baskılayarak tamamlayıcı bir rol oynar.
Osaka mutasyonu
Ailesel Alzheimer hastalığının bir Japon soyağacının, APP'nin 693 kodonunun bir silme mutasyonu ile ilişkili olduğu bulunmuştur.[65] Bu mutasyon ve Alzheimer hastalığı ile ilişkisi ilk olarak 2008'de bildirildi.[66] Bu mutasyon, Osaka mutasyonu olarak bilinir. Sadece bu mutasyona sahip homozigotlar Alzheimer hastalığı geliştirir. Bu mutasyon Ap oligomerizasyonunu hızlandırır, ancak proteinler amiloid fibriller oluşturmaz, bu da bu hastalığın nedeni olan fibrillerden ziyade Ap oligomerizasyonu olduğunu düşündürür. Bu mutasyonu ifade eden fareler, Alzheimer hastalığının tüm olağan patolojilerine sahiptir.
Tau hipotezi

tau hipotezi bunu öneriyor tau proteini anormallikler hastalık kademesini başlatır.[56] Bu modelde, hiperfosforile tau, diğer tau iplikleriyle eşleşmeye başlar. Sonunda oluştururlar nörofibrillerin sinir hücresi gövdelerinin içinde.[67] Bu gerçekleştiğinde, mikrotübüller parçalanmak, hücrenin yapısını yok etmek hücre iskeleti nöronun taşıma sistemini çökertir.[68] Bu, önce nöronlar arasındaki biyokimyasal iletişimde arızalara ve daha sonra hücrelerin ölümüne neden olabilir.[69]
Diğer hipotezler
Enflamatuar bir hipotez, AD'nin beyinde nörodejenerasyonla sonuçlanan kendi kendini devam ettiren ilerleyici bir enflamasyondan kaynaklandığıdır.[70] Kronik bir rol periodontal enfeksiyon[70] ve bağırsak mikrobiyotresi önerildi.[71]
Bir nörovasküler hipotez ileri sürülmüştür. Kan beyin bariyeri dahil olabilir.[72] Spiroket enfeksiyonları ayrıca bunama ile bağlantılı.[73][74]
Hücresel homeostaz nın-nin biyometreler İyonik bakır, demir ve çinko gibi, AD'de bozulur, ancak bunun proteinler tarafından üretilip üretilmediği veya proteinlerdeki değişikliklere neden olup olmadığı belirsizliğini koruyor. Bu iyonlar tau, APP ve APOE'yi etkiler ve bunlardan etkilenir.[75] ve düzensizlikleri neden olabilir oksidatif stres bu patolojiye katkıda bulunabilir.[76][77][78][79][80] Bu çalışmaların bazılarının kalitesi eleştirildi,[81][82] ve bağlantı tartışmalı olmaya devam ediyor.[83] Araştırmacıların çoğu alüminyum ile nedensel bir bağlantıyı desteklemiyor.[82]
Sigara içmek önemli bir AD risk faktörüdür.[84] Sistemik belirteçler of doğuştan bağışıklık sistemi geç başlangıçlı AD için risk faktörleridir.[85]
Maruz kalmanın kesin kanıtları var hava kirliliği Alzheimer hastalığının gelişimine katkıda bulunan bir faktör olabilir.[86]
Bir hipotez, oligodendrositler ve yaşlanma sırasında bunlarla ilişkili miyelin akson hasarına katkıda bulunur, bu da daha sonra amiloid üretimine ve bir yan etki olarak tau hiper-fosforilasyonuna neden olur.[87][88]
Retrogenez tıbbi bir hipotez 1980'lerde Barry Reisberg tarafından önerilen Alzheimer hastalığının gelişimi ve ilerlemesi hakkında.[89] Hipotez, tıpkı fetüsün bir süreçten geçmesi gibi nörogelişim ile başlayan sinirlenme ve ile biten miyelinleşme, AD'li kişilerin beyinleri tersine dönüyor nörodejenerasyon ile başlayan süreç demiyelinizasyon ve aksonların ölümü (beyaz madde) ve gri maddenin ölümüyle sona eriyor.[90] Benzer şekilde, hipotez, bebekler hallerden geçerken bilişsel gelişim, AD'li insanlar ilerlemenin tersi sürecinden geçerler. Kognitif bozukluk.[89] Reisberg, AD'li kişilere bakanların hastalığın ilerlemesinin aşamalarını belirlemelerine olanak tanıdığını ve her aşamada ihtiyaç duyulan bakım türü hakkında tavsiyelerde bulunduğunu söylediği "FAST" (Fonksiyonel Değerlendirme Evreleme Aracı) olarak bilinen bakım değerlendirme aracını geliştirdi.[89][91]
İle ilişki Çölyak hastalığı Belirsizdir, 2019 çalışmasında CD'si olanlarda genel olarak demansta artış bulmazken, 2018 yılında yapılan bir inceleme AD dahil olmak üzere çeşitli demans türleri ile bir ilişki bulmuştur.[92][93]
Patofizyoloji

Nöropatoloji
Alzheimer hastalığı, nöronlar ve sinapslar içinde beyin zarı ve belirli subkortikal bölgeler. Bu kayıp, brüt atrofi bölgedeki dejenerasyon dahil olmak üzere etkilenen bölgelerin Temporal lob ve parietal lob ve bölümleri ön korteks ve singulat girus.[94] Dejenerasyon, beyin sapı çekirdeklerinde de mevcuttur. locus coeruleus.[95] Kullanan çalışmalar MR ve EVCİL HAYVAN hafif bilişsel bozukluktan Alzheimer hastalığına ilerledikçe ve sağlıklı yaşlı yetişkinlerden alınan benzer görüntülerle karşılaştırıldığında, AD'li kişilerde belirli beyin bölgelerinin boyutunda azalma olduğunu belgelemişlerdir.[96][97]
Her ikisi de amiloid plaklar ve nörofibrillerin tarafından açıkça görülebilir mikroskopi AD'den muzdarip olanların beyinlerinde,[98] özellikle hipokamp.[99] Plaklar çoğunlukla yoğun çözülmez mevduatları beta-amiloid peptid ve hücresel nöronların dışında ve çevresinde malzeme. Karmakarışıklıklar (nörofibriler yumaklar), mikrotübül ile ilişkili protein tau'nun hiperfosforile hale gelen ve hücrelerin içinde biriken kümeleridir. Birçok yaşlı birey, yaşlanmanın bir sonucu olarak bazı plaklar ve düğümler geliştirse de, AD'li kişilerin beyinleri, temporal lob gibi belirli beyin bölgelerinde daha fazla sayıda bulunur.[100] Lewy cisimleri AD'li kişilerin beyinlerinde nadir değildir.[101]
Biyokimya
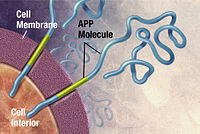


Alzheimer hastalığı şu şekilde tanımlanmıştır: protein yanlış katlanması hastalık (proteopati ), sebebiyle plak anormal katlanmış birikme amiloid beta protein ve tau beyindeki protein.[102] Plaketler küçükten yapılmıştır peptidler, 39–43 amino asitler uzunluğunda, çağrıldı amiloid beta (Birβ). Birβ daha büyük olanın bir parçasıdır amiloid öncü protein (APP). APP bir transmembran protein bu nöron zarından geçer. APP, nöron büyümesi, hayatta kalma ve yaralanma sonrası onarım için kritik öneme sahiptir.[103][104] Alzheimer hastalığında, gama sırrı ve beta sırrı birlikte hareket etmek proteolitik APP'nin daha küçük parçalara bölünmesine neden olan işlem.[105] Bu parçalardan biri, amiloid beta fibrillerine yol açar, bu daha sonra nöronların dışında yoğun oluşumlarda biriken kümeler oluşturur. yaşlılık plakları.[98][106]
AD ayrıca bir tauopati anormal toplanması nedeniyle tau proteini. Her nöronun bir hücre iskeleti kısmen adı verilen yapılardan oluşan bir iç destek yapısı mikrotübüller. Bu mikrotübüller, besinleri ve molekülleri hücrenin gövdesinden hücrenin uçlarına yönlendiren izler gibi davranır. akson ve geri. Adı verilen bir protein tau mikrotübülleri stabilize eder fosforile ve bu nedenle a denir mikrotübül ile ilişkili protein. AD'de tau kimyasal değişikliklere uğrar ve hiperfosforile; daha sonra diğer konularla eşleşmeye başlar ve nörofibrillerin ve nöronun nakil sistemini parçalamak.[107] Patojenik tau ayrıca nöronal ölüme neden olabilir. yeri değiştirilebilir eleman düzensizlik.[108]
Hastalık mekanizması
Beta-amiloid peptidin üretim ve agregasyon bozukluklarının AD patolojisine tam olarak nasıl yol açtığı bilinmemektedir.[109][110]Amiloid hipotezi geleneksel olarak beta-amiloid birikimine işaret eder. peptidler nöron dejenerasyonunu tetikleyen merkezi olay olarak. Toplanmış amiloid birikimi fibriller Hücrenin bozulmasından sorumlu olan proteinin toksik formu olduğuna inanılıyor. kalsiyum iyon homeostaz, indükler Programlanmış hücre ölümü (apoptoz ).[111] A olduğu da bilinmektedir.β seçilerek oluşturuluyor mitokondri Alzheimer'den etkilenen beyinlerin hücrelerinde ve ayrıca belirli enzim fonksiyonları ve kullanımı glikoz nöronlar tarafından.[112]
Çeşitli enflamatuar süreçler ve sitokinler Alzheimer hastalığının patolojisinde de rol oynayabilir. İltihap genel bir işaretidir doku herhangi bir hastalıkta hasar olabilir ve AD'deki doku hasarına ikincil olabilir veya bir immünolojik yanıtın bir işareti olabilir.[113] Beyindeki nöronlar ve immünolojik mekanizmalar arasında güçlü bir etkileşim olduğuna dair artan kanıtlar var. Obezite ve sistemik enflamasyon, hastalığın ilerlemesini destekleyen immünolojik süreçlere müdahale edebilir.[114]
Farklı dağılımdaki değişiklikler nörotrofik faktörler ve gibi reseptörlerinin ifadesinde Beyinden türetilen nörotrofik faktör (BDNF) AD'de açıklanmıştır.[115][116]
Teşhis

Alzheimer hastalığı genellikle kişinin hastalığına göre teşhis edilir. tıbbi geçmiş, akrabalardan geçmiş ve davranışsal gözlemler. Karakteristik varlığı nörolojik ve nöropsikolojik özellikler ve alternatif koşulların olmaması destekleyicidir.[117][118] ileri tıbbi Görüntüleme ile bilgisayarlı tomografi (CT) veya manyetik rezonans görüntüleme (MRI) ve Tek foton emisyonlu bilgisayarlı tomografi (SPECT) veya Pozitron emisyon tomografi (PET), diğer serebral patolojileri veya bunamanın alt tiplerini dışlamak için kullanılabilir.[119] Ayrıca, prodromal Alzheimer hastalığının aşamaları (hafif bilişsel bozukluk).[120]
Entelektüel işleyişin değerlendirilmesi hafıza testinin dahil edilmesi, hastalığın durumunu daha da karakterize edebilir.[22] Tıp kuruluşları, hekimlerin teşhis sürecini kolaylaştırmak ve standartlaştırmak için tanı kriterleri oluşturmuştur. Teşhis çok yüksek doğrulukla doğrulanabilir otopsi beyin materyali mevcut olduğunda ve incelenebilir olduğunda histolojik olarak.[121]
Kriterler
Ulusal Nörolojik ve İletişimsel Bozukluklar ve İnme Enstitüsü (NINCDS) ve Alzheimer Hastalığı ve İlgili Bozukluklar Derneği (ADRDA, artık Alzheimer Derneği ) en sık kullanılanı kurdu NINCDS-ADRDA Alzheimer Kriterleri 1984'te teşhis için,[121] 2007'de kapsamlı bir şekilde güncellendi.[122] Bu kriterler, Kognitif bozukluk ve şüpheli bir demans sendromu, nöropsikolojik test olası veya muhtemel AD'nin klinik teşhisi için. Bir histopatolojik dahil onay mikroskobik incelenmesi beyin dokusu kesin teşhis için gereklidir. İyi istatistiksel güvenilirlik ve geçerlilik tanı kriterleri ile kesin histopatolojik doğrulama arasında gösterilmiştir.[123] AD'de en yaygın olarak sekiz entelektüel alan bozulur—hafıza, dil, algısal beceriler, Dikkat, motor becerileri, oryantasyon, problem çözme ve yönetici işlevsel yetenekleri. Bu alanlar, NINCDS-ADRDA Alzheimer Kriterlerine eşdeğerdir. Ruhsal Bozuklukların Tanısal ve İstatistiksel El Kitabı (DSM-IV-TR) tarafından yayınlanan Amerikan Psikiyatri Derneği.[124][125]
Teknikler

Nöropsikolojik testler benzeri mini zihinsel durum muayenesi (MMSE), tanı için gerekli bilişsel bozuklukları değerlendirmek için yaygın olarak kullanılmaktadır. Özellikle hastalığın ilk aşamalarında, sonuçların yüksek güvenilirliği için daha kapsamlı test dizileri gereklidir.[126][127] Nörolojik muayene Erken AD'de, diğer demans nedenleri de dahil olmak üzere diğer hastalık süreçlerinden kaynaklananlardan farklı olmayabilen bariz bilişsel bozukluk dışında genellikle normal sonuçlar verecektir.
Daha ileri nörolojik muayeneler, ayırıcı tanı AD ve diğer hastalıklar.[22] Aile üyeleriyle yapılan görüşmeler de hastalığın değerlendirilmesinde kullanılmaktadır. Bakıcılar, günlük yaşam yeteneklerinin yanı sıra kişinin zamanla azalması hakkında önemli bilgiler sağlayabilir. Zihinsel işlev.[128] Bir bakıcının bakış açısı özellikle önemlidir çünkü AD'li bir kişi genellikle kendisinin farkında değildir. açıklar.[129] Çoğu zaman, aileler de başlangıçtaki bunama semptomlarını tespit etmekte güçlük çekerler ve bir doktora doğru bilgileri iletemeyebilirler.[130]
Ek testler, hastalığın bazı özellikleri hakkında ekstra bilgi sağlar veya diğer tanıları dışlamak için kullanılır. Kan testleri AD'den başka demans nedenlerini belirleyebilir[22]- nadir durumlarda geri döndürülebilen nedenler.[131] Gerçekleştirmek yaygındır tiroid fonksiyon testleri, değerlendirmek B12, kural dışı frengi, metabolik sorunları (böbrek fonksiyonu, elektrolit seviyeleri ve diyabet testleri dahil) dışlayın, ağır metal seviyelerini (örn. kurşun, cıva) ve anemiyi değerlendirin. (Ayrıca ekarte etmek gerekir deliryum ).
Psikolojik testler için depresyon depresyon, AD ile eşzamanlı olabileceğinden (bkz. Alzheimer hastalığının depresyonu ), bilişsel bozukluğun erken bir belirtisi,[132] hatta nedeni.[133][134]
Düşük doğruluk nedeniyle, C-PIB-PET taramasının erken tanı aracı olarak kullanılması veya insanlar hafif bilişsel bozukluk (MCI) belirtileri gösterdiğinde Alzheimer hastalığının gelişimini tahmin etmek için kullanılması önerilmez.[135] Kullanımı 18F-FDG PET taramaları, Alzheimer hastalığı geliştirebilecek kişileri tespit etmek için tek bir test olarak, kanıtlarla da desteklenmemektedir.[136]
Önleme

AD'yi önlemede herhangi bir özel önlemin etkili olduğunu destekleyen kesin bir kanıt yoktur.[13] AD'nin başlangıcını önlemek veya geciktirmek için alınan önlemlere ilişkin küresel çalışmalar, genellikle tutarsız sonuçlar üretmiştir. Epidemiyolojik çalışmalar, diyet, kardiyovasküler risk, farmasötik ürünler veya diğerleri arasında entelektüel faaliyetler gibi bazı değiştirilebilir faktörler ile bir popülasyonun gelişme olasılığı arasında ilişkiler önermektedir. AD. Yalnızca klinik denemeler de dahil olmak üzere daha fazla araştırma, bu faktörlerin AD'yi önlemeye yardımcı olup olmayacağını ortaya çıkaracaktır.[13]
İlaç tedavisi
Kardiyovasküler risk faktörleri, örneğin hiperkolesterolemi, hipertansiyon, diyabet, ve sigara içmek, daha yüksek bir başlangıç riski ve AD seyrinin kötüleşmesi ile ilişkilidir.[137][138] Kan basıncı ilaçları riski azaltabilir.[139] Statinler, hangisi daha düşük kolesterol ancak, hastalığın seyrini önlemede veya iyileştirmede etkili olmamıştır.[140][141][142]
Uzun süreli kullanımı steroidal olmayan anti-enflamatuar ilaçlar (NSAID'ler) 2007'de AD geliştirme olasılığının azalmasıyla ilişkili olduğu düşünülüyordu.[143] Kanıtlar ayrıca NSAID'lerin azaltabileceği fikrini de ortaya koydu. iltihap ile ilgili amiloid plaklar, ancak yüksek olumsuz olaylar nedeniyle denemeler askıya alındı.[13] Hiçbir önleme çalışması tamamlanmadı.[13] Bir tedavi olarak yararlı görünmüyorlar, ancak 2011 itibariyle[Güncelleme] presemptomatik önleyici adaylar olarak düşünülmüştür.[144] Menopozda hormon replasman tedavisi önceden kullanılmasına rağmen demans riskini artırabilir.[145]
Yaşam tarzı
Gibi entelektüel faaliyetlerde bulunan kişiler okuma, oynuyor masa oyunları, tamamlanıyor çapraz bulmaca, oynuyor müzik Enstrümanları veya normal sosyal etkileşim Alzheimer hastalığı için azalmış bir risk gösterir.[146] Bu uyumludur bilişsel rezerv Bazı yaşam deneyimlerinin, bireye demans belirtilerinin başlangıcını geciktiren bilişsel bir rezerv sağlayan daha verimli sinirsel işlevlerle sonuçlandığını belirten teori.[146] Eğitim hastalığın süresini değiştirmeden AD sendromunun başlangıcını geciktirir.[147] Öğrenmek ikinci dil Hayatın ilerleyen dönemlerinde bile Alzheimer hastalığının başlangıcını geciktirdiği görülmektedir.[148]Fiziksel aktivite ayrıca düşük AD riskiyle de ilişkilidir.[147] Fiziksel egzersiz, demans oranının azalmasıyla ilişkilidir.[149] Fiziksel egzersiz, Alzheimer hastalığı olanlarda semptom şiddetini azaltmada da etkilidir.[150]
Diyet
Sürdüren insanlar sağlıklı, Japonca veya Akdeniz diyeti düşük AD riskine sahip.[151] Akdeniz diyeti, hastalığı olanlarda sonuçları iyileştirebilir.[152] Yüksek diyet yiyenler doymuş yağlar ve basit karbonhidratlar (mono- ve disakkarit ) daha yüksek riske sahiptir.[153] Akdeniz diyetinin yararlı kardiyovasküler etkisi, etki mekanizması olarak önerilmiştir.[154]
Nüfus temelli çalışmalar ve randomize kontrollü çalışmalar arasında sonuçlar farklılık gösterdiğinden, diyet bileşenlerine ilişkin sonuçları tespit etmek bazen zor olmuştur.[151] Özellikle alkol kullanımının hafif ve orta düzeyde olduğuna dair sınırlı kanıt vardır. kırmızı şarap, daha düşük AD riski ile ilişkilidir.[151] Geçici kanıt var kafein koruyucu olabilir.[155] Yüksek miktarda yiyecek flavonoidler gibi kakao, kırmızı şarap ve Çay AD riskini azaltabilir.[156][157]
Kullanımıyla ilgili yorumlar vitaminler ve mineraller bunları tavsiye edecek kadar tutarlı kanıt bulamamışlardır. Bu, A vitamini içerir,[158][159] C,[160][161] E vitamininin alfa tokoferol formu,[162] selenyum,[163] çinko,[164][165] ve B vitamini içeren veya içermeyen folik asit12.[166] Randomize kontrollü bir çalışmadan elde edilen kanıtlar, E vitamininin alfa-tokoferol formunun bilişsel gerilemeyi yavaşlattığını gösterdi, bu kanıtın kalite olarak "orta" olduğuna karar verildi.[162] İncelenen denemeler folik asit (B9) ve diğer B vitaminleri bilişsel gerileme ile önemli bir ilişki gösteremedi.[167] Bitki ve balıklardan elde edilen Omega-3 yağ asidi takviyeleri ve diyet dokosaheksaenoik asit (DHA), hafif ila orta derecede Alzheimer hastalığı olan insanlara fayda sağlamıyor gibi görünmektedir.[168][169]
Kurkumin 2010 itibariyle[Güncelleme] hayvanlarda kesin olmayan kanıtlar olmasına rağmen insanlara fayda sağlamamıştı.[170] Tutarsız ve ikna edici olmayan kanıtlar vardı. ginkgo kognitif bozukluk ve demans üzerinde herhangi bir olumlu etkiye sahiptir.[171] 2008 itibariyle[Güncelleme] somut bir kanıt yoktu kanabinoidler AD veya demans semptomlarının iyileştirilmesinde etkilidir;[172] ancak, endokannabinoidlerle ilgili bazı araştırmalar umut verici görünüyordu.[173]
Yönetim
Alzheimer hastalığının tedavisi yoktur; Mevcut tedaviler nispeten küçük semptomatik fayda sağlar, ancak hafifletici doğada. Mevcut tedaviler farmasötik, psikososyal ve bakıcılık olarak ikiye ayrılabilir.
İlaçlar


AD'nin bilişsel sorunlarını tedavi etmek için şu anda beş ilaç kullanılmaktadır: dördü asetilkolinesteraz inhibitörleri (takrin, Rivastigmin, galantamin ve Donepezil ) ve diğer (memantin ) bir NMDA reseptör antagonisti. Kullanımlarının yararı azdır.[174][175][176] Hiçbir ilacın hastalığın ilerlemesini geciktirdiği veya durdurduğu açıkça gösterilmemiştir.
Aktivitesinde azalma kolinerjik nöronlar, Alzheimer hastalığının iyi bilinen bir özelliğidir.[177] Asetilkolinesteraz inhibitörleri, asetilkolin (ACh) parçalanır, böylece beyindeki ACh konsantrasyonu artar ve kolinerjik nöronların ölümünün neden olduğu ACh kaybı ile mücadele edilir.[178] Hafif ve orta şiddette Alzheimer hastalığında bu ilaçların etkinliğine dair kanıtlar vardır,[179][175][174] ve ileri aşamada kullanımlarına dair bazı kanıtlar.[174] Bu ilaçların kullanımı hafif bilişsel bozukluk AD'nin başlamasının gecikmesinde herhangi bir etki göstermemiştir.[180] En genel yan etkiler vardır mide bulantısı ve kusma her ikisi de kolinerjik fazlalıkla bağlantılıdır. Bu yan etkiler, kullanıcıların yaklaşık% 10-20'sinde ortaya çıkar, hafif ila orta şiddettedir ve ilaç dozlarını yavaşça ayarlayarak yönetilebilir.[181] Daha az yaygın ikincil etkiler kas içerir kramplar, azaldı kalp atış hızı (bradikardi ), azaltıldı iştah ve ağırlık ve arttı mide asidi üretim.[179]
Glutamat uyarıcıdır nörotransmiter of gergin sistem aşırı miktarlarda olmasına rağmen beyin e sebep olabilir hücre adı verilen bir süreçle ölüm eksitotoksisite Glutamatın aşırı uyarılmasından oluşan reseptörler. Eksitotoksisite sadece Alzheimer hastalığında değil, aynı zamanda diğer nörolojik hastalıklarda da ortaya çıkar. Parkinson hastalığı ve multipl Skleroz.[182] Memantin rekabetçi değil NMDA reseptör antagonisti ilk önce bir anti- olarak kullanıldıgrip ajan. Üzerinde hareket eder glutamaterjik sistem engelleyerek NMDA reseptörleri ve glutamat tarafından aşırı uyarılmalarının engellenmesi.[182][183] Memantinin, orta ila şiddetli Alzheimer hastalığının tedavisinde küçük bir yararı olduğu gösterilmiştir.[184] Memantin ile bildirilen advers olaylar seyrek ve hafiftir; halüsinasyonlar, bilinç bulanıklığı, konfüzyon, baş dönmesi, baş ağrısı ve yorgunluk.[185] Memantin ve donepezil kombinasyonunun " istatistiksel olarak anlamlı ancak klinik olarak marjinal etkinlik ".[186]
Atipik antipsikotikler azaltmada mütevazı derecede faydalıdır saldırganlık ve psikoz Alzheimer hastalığı olan kişilerde, ancak avantajları ciddi yan etkilerle dengelenmektedir. inme, hareket zorlukları veya bilişsel gerileme.[187] Uzun vadede kullanıldıklarında, artan ölüm oranıyla ilişkili oldukları görülmüştür.[188] Bu grup insanda antipsikotik kullanımını durdurmak güvenli görünmektedir.[189]
Psikososyal müdahale
Psikososyal müdahaleler, farmasötik tedaviye ek olarak kullanılır ve davranış, duygu, biliş veya uyarım odaklı yaklaşımlar içinde sınıflandırılabilir. Research on efficacy is unavailable and rarely specific to AD, focusing instead on dementia in general.[190]
Behavioural interventions attempt to identify and reduce the antecedents and consequences of problem behaviours. This approach has not shown success in improving overall functioning,[191] but can help to reduce some specific problem behaviours, such as inkontinans.[192] There is a lack of high quality data on the effectiveness of these techniques in other behaviour problems such as wandering.[193][194] Music therapy is effective in reducing behavioural and psychological symptoms.[195]
Emotion-oriented interventions include reminiscence therapy, validation therapy, supportive psikoterapi, sensory integration, olarak da adlandırılır snoezelen, ve simulated presence therapy. A Cochrane review has found no evidence that this is effective.[196] Supportive psychotherapy has received little or no formal scientific study, but some clinicians find it useful in helping mildly impaired people adjust to their illness.[190] Reminiscence therapy (RT) involves the discussion of past experiences individually or in group, many times with the aid of photographs, household items, music and sound recordings, or other familiar items from the past. A 2018 review of the effectiveness of RT found that effects were inconsistent, small in size and of doubtful clinical significance, and varied by setting.[197] Simulated presence therapy (SPT) is based on attachment theories and involves playing a recording with voices of the closest relatives of the person with Alzheimer's disease. There is partial evidence indicating that SPT may reduce challenging behaviours.[198]Finally, validation therapy is based on acceptance of the reality and personal truth of another's experience, while sensory integration is based on exercises aimed to stimulate duyular. There is no evidence to support the usefulness of these therapies.[199][200]
The aim of cognition-oriented treatments, which include reality orientation and cognitive retraining, is the reduction of cognitive deficits. Reality orientation consists in the presentation of information about time, place or person to ease the understanding of the person about its surroundings and his or her place in them. On the other hand, cognitive retraining tries to improve impaired capacities by exercitation of mental abilities. Both have shown some efficacy improving cognitive capacities,[201] although in some studies these effects were transient and negative effects, such as frustration, have also been reported.[190]
Stimulation-oriented treatments include Sanat, müzik ve Evcil Hayvan therapies, egzersiz yapmak, and any other kind of rekreasyonel aktiviteler. Stimulation has modest support for improving behaviour, mood, and, to a lesser extent, function. Nevertheless, as important as these effects are, the main support for the use of stimulation therapies is the change in the person's routine.[190]
Caregiving
Since Alzheimer's has no cure and it gradually renders people incapable of tending for their own needs, caregiving is essentially the treatment and must be carefully managed over the course of the disease.
During the early and moderate stages, modifications to the living environment and lifestyle can increase hasta güvenliği and reduce caretaker burden.[202][203] Examples of such modifications are the adherence to simplified routines, the placing of safety locks, the labelling of household items to cue the person with the disease or the use of modified daily life objects.[190][204][205] If eating becomes problematic, food will need to be prepared in smaller pieces or even pureed.[206] Ne zaman swallowing difficulties arise, the use of feeding tubes gerekli olabilir. In such cases, the medical efficacy and ethics of continuing feeding is an important consideration of the caregivers and family members.[207][208] The use of physical restraints is rarely indicated in any stage of the disease, although there are situations when they are necessary to prevent harm to the person with AD or their caregivers.[190]
As the disease progresses, different medical issues can appear, such as oral and dental disease, basınç ülserleri, yetersiz beslenme, hijyen problems, or solunum, cilt veya göz enfeksiyonlar. Careful management can prevent them, while professional treatment is needed when they do arise.[209][210] During the final stages of the disease, treatment is centred on relieving discomfort until death, often with the help of darülaceze.[211]
Prognoz

The early stages of Alzheimer's disease are difficult to diagnose. A definitive diagnosis is usually made once cognitive impairment compromises daily living activities, although the person may still be living independently. The symptoms will progress from mild cognitive problems, such as memory loss through increasing stages of cognitive and non-cognitive disturbances, eliminating any possibility of independent living, especially in the late stages of the disease.[29]
Yaşam beklentisi of people with AD is reduced.[212] Following diagnosis it typically ranges from three to ten years.[212]
Fewer than 3% of people live more than fourteen years.[213] Disease features significantly associated with reduced survival are an increased severity of cognitive impairment, decreased functional level, history of falls, and disturbances in the neurological examination. Other coincident diseases such as kalp sorunları, diyabet or history of alkol kötüye kullanımı are also related with shortened survival.[214][215][216] While the earlier the age at onset the higher the total survival years, life expectancy is particularly reduced when compared to the healthy population among those who are younger.[217] Men have a less favourable survival prognosis than women.[213][218]
Akciğer iltihaplanması ve dehidrasyon are the most frequent immediate causes of death brought by AD, while kanser is a less frequent cause of death than in the general population.[218]
Epidemiyoloji
| Yaş | New affected per thousand kişi-yıl |
|---|---|
| 65–69 | 3 |
| 70–74 | 6 |
| 75–79 | 9 |
| 80–84 | 23 |
| 85–89 | 40 |
| 90– | 69 |
Two main measures are used in epidemiyolojik studies: incidence and prevalence. İnsidans is the number of new cases per unit of person–time at risk (usually number of new cases per thousand person–years); süre yaygınlık is the total number of cases of the disease in the population at any given time.
Regarding incidence, grup boylamsal çalışmalar (studies where a disease-free population is followed over the years) provide rates between 10 and 15 per thousand person–years for all dementias and 5–8 for AD,[219][220] which means that half of new dementia cases each year are AD. Advancing age is a primary risk factor for the disease and incidence rates are not equal for all ages: every five years after the age of 65, the risk of acquiring the disease approximately doubles, increasing from 3 to as much as 69 per thousand person years.[219][220] There are also sex differences in the incidence rates, women having a higher risk of developing AD particularly in the population older than 85.[220][221] İçinde Amerika Birleşik Devletleri, the risk of dying from Alzheimer's disease is 26% higher among the non-Hispanic white population than among the non-Hispanic black population, whereas the Hispanic population has a 30% lower risk than the non-Hispanic white population.[222]

Prevalence of AD in populations is dependent upon different factors including incidence and survival. Since the incidence of AD increases with age, it is particularly important to include the mean age of the population of interest. In the United States, Alzheimer prevalence was estimated to be 1.6% in 2000 both overall and in the 65–74 age group, with the rate increasing to 19% in the 75–84 group and to 42% in the greater than 84 group.[223] Prevalence rates in less developed regions are lower.[224] Dünya Sağlık Örgütü estimated that in 2005, 0.379% of people worldwide had dementia, and that the prevalence would increase to 0.441% in 2015 and to 0.556% in 2030.[225] Other studies have reached similar conclusions.[224] Another study estimated that in 2006, 0.40% of the world population (range 0.17–0.89%; absolute number 26.6 milyon, range 11.4–59.4 million) were afflicted by AD, and that the prevalence rate would triple and the absolute number would quadruple by 2050.[226]
Tarih

ancient Greek and Roman filozoflar ve doktorlar associated old age with increasing demans.[18] It was not until 1901 that German psikiyatrist Alois Alzheimer identified the first case of what became known as Alzheimer's disease, named after him, in a fifty-year-old woman he called Auguste D. He followed her case until she died in 1906, when he first reported publicly on it.[227] During the next five years, eleven similar cases were reported in the tıbbi literatür, some of them already using the term Alzheimer's disease.[18] The disease was first described as a distinctive disease by Emil Kraepelin after suppressing some of the clinical (delusions and hallucinations) and pathological features (arteriosclerotic changes) contained in the original report of Auguste D.[228] O dahil Alzheimer hastalığı, ayrıca adlandırıldı presenile demans by Kraepelin, as a subtype of senil demans in the eighth edition of his Textbook of Psychiatry, yayınlandı 15 July, 1910.[229]
For most of the 20th century, the diagnosis of Alzheimer's disease was reserved for individuals between the ages of 45 and 65 who developed symptoms of dementia. The terminology changed after 1977 when a conference on AD concluded that the clinical and patolojik manifestations of presenile and senile dementia were almost identical, although the authors also added that this did not rule out the possibility that they had different causes.[230] This eventually led to the diagnosis of Alzheimer hastalığı independent of age.[231] Dönem senile dementia of the Alzheimer type (SDAT) was used for a time to describe the condition in those over 65, with classical Alzheimer's disease being used to describe those who were younger. Eventually, the term Alzheimer's disease was formally adopted in medical isimlendirme to describe individuals of all ages with a characteristic common symptom pattern, disease course, and nöropatoloji.[232]
Toplum ve kültür
Social costs
Dementia, and specifically Alzheimer's disease, may be among the most costly diseases for society in Avrupa ve Amerika Birleşik Devletleri,[19][20] while their costs in other countries such as Arjantin,[233] ve Güney Kore,[234] are also high and rising. These costs will probably increase with the ageing of society, becoming an important sosyal problem. AD-associated costs include direct medical costs such as bakım evi bakımı, direct nonmedical costs such as in-home günlük bakım, and indirect costs such as lost üretkenlik of both patient and caregiver.[20] Numbers vary between studies but dementia costs worldwide have been calculated around $160 billion,[235] while costs of Alzheimer's disease in the United States may be $100 billion each year.[20]
The greatest origin of costs for society is the long-term care tarafından sağlık uzmanları ve özellikle institutionalisation, which corresponds to 2/3 of the total costs for society.[19] The cost of living at home is also very high,[19] especially when informal costs for the family, such as caregiving time and caregiver's lost earnings, are taken into account.[236]
Costs increase with dementia severity and the presence of behavioural disturbances,[237] and are related to the increased caregiving time required for the provision of physical care.[236] Therefore, any treatment that slows cognitive decline, delays institutionalisation or reduces caregivers' hours will have economic benefits. Economic evaluations of current treatments have shown positive results.[20]
Caregiving burden
The role of the main caregiver is often taken by the spouse or a close relative.[238] Alzheimer's disease is known for placing a great burden on caregivers which includes social, psychological, physical or economic aspects.[14][239][240] Home care is usually preferred by people with AD and their families.[241] This option also delays or eliminates the need for more professional and costly levels of care.[241][242] Nevertheless, two-thirds of nursing home residents have dementias.[190]
Demans caregivers are subject to high rates of physical and mental disorders.[243] Factors associated with greater psychosocial problems of the primary caregivers include having an affected person at home, the carer being a spouse, demanding behaviours of the cared person such as depression, behavioural disturbances, hallucinations, sleep problems or walking disruptions and social isolation.[244][245] Regarding economic problems, family caregivers often give up time from work to spend 47 hours per week on average with the person with AD, while the costs of caring for them are high. Direct and indirect costs of caring for an Alzheimer's patient average between $18,000 and $77,500 per year in the United States, depending on the study.[236][238]
Bilişsel davranışçı terapi and the teaching of başa çıkma stratejileri either individually or in group have demonstrated their efficacy in improving caregivers' psychological health.[14][246]
Medya
AD has been portrayed in films such as: İris (2001), based on John Bayley 's memoir of his wife Iris Murdoch;[247] Defter (2004), based on Nicholas Sparks ' 1996 aynı isimli roman;[248] Hatırlanacak bir an (2004); Thanmathra (2005);[249] Memories of Tomorrow (Ashita no Kioku) (2006), based on Hiroshi Ogiwara's novel of the same name;[250] Ondan uzakta (2006), based on Alice Munro 's kısa hikaye "The Bear Came over the Mountain ";[251] Hala Alice (2014), about a Kolombiya Üniversitesi professor who has early onset Alzheimer's disease, based on Lisa Genova 's Aynı adlı 2007 romanı ve öne çıkan Julianne Moore başlık rolünde. Documentaries on Alzheimer's disease include Malcolm and Barbara: A Love Story (1999) ve Malcolm and Barbara: Love's Farewell (2007), both featuring Malcolm Pointon.[252][253][254] It has also been portrayed in music by the Caretaker içinde Everywhere at the End of Time.
Araştırma talimatları
İlaç tedavisi
In the decade 2002–2012, 244 compounds were assessed in Phase I, Phase II, or Phase III trials, and only one of these (memantin ) Alınan FDA approval (though others were still in the pipeline).[255] Solanezumab ve aducanumab failed to show effectiveness in people who already had Alzheimer's symptoms.[256]
One area of clinical research is focused on treating the underlying disease pathology. Azaltma beta-amiloid levels is a common target of compounds[257] (gibi apomorfin ) under investigation. İmmünoterapi veya aşılama for the amyloid protein is one treatment modality çalışma altında.[258] Unlike preventive vaccination, the putative therapy would be used to treat people already diagnosed. It is based upon the concept of training the immune system to recognise, attack, and reverse deposition of amyloid, thereby altering the course of the disease.[259] An example of such a vaccine under investigation was ACC-001,[260][261] although the trials were suspended in 2008.[262] Another similar agent is bapineuzumab, an antibody designed as identical to the naturally induced anti-amyloid antibody.[263] Ancak, immünoterapötik agents have been found to cause some concerning Advers İlaç Reaksiyonları, gibi amyloid-related imaging abnormalities.[264] Other approaches are neuroprotective agents, such as AL-108,[265] and metal-protein interaction attenuation agents, such as PBT2.[266] Bir TNFα receptor-blocking füzyon proteini, etanersept has showed encouraging results.[267]
In 2008, two separate clinical trials showed positive results in modifying the course of disease in mild to moderate AD with methylthioninium chloride, a drug that inhibits tau aggregation,[268][269] ve dimebon, bir antihistamin.[270]The consecutive phase-III trial of dimebon failed to show positive effects in the primary and secondary endpoints.[271][272][273] Work with methylthioninium chloride showed that bioavailability of methylthioninium from the gut was affected by feeding and by stomach acidity, leading to unexpectedly variable dosing.[274] A new stabilised formulation, as the ön ilaç LMTX, is in phase-III trials (in 2014).[275]
In early 2017, a trial of verubecestat, which inhibits the beta-secretase protein responsible for creating beta-amyloid protein was discontinued as an independent panel found "virtually no chance of finding a positive clinical effect".[276] In 2018 and 2019, more trials, including aducanumab which reduced amyloid beta concentrations, failed, leading some to question the validity of the amyloid hypothesis.[277][278] However, in October 2019, an analysis of another dataset found that aducanumab may reduce clinical decline in people with early Alzheimer's disease and the Biogen company may seek regulatory approval again.[279]
The senescence accelerated mouse (SAMP8) is an Alzheimer's disease (AD) animal model in which amyloid precursor protein (APP) is overproduced. The mice develops early memory disturbances and alters the blood–brain barrier, which causes a decreased expulsion of amyloid-β protein from the brain. It has a marked increase in oxidative stress in the brain. Medications that reduce oxidative stress have been shown to improve memory. Treatments that reduce amyloid-β (antisense to APP and antibodies to amyloid-β) not only improve memory but also reduce oxidative stress. It has been shown that the initial deviations in lipid peroxidative damage favor mitochondrial dysfunction as being a trigger for amyloid-β overproduction in this AD mouse strain. This process begets increased amyloid-beta, which further damages mitochondria.[280]
Behavioral prevention
Research on the effects of meditation on preserving memory and cognitive functions is at an early stage.[281] A 2015 review suggests that farkındalık -based interventions may prevent or delay the onset of mild cognitive impairment and Alzheimer's disease.[282]
Possible transmission
Rare cases of possible aktarma between people are being studied,[283] Örneğin. -e büyüme hormonu hastalar.[284]
Enfeksiyonlar
herpes simpleks virus HSV-1 has been found in the same areas as amyloid plaques.[285] This suggested the possibility that AD could be treated or prevented with antiviral ilaç tedavisi.[285][286] Studies of antivirals in hücre kültürleri have shown promising results.[287]
Fungal infection of AD brain has also been described.[288]This hypothesis was proposed by the mikrobiyolog L. Carrasco when his group found statistical correlation between disseminated mycoses and AD.[289]Further work revealed that fungal infection is present in different brain regions of AD patients, but not in the control individuals.[290][291]A fungal infection explains the symptoms observed in AD patients. The slow progression of AD fits with the chronic nature of some systemic fungal infections, which can be asymptomatic and thus, unnoticed and untreated.[290]The fungal hypotheses are also compatible with some other established AD hypotheses, like the amyloid hypothesis, that can be explained as an immune system response to an infection in the CNS,[292][293][294] as found by R. Moir and R. Tanzi in mouse and worm models of AD.
Görüntüleme
Bu bölümün olması gerekiyor güncellenmiş. (Nisan 2018) |
Birçoğunun tıbbi Görüntüleme techniques available, Tek foton emisyonlu bilgisayarlı tomografi (SPECT) appears to be superior in differentiating Alzheimer's disease from other types of dementia, and this has been shown to give a greater level of accuracy compared with mental testing and tıbbi geçmiş analizi.[295] Advances have led to the proposal of new diagnostic criteria.[22][122]
PiB PET remains investigational, but a similar PET scanning radyofarmasötik aranan florbetapir, containing the longer-lasting radionuclide flor-18, is a diagnostic tool in Alzheimer's disease.[296][297]
Amyloid imaging is likely to be used in conjunction with other markers rather than as an alternative.[298] Volumetrik MR can detect changes in the size of brain regions. Measuring those regions that atrophy during the progress of Alzheimer's disease is showing promise as a diagnostic indicator. It may prove less expensive than other imaging methods currently under study.[299]
In 2011, an FDA panel voted unanimously to recommend approval of florbetapir.[300] The imaging agent can help to detect Alzheimer's brain plaques.[301] A negative scan indicates sparse or no plaques, which is not consistent with a diagnosis of AD.[302]
Teşhis
Emphasis in Alzheimer's research has been placed on diagnosing the condition before symptoms begin.[303] A number of biochemical tests have been developed to enable earlier detection. Some such tests involve the analysis of Beyin omurilik sıvısı for beta-amyloid, total tau protein and phosphorylated tau181P protein concentrations.[304] Because drawing CSF can be painful, repeated draws are avoided. A blood test for circulatory miRNA and inflammatory biomarkers is a potential alternative indicator.[304]
A series of studies suggest that ageing-related breakdown of the blood–brain barrier may be causative of AD, and conclude that markers for that damage may be an early predictor of the disease.[305][306][307]
Referanslar
- ^ a b c d e f g h ben j k l m Burns A, Iliffe S (February 2009). "Alzheimer's disease". BMJ. 338: b158. doi:10.1136/bmj.b158. PMID 19196745. S2CID 8570146.
- ^ a b c d e f g h "Dementia Fact sheet". Dünya Sağlık Örgütü. 12 Aralık 2017.
- ^ a b Mendez MF (November 2012). "Early-onset Alzheimer's disease: nonamnestic subtypes and type 2 AD". Archives of Medical Research. 43 (8): 677–85. doi:10.1016/j.arcmed.2012.11.009. PMC 3532551. PMID 23178565.
- ^ a b c d e Ballard C, Gauthier S, Corbett A, Brayne C, Aarsland D, Jones E (March 2011). "Alzheimer's disease". Lancet. 377 (9770): 1019–31. doi:10.1016/S0140-6736(10)61349-9. PMID 21371747. S2CID 20893019.
- ^ a b "Dementia diagnosis and assessment" (PDF). Ulusal Sağlık ve Bakım Mükemmelliği Enstitüsü (NICE). Arşivlenen orijinal (PDF) 5 Aralık 2014. Alındı 30 Kasım 2014.
- ^ Commission de la transparence (June 2012). "Drugs for Alzheimer's disease: best avoided. No therapeutic advantage" [Drugs for Alzheimer's disease: best avoided. No therapeutic advantage]. Prescrire International. 21 (128): 150. PMID 22822592.
- ^ a b Querfurth HW, LaFerla FM (January 2010). "Alzheimer's disease". New England Tıp Dergisi. 362 (4): 329–44. doi:10.1056/NEJMra0909142. PMID 20107219. S2CID 205115756.
- ^ a b GBD 2015 Hastalık Yaralanma İnsidans Yaygınlığı İşbirlikçileri (Ekim 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016 / S0140-6736 (16) 31678-6. PMC 5055577. PMID 27733282.
- ^ a b GBD 2015 Ölüm Sebepleri İşbirlikçileri (Ekim 2016). "249 ölüm nedeni için küresel, bölgesel ve ulusal yaşam beklentisi, tüm nedenlere bağlı ölüm oranı ve nedene özgü ölüm oranı, 1980-2015: Küresel Hastalık Yükü Çalışması 2015 için sistematik bir analiz". Lancet. 388 (10053): 1459–1544. doi:10.1016/S0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ "About Alzheimer's Disease: Symptoms". National Institute on Aging. Arşivlenen orijinal 15 Ocak 2012'de. Alındı 28 Aralık 2011.
- ^ Todd S, Barr S, Roberts M, Passmore AP (November 2013). "Survival in dementia and predictors of mortality: a review". Uluslararası Geriatrik Psikiyatri Dergisi. 28 (11): 1109–24. doi:10.1002/gps.3946. PMID 23526458. S2CID 25445595.
- ^ "So, What Can You Do?". National Institute on Aging. 29 July 2016. Archived from orijinal 3 Nisan 2017.
- ^ a b c d e Hsu D, Marshall GA (2017). "Primary and Secondary Prevention Trials in Alzheimer Disease: Looking Back, Moving Forward". Current Alzheimer Research. 14 (4): 426–40. doi:10.2174/1567205013666160930112125. PMC 5329133. PMID 27697063.
- ^ a b c d Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J (July 2007). "Systematic review of information and support interventions for caregivers of people with dementia". BMC Geriatrics. 7: 18. doi:10.1186/1471-2318-7-18. PMC 1951962. PMID 17662119.
- ^ Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S (April 2015). "Exercise programs for people with dementia". Sistematik İncelemelerin Cochrane Veritabanı (Gönderilen makale). 132 (4): CD006489. doi:10.1002/14651858.CD006489.pub4. PMID 25874613.
- ^ National Institute for Health and Clinical Excellence. "Low-dose antipsychotics in people with dementia". Ulusal Sağlık ve Bakım Mükemmelliği Enstitüsü (NICE). Arşivlenen orijinal 5 Aralık 2014. Alındı 29 Kasım 2014.
- ^ "Information for Healthcare Professionals: Conventional Antipsychotics". ABD Gıda ve İlaç İdaresi. 16 Haziran 2008. Arşivlenen orijinal 29 Kasım 2014. Alındı 29 Kasım 2014.
- ^ a b c Berchtold NC, Cotman CW (1998). "Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s". Yaşlanmanın Nörobiyolojisi. 19 (3): 173–89. doi:10.1016/S0197-4580(98)00052-9. PMID 9661992. S2CID 24808582.
- ^ a b c d Bonin-Guillaume S, Zekry D, Giacobini E, Gold G, Michel JP (January 2005). "[The economical impact of dementia]". Presse Médicale (Fransızcada). 34 (1): 35–41. doi:10.1016/s0755-4982(05)83882-5. PMID 15685097.
- ^ a b c d e Meek PD, McKeithan K, Schumock GT (1998). "Economic considerations in Alzheimer's disease". Pharmacotherapy. 18 (2 Pt 2): 68–73, discussion 79–82. doi:10.1002/j.1875-9114.1998.tb03880.x (etkin olmayan 11 Kasım 2020). PMID 9543467.CS1 Maint: DOI Kasım 2020 itibariyle aktif değil (bağlantı)
- ^ "Evaluating Prescription Drugs Used to Treat: Alzheimer's Disease Comparing Effectiveness, Safety, and Price" (PDF). Tüketici Raporları Drug Effectiveness Review Project. Tüketici Raporları. Mayıs 2012. Arşivlenen orijinal (PDF) on 5 September 2012. Alındı 1 Mayıs 2013.
- ^ a b c d e Waldemar G, Dubois B, Emre M, Georges J, McKeith IG, Rossor M, Scheltens P, Tariska P, Winblad B (January 2007). "Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline". Avrupa Nöroloji Dergisi. 14 (1): e1–26. doi:10.1111/j.1468-1331.2006.01605.x. PMID 17222085. S2CID 2725064.
- ^ a b c Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ (September 2004). "Multiple cognitive deficits during the transition to Alzheimer's disease". İç Hastalıkları Dergisi. 256 (3): 195–204. doi:10.1111/j.1365-2796.2004.01386.x. PMID 15324363. S2CID 37005854.
- ^ Nygård L (2003). "Instrumental activities of daily living: a stepping-stone towards Alzheimer's disease diagnosis in subjects with mild cognitive impairment?". Acta Neurologica Scandinavica. Ek. 179 (s179): 42–6. doi:10.1034/j.1600-0404.107.s179.8.x. PMID 12603250. S2CID 25313065.
- ^ a b Arnáiz E, Almkvist O (2003). "Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease". Acta Neurologica Scandinavica. Ek. 179: 34–41. doi:10.1034/j.1600-0404.107.s179.7.x. PMID 12603249. S2CID 22494768.
- ^ Deardorff WJ, Grossberg GT (2019). "Behavioral and psychological symptoms in Alzheimer's dementia and vascular dementia". Klinik Nöroloji El Kitabı. 165: 5–32. doi:10.1016/B978-0-444-64012-3.00002-2. ISBN 9780444640123. PMID 31727229.
- ^ Murray ED, Buttner N, Price BH (2012). "Depression and Psychosis in Neurological Practice". In Bradley WG, Daroff RB, Fenichel GM, Jankovic J (eds.). Bradley'nin klinik pratikte nörolojisi (6. baskı). Philadelphia, PA: Elsevier / Saunders. ISBN 978-1-4377-0434-1.
- ^ Grundman M, Petersen RC, Ferris SH, et al. (Ocak 2004). "Mild cognitive impairment can be distinguished from Alzheimer disease and normal aging for clinical trials". Nöroloji Arşivleri. 61 (1): 59–66. doi:10.1001/archneur.61.1.59. PMID 14732621.
- ^ a b c d e f g h ben j k l m n Ö p q r s Förstl H, Kurz A (1999). "Clinical features of Alzheimer's disease". European Archives of Psychiatry and Clinical Neuroscience. 249 (6): 288–90. doi:10.1007/s004060050101. PMID 10653284. S2CID 26142779.
- ^ Carlesimo GA, Oscar-Berman M (June 1992). "Memory deficits in Alzheimer's patients: a comprehensive review". Nöropsikoloji İncelemesi. 3 (2): 119–69. doi:10.1007/BF01108841. PMID 1300219. S2CID 19548915.
- ^ Jelicic M, Bonebakker AE, Bonke B (1995). "Implicit memory performance of patients with Alzheimer's disease: a brief review". International Psychogeriatrics. 7 (3): 385–92. doi:10.1017/S1041610295002134. PMID 8821346.
- ^ a b Taler V, Phillips NA (July 2008). "Language performance in Alzheimer's disease and mild cognitive impairment: a comparative review". Klinik ve Deneysel Nöropsikoloji Dergisi. 30 (5): 501–56. doi:10.1080/13803390701550128. PMID 18569251. S2CID 37153159.
- ^ a b c Frank EM (September 1994). "Effect of Alzheimer's disease on communication function". Güney Carolina Tıp Derneği Dergisi. 90 (9): 417–23. PMID 7967534.
- ^ Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A (May 2001). "Sundowning and circadian rhythms in Alzheimer's disease". Amerikan Psikiyatri Dergisi. 158 (5): 704–11. doi:10.1176/appi.ajp.158.5.704. PMID 11329390. S2CID 10492607.
- ^ Gold DP, Reis MF, Markiewicz D, Andres D (January 1995). "When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia". Amerikan Geriatri Derneği Dergisi. 43 (1): 10–6. doi:10.1111/j.1532-5415.1995.tb06235.x. PMID 7806732. S2CID 29847950.
- ^ Alzheimer's disease - Causes (NHS)
- ^ "What We Know Today About Alzheimer's Disease". Alzheimer's Association. Arşivlenen orijinal 7 Ekim 2011 tarihinde. Alındı 1 Ekim 2011.
While scientists know Alzheimer's disease involves progressive brain cell failure, the reason cells fail isn't clear.
- ^ Reitz C, Mayeux R (April 2014). "Alzheimer disease: epidemiology, diagnostic criteria, risk factors and biomarkers". Biochemical Pharmacology. 88 (4): 640–51. doi:10.1016/j.bcp.2013.12.024. PMC 3992261. PMID 24398425.
- ^ Wilson RS, Barral S, Lee JH, Leurgans SE, Foroud TM, Sweet RA, Graff-Radford N, Bird TD, Mayeux R, Bennett DA (2011). "Heritability of different forms of memory in the Late Onset Alzheimer's Disease Family Study". Alzheimer Hastalığı Dergisi. 23 (2): 249–55. doi:10.3233/JAD-2010-101515. PMC 3130303. PMID 20930268.
- ^ a b c Blennow K, de Leon MJ, Zetterberg H (July 2006). "Alzheimer's disease". Lancet. 368 (9533): 387–403. doi:10.1016/S0140-6736(06)69113-7. PMID 16876668. S2CID 47544338.
- ^ a b Waring SC, Rosenberg RN (March 2008). "Genome-wide association studies in Alzheimer disease". Nöroloji Arşivleri. 65 (3): 329–34. doi:10.1001/archneur.65.3.329. PMID 18332245.
- ^ Selkoe DJ (June 1999). "Translating cell biology into therapeutic advances in Alzheimer's disease". Doğa. 399 (6738 Suppl): A23–31. doi:10.1038/19866. PMID 10392577. S2CID 42287088.
- ^ Borchelt DR, Thinakaran G, Eckman CB, et al. (Kasım 1996). "Familial Alzheimer's disease-linked presenilin 1 variants elevate Abeta1-42/1-40 ratio in vitro and in vivo". Nöron. 17 (5): 1005–13. doi:10.1016/S0896-6273(00)80230-5. PMID 8938131. S2CID 18315650.
- ^ Kim, JH (December 2018). "Genetics of Alzheimer's Disease". Dementia and Neurocognitive Disorders. 17 (4): 131–36. doi:10.12779/dnd.2018.17.4.131. PMC 6425887. PMID 30906402.
- ^ Strittmatter WJ, Saunders AM, Schmechel D, Pericak-Vance M, Enghild J, Salvesen GS, Roses AD (March 1993). "Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 90 (5): 1977–81. Bibcode:1993PNAS...90.1977S. doi:10.1073/pnas.90.5.1977. PMC 46003. PMID 8446617.
- ^ a b Mahley RW, Weisgraber KH, Huang Y (April 2006). "Apolipoprotein E4: a causative factor and therapeutic target in neuropathology, including Alzheimer's disease". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 103 (15): 5644–51. Bibcode:2006PNAS..103.5644M. doi:10.1073/pnas.0600549103. PMC 1414631. PMID 16567625.
- ^ Hall K, Murrell J, Ogunniyi A, Deeg M, Baiyewu O, Gao S, Gureje O, Dickens J, Evans R, Smith-Gamble V, Unverzagt FW, Shen J, Hendrie H (January 2006). "Cholesterol, APOE genotype, and Alzheimer disease: an epidemiologic study of Nigerian Yoruba". Nöroloji. 66 (2): 223–27. doi:10.1212/01.wnl.0000194507.39504.17. PMC 2860622. PMID 16434658.
- ^ Gureje O, Ogunniyi A, Baiyewu O, et al. (Ocak 2006). "APOE epsilon4 is not associated with Alzheimer's disease in elderly Nigerians". Nöroloji Yıllıkları. 59 (1): 182–85. doi:10.1002/ana.20694. PMC 2855121. PMID 16278853.
- ^ a b Lambert JC, Ibrahim-Verbaas CA, Harold D, et al. (Aralık 2013). "Meta-analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer's disease". Doğa Genetiği. 45 (12): 1452–58. doi:10.1038/ng.2802. PMC 3896259. PMID 24162737.
- ^ Jonsson T, Stefansson H, Steinberg S, et al. (Ocak 2013). "Variant of TREM2 associated with the risk of Alzheimer's disease". New England Tıp Dergisi (Original article). 368 (2): 107–16. doi:10.1056/NEJMoa1211103. PMC 3677583. PMID 23150908.
- ^ Guerreiro R, Wojtas A, Bras J, et al. (Ocak 2013). "TREM2 variants in Alzheimer's disease". New England Tıp Dergisi (Original article). 368 (2): 117–27. doi:10.1056/NEJMoa1211851. PMC 3631573. PMID 23150934.
- ^ Mukherjee S, Mez J, Trittschuh EH, Saykin AJ, Gibbons LE, Fardo DW, Wessels M, Bauman J, Moore M, Choi SE, Gross AL, Rich J, Louden DK, Sanders RE, Grabowski TJ, Bird TD, et al. (December 2018). "Genetic data and cognitively defined late-onset Alzheimer's disease subgroups". Molecular Psychiatry. 25 (11): 2942–2951. doi:10.1038/s41380-018-0298-8. PMC 6548676. PMID 30514930.
- ^ Francis PT, Palmer AM, Snape M, Wilcock GK (February 1999). "Alzheimer hastalığının kolinerjik hipotezi: ilerlemenin gözden geçirilmesi". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 66 (2): 137–47. doi:10.1136 / jnnp.66.2.137. PMC 1736202. PMID 10071091.
- ^ Martorana A, Esposito Z, Koch G (Ağustos 2010). "Kolinerjik hipotezin ötesinde: Mevcut ilaçlar Alzheimer hastalığında işe yarıyor mu?". CNS Neuroscience & Therapeutics. 16 (4): 235–45. doi:10.1111 / j.1755-5949.2010.00175.x. PMC 6493875. PMID 20560995.
- ^ Hardy J, Allsop D (Ekim 1991). "Alzheimer hastalığının etiyolojisinde ana olay olarak amiloid birikimi". Farmakolojik Bilimlerdeki Eğilimler. 12 (10): 383–88. doi:10.1016 / 0165-6147 (91) 90609-V. PMID 1763432.
- ^ a b Mudher A, Lovestone S (Ocak 2002). "Alzheimer hastalığı - tauistler ve vaftizciler sonunda el sıkışır mı?" Sinirbilimlerindeki Eğilimler. 25 (1): 22–26. doi:10.1016 / S0166-2236 (00) 02031-2. PMID 11801334. S2CID 37380445.
- ^ Nistor M, Don M, Parekh M, Sarsoza F, Goodus M, Lopez GE, Kawas C, Leverenz J, Doran E, Lott IT, Hill M, Head E (Ekim 2007). "Down sendromunda ve normal beyinde yaşın ve beta-amiloidin bir fonksiyonu olarak alfa ve beta sekretaz aktivitesi". Yaşlanmanın Nörobiyolojisi. 28 (10): 1493–506. doi:10.1016 / j.neurobiolaging.2006.06.023. PMC 3375834. PMID 16904243.
- ^ Lott IT, Head E (Mart 2005). "Alzheimer hastalığı ve Down sendromu: patogenezdeki faktörler". Yaşlanmanın Nörobiyolojisi. 26 (3): 383–89. doi:10.1016 / j.neurobiolaging.2004.08.005. PMID 15639317. S2CID 27716613.
- ^ Polvikoski T, Sulkava R, Haltia M, Kainulainen K, Vuorio A, Verkkoniemi A, Niinistö L, Halonen P, Kontula K (Kasım 1995). "Apolipoprotein E, demans ve beta-amiloid proteinin kortikal birikimi". New England Tıp Dergisi. 333 (19): 1242–47. doi:10.1056 / NEJM199511093331902. PMID 7566000.
- ^ Transgenik fareler:
- Oyunlar D, Adams D, Alessandrini R, Barbour R, Berthelette P, Blackwell C, Carr T, Clemens J, Donaldson T, Gillespie F (Şubat 1995). "V717F beta-amiloid öncü proteinini aşırı ifade eden transgenik farelerde Alzheimer tipi nöropatoloji". Doğa. 373 (6514): 523–27. Bibcode:1995 Natur.373..523G. doi:10.1038 / 373523a0. PMID 7845465. S2CID 4255816.
- Masliah E, Sisk A, Mallory M, Mucke L, Schenk D, Games D (Eylül 1996). "V717F beta-amiloid öncü proteini ve Alzheimer hastalığını aşırı ifade eden transgenik farelerde nörodejeneratif patolojinin karşılaştırılması". Nörobilim Dergisi. 16 (18): 5795–811. doi:10.1523 / JNEUROSCI.16-18-05795.1996. PMC 6578961. PMID 8795633.
- Hsiao K, Chapman P, Nilsen S, Eckman C, Harigaya Y, Younkin S, Yang F, Cole G (Ekim 1996). "Transgenik farelerde bağıntılı bellek eksiklikleri, Abeta yükselmesi ve amiloid plakları". Bilim. 274 (5284): 99–102. Bibcode:1996Sci ... 274 ... 99H. doi:10.1126 / bilim.274.5284.99. PMID 8810256. S2CID 32419070.
- Lalonde R, Dumont M, Staufenbiel M, Sturchler-Pierrat C, Strazielle C (Kasım 2002). "İsveç mutasyonu olan dişi APP23 transgenik farelerde mekansal öğrenme, keşif, kaygı ve motor koordinasyonu". Beyin Araştırması. 956 (1): 36–44. doi:10.1016 / S0006-8993 (02) 03476-5. PMID 12426044. S2CID 10083365.
- ^ Holmes C, Boche D, Wilkinson D, Yadegarfar G, Hopkins V, Bayer A, Jones RW, Bullock R, Love S, Neal JW, Zotova E, Nicoll JA (Temmuz 2008). "Alzheimer hastalığında Abeta42 aşılamasının uzun vadeli etkileri: randomize, plasebo kontrollü bir faz I denemesinin takibi". Lancet. 372 (9634): 216–23. doi:10.1016 / S0140-6736 (08) 61075-2. PMID 18640458. S2CID 18340153.
- ^ Lacor PN, Buniel MC, Furlow PW, vd. (Ocak 2007). "Sinaps bileşimi, şekli ve yoğunluğundaki Abeta oligomer kaynaklı sapmalar, Alzheimer hastalığında bağlantı kaybı için moleküler bir temel sağlar". Nörobilim Dergisi. 27 (4): 796–807. doi:10.1523 / JNEUROSCI.3501-06.2007. PMC 6672917. PMID 17251419.
- ^ Laurén J, Gimbel DA, Nygaard HB, Gilbert JW, Strittmatter SM (Şubat 2009). "Hücresel prion proteini, amiloid-beta oligomerler tarafından sinaptik plastisitenin bozulmasına aracılık eder". Doğa. 457 (7233): 1128–32. Bibcode:2009Natur.457.1128L. doi:10.1038 / nature07761. PMC 2748841. PMID 19242475.
- ^ a b Nikolaev A, McLaughlin T, O'Leary DD, Tessier-Lavigne M (Şubat 2009). "APP, farklı kaspazlar aracılığıyla akson budamasını ve nöron ölümünü tetiklemek için DR6'yı bağlar". Doğa. 457 (7232): 981–89. Bibcode:2009Natur.457..981N. doi:10.1038 / nature07767. PMC 2677572. PMID 19225519.
- ^ Tomiyama T (2010). "Alzheimer hastalığının etiyolojisinde beta-amiloidin rolü". Beyin Siniri. 62 (7): 691–699. PMID 20675873.
- ^ Tomiyama T, Nagata T, Shimada H, Teraoka R, Fukushima A, Kanemitsu H, Takuma H, Kuwano R, Imagawa M, Ataka S, Wada Y, Yoshioka E, Nishizaki T, Watanabe Y, Mori H (2008). "Alzheimer tipi demansta oligomerizasyonu destekleyen yeni bir amiloid beta varyantı". Ann Neurol. 63 (3): 377–387. doi:10.1002 / ana.21321. PMID 18300294. S2CID 42311988.CS1 bakimi: birden çok ad: yazarlar listesi (bağlantı)
- ^ Goedert M, Spillantini MG, Crowther RA (Temmuz 1991). "Tau proteinleri ve nörofibriler dejenerasyon". Beyin Patolojisi. 1 (4): 279–86. doi:10.1111 / j.1750-3639.1991.tb00671.x. PMID 1669718. S2CID 33331924.
- ^ Iqbal K, Alonso A, Chen S, Chohan MO, El-Akkad E, Gong CX, Khatoon S, Li B, Liu F, Rahman A, Tanimukai H, Grundke-Iqbal I (Ocak 2005). "Alzheimer hastalığı ve diğer tauopatilerde Tau patolojisi". Biochimica et Biophysica Açta (BBA) - Hastalığın Moleküler Temeli. 1739 (2–3): 198–210. doi:10.1016 / j.bbadis.2004.09.008. PMID 15615638.
- ^ Chun W, Johnson GV (Ocak 2007). "Tau fosforilasyonunun ve bölünmenin nöronal hücre ölümündeki rolü". Biyobilimde Sınırlar. 12: 733–56. doi:10.2741/2097. PMID 17127334. S2CID 40048768.
- ^ a b Kamer AR, Craig RG, Dasanayake AP, Brys M, Glodzik-Sobanska L, de Leon MJ (Temmuz 2008). "Enflamasyon ve Alzheimer hastalığı: periodontal hastalıkların olası rolü". Alzheimer ve Demans. 4 (4): 242–50. doi:10.1016 / j.jalz.2007.08.004. PMID 18631974. S2CID 8633979.
- ^ Collins SM, Surette M, Bercik P (Kasım 2012). "Bağırsak mikrobiyotası ve beyin arasındaki etkileşim". Doğa Yorumları. Mikrobiyoloji. 10 (11): 735–42. doi:10.1038 / nrmicro2876. PMID 23000955. S2CID 36411264.
- ^ Deane R, Zlokovic BV (Nisan 2007). "Alzheimer hastalığının patogenezinde kan-beyin bariyerinin rolü". Güncel Alzheimer Araştırması. 4 (2): 191–97. doi:10.2174/156720507780362245. PMID 17430246.
- ^ Miklossy J (Ağustos 2011). "Alzheimer hastalığı - bir nörospirochetoz. Koch ve Hill kriterlerini takip eden kanıtların analizi". Nöroinflamasyon Dergisi. 8 (1): 90. doi:10.1186/1742-2094-8-90. PMC 3171359. PMID 21816039.
- ^ Allen, HB (27 Haziran 2016). "Alzheimer Hastalığı: Spiroketlerin, Biyofilmlerin, Bağışıklık Sisteminin ve Amiloid-β'nin Potansiyel Tedavi ve Önleme Açısından Rolünün Değerlendirilmesi". Alzheimer Hastalığı Dergisi. 53 (4): 1271–76. doi:10.3233 / JAD-160388. PMC 5008232. PMID 27372648.
- ^ Xu H, Finkelstein DI, Adlard PA (12 Haziran 2014). "Alzheimer hastalığında metaller ve Apolipoprotein E'nin etkileşimleri". Yaşlanma Nörobiliminde Sınırlar. 6: 121. doi:10.3389 / fnagi.2014.00121. PMC 4054654. PMID 24971061.
AD'de bulunan metal iyon dısomeostazının hastalığın bir nedeni mi yoksa sonucu mu olduğunu hala bilmiyor olsak da, metal iyonları ile önemli AD ile ilişkili anahtar proteinler arasında doğrudan bir korelasyon olduğunu gösteren giderek artan sayıda kanıt vardır.
- ^ Su B, Wang X, Nunomura A, Moreira PI, Lee HG, Perry G, Smith MA, Zhu X (Aralık 2008). "Alzheimer hastalığında oksidatif stres sinyali". Güncel Alzheimer Araştırması. 5 (6): 525–32. doi:10.2174/156720508786898451. PMC 2780015. PMID 19075578.
- ^ Kastenholz B, Garfin DE, Horst J, Nagel KA (2009). "Metal şaperonları dikin: bunama tedavisinde yeni bir bakış açısı". Amiloid. 16 (2): 81–83. doi:10.1080/13506120902879392. PMID 20536399. S2CID 37490474.
- ^ "Alüminyum ve Alzheimer hastalığı". Demans hakkında gerçekler. Alzheimer Derneği. Arşivlenen orijinal 27 Ekim 2005. Alındı 14 Ekim 2005.
- ^ Bondy SC (Ocak 2016). "Düşük alüminyum seviyeleri, Alzheimer hastalığı ve yaşa bağlı nörodejenerasyonla ilişkili davranışsal ve morfolojik değişikliklere yol açabilir". Nörotoksikoloji (Gönderilen makale). 52: 222–29. doi:10.1016 / j.neuro.2015.12.002. PMID 26687397.
- ^ Kandimalla R, Vallamkondu J, Corgiat EB, Gill KD (Mart 2016). "Alzheimer Hastalığı Gelişiminde Alüminyum Maruz Kalma Yönlerini Anlamak". Beyin Patolojisi. 26 (2): 139–54. doi:10.1111 / bpa.12333. PMID 26494454. S2CID 40859643.
- ^ Santibáñez M, Bolumar F, García AM (Kasım 2007). "Alzheimer hastalığında mesleki risk faktörleri: yayınlanmış epidemiyolojik çalışmaların kalitesini değerlendiren bir inceleme". Mesleki ve Çevresel Tıp. 64 (11): 723–32. doi:10.1136 / oem.2006.028209. PMC 2078415. PMID 17525096.
- ^ a b Lidsky TI (Mayıs 2014). "Alüminyum Hipotezi öldü mü?". Mesleki ve Çevresel Tıp Dergisi. 56 (5 Ek): S73–79. doi:10.1097 / jom.0000000000000063. PMC 4131942. PMID 24806729.
- ^ Yegambaram M, Manivannan B, Beach TG, Halden RU (2015). "Alzheimer hastalığının etiyolojisinde çevresel kirleticilerin rolü: bir inceleme". Güncel Alzheimer Araştırması. 12 (2): 116–46. doi:10.2174/1567205012666150204121719. PMC 4428475. PMID 25654508.
- ^ Cataldo JK, Prochaska JJ, Glantz SA (2010). "Sigara içmek Alzheimer Hastalığı için bir risk faktörüdür: tütün endüstrisi üyeliğini kontrol eden bir analiz". Alzheimer Hastalığı Dergisi. 19 (2): 465–80. doi:10.3233 / JAD-2010-1240. PMC 2906761. PMID 20110594.
- ^ Eikelenboom P, van Exel E, Hoozemans JJ, Veerhuis R, Rozemuller AJ, van Gool WA (2010). "Nöroinflamasyon - Alzheimer hastalığının hem tarihi hem de patogenezinde erken bir olay". Nörodejeneratif hastalıklar. 7 (1–3): 38–41. doi:10.1159/000283480. PMID 20160456. S2CID 40048333.
- ^ Moulton PV, Yang W (2012). "Hava kirliliği, oksidatif stres ve Alzheimer hastalığı". Çevre ve Halk Sağlığı Dergisi (Gözden geçirmek). 2012: 1–9. doi:10.1155/2012/472751. PMC 3317180. PMID 22523504.
- ^ Bartzokis G (Ağustos 2011). "Yaşa bağlı miyelin yıkımına homeostatik yanıtlar olarak Alzheimer hastalığı". Yaşlanmanın Nörobiyolojisi. 32 (8): 1341–71. doi:10.1016 / j.neurobiolaging.2009.08.007. PMC 3128664. PMID 19775776.
- ^ Cai Z, Xiao M (2016). "Oligodendrositler ve Alzheimer hastalığı". The International Journal of Neuroscience. 126 (2): 97–104. doi:10.3109/00207454.2015.1025778. PMID 26000818. S2CID 21448714.
- ^ a b c Reisberg B, Franssen EH, Hasan SM, ve diğerleri. (1999). "Retrogenez: beyin yaşlanmasında klinik, fizyolojik ve patolojik mekanizmalar, Alzheimer ve diğer bunama süreçleri". Avrupa Psikiyatri ve Klinik Sinirbilim Arşivi. 249 Özel Sayı 3 (3): 28-36. doi:10.1007 / pl00014170. PMID 10654097. S2CID 23410069.
- ^ Alves GS, Oertel Knöchel V, Knöchel C, Carvalho AF, Pantel J, Engelhardt E, Laks J (2015). "Retrogenez teorisinin Alzheimer hastalığı patolojisine entegre edilmesi: DTI-TBSS'nin beyaz cevher mikroyapısal bütünlüğünün araştırılmasından elde edilen bilgiler". BioMed Research International. 2015: 291658. doi:10.1155/2015/291658. PMC 4320890. PMID 25685779.
- ^ Brenner Carson, Verna (2015). Alzheimer Hastalığına Bakıcılık. New York: Springer New York Bilimler Akademisi. s. 1–9. ISBN 978-1-4939-2406-6.
- ^ Zis P, Hadjivassiliou M (Şubat 2019). "Gluten Duyarlılığı ve Çölyak Hastalığının Nörolojik Belirtilerinin Tedavisi". Nörolojide Güncel Tedavi Seçenekleri. 21 (3): 10. doi:10.1007 / s11940-019-0552-7. PMID 30806821. S2CID 73466457.
- ^ Makhlouf S, Messelmani M, Zaouali J, Mrissa R (Mart 2018). "Çölyak hastalığı ve çölyak dışı glüten duyarlılığında bilişsel bozulma: ana bilişsel bozukluklar, glütensiz diyetin görüntüleme ve etkisi hakkındaki literatürün gözden geçirilmesi". Acta Neurologica Belgica (Gözden geçirmek). 118 (1): 21–27. doi:10.1007 / s13760-017-0870-z. PMID 29247390. S2CID 3943047.
- ^ Wenk GL (2003). "Alzheimer hastalığında nöropatolojik değişiklikler". Klinik Psikiyatri Dergisi. 64 Özel Sayı 9: 7-10. PMID 12934968.
- ^ Braak H, Del Tredici K (Aralık 2012). "Sporadik Alzheimer hastalığı nerede, ne zaman ve hangi biçimde başlar?" Nörolojide Güncel Görüş. 25 (6): 708–14. doi:10.1097 / WCO.0b013e32835a3432. PMID 23160422.
- ^ Desikan RS, Cabral HJ, Hess CP, Dillon WP, Glastonbury CM, Weiner MW, Schmansky NJ, Greve DN, Salat DH, Buckner RL, Fischl B (Ağustos 2009). "Otomatik MRI ölçümleri, hafif bilişsel bozukluğu ve Alzheimer hastalığı olan bireyleri tanımlar". Beyin. 132 (Pt 8): 2048–57. doi:10.1093 / beyin / awp123. PMC 2714061. PMID 19460794.
- ^ Moan R (20 Temmuz 2009). "MRI Yazılımı Klinik Öncesi Alzheimer Hastalığını Doğru Bir Şekilde Tanımlıyor". Tanısal görüntüleme. Arşivlenen orijinal 16 Mayıs 2016 tarihinde. Alındı 7 Ocak 2013.
- ^ a b Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (Haziran 2004). "Nöritik plakların ve karışıklıkların AD'nin gelişimi ve evrimindeki önemi". Nöroloji. 62 (11): 1984–89. doi:10.1212 / 01.WNL.0000129697.01779.0A. PMID 15184601. S2CID 25017332.
- ^ DeTure, Michael A .; Dickson, Dennis W. (2019). "Alzheimer hastalığının nöropatolojik teşhisi". Moleküler Nörodejenerasyon. 14 (1): 32. doi:10.1186 / s13024-019-0333-5. ISSN 1750-1326. PMC 6679484. PMID 31375134.
- ^ Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH (1994). "Yaşlı hastaların serebral korteksindeki nörofibriler yumakların ve senil plakların bölgesel dağılımı: bir geriatri hastanesinden bir yıllık otopsi popülasyonunun nicel bir değerlendirmesi" (PDF). Beyin zarı. 4 (2): 138–50. doi:10.1093 / cercor / 4.2.138. PMID 8038565.
- ^ Kotzbauer PT, Trojanowsk JQ, Lee VM (Ekim 2001). "Alzheimer hastalığında Lewy vücut patolojisi". Moleküler Sinirbilim Dergisi. 17 (2): 225–32. doi:10.1385 / JMN: 17: 2: 225. PMID 11816795. S2CID 44407971.
- ^ Hashimoto M, Rockenstein E, Crews L, Masliah E (2003). "Alzheimer ve Parkinson hastalıklarında mitokondriyal disfonksiyon ve nörodejenerasyonda protein toplanmasının rolü". Nöromoleküler Tıp. 4 (1–2): 21–36. doi:10.1385 / NMM: 4: 1-2: 21. PMID 14528050. S2CID 20760249.
- ^ Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J (Temmuz 2006). "Sinaps oluşumu ve işlevi, amiloid öncü protein tarafından modüle edilir". Nörobilim Dergisi. 26 (27): 7212–21. doi:10.1523 / JNEUROSCI.1450-06.2006. PMC 6673945. PMID 16822978.
- ^ Turner PR, O'Connor K, Tate WP, Abraham WC (Mayıs 2003). "Sinirsel aktivite, esneklik ve hafızayı düzenlemede amiloid öncü protein ve fragmanlarının rolleri". Nörobiyolojide İlerleme. 70 (1): 1–32. doi:10.1016 / S0301-0082 (03) 00089-3. PMID 12927332. S2CID 25376584.
- ^ Hooper NM (Nisan 2005). "Amiloid öncü protein ve prion proteininin işlenmesinde proteoliz ve lipid sallarının rolleri". Biyokimya Topluluğu İşlemleri. 33 (Pt 2): 335–38. doi:10.1042 / BST0330335. PMID 15787600. S2CID 14269634.
- ^ Ohnishi S, Takano K (Mart 2004). "Protein katlanması açısından amiloid fibriller". Hücresel ve Moleküler Yaşam Bilimleri. 61 (5): 511–24. doi:10.1007 / s00018-003-3264-8. PMID 15004691. S2CID 25739126.
- ^ Hernández F, Avila J (Eylül 2007). "Tauopatiler". Hücresel ve Moleküler Yaşam Bilimleri. 64 (17): 2219–33. doi:10.1007 / s00018-007-7220-x. PMID 17604998.
- ^ Sun W, Samimi H, Gamez M, Zare H, Frost B (Ağustos 2018). "Patojenik tau kaynaklı piRNA tükenmesi, nörodejeneratif tauopatilerde transpoze edilebilir eleman düzensizliği yoluyla nöronal ölümü destekler". Doğa Sinirbilim. 21 (8): 1038–48. doi:10.1038 / s41593-018-0194-1. PMC 6095477. PMID 30038280.
- ^ Van Broeck B, Van Broeckhoven C, Kumar-Singh S (2007). "Alzheimer hastalığının moleküler mekanizmalarına ilişkin güncel bilgiler ve bunların terapötik yaklaşımlar üzerindeki etkileri". Nörodejeneratif hastalıklar. 4 (5): 349–65. doi:10.1159/000105156. PMID 17622778. S2CID 7949658.
- ^ Huang Y, Mucke L (Mart 2012). "Alzheimer mekanizmaları ve tedavi stratejileri". Hücre. 148 (6): 1204–22. doi:10.1016 / j.cell.2012.02.040. PMC 3319071. PMID 22424230.
- ^ Yankner BA, Duffy LK, Kirschner DA (Ekim 1990). "Amiloid beta proteininin nörotrofik ve nörotoksik etkileri: taşikinin nöropeptidleri ile tersine çevirme". Bilim. 250 (4978): 279–82. Bibcode:1990Sci ... 250..279Y. doi:10.1126 / science.2218531. PMID 2218531.
- ^ Chen X, Yan SD (Aralık 2006). "Mitokondriyal Abeta: Alzheimer hastalığında metabolik işlev bozukluğunun potansiyel bir nedeni". IUBMB Life. 58 (12): 686–94. doi:10.1080/15216540601047767. PMID 17424907. S2CID 85423830.
- ^ Greig NH, Mattson MP, Perry T, Chan SL, Giordano T, Sambamurti K, Rogers JT, Ovadia H, Lahiri DK (Aralık 2004). "Nörodejeneratif hastalıklar için yeni tedavi stratejileri ve ilaç adayları: p53 ve TNF-alfa inhibitörleri ve GLP-1 reseptör agonistleri". New York Bilimler Akademisi Yıllıkları. 1035: 290–315. doi:10.1196 / annals.1332.018. PMID 15681814. S2CID 84659695.
- ^ Heneka MT, Carson MJ, El Khoury J ve diğerleri. (Nisan 2015). "Alzheimer hastalığında nöroinflamasyon". Neşter. Nöroloji. 14 (4): 388–405. doi:10.1016 / S1474-4422 (15) 70016-5. PMC 5909703. PMID 25792098.
- ^ Tapia-Arancibia L, Aliaga E, Silhol M, Arancibia S (Kasım 2008). "Normal yaşlanma ve Alzheimer hastalığında beyin BDNF işlevi hakkında yeni bilgiler". Beyin Araştırma İncelemeleri. 59 (1): 201–20. doi:10.1016 / j.brainresrev.2008.07.007. hdl:10533/142174. PMID 18708092. S2CID 6589846.
- ^ Schindowski K, Belarbi K, Buée L (Şubat 2008). "Alzheimer hastalığında nörotrofik faktörler: aksonal taşınmanın rolü". Genler, Beyin ve Davranış. 7 (Ek 1): 43–56. doi:10.1111 / j.1601-183X.2007.00378.x. PMC 2228393. PMID 18184369.
- ^ Mendez MF (2006). "Erken başlangıçlı demansın doğru teşhisi". Uluslararası Tıpta Psikiyatri Dergisi. 36 (4): 401–12. doi:10.2190 / Q6J4-R143-P630-KW41. PMID 17407994. S2CID 43715976.
- ^ Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J (Kasım 2006). "Alzheimer hastalığına terapötik yaklaşımlar". Beyin. 129 (Pt 11): 2840–55. doi:10.1093 / beyin / awl280. PMID 17018549.
- ^ Demans: Hızlı Başvuru Kılavuzu (PDF). Londra, Birleşik Krallık) Ulusal Sağlık ve Klinik Mükemmellik Enstitüsü. Kasım 2006. ISBN 978-1-84629-312-2. Arşivlenen orijinal (PDF) 27 Şubat 2008. Alındı 22 Şubat 2008.
- ^ Schroeter ML, Stein T, Maslowski N, Neumann J (Ekim 2009). "Alzheimer hastalığı ile hafif bilişsel bozukluğun sinirsel bağlantıları: 1351 hastayı içeren sistematik ve kantitatif bir meta-analiz". NeuroImage. 47 (4): 1196–206. doi:10.1016 / j.neuroimage.2009.05.037. PMC 2730171. PMID 19463961.
- ^ a b McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM (Temmuz 1984). "Alzheimer hastalığının klinik teşhisi: Alzheimer Hastalığı Sağlık ve İnsan Hizmetleri Departmanı'nın himayesinde NINCDS-ADRDA Çalışma Grubu raporu". Nöroloji. 34 (7): 939–44. doi:10.1212 / wnl.34.7.939. PMID 6610841. S2CID 11646075.
- ^ a b Dubois B, Feldman HH, Jacova C, vd. (Ağustos 2007). "Alzheimer hastalığının teşhisi için araştırma kriterleri: NINCDS-ADRDA kriterlerinin gözden geçirilmesi". Neşter. Nöroloji. 6 (8): 734–46. doi:10.1016 / S1474-4422 (07) 70178-3. PMID 17616482. S2CID 7356809.
- ^ Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF (Aralık 1994). "Alzheimer hastalığı için NINCDS-ADRDA kriterlerinin güvenilirliği ve geçerliliği. Ulusal Ruh Sağlığı Genetik Girişimi Enstitüsü". Nöroloji Arşivleri. 51 (12): 1198–204. doi:10.1001 / archneur.1994.00540240042014. PMID 7986174.
- ^ Amerikan Psikiyatri Birliği (2000). Ruhsal bozuklukların tanı ve istatistiksel el kitabı: DSM-IV-TR (4th Edition Text Revision ed.). Washington, DC: Amerikan Psikiyatri Birliği. ISBN 978-0-89042-025-6.
- ^ Ito N (Mayıs 1996). "[Demansın klinik yönleri]". [Hokkaido Igaku Zasshi] Hokkaido Tıp Bilimleri Dergisi (Japonyada). 71 (3): 315–20. PMID 8752526.
- ^ Tombaugh TN, McIntyre NJ (Eylül 1992). "Mini zihinsel durum muayenesi: kapsamlı bir inceleme". Amerikan Geriatri Derneği Dergisi. 40 (9): 922–35. doi:10.1111 / j.1532-5415.1992.tb01992.x. PMID 1512391. S2CID 25169596.
- ^ Pasquier F (Ocak 1999). "Demansın erken teşhisi: nöropsikoloji". Nöroloji Dergisi. 246 (1): 6–15. doi:10.1007 / s004150050299. PMID 9987708. S2CID 2108587.
- ^ Harvey PD, Moriarty PJ, Kleinman L, Coyne K, Sadowsky CH, Chen M, Mirski DF (2005). "Demans için bir bakıcı değerlendirmesinin doğrulanması: Demans Şiddet Ölçeği". Alzheimer Hastalığı ve İlişkili Bozukluklar. 19 (4): 186–94. doi:10.1097 / 01.wad.0000189034.43203.60. PMID 16327345. S2CID 20238911.
- ^ Antoine C, Antoine P, Guermonprez P, Frigard B (2004). "[Alzheimer hastalığında eksikliklerin ve anosognozinin bilinci]". L'Encephale (Fransızcada). 30 (6): 570–77. doi:10.1016 / S0013-7006 (04) 95472-3. PMID 15738860.
- ^ Cruz VT, Pais J, Teixeira A, Nunes B (2004). "[Alzheimer hastalığının ilk belirtileri: bakıcı algısı]". Acta Medica Portuguesa (Portekizcede). 17 (6): 435–44. PMID 16197855.
- ^ Clarfield AM (Ekim 2003). "Tersinir demansların azalan prevalansı: güncellenmiş bir meta-analiz". İç Hastalıkları Arşivleri. 163 (18): 2219–29. doi:10.1001 / archinte.163.18.2219. PMID 14557220.
- ^ Sun X, Steffens DC, Au R, Folstein M, Summergrad P, Yee J, Rosenberg I, Mwamburi DM, Qiu WQ (Mayıs 2008). "Amiloid ilişkili depresyon: Alzheimer hastalığının prodromal depresyonu mu?". Genel Psikiyatri Arşivleri. 65 (5): 542–50. doi:10.1001 / archpsyc.65.5.542. PMC 3042807. PMID 18458206.
- ^ Geldmacher DS, Whitehouse PJ (Mayıs 1997). "Alzheimer hastalığının ayırıcı tanısı". Nöroloji. 48 (5 Ek 6): S2–9. doi:10.1212 / WNL.48.5_Suppl_6.2S. PMID 9153154. S2CID 30018544.
- ^ Potter GG, Steffens DC (Mayıs 2007). "Yaşlı yetişkinlerde depresyonun bilişsel bozukluk ve bunamaya katkısı". Nörolog. 13 (3): 105–17. doi:10.1097 / 01.nrl.0000252947.15389.a9. PMID 17495754. S2CID 24569198.
- ^ Zhang S, Smailagic N, Hyde C, Noel-Storr AH, Takwoingi Y, McShane R, Feng J (Temmuz 2014). "(11) C-PIB-PET, Alzheimer hastalığı demansının ve hafif bilişsel bozukluğu (MCI) olan kişilerde diğer demansların erken teşhisi için". Sistematik İncelemelerin Cochrane Veritabanı (7): CD010386. doi:10.1002 / 14651858.CD010386.pub2. PMC 6464750. PMID 25052054.
- ^ Smailagic N, Vacante M, Hyde C, Martin S, Ukoumunne O, Sachpekidis C (Ocak 2015). "18Hafif bilişsel bozukluğu (MCI) olan kişilerde Alzheimer hastalığı demansı ve diğer demansların erken teşhisi için F-FDG PET ". Sistematik İncelemelerin Cochrane Veritabanı. 1: CD010632. doi:10.1002 / 14651858.CD010632.pub2. PMC 7081123. PMID 25629415.
- ^ Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD (Şubat 2008). "Demansın teşhisi ve tedavisi: 1. Alzheimer hastalığının risk değerlendirmesi ve birincil önlenmesi". CMAJ. 178 (5): 548–56. doi:10.1503 / cmaj.070796. PMC 2244657. PMID 18299540.
- ^ Rosendorff C, Beeri MS, Silverman JM (2007). "Alzheimer hastalığı için kardiyovasküler risk faktörleri". Amerikan Geriatrik Kardiyoloji Dergisi. 16 (3): 143–49. doi:10.1111 / j.1076-7460.2007.06696.x. PMID 17483665.
- ^ Ding J, Davis-Plourde KL, Sedaghat S, ve diğerleri. (Ocak 2020). "Antihipertansif ilaçlar ve olaylı demans ve Alzheimer hastalığı riski: ileriye dönük kohort çalışmalarından bireysel katılımcı verilerinin bir meta-analizi". Neşter. Nöroloji. 19 (1): 61–70. doi:10.1016 / S1474-4422 (19) 30393-X. PMC 7391421. PMID 31706889.
- ^ Reiss AB, Wirkowski E (2007). "HMG-CoA redüktaz inhibitörlerinin nörolojik bozukluklardaki rolü: bugüne kadar ilerleme". İlaçlar. 67 (15): 2111–20. doi:10.2165/00003495-200767150-00001. PMID 17927279. S2CID 29107420.
- ^ Kuller LH (Ağustos 2007). "Statinler ve demans". Güncel Ateroskleroz Raporları. 9 (2): 154–61. doi:10.1007 / s11883-007-0012-9. PMID 17877925. S2CID 20488187.
- ^ McGuinness B, Craig D, Bullock R, Malouf R, Passmore P (Temmuz 2014). "Demans tedavisi için statinler". Sistematik İncelemelerin Cochrane Veritabanı. 7 (7): CD007514. doi:10.1002 / 14651858.CD007514.pub3. PMID 25004278.
- ^ Szekely CA, Kasaba T, Zandi PP (2007). Alzheimer hastalığının kemoprevansiyonu için NSAID'ler. Hücre altı Biyokimya. 42. s. 229–48. doi:10.1007/1-4020-5688-5_11. ISBN 978-1-4020-5687-1. PMID 17612054.
- ^ Hoozemans JJ, Veerhuis R, Rozemuller JM, Eikelenboom P (Şubat 2011). "İltihaplı beyni yatıştırmak: steroidal olmayan anti-enflamatuar ilaçların Alzheimer hastalığı patolojisi üzerindeki etkisi". CNS ve Nörolojik Bozukluklar İlaç Hedefleri. 10 (1): 57–67. doi:10.2174/187152711794488665. PMID 21143138.
- ^ Marjoribanks J, Farquhar C, Roberts H, Lethaby A, Lee J (Ocak 2017). "Perimenopozal ve menopoz sonrası kadınlar için uzun vadeli hormon tedavisi". Sistematik İncelemelerin Cochrane Veritabanı. 1: CD004143. doi:10.1002 / 14651858.CD004143.pub5. PMC 6465148. PMID 28093732.
- ^ a b Stern Y (Temmuz 2006). "Bilişsel rezerv ve Alzheimer hastalığı". Alzheimer Hastalığı ve İlişkili Bozukluklar. 20 (3 Özel Sayı 2): S69–74. doi:10.1097 / 01.wad.0000213815.20177.19. PMID 16917199. S2CID 9827674.
- ^ a b Paradise M, Cooper C, Livingston G (Şubat 2009). "Eğitimin Alzheimer hastalığında sağkalım üzerindeki etkisinin sistematik incelemesi". Uluslararası Psikogeriatri. 21 (1): 25–32. doi:10.1017 / S1041610208008053. PMID 19026089.
- ^ Neergaard L (19 Şubat 2011). "2 Dil Konuşmak Alzheimer'ı Geciktirebilir". Denver Postası. İlişkili basın. Arşivlenen orijinal 2 Mayıs 2014.
- ^ Cheng ST (Eylül 2016). "Bilişsel Rezerv ve Demansın Önlenmesi: Fiziksel ve Bilişsel Etkinliklerin Rolü". Güncel Psikiyatri Raporları. 18 (9): 85. doi:10.1007 / s11920-016-0721-2. PMC 4969323. PMID 27481112.
- ^ Farina N, Rusted J, Tabet N (Ocak 2014). "Egzersiz müdahalelerinin Alzheimer hastalığında bilişsel sonuç üzerindeki etkisi: sistematik bir inceleme". Uluslararası Psikogeriatri. 26 (1): 9–18. doi:10.1017 / S1041610213001385. PMID 23962667. S2CID 24936334.
- ^ a b c Hu N, Yu JT, Tan L, Wang YL, Sun L, Tan L (2013). "Beslenme ve Alzheimer hastalığı riski". BioMed Research International (Gözden geçirmek). 2013: 1–12. doi:10.1155/2013/524820. PMC 3705810. PMID 23865055.
- ^ Solfrizzi V, Panza F, Frisardi V, Seripa D, Logroscino G, Imbimbo BP, Pilotto A (Mayıs 2011). "Diyet ve Alzheimer hastalığı risk faktörleri veya önleme: mevcut kanıt". Nöroterapötiklerin Uzman Değerlendirmesi. 11 (5): 677–708. doi:10.1586 / ern.11.56. PMID 21539488. S2CID 27604317.
- ^ Kanoski SE, Davidson TL (Nisan 2011). "Batı diyet tüketimi ve bilişsel bozukluk: hipokampal disfonksiyon ve obezite ile bağlantılar". Fizyoloji ve Davranış (Gözden geçirmek). 103 (1): 59–68. doi:10.1016 / j.physbeh.2010.12.003. PMC 3056912. PMID 21167850.
- ^ Solfrizzi V, Capurso C, D'Introno A, Colacicco AM, Santamato A, Ranieri M, Fiore P, Capurso A, Panza F (Ocak 2008). "Yırtıcılık ve demans sendromlarında yaşam tarzıyla ilgili faktörler". Nöroterapötiklerin Uzman Değerlendirmesi. 8 (1): 133–58. doi:10.1586/14737175.8.1.133. PMID 18088206. S2CID 20897989.
- ^ Santos C, Costa J, Santos J, Vaz-Carneiro A, Lunet N (2010). "Kafein alımı ve bunama: sistematik inceleme ve meta-analiz". Alzheimer Hastalığı Dergisi. 20 Özel Sayı 1: S187–204. doi:10.3233 / JAD-2010-091387. PMID 20182026.
- ^ Nehlig A (Mart 2013). "Kakao flavanolün nöroprotektif etkileri ve bilişsel performans üzerindeki etkisi". İngiliz Klinik Farmakoloji Dergisi (Gözden geçirmek). 75 (3): 716–27. doi:10.1111 / j.1365-2125.2012.04378.x. PMC 3575938. PMID 22775434.
- ^ Stoclet JC, Schini-Kerth V (Mart 2011). "[Diyet flavonoidleri ve insan sağlığı]". Annales Pharmaceutiques Françaises. 69 (2): 78–90. doi:10.1016 / j.pharma.2010.11.004. PMID 21440100.
- ^ Ono K, Yamada M (Nisan 2012). "A vitamini ve Alzheimer hastalığı". Geriatri ve Gerontoloji Uluslararası (Gözden geçirmek). 12 (2): 180–88. doi:10.1111 / j.1447-0594.2011.00786.x. PMID 22221326. S2CID 205507828.
- ^ Lerner AJ, Gustaw-Rothenberg K, Smyth S, Casadesus G (Mart – Nisan 2012). "Alzheimer hastalığının tedavisi için retinoidler". BioFactors. 38 (2): 84–89. doi:10.1002 / biof.196. PMID 22419567. S2CID 27616679.
- ^ Heo JH, Lee KM (Mart 2013). "Alzheimer hastalığının tedavisi ve önlenmesinde antioksidan C vitamininin olası rolü". Amerikan Alzheimer Hastalığı ve Diğer Demanslar Dergisi (Gözden geçirmek). 28 (2): 120–25. doi:10.1177/1533317512473193. PMID 23307795. S2CID 27132196.
- ^ Boothby LA, Doering PL (Aralık 2005). "Alzheimer hastalığı için C vitamini ve E vitamini". Farmakoterapi Yıllıkları. 39 (12): 2073–80. doi:10.1345 / aph.1E495. PMID 16227450. S2CID 46645284.
- ^ a b Farina N, Llewellyn D, Isaac MG, Tabet N (Nisan 2017). "Alzheimer demansı ve hafif bilişsel bozukluk için E Vitamini". Sistematik İncelemelerin Cochrane Veritabanı. 4: CD002854. doi:10.1002 / 14651858.CD002854.pub5. PMC 6478142. PMID 28418065.
- ^ Loef M, Schrauzer GN, Walach H (2011). "Selenyum ve Alzheimer hastalığı: sistematik bir inceleme". Alzheimer Hastalığı Dergisi (Gözden geçirmek). 26 (1): 81–104. doi:10.3233 / JAD-2011-110414. PMID 21593562. S2CID 30661765.
- ^ Loef M, von Stillfried N, Walach H (Eylül 2012). "Çinko diyeti ve Alzheimer hastalığı: sistematik bir inceleme". Beslenme Sinirbilimi (Gözden geçirmek). 15 (5): 2–12. doi:10.1179 / 1476830512Y.0000000010. PMID 22583839. S2CID 23381337.
- ^ Avan A, Hoogenraad TU (2015). "Alzheimer Hastalığında Çinko ve Bakır". Alzheimer Hastalığı Dergisi (Gözden geçirmek). 46 (1): 89–92. doi:10.3233 / JAD-150186. PMID 25835420.
- ^ Malouf R, Grimley Evans J (Ekim 2008). "Sağlıklı yaşlı ve demanslı insanların önlenmesi ve tedavisi için B12 vitamini içeren veya içermeyen folik asit". Sistematik İncelemelerin Cochrane Veritabanı (4): CD004514. doi:10.1002 / 14651858.CD004514.pub2. PMID 18843658.
- ^ Wald DS, Kasturiratne A, Simmonds M (Haziran 2010). "Folik asidin diğer B vitaminleri ile birlikte veya tek başına, bilişsel gerileme üzerindeki etkisi: randomize çalışmaların meta-analizi". Amerikan Tıp Dergisi. 123 (6): 522–527.e2. doi:10.1016 / j.amjmed.2010.01.017. PMID 20569758.
- ^ Cunnane SC, Chouinard-Watkins R, Castellano CA, Barberger-Gateau P (Ocak 2013). "Dokosaheksaenoik asit homeostazı, beyin yaşlanması ve Alzheimer hastalığı: Kanıtları uzlaştırabilir miyiz?". Prostaglandinler, Lökotrienler ve Temel Yağ Asitleri. 88 (1): 61–70. doi:10.1016 / j.plefa.2012.04.006. PMID 22575581.
- ^ Burckhardt M, Herke M, Wustmann T, Watzke S, Langer G, Fink A (Nisan 2016). "Demans tedavisi için Omega-3 yağ asitleri". Sistematik İncelemelerin Cochrane Veritabanı. 4: CD009002. doi:10.1002 / 14651858.CD009002.pub3. PMC 7117565. PMID 27063583.
- ^ Hamaguchi T, Ono K, Yamada M (Ekim 2010). "İNCELEME: Kurkumin ve Alzheimer hastalığı". CNS Neuroscience & Therapeutics (gözden geçirmek). 16 (5): 285–97. doi:10.1111 / j.1755-5949.2010.00147.x. PMC 6493893. PMID 20406252.
- ^ Birks J, Grimley Evans J (Ocak 2009). Bilişsel bozukluk ve bunama için "Ginkgo biloba". Sistematik İncelemelerin Cochrane Veritabanı (1): CD003120. doi:10.1002 / 14651858.CD003120.pub3. PMID 19160216.
- ^ Krishnan S, Cairns R, Howard R (Nisan 2009). Krishnan S (ed.). "Demans tedavisi için kannabinoidler". Sistematik İncelemelerin Cochrane Veritabanı (2): CD007204. doi:10.1002 / 14651858.CD007204.pub2. PMC 7197039. PMID 19370677.
- ^ Bilkei-Gorzo A (Aralık 2012). "Normal ve patolojik beyin yaşlanmasında endokannabinoid sistem". Londra Kraliyet Cemiyeti'nin Felsefi İşlemleri. Seri B, Biyolojik Bilimler. 367 (1607): 3326–41. doi:10.1098 / rstb.2011.0388. PMC 3481530. PMID 23108550.
- ^ a b c Birks JS, Harvey RJ (Haziran 2018). "Alzheimer hastalığına bağlı demans için Donepezil". Sistematik İncelemelerin Cochrane Veritabanı. 6: CD001190. doi:10.1002 / 14651858.CD001190.pub3. PMC 6513124. PMID 29923184.
- ^ a b Birks JS, Grimley Evans J (Nisan 2015). Birks JS (ed.). "Alzheimer hastalığı için Rivastigmin". Sistematik İncelemelerin Cochrane Veritabanı (4): CD001191. doi:10.1002 / 14651858.CD001191.pub3. PMID 25858345.
- ^ Fink HA, Linskens EJ, MacDonald R, vd. (Mayıs 2020). "Klinik Alzheimer Tipi Demans Tedavisinde Reçeteli İlaçların ve Takviyelerin Yararları ve Zararları". İç Hastalıkları Yıllıkları. 172 (10): 656–668. doi:10.7326 / M19-3887. PMID 32340037. S2CID 216595473.
- ^ Geula C, Mesulam MM (1995). "Kolinesterazlar ve Alzheimer hastalığının patolojisi". Alzheimer Hastalığı ve İlişkili Bozukluklar. 9 Özel Sayı 2: 23–28. doi:10.1097/00002093-199501002-00005. PMID 8534419.
- ^ Stahl SM (Kasım 2000). "Alzheimer hastalığı için yeni kolinesteraz inhibitörleri, Bölüm 2: etki mekanizmalarının gösterilmesi". Klinik Psikiyatri Dergisi. 61 (11): 813–14. doi:10.4088 / JCP.v61n1101. PMID 11105732.
- ^ a b Birks J (Ocak 2006). Birks J (ed.). "Alzheimer hastalığı için kolinesteraz inhibitörleri". Sistematik İncelemelerin Cochrane Veritabanı (1): CD005593. doi:10.1002 / 14651858.CD005593. PMID 16437532.
- ^ Raschetti R, Albanese E, Vanacore N, Maggini M (Kasım 2007). "Hafif bilişsel bozuklukta kolinesteraz inhibitörleri: randomize çalışmaların sistematik bir incelemesi". PLOS Tıp. 4 (11): e338. doi:10.1371 / journal.pmed.0040338. PMC 2082649. PMID 18044984.
- ^ Alldredge BK, Corelli RL, Ernst ME, Guglielmo BJ, Jacobson PA, Kradjan WA, Williams BR (2013). Uygulamalı terapötikler: ilaçların klinik kullanımı (10. baskı). Baltimore: Wolters Kluwer Health / Lippincott Williams & Wilkins. s. 2385. ISBN 978-1-60913-713-7.
- ^ a b Lipton SA (Şubat 2006). "NMDA reseptör blokajıyla nöroproteksiyonda paradigma kayması: memantin ve ötesi". Doğa Yorumları. İlaç Keşfi. 5 (2): 160–70. doi:10.1038 / nrd1958. PMID 16424917. S2CID 21379258.
- ^ "Memantin". ABD Ulusal Tıp Kütüphanesi (Medline). 4 Ocak 2004. Arşivlenen orijinal 22 Şubat 2010. Alındı 3 Şubat 2010.
- ^ McShane R, Westby MJ, Roberts E, Minakaran N, Schneider L, Farrimond LE, Maayan N, Ware J, Debarros J (Mayıs 2019). "Demans için memantin". Sistematik İncelemelerin Cochrane Veritabanı. 3 (3): CD003154. doi:10.1002 / 14651858.CD003154.pub6. PMC 6425228. PMID 30891742.
- ^ "Namenda reçeteleme bilgisi" (PDF). Orman İlaçları. Arşivlenen orijinal (PDF) 27 Şubat 2008. Alındı 19 Şubat 2008. (birincil kaynak)
- ^ Raina P, Santaguida P, Ismaila A, Patterson C, Cowan D, Levine M, Booker L, Oremus M (Mart 2008). "Demans tedavisinde kolinesteraz inhibitörleri ve memantinin etkinliği: klinik uygulama kılavuzu için kanıt incelemesi". İç Hastalıkları Yıllıkları. 148 (5): 379–97. doi:10.7326/0003-4819-148-5-200803040-00009. PMID 18316756. S2CID 22235353.
- ^ Ballard C, Waite J (Ocak 2006). Ballard CG (ed.). "Alzheimer hastalığında saldırganlık ve psikoz tedavisi için atipik antipsikotiklerin etkinliği". Sistematik İncelemelerin Cochrane Veritabanı (1): CD003476. doi:10.1002 / 14651858.CD003476.pub2. PMID 16437455.
- ^ Ballard C, Hanney ML, Theodoulou M, Douglas S, McShane R, Kossakowski K, Gill R, Juszczak E, Yu LM, Jacoby R (Şubat 2009). "Demans antipsikotik yoksunluk denemesi (DART-AD): randomize, plasebo kontrollü bir çalışmanın uzun vadeli takibi". Lancet Nörolojisi. 8 (2): 151–57. doi:10.1016 / S1474-4422 (08) 70295-3. PMID 19138567. S2CID 23000439. Lay özeti.
- ^ Declercq T, Petrovic M, Azermai M, Vander Stichele R, De Sutter AI, van Driel ML, Christiaens T (Mart 2013). "Demanslı yaşlı kişilerde davranışsal ve psikolojik semptomlar için kronik antipsikotik ilaçların kesilmesi veya devam ettirilmesi" (PDF). Sistematik İncelemelerin Cochrane Veritabanı. 3 (3): CD007726. doi:10.1002 / 14651858.CD007726.pub2. hdl:1854 / LU-3109108. PMID 23543555.
- ^ a b c d e f g Rabins PV, Blacker D, Rovner BW, vd. (Uygulama Rehberi Yönlendirme Komitesi) (Aralık 2007). "Alzheimer hastalığı ve diğer demans hastalarının tedavisi için Amerikan Psikiyatri Birliği uygulama kılavuzu. İkinci baskı". Amerikan Psikiyatri Dergisi. 164 (12 Ek): 5-56. PMID 18340692.
- ^ Bottino CM, Carvalho IA, Alvarez AM, ve diğerleri. (Aralık 2005). "Alzheimer hastalarında ilaç tedavisi ile birleştirilmiş bilişsel rehabilitasyon: bir pilot çalışma". Klinik Rehabilitasyon. 19 (8): 861–69. doi:10.1191 / 0269215505cr911oa. PMID 16323385. S2CID 21290731.
- ^ Doody RS, Stevens JC, Beck C, vd. (Mayıs 2001). "Uygulama parametresi: demans yönetimi (kanıta dayalı bir inceleme). Amerikan Nöroloji Akademisi Kalite Standartları Alt Komitesi Raporu". Nöroloji. 56 (9): 1154–66. doi:10.1212 / WNL.56.9.1154. PMID 11342679. S2CID 10711725.
- ^ Hermans DG, Htay UH, McShane R (Ocak 2007). "Demanslı kişilerin ev ortamında dolaşmasına yönelik farmakolojik olmayan müdahaleler". Sistematik İncelemelerin Cochrane Veritabanı (1): CD005994. doi:10.1002 / 14651858.CD005994.pub2. PMC 6669244. PMID 17253573.
- ^ Robinson L, Hutchings D, Dickinson HO, Corner L, Beyer F, Finch T, Hughes J, Vanoli A, Ballard C, Bond J (Ocak 2007). "Demansta dolaşmayı azaltmak için farmakolojik olmayan müdahalelerin etkinliği ve kabul edilebilirliği: sistematik bir inceleme". Uluslararası Geriatrik Psikiyatri Dergisi. 22 (1): 9–22. doi:10.1002 / gps.1643. PMID 17096455. S2CID 45660235.
- ^ Abraha I, Rimland JM, Trotta FM, Dell'Aquila G, Cruz-Jentoft A, Petrovic M, Gudmundsson A, Soiza R, O'Mahony D, Guaita A, Cherubini A (Mart 2017). "Demanslı yaşlı hastalarda davranış bozukluklarını tedavi etmek için farmakolojik olmayan müdahalelerin sistematik incelemelerinin sistematik incelemesi. SENATOR-OnTop serisi". BMJ Açık. 7 (3): e012759. doi:10.1136 / bmjopen-2016-012759. PMC 5372076. PMID 28302633.
- ^ Chung JC, Lai CK, Chung PM, Fransız HP (2002). "Demans için Snoezelen". Sistematik İncelemelerin Cochrane Veritabanı (4): CD003152. doi:10.1002 / 14651858.CD003152. PMID 12519587.
- ^ Woods B, O'Philbin L, Farrell EM, Spector AE, Orrell M (Mart 2018). "Demans için hatırlama tedavisi". Sistematik İncelemelerin Cochrane Veritabanı. 3: CD001120. doi:10.1002 / 14651858.CD001120.pub3. PMC 6494367. PMID 29493789.
- ^ Zetteler J (Kasım 2008). "Demanslı bireyler için simüle edilmiş varlık terapisinin etkinliği: sistematik bir inceleme ve meta-analiz". Yaşlanma ve Ruh Sağlığı. 12 (6): 779–85. doi:10.1080/13607860802380631. PMID 19023729. S2CID 39529938.
- ^ Neal M, Barton Wright P (2003). Neal M (ed.). "Demans için doğrulama tedavisi". Sistematik İncelemelerin Cochrane Veritabanı (3): CD001394. doi:10.1002 / 14651858.CD001394. PMID 12917907.
- ^ Chung JC, Lai CK, Chung PM, Fransız HP (2002). Chung JC (ed.). "Demans için Snoezelen". Sistematik İncelemelerin Cochrane Veritabanı (4): CD003152. doi:10.1002 / 14651858.CD003152. PMID 12519587. (2009 itibariyle güncel)
- ^ Spector A, Thorgrimsen L, Woods B, Royan L, Davies S, Butterworth M, Orrell M (Eylül 2003). "Demans hastaları için kanıta dayalı bir bilişsel stimülasyon terapisinin etkinliği: randomize kontrollü çalışma". İngiliz Psikiyatri Dergisi. 183 (3): 248–54. doi:10.1192 / bjp.183.3.248. PMID 12948999.
- ^ Gitlin LN, Corcoran M, Winter L, Boyce A, Hauck WW (Şubat 2001). "Bir ev çevresel müdahalesinin randomize, kontrollü bir denemesi: bakım verenlerde etkinlik ve üzüntü ve demanslı kişilerin günlük işlevi üzerindeki etki". Gerontolog. 41 (1): 4–14. doi:10.1093 / geront / 41.1.4. PMID 11220813.
- ^ Gitlin LN, Hauck WW, Dennis MP, Winter L (Mart 2005). "Aile bakıcıları ve Alzheimer hastalığı ve ilgili bozuklukları olan bireyler için evde çevresel beceri geliştirme programının etkilerinin sürdürülmesi". Gerontology Dergileri. Seri A, Biyolojik Bilimler ve Tıp Bilimleri. 60 (3): 368–74. doi:10.1093 / gerona / 60.3.368. PMID 15860476.
- ^ "Davranışsal ve Psikiyatrik Belirtileri Tedavi Etmek". Alzheimer Derneği. 2006. Arşivlenen orijinal 25 Eylül 2006'da. Alındı 25 Eylül 2006.
- ^ Dunne TE, Neargarder SA, Cipolloni PB, Cronin-Golomb A (Ağustos 2004). "Görsel kontrast, ilerlemiş Alzheimer hastalığında yiyecek ve sıvı alımını artırır". Klinik Beslenme. 23 (4): 533–38. doi:10.1016 / j.clnu.2003.09.015. PMID 15297089.
- ^ Dudek SB (2007). Hemşirelik Uygulaması için Beslenme Temelleri. Hagerstown, Maryland: Lippincott Williams & Wilkins. s. 360. ISBN 978-0-7817-6651-7. Alındı 19 Ağustos 2008.
- ^ Dennehy C (2006). "Hasta haklarının analizi: demans ve PEG takılması". İngiliz Hemşirelik Dergisi. 15 (1): 18–20. doi:10.12968 / bjon.2006.15.1.20303. PMID 16415742.
- ^ Chernoff R (Nisan 2006). "Demanslı hastaları tüple besleyen". Klinik Uygulamada Beslenme. 21 (2): 142–46. doi:10.1177/0115426506021002142. PMID 16556924.
- ^ Gambassi G, Landi F, Lapane KL, Sgadari A, Mor V, Bernabei R (Temmuz 1999). "Huzurevlerinde yaşayan Alzheimer hastalarında ölüm oranı belirleyicileri". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 67 (1): 59–65. doi:10.1136 / jnnp.67.1.59. PMC 1736445. PMID 10369823.
- ^ Tıbbi Konular:
- B Başkanı (Ocak 2003). "Demans hastaları için palyatif bakım". Evde Sağlık Hemşiresi. 21 (1): 53–60, test 61. doi:10.1097/00004045-200301000-00012. PMID 12544465.
- Friedlander AH, Norman DC, Mahler ME, Norman KM, Yagiela JA (Eylül 2006). "Alzheimer hastalığı: psikopatoloji, tıbbi tedavi ve diş hekimliği sonuçları". Amerikan Dişhekimleri Birliği Dergisi. 137 (9): 1240–51. doi:10.14219 / jada.archive.2006.0381. PMID 16946428.
- Belmin J (2007). "Alzheimer hastalığında kilo kaybının teşhisi ve yönetimi için pratik kılavuzlar: büyük bir uzman panelinin uygunluk derecelendirmelerinden bir fikir birliği". Beslenme, Sağlık ve Yaşlanma Dergisi. 11 (1): 33–37. PMID 17315078.
- McCurry SM, Gibbons LE, Logsdon RG, Vitiello M, Teri L (Ekim 2003). "Demans hastalarının uyku hijyeni uygulamalarını değiştirmek için bakıcıları eğitmek: NITE-AD projesi". Amerikan Geriatri Derneği Dergisi. 51 (10): 1455–60. doi:10.1046 / j.1532-5415.2003.51466.x. PMID 14511168. S2CID 24065377.
- Perls TT, Herget M (Aralık 1995). "Bir Alzheimer özel bakım ünitesinde daha yüksek solunum yolu enfeksiyon oranları ve başarılı müdahale". Amerikan Geriatri Derneği Dergisi. 43 (12): 1341–44. doi:10.1111 / j.1532-5415.1995.tb06611.x. PMID 7490383. S2CID 30067677.
- ^ Shega JW, Levin A, Hougham GW, Cox-Hayley D, Luchins D, Hanrahan P, Stocking C, Sachs GA (Nisan 2003). "Alzheimer Bakım Çabalarında Palyatif Mükemmellik (BARIŞ): bir program açıklaması". Palyatif Tıp Dergisi. 6 (2): 315–20. doi:10.1089/109662103764978641. PMID 12854952. S2CID 6072807.
- ^ a b Zanetti O, Solerte SB, Cantoni F (2009). "Alzheimer hastalığında (AD) yaşam beklentisi". Gerontoloji ve Geriatri Arşivleri. 49 Özel Sayı 1: 237–43. doi:10.1016 / j.archger.2009.09.035. PMID 19836639.
- ^ a b Mölsä PK, Marttila RJ, Rinne UK (Mart 1995). "Uzun vadeli sağkalım ve Alzheimer hastalığı ve çoklu enfarktüslü demansta mortalitenin öngörücüleri". Acta Neurologica Scandinavica. 91 (3): 159–64. doi:10.1111 / j.1600-0404.1995.tb00426.x. PMID 7793228. S2CID 19724937.
- ^ Bowen JD, Malter AD, Sheppard L, Kukull WA, McCormick WC, Teri L, Larson EB (Ağustos 1996). "Olası Alzheimer hastalığı teşhisi konan hastalarda ölüm oranı belirleyicileri". Nöroloji. 47 (2): 433–39. doi:10.1212 / wnl.47.2.433. PMID 8757016. S2CID 24961809.
- ^ Larson EB, Shadlen MF, Wang L, McCormick WC, Bowen JD, Teri L, Kukull WA (Nisan 2004). "Alzheimer hastalığının ilk tanısından sonra hayatta kalma". İç Hastalıkları Yıllıkları. 140 (7): 501–09. doi:10.7326/0003-4819-140-7-200404060-00008. PMID 15068977. S2CID 27410149.
- ^ Jagger C, Clarke M, Stone A (Ocak 1995). "Alzheimer hastalığı ile hayatta kalmanın belirleyicileri: toplum temelli bir çalışma". Psikolojik Tıp. 25 (1): 171–77. doi:10.1017 / S0033291700028191. PMID 7792352.
- ^ Dodge HH, Shen C, Pandav R, DeKosky ST, Ganguli M (Şubat 2003). "Alzheimer hastalığı ile ilişkili fonksiyonel geçişler ve aktif yaşam beklentisi". Nöroloji Arşivleri. 60 (2): 253–59. doi:10.1001 / archneur.60.2.253. PMID 12580712.
- ^ a b Ganguli M, Dodge HH, Shen C, Pandav RS, DeKosky ST (Mayıs 2005). "Alzheimer hastalığı ve ölüm oranı: 15 yıllık bir epidemiyolojik çalışma". Nöroloji Arşivleri. 62 (5): 779–84. doi:10.1001 / archneur.62.5.779. PMID 15883266.
- ^ a b c Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (Ocak 2008). "Orta İspanya'nın üç yaşlı popülasyonunda demans insidansı ve alt tipleri". Nörolojik Bilimler Dergisi. 264 (1–2): 63–72. doi:10.1016 / j.jns.2007.07.021. PMID 17727890. S2CID 34341344.
- ^ a b c Di Carlo A, Baldereschi M, Amaducci L, Lepore V, Bracco L, Maggi S, Bonaiuto S, Perissinotto E, Scarlato G, Farchi G, Inzitari D (Ocak 2002). "İtalya'da demans, Alzheimer hastalığı ve vasküler demans insidansı. ILSA Çalışması". Amerikan Geriatri Derneği Dergisi. 50 (1): 41–48. doi:10.1046 / j.1532-5415.2002.50006.x. PMID 12028245. S2CID 22576935.
- ^ Andersen K, Launer LJ, Dewey ME, vd. (Aralık 1999). "AD ve vasküler demans insidansında cinsiyet farklılıkları: EURODEM Çalışmaları. EURODEM İnsidans Araştırma Grubu". Nöroloji. 53 (9): 1992–97. doi:10.1212 / wnl.53.9.1992. PMID 10599770. S2CID 22725252.
- ^ Tejada-Vera B. (2013). Amerika Birleşik Devletleri'nde Alzheimer Hastalığından Ölüm: 2000 ve 2010 Verileri. Hyattsville, MD: ABD Sağlık ve İnsan Hizmetleri Bakanlığı, Hastalık Kontrol ve Önleme Merkezleri, Ulusal Sağlık İstatistikleri Merkezi.
- ^ 2000 ABD tahminleri:
- Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA (Ağustos 2003). "ABD popülasyonunda Alzheimer hastalığı: 2000 nüfus sayımını kullanan yaygınlık tahminleri". Nöroloji Arşivleri. 60 (8): 1119–22. doi:10.1001 / archneur.60.8.1119. PMID 12925369.
- "Genel Demografik Özellik Profilleri, 2000 Nüfus ve Konut Sayımı, Amerika Birleşik Devletleri" (PDF). ABD Sayım Bürosu. 2001. Arşivlenen orijinal (PDF) 19 Ağustos 2008. Alındı 27 Ağustos 2008.
- ^ a b Ferri CP, Prince M, Brayne C, Brodaty H, Fratiglioni L, Ganguli M, Hall K, Hasegawa K, Hendrie H, Huang Y, Jorm A, Mathers C, Menezes PR, Rimmer E, Scazufca M (December 2005). "Global prevalence of dementia: a Delphi consensus study". Lancet. 366 (9503): 2112–17. doi:10.1016/S0140-6736(05)67889-0. PMC 2850264. PMID 16360788.
- ^ World Health Organization (2006). Neurological Disorders: Public Health Challenges. Switzerland: World Health Organization. pp. 204–07. ISBN 978-92-4-156336-9. Arşivlenen orijinal 10 Şubat 2010.
- ^ 2006 prevalence estimate:
- Brookmeyer R, Johnson E, Ziegler-Graham K, Arrighi HM (July 2007). "Forecasting the global burden of Alzheimer's disease". Alzheimer ve Demans. 3 (3): 186–91. CiteSeerX 10.1.1.729.847. doi:10.1016/j.jalz.2007.04.381. PMID 19595937. S2CID 15536204. Arşivlenen orijinal 7 Aralık 2008'de. Alındı 18 Haziran 2008.
- "Öne Çıkanlar" (PDF). World Population Prospects: The 2006 Revision. Working Paper No. ESA/P/WP.202. Population Division, Department of Economic and Social Affairs, United Nations. 2007. Arşivlenen orijinal (PDF) 19 Ağustos 2008. Alındı 27 Ağustos 2008.
- ^ Auguste D.:
- Alzheimer A (1907). "Über eine eigenartige Erkrankung der Hirnrinde" [About a peculiar disease of the cerebral cortex]. Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin (Almanca'da). 64 (1–2): 146–48.
- Alzheimer A (1987). Translated by H. Greenson. "About a peculiar disease of the cerebral cortex. By Alois Alzheimer, 1907 (Translated by L. Jarvik and H. Greenson)". Alzheimer Disease and Associated Disorders. 1 (1): 3–8. PMID 3331112.
- Ulrike M, Konrad M (2003). Alzheimer: The Life of a Physician and the Career of a Disease. New York: Columbia Üniversitesi Yayınları. s.270. ISBN 978-0-231-11896-5.
- ^ Berrios GE (1990). "Alzheimer's Disease: A Conceptual History". Int. J. Geriatr. Psikiyatri. 5 (6): 355–65. doi:10.1002/gps.930050603. S2CID 145155424.
- ^ Kraepelin Emil (2007). Clinical Psychiatry: A Textbook For Students And Physicians (Reprint). Translated by Diefendorf A. Ross. Kessinger Yayıncılık. s. 568. ISBN 978-1-4325-0833-3.
- ^ Katzman R, Terry RD, Bick KL, eds. (1978). Alzheimer's Disease: Senile Dementia and Related Disorders. New York: Raven Press. s. 595. ISBN 978-0-89004-225-0.
- ^ Boller F, Forbes MM (June 1998). "History of dementia and dementia in history: an overview". Nörolojik Bilimler Dergisi. 158 (2): 125–33. doi:10.1016/S0022-510X(98)00128-2. PMID 9702682. S2CID 42399340.
- ^ Amaducci LA, Rocca WA, Schoenberg BS (November 1986). "Origin of the distinction between Alzheimer's disease and senile dementia: how history can clarify nosology". Nöroloji. 36 (11): 1497–9. doi:10.1212/wnl.36.11.1497. PMID 3531918. S2CID 7689479.
- ^ Allegri RF, Butman J, Arizaga RL, Machnicki G, Serrano C, Taragano FE, Sarasola D, Lon L (August 2007). "Economic impact of dementia in developing countries: an evaluation of costs of Alzheimer-type dementia in Argentina". International Psychogeriatrics. 19 (4): 705–18. doi:10.1017/S1041610206003784. PMID 16870037. S2CID 41247271.
- ^ Suh GH, Knapp M, Kang CJ (August 2006). "The economic costs of dementia in Korea, 2002". Uluslararası Geriatrik Psikiyatri Dergisi. 21 (8): 722–28. doi:10.1002/gps.1552. PMID 16858741. S2CID 24138151.
- ^ Wimo A, Jonsson L, Winblad B (2006). "An estimate of the worldwide prevalence and direct costs of dementia in 2003". Dementia and Geriatric Cognitive Disorders. 21 (3): 175–81. doi:10.1159/000090733. PMID 16401889. S2CID 11304720.
- ^ a b c Moore MJ, Zhu CW, Clipp EC (July 2001). "Informal costs of dementia care: estimates from the National Longitudinal Caregiver Study". The Journals of Gerontology. Series B, Psychological Sciences and Social Sciences. 56 (4): S219–28. doi:10.1093/geronb/56.4.S219. PMID 11445614.
- ^ Jönsson L, Eriksdotter Jönhagen M, et al. (May 2006). "Determinants of costs of care for patients with Alzheimer's disease". Uluslararası Geriatrik Psikiyatri Dergisi. 21 (5): 449–59. doi:10.1002/gps.1489. PMID 16676288. S2CID 20193233.
- ^ a b "The MetLife study of Alzheimer's disease: The caregiving experience" (PDF). MetLife Mature Market Institute. Ağustos 2006. Arşivlenen orijinal (PDF) 8 Ocak 2011 tarihinde. Alındı 5 Şubat 2011.
- ^ Schneider J, Murray J, Banerjee S, Mann A (August 1999). "EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: I – Factors associated with carer burden". Uluslararası Geriatrik Psikiyatri Dergisi. 14 (8): 651–61. doi:10.1002/(SICI)1099-1166(199908)14:8<651::AID-GPS992>3.0.CO;2-B. PMID 10489656.
- ^ Murray J, Schneider J, Banerjee S, Mann A (August 1999). "EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: II – A qualitative analysis of the experience of caregiving". Uluslararası Geriatrik Psikiyatri Dergisi. 14 (8): 662–67. doi:10.1002/(SICI)1099-1166(199908)14:8<662::AID-GPS993>3.0.CO;2-4. PMID 10489657.
- ^ a b Zhu CW, Sano M (2006). "Economic considerations in the management of Alzheimer's disease". Yaşlanmada Klinik Müdahaleler. 1 (2): 143–54. doi:10.2147/ciia.2006.1.2.143. PMC 2695165. PMID 18044111.
- ^ Gaugler JE, Kane RL, Kane RA, Newcomer R (April 2005). "Early community-based service utilization and its effects on institutionalization in dementia caregiving". The Gerontologist. 45 (2): 177–85. doi:10.1093/geront/45.2.177. PMID 15799982.
- ^ Ritchie K, Lovestone S (November 2002). "The dementias". Lancet. 360 (9347): 1759–66. doi:10.1016/S0140-6736(02)11667-9. PMID 12480441. S2CID 21404062.
- ^ Brodaty H, Hadzi-Pavlovic D (September 1990). "Psychosocial effects on carers of living with persons with dementia". The Australian and New Zealand Journal of Psychiatry. 24 (3): 351–61. doi:10.3109/00048679009077702. PMID 2241719. S2CID 11788466.
- ^ Donaldson C, Tarrier N, Burns A (April 1998). "Determinants of carer stress in Alzheimer's disease". Uluslararası Geriatrik Psikiyatri Dergisi. 13 (4): 248–56. doi:10.1002/(SICI)1099-1166(199804)13:4<248::AID-GPS770>3.0.CO;2-0. PMID 9646153.
- ^ Pusey H, Richards D (May 2001). "A systematic review of the effectiveness of psychosocial interventions for carers of people with dementia". Yaşlanma ve Ruh Sağlığı. 5 (2): 107–19. doi:10.1080/13607860120038302. PMID 11511058. S2CID 32517015.
- ^ Bayley J (2000). Iris: A Memoir of Iris Murdoch. Londra: Abaküs. ISBN 978-0-349-11215-2. OCLC 41960006.
- ^ Sparks N (1996). The notebook. Thorndike, Maine: Thorndike Press. s.268. ISBN 978-0-7862-0821-0.
- ^ "Thanmathra". Webindia123.com. Arşivlenen orijinal 6 Kasım 2007'de. Alındı 24 Ocak 2008.
- ^ Ogiwara H (2004). Ashita no Kioku (Japonyada). Tōkyō: Kōbunsha. ISBN 978-4-334-92446-1. OCLC 57352130.
- ^ Munro A (2001). Hateship, Friendship, Courtship, Loveship, Marriage: Stories. New York: A.A. Knopf. ISBN 978-0-375-41300-1. OCLC 46929223.
- ^ "Malcolm and Barbara: A love story". Dfgdocs. Arşivlenen orijinal 24 Mayıs 2008. Alındı 24 Ocak 2008.
- ^ "Malcolm and Barbara: A love story". BBC Cambridgeshire. Arşivlenen orijinal 10 Kasım 2012'de. Alındı 2 Mart 2008.
- ^ Plunkett J (7 August 2007). "Alzheimer's film-maker to face ITV lawyers". London: Guardian Media. Arşivlenen orijinal 15 Ocak 2008. Alındı 24 Ocak 2008.
- ^ Cummings JL, Morstorf T, Zhong K (July 2014). "Alzheimer's disease drug-development pipeline: few candidates, frequent failures". Alzheimer's Research & Therapy. 6 (4): 37. doi:10.1186/alzrt269. PMC 4095696. PMID 25024750.
- ^ Gutis, Phillip S. (22 March 2019). "An Alzheimer's Drug Trial Gave Me Hope, and Then It Ended". New York Times. Alındı 25 Mart 2019.
- ^ Lashuel HA, Hartley DM, Balakhaneh D, Aggarwal A, Teichberg S, Callaway DJ (November 2002). "New class of inhibitors of amyloid-beta fibril formation. Implications for the mechanism of pathogenesis in Alzheimer's disease". Biyolojik Kimya Dergisi. 277 (45): 42881–90. doi:10.1074/jbc.M206593200. PMID 12167652.
- ^ Dodel R, Neff F, Noelker C, Pul R, Du Y, Bacher M, Oertel W (March 2010). "Intravenous immunoglobulins as a treatment for Alzheimer's disease: rationale and current evidence". İlaçlar. 70 (5): 513–28. doi:10.2165/11533070-000000000-00000. PMID 20329802. S2CID 40577156. Arşivlenen orijinal 17 Eylül 2011.
- ^ Aşılama:
- Hawkes CA, McLaurin J (November 2007). "Immunotherapy as treatment for Alzheimer's disease". Nöroterapötiklerin Uzman Değerlendirmesi. 7 (11): 1535–48. doi:10.1586/14737175.7.11.1535. PMID 17997702. S2CID 41759093.
- Solomon B (June 2007). "Clinical immunologic approaches for the treatment of Alzheimer's disease". Araştırma İlaçları Hakkında Uzman Görüşü. 16 (6): 819–28. doi:10.1517/13543784.16.6.819. PMID 17501694. S2CID 45559356.
- Woodhouse A, Dickson TC, Vickers JC (2007). "Vaccination strategies for Alzheimer's disease: A new hope?". İlaçlar ve Yaşlanma. 24 (2): 107–19. doi:10.2165/00002512-200724020-00003. PMID 17313199. S2CID 28279428.
- ^ "Study Evaluating ACC-001 in Mild to Moderate Alzheimers Disease Subjects". Clinical Trial. US National Institutes of Health. 11 Mart 2008. Arşivlenen orijinal 30 Temmuz 2013 tarihinde. Alındı 5 Haziran 2008.
- ^ "Study Evaluating Safety, Tolerability, and Immunogenicity of ACC-001 in Subjects with Alzheimer's Disease". US National Institutes of Health. Arşivlenen orijinal on 29 October 2008. Alındı 5 Haziran 2008.
- ^ "Alzheimer's Disease Vaccine Trial Suspended on Safety Concern". Medpage Today. 18 Nisan 2008. Arşivlenen orijinal 23 Nisan 2008. Alındı 14 Haziran 2008.
- ^ "Bapineuzumab in Patients with Mild to Moderate Alzheimer's Disease/ Apo_e4 Non-carriers" (Clinical Trial). US National Institutes of Health. 29 Şubat 2008. Arşivlenen orijinal 22 Mart 2008. Alındı 23 Mart 2008.
- ^ Sperling RA, Jack CR, Black SE, Frosch MP, Greenberg SM, Hyman BT, Scheltens P, Carrillo MC, Thies W, Bednar MM, Black RS, Brashear HR, Grundman M, Siemers ER, Feldman HH, Schindler RJ (July 2011). "Amyloid-related imaging abnormalities in amyloid-modifying therapeutic trials: recommendations from the Alzheimer's Association Research Roundtable Workgroup". Alzheimer ve Demans. 7 (4): 367–85. doi:10.1016/j.jalz.2011.05.2351. PMC 3693547. PMID 21784348.
- ^ "Safety, Tolerability and Efficacy Study to Evaluate Subjects with Mild Cognitive Impairment" (Clinical Trial). US National Institutes of Health. 11 Mart 2008. Arşivlenen orijinal 22 Ekim 2008. Alındı 23 Mart 2008.
- ^ "Study Evaluating the Safety, Tolerability and Efficacy of PBT2 in Patients with Early Alzheimer's Disease" (Clinical Trial). US National Institutes of Health. 13 Ocak 2008. Arşivlenen orijinal on 31 August 2008. Alındı 23 Mart 2008.
- ^ Etanercept research:
- Tobinick E (September 2009). "Tumour necrosis factor modulation for treatment of Alzheimer's disease: rationale and current evidence". CNS İlaçları. 23 (9): 713–25. doi:10.2165/11310810-000000000-00000. PMID 19689163. S2CID 5267301.
- Tobinick E, Gross H, Weinberger A, Cohen H (April 2006). "TNF-alpha modulation for treatment of Alzheimer's disease: a 6-month pilot study". MedGenMed. 8 (2): 25. PMC 1785182. PMID 16926764.
- Griffin WS (January 2008). "Perispinal etanercept: potential as an Alzheimer therapeutic". Nöroinflamasyon Dergisi. 5: 3. doi:10.1186/1742-2094-5-3. PMC 2241592. PMID 18186919.
- Tobinick E (December 2007). "Perispinal etanercept for treatment of Alzheimer's disease". Current Alzheimer Research. 4 (5): 550–52. doi:10.2174/156720507783018217. PMID 18220520.
- Cheng X, Shen Y, Li R (November 2014). "Targeting TNF: a therapeutic strategy for Alzheimer's disease". Bugün İlaç Keşfi. 19 (11): 1822–27. doi:10.1016/j.drudis.2014.06.029. PMID 24998784.
- ^ Wischik CM, Bentham P, Wischik DJ, Seng KM (July 2008). "Tau aggregation inhibitor (TAI) therapy with remberTM arrests disease progression in mild and moderate Alzheimer's disease over 50 weeks". Alzheimer ve Demans. 4 (4): T167. doi:10.1016/j.jalz.2008.05.438. S2CID 54291555. Alındı 30 Temmuz 2008.
- ^ Harrington C, Rickard J, Horsley D (July 2008). "Methylthioninium chloride (MTC) acts as a tau aggregation inhibitor (TAI) in a cellular model and reverses tau pathology in transgenic mouse models of Alzheimer's disease". Alzheimer ve Demans. 4 (4): T120–21. doi:10.1016/j.jalz.2008.05.259. S2CID 54427606.
- ^ Doody RS, Gavrilova SI, Sano M, Thomas RG, Aisen PS, Bachurin SO, Seely L, Hung D (July 2008). "Effect of dimebon on cognition, activities of daily living, behaviour, and global function in patients with mild-to-moderate Alzheimer's disease: a randomised, double-blind, placebo-controlled study". Lancet. 372 (9634): 207–15. doi:10.1016/S0140-6736(08)61074-0. PMID 18640457. S2CID 205951657.
- ^ Bezprozvanny I (October 2010). "The rise and fall of Dimebon". Drug News & Perspectives (Original article). 23 (8): 518–23. doi:10.1358/dnp.2010.23.8.1500435. PMC 3922928. PMID 21031168.
- ^ "Pfizer And Medivation announce results from two phase 3 studies in Dimebon (latrepirdine*) Alzheimer's disease clinical development program (NASDAQ:MDVN)" (Basın bülteni). Arşivlenen orijinal 4 Eylül 2012 tarihinde. Alındı 16 Kasım 2012.
- ^ Wendler A, Wehling M (March 2012). "Translatability scoring in drug development: eight case studies". Journal of Translational Medicine. 10 (1): 39. doi:10.1186/1479-5876-10-39. PMC 3330010. PMID 22397594.
- ^ Baddeley TC, McCaffrey J, Storey JM, Cheung JK, Melis V, Horsley D, Harrington CR, Wischik CM (January 2015). "Complex disposition of methylthioninium redox forms determines efficacy in tau aggregation inhibitor therapy for Alzheimer's disease". The Journal of Pharmacology and Experimental Therapeutics. 352 (1): 110–18. doi:10.1124/jpet.114.219352. PMID 25320049. S2CID 206501788.
- ^ Wischik CM, Harrington CR, Storey JM (April 2014). "Tau-aggregation inhibitor therapy for Alzheimer's disease". Biochemical Pharmacology. 88 (4): 529–39. doi:10.1016/j.bcp.2013.12.008. PMID 24361915.
- ^ Feuerstein A (14 February 2017). "Merck Alzheimer's Drug Study Halted Early for Futility". New York City: TheStreet, Inc. Archived from orijinal 16 Şubat 2017.Merck Alzheimer's Drug Study Halted Early for Futility Independent study monitors concluded that there was "virtually no chance of finding a positive clinical effect."
- ^ "After A Big Failure, Scientists And Patients Hunt For A New Type Of Alzheimer's Drug". NPR.org. Alındı 17 Mayıs 2019.
- ^ Gallagher, James (2 May 2019). "Dementia is 'greatest health challenge'". Alındı 17 Mayıs 2019.
- ^ "Biogen Plans Regulatory Filing for Aducanumab in Alzheimer's Disease Based on New Analysis of Larger Dataset from Phase 3 Studies". 22 Ekim 2019.
- ^ Morley JE, Armbrecht HJ, Farr SA, Kumar VB (May 2012). "The senescence accelerated mouse (SAMP8) as a model for oxidative stress and Alzheimer's disease". Biochimica et Biophysica Açta (BBA) - Hastalığın Moleküler Temeli. 1822 (5): 650–6. doi:10.1016/j.bbadis.2011.11.015. PMID 22142563.
- ^ Marciniak R, Sheardova K, Cermáková P, Hudeček D, Sumec R, Hort J (2014). "Effect of meditation on cognitive functions in context of aging and neurodegenerative diseases". Davranışsal Sinirbilimde Sınırlar. 8: 17. doi:10.3389/fnbeh.2014.00017. PMC 3903052. PMID 24478663.
- ^ Larouche E, Hudon C, Goulet S (January 2015). "Potential benefits of mindfulness-based interventions in mild cognitive impairment and Alzheimer's disease: an interdisciplinary perspective". Davranışsal Beyin Araştırması. 276 (276): 199–212. doi:10.1016/j.bbr.2014.05.058. hdl:20.500.11794/39836. PMID 24893317. S2CID 36235259.
- ^ Jaunmuktane Z, Mead S, Ellis M, et al. (September 2015). "Evidence for human transmission of amyloid-β pathology and cerebral amyloid angiopathy". Doğa. 525 (7568): 247–50. Bibcode:2015Natur.525..247J. doi:10.1038/nature15369. PMID 26354483. S2CID 4465638.
- ^ Abbott A (September 2015). "Autopsies reveal signs of Alzheimer's in growth-hormone patients". Doğa. 525 (7568): 165–66. Bibcode:2015Natur.525..165A. doi:10.1038/525165a. PMID 26354460. S2CID 2512394.
- ^ a b Martin C, Solís L, Concha MI, Otth C (June 2011). "[Herpes simplex virus type 1 as risk factor associated to Alzheimer disease]" [Herpes Simplex Virus Type 1 as Risk Factor Associated to Alzheimer Disease]. Revista Médica de Chile (ispanyolca'da). 139 (6): 779–86. doi:10.4067/S0034-98872011000600013. PMID 22051760.
- ^ Wozniak MA, Mee AP, Itzhaki RF (January 2009). "Herpes simplex virus type 1 DNA is located within Alzheimer's disease amyloid plaques". The Journal of Pathology (Original study). 217 (1): 131–38. doi:10.1002/path.2449. PMID 18973185. S2CID 5176764.
- ^ Itzhaki RF (2014). "Herpes simplex virus type 1 and Alzheimer's disease: increasing evidence for a major role of the virus". Frontiers in Aging Neuroscience. 6: 202. doi:10.3389/fnagi.2014.00202. PMC 4128394. PMID 25157230.
- ^ Itzhaki RF, Lathe R, Balin BJ, et al. (2016). "Microbes and Alzheimer's Disease". Alzheimer Hastalığı Dergisi. 51 (4): 979–84. doi:10.3233/JAD-160152. PMC 5457904. PMID 26967229. Arşivlenen orijinal 10 Kasım 2016.
- ^ Alonso R, Pisa D, Rábano A, Carrasco L (July 2014). "Alzheimer's disease and disseminated mycoses". Avrupa Klinik Mikrobiyoloji ve Enfeksiyon Hastalıkları Dergisi. 33 (7): 1125–32. doi:10.1007/s10096-013-2045-z. PMID 24452965. S2CID 14780610.
- ^ a b Pisa D, Alonso R, Rábano A, Rodal I, Carrasco L (October 2015). "Different Brain Regions are Infected with Fungi in Alzheimer's Disease". Bilimsel Raporlar. 5: 15015. Bibcode:2015NatSR...515015P. doi:10.1038/srep15015. PMC 4606562. PMID 26468932.
- ^ "Fungus, the bogeyman". Ekonomist. 22 Ekim 2015. Arşivlendi orijinal on 8 August 2017.
- ^ Kumar DK, Choi SH, Washicosky KJ, Eimer WA, Tucker S, Ghofrani J, Lefkowitz A, McColl G, Goldstein LE, Tanzi RE, Moir RD (May 2016). "Amyloid-β peptide protects against microbial infection in mouse and worm models of Alzheimer's disease". Bilim Çeviri Tıbbı. 8 (340): 340ra72. doi:10.1126/scitranslmed.aaf1059. PMC 5505565. PMID 27225182.
- ^ Kolata, Gina (25 May 2016). "Could Alzheimer's Stem From Infections? It Makes Sense, Experts Say". New York Times. Arşivlenen orijinal 4 Şubat 2017.
- ^ "Alzheimer's culprit may fight other diseases". Bilim Haberleri. 16 Haziran 2016. Arşivlenen orijinal on 26 May 2016.
- ^ Dougall NJ, Bruggink S, Ebmeier KP (2004). "Demansta 99mTc-HMPAO-SPECT tanısal doğruluğunun sistematik incelemesi". Amerikan Geriatrik Psikiyatri Dergisi. 12 (6): 554–70. doi:10.1176/appi.ajgp.12.6.554. PMID 15545324.
- ^ Carpenter AP, Pontecorvo MJ, Hefti FF, Skovronsky DM (August 2009). "The use of the exploratory IND in the evaluation and development of 18F-PET radiopharmaceuticals for amyloid imaging in the brain: a review of one company's experience". Üç Aylık Nükleer Tıp ve Moleküler Görüntüleme Dergisi. 53 (4): 387–93. PMID 19834448.
- ^ Leung K (8 April 2010). "(E)-4-(2-(6-(2-(2-(2-(18F-fluoroethoxy)ethoxy)ethoxy)pyridin-3-yl)vinyl)-N-methyl benzenamine [[18F]AV-45]". Moleküler Görüntüleme ve Kontrast Ajan Veritabanı. Arşivlenen orijinal 7 Haziran 2010'da. Alındı 24 Haziran 2010.
- ^ Rabinovici GD, Jagust WJ (2009). "Yaşlanma ve demansta amiloid görüntüleme: amiloid hipotezinin in vivo test edilmesi". Davranışsal Nöroloji. 21 (1): 117–28. doi:10.1155/2009/609839. PMC 2804478. PMID 19847050. Arşivlenen orijinal 30 Temmuz 2013.
- ^ O'Brien JT (December 2007). "Role of imaging techniques in the diagnosis of dementia". İngiliz Radyoloji Dergisi. 80 Spec No 2 (Spec No 2): S71–77. doi:10.1259/bjr/33117326. PMID 18445747.
- ^ "FDA Panel Recommends Conditional Approval for PET Agent". Görüntüleme Teknolojisi Haberleri. 21 Ocak 2011. Alındı 17 Haziran 2019.
- ^ Clark CM, Schneider JA, Bedell BJ, et al. (Ocak 2011). "Use of florbetapir-PET for imaging beta-amyloid pathology". JAMA. 305 (3): 275–83. doi:10.1001/jama.2010.2008. PMC 7041965. PMID 21245183.
- ^ "Amyvid". Community register of medicinal products for human use. European Community. 17 Ocak 2013. Alındı 18 Nisan 2018.
- ^ Chong MS, Sahadevan S (September 2005). "Preclinical Alzheimer's disease: diagnosis and prediction of progression". The Lancet. Nöroloji. 4 (9): 576–79. doi:10.1016/s1474-4422(05)70168-x. PMID 16109364. S2CID 45448888.
- ^ a b Sharma N, Singh AN (July 2016). "Exploring Biomarkers for Alzheimer's Disease". Klinik ve Teşhis Araştırmaları Dergisi (Gözden geçirmek). 10 (7): KE01–06. doi:10.7860/JCDR/2016/18828.8166. PMC 5020308. PMID 27630867.
- ^ Montagne A, Barnes SR, Sweeney MD, et al. (Ocak 2015). "Blood-brain barrier breakdown in the aging human hippocampus". Nöron. 85 (2): 296–302. doi:10.1016/j.neuron.2014.12.032. PMC 4350773. PMID 25611508.
- ^ Nation DA, Sweeney MD, Montagne A, et al. (Şubat 2019). "Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction". Doğa Tıbbı. 25 (2): 270–276. doi:10.1038/s41591-018-0297-y. PMC 6367058. PMID 30643288.
- ^ Montagne A, Nation DA, Sagare AP, et al. (Mayıs 2020). "APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline". Doğa. 581 (7806): 71–76. Bibcode:2020Natur.581...71M. doi:10.1038/s41586-020-2247-3. PMC 7250000. PMID 32376954.
daha fazla okuma
| Kütüphane kaynakları hakkında Alzheimer hastalığı |
- Irvine K, Laws KR, Gale TM, Kondel TK (2012). "Greater cognitive deterioration in women than men with Alzheimer's disease: a meta analysis". Klinik ve Deneysel Nöropsikoloji Dergisi (Meta-analysis). 34 (9): 989–98. doi:10.1080/13803395.2012.712676. PMID 22913619. S2CID 28300240.
- Harilal S, Jose J, Parambi DG, Kumar R, Mathew GE, Uddin MS, et al. (Eylül 2019). "Advancements in nanotherapeutics for Alzheimer's disease: current perspectives". Eczacılık ve Farmakoloji Dergisi. 71 (9): 1370–1383. doi:10.1111/jphp.13132. PMID 31304982. S2CID 196616758.
Dış bağlantılar
| Sınıflandırma | |
|---|---|
| Dış kaynaklar |
