Gadobutrol - Gadobutrol
 | |
| Klinik veriler | |
|---|---|
| AHFS /Drugs.com | Uluslararası İlaç İsimleri |
| Lisans verileri | |
| Gebelik kategori |
|
| Rotaları yönetim | IV |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum |
|
| Tanımlayıcılar | |
| |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Kimyasal ve fiziksel veriler | |
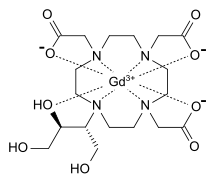
| Formül | C18H31GdN4Ö9 |
| Molar kütle | 604.72 g · mol−1 |
| 3 boyutlu model (JSmol ) | |
| |
| |
| | |
Gadobutrol (HAN ) (Gd-DO3A-butrol) bir gadolinyum bazlı MRI kontrast maddesi (GBCA).
Kanada ve Amerika Birleşik Devletleri'nde pazarlama onayı aldı.[1][2][3][4]
2007 itibariyle, tek GBCA 1.0 molar konsantrasyonlarda onaylanmıştır.[5]
Gadobutrol tarafından pazarlanmaktadır Bayer AG gibi Gadovistve Bayer HealthCare Pharmaceuticals tarafından Gadavist.[6]
Tıbbi kullanımlar
Gadobutrol, yetişkinlerde ve çocuklarda tanısal manyetik rezonans görüntülemede (MRI) kullanılan tıbbi bir üründür. Kraniyal, omurga, göğüs veya diğer incelemeler sırasında kontrast artışı sağlar. Merkezi sinir sisteminde, Gadobutrol, bozulmuş kan beyin bariyeri (BBB) ve / veya anormal damarlanma olan herhangi bir alanı vurgulayarak çalışır. Göğüs dokusunda Gadobutrol, malign meme hastalığının varlığını ve kapsamını ortaya çıkarır. Benzer şekilde gadobutrol, felç teşhisi, tümör perfüzyonunun tespiti ve fokal serebral iskeminin varlığı için kontrastlı manyetik rezonans anjiyografide (CE-MRA) da kullanılır.[6][7]
Gadobutrol, yalnızca tıp uzmanları tarafından intravenöz olarak uygulanmalıdır. Enjeksiyon hazırlanırken ve uygulanırken her zaman steril teknikler kullanılmalıdır. Diğer GBCA'larla karşılaştırıldığında, Gadobutrol, yüksek hacimli bir uygulamayı hafifletmek için daha konsantre bir formda (1 mmol / mL) mevcuttur. Önerilen doz 0.1 mL / kg vücut ağırlığıdır.[6]
Yan etkiler
Gadobutrolün güvenliği, çeşitli popülasyonlarda ve çoklu dozlarda çoklu uygulamalar için klinik deneyler ve pazarlama sonrası boyunca değerlendirildi.[6][7]
Gadobutrol'e karşı en şiddetli reaksiyon, ilacın eliminasyonu bozulmuş hastalarda nefrojenik sistem fibrozudur (NSF). Risk, kronik, bozulmuş böbrek fonksiyonu olan ve akut böbrek hasarı olan hastalar arasında en yüksektir. NSF, cilt, kas ve iç organların ölümüne veya ciddi şekilde bozulmasına neden olabilir.[6]
Başka bir kontrast maddeye karşı daha önce advers reaksiyon yaşamış, bronşiyal astımı ve / veya alerjik bozuklukları olan hastalarda gadobutrol'e aşırı duyarlılık reaksiyonu riski artmıştır. Aşırı duyarlılık reaksiyonları, hafiften şiddetliye kadar değişen anafilaktoid ve anafilaktik reaksiyonları içerebilir. Bu reaksiyonlar nadirdir, ancak gadobutrol uygulaması sırasında ve sonrasında hastanın belirti ve semptomlar açısından izlenmesi gereklidir.[6][7]
Diğer, daha hafif advers reaksiyonlar, uygulamadan sonra hastaların küçük bir kısmında gözlenmiştir. Bu reaksiyonlar aşağıdakileri içerebilir ancak bunlarla sınırlı değildir:[6]
- Baş ağrısı
- Bulantı ve / veya kusma
- Enjeksiyon bölgesi reaksiyonları (soğukluk hissi, sıcaklık, ağrı veya yanma)
- Disguzi (ağızda hoş olmayan tat)
- Sıcak basması
- Baş dönmesi
- Döküntü
- Eritem (ciltte kızarıklık)
- Dispne (nefes almada güçlük)
- Parestezi (yanma hissi)
Belirli popülasyonlarda kullanın
Gebelik
FDA, gadobutrolü gebelik kategorisi C olarak etiketlemiştir. Gebe kadınlarda gadobutrol ile ilgili yeterli çalışma yapılmamıştır. Bununla birlikte, diğer GBCA'ların insanlarda plasentayı geçtiği ve fetal maruziyetle sonuçlandığı, ancak fetüse olumsuz etkiler göstermediği gösterilmiştir.[6]
Hamile sıçanların ve tavşanların vücut yüzey alanına göre sırasıyla insan eşdeğer dozunun 12 ve 8 katına maruz bırakılan hayvan çalışmaları yapılmıştır. Bu maruziyetler genellikle embriyo gelişiminin gecikmesine ve embriyo ölümü. Embriyo geriliği önerilen insan dozunun 8 katına kadar uygulanan maymunlarda görülmemiştir ancak embriyo ölümüyle sonuçlanmıştır. Hayvanlara günler boyunca tekrar tekrar çoklu dozlar uygulandı, bu nedenle maruziyet seviyeleri, insanlarda deneyimlenenlerden çok daha yüksekti.[6]
Gadobutrol, yalnızca hamile kadınlarda, potansiyel yarar fetüsün riskinden daha ağır basarsa uygulanmalıdır.[6][7]
Emzirme
İnsanlarda süte aktarılan Gadobutrol miktarı bilinmemektedir. Diğer GBCA'ların anne sütüne geçmesine ilişkin sınırlı veriler mevcuttur, ancak uygulanan materyalin anne sütüne% 0,01 ila% 0,04 oranında aktarıldığını düşündürmektedir. Gadrobutrol için klinik olmayan veriler, önerilen dozun intravenöz uygulaması üzerine% 0.01'den daha azının anne sütüne geçtiğini göstermektedir. Diğer veriler, GI yolu yoluyla absorpsiyonun çok zayıf olduğunu göstermektedir (yaklaşık% 5). En üst düzeyde güvenlik için, gadobutrol uygulandıktan ve herhangi bir sütün uygun şekilde atılmasından sonra emzirmeye 24 saat ara verilmelidir.[6][7]
Pediatri
Güvenlik, etkililik ve farmakokinetik 2-17 yaş arası çocuklarda iyi bir şekilde kurulmuştur. Önerilen 0.1 mL / kg vücut ağırlığı dozu için herhangi bir ayarlamaya gerek olmadığı bulunmuştur.[6][7]
2 yaşın altındaki çocuklar için güvenlilik ve etkililik verileri sınırlıdır ancak bu popülasyonda 0.1 mL / kg vücut ağırlığı dozunun kullanılabileceğini göstermiştir. Ancak, ajanın vücuttan atılması için mümkün olan en düşük dozun kullanılması ve dozlar arasında en az 7 günlük bir süreye izin verilmesi önerilir.[7]
Geriatri
Klinik veriler, gadobutrolün 65 yaş ve üstü deneklerde 65 yaşın altındakilere kıyasla güvenlilik veya etkililiğinde hiçbir fark olmadığını göstermiştir. Böbrek yetmezliği olmayanlar için gerekli özel önlemler ve / veya doz ayarlaması yoktur.[6][7]
Böbrek yetmezliği olan nüfus
Gadobutrol uygulamasından önce tüm hastalar için böbrek yetmezliğinin değerlendirilmesi önerilir. Bu popülasyonlarda dozun ayarlanması gerekli değildir, ancak gadobutrolün hemodiyaliz kullanılarak vücuttan atılması gerekecektir.[6]
Etkileşimler
Gadobutrol ile bilinen bir ilaç etkileşimi yoktur. Ancak diğer ilaçlarla karıştırılmamalıdır.[6]
Hareket mekanizması
Gadobutrol, manyetik rezonans görüntülemede kullanılmak üzere intravenöz olarak uygulanan bir paramanyetik makrosiklik kontrast ajanıdır. Kontrast artırıcı etki, uzunlamasına gevşeme sürelerindeki (T1) farklılıkları ve spin-spin veya enine gevşeme sürelerindeki (enine gevşeme) farklılıkları azaltmak için çalışan nötr gadolinyum ve dihidroksi-hidroksimetil-tetraazasiklododekan-triasetik asit (butrol) kompleksinin bir sonucudur. T2). Proton yoğunluğundaki farklılıklar ile birlikte bu gevşeme süreleri, bir MRI'ın doku görselleştirme yeteneklerine katkıda bulunan radyo frekansı sinyallerinin yoğunluğundaki değişimden sorumludur. T1 ve T2'nin kısalmasının artmasıyla daha fazla sinyal zenginleştirme ve dolayısıyla daha fazla doku görselleştirme elde edilir.[7][8]
Tarih
Ticarileştirme
Gadobutrol, ilk olarak 1998 yılında, beyin ve omuriliğin kontrastlı MRI taramalarında kullanılmak üzere İsviçre'de onaylandı. O zamandan beri, çok sayıda kullanım için tüm Avrupa Birliği ülkeleri, Amerika Birleşik Devletleri, Kanada, Meksika, Avustralya, Yeni Zelanda, Çin, Güney Kore, Rusya ve Brezilya dahil olmak üzere 65 başka ülkede onaylanmış ve pazarlanmıştır.[9] Gadobutrol, ilk olarak 2011 yılında Amerika Birleşik Devletleri'nde merkezi sinir sistemi MRI'larında kullanılmak üzere onaylanmıştır. Şu anda Bayer Healthcare Pharmaceuticals Inc. tarafından üretilmekte ve Gadavist markası altında pazarlanmaktadır.[9][10] Gadavist, 2015 yılında FDA tarafından 2 yaşın altındaki çocuklarda kullanım için güvenli ilk kontrast madde olarak onaylandı. En yakın zamanda, 2016'nın başlarında, Gadavist, Amerika Birleşik Devletleri'nde kontrastlı manyetik rezonans anjiyografide kullanım için onaylandı.[10]
Araştırma ve klinik denemeler
Gadavist, Amerika Birleşik Devletleri'nde yürütülen bir faz 2 ve iki faz 3 klinik çalışmanın yanı sıra, esas olarak Asya ve Avrupa Birliği'nde gerçekleştirilen 43 klinik araştırmanın bulgularını sunduktan sonra 2011 yılında Amerika Birleşik Devletleri'nde onaylandı.[9] Çok merkezli, randomize, çift kör, faz 3 klinik deneyler (biri aktif karşılaştırma kolu olmadan tamamlandı)[11] 18 yaşın üzerinde, hem erkek hem de kadın, CNS'nin kontrastlı bir MRI'sı için sevk edilen 402 hasta kaydedildi.[12] Her hasta, intravenöz enjeksiyon yoluyla tek bir gadobutrol dozu (0.1 mmol / kg vücut ağırlığı), ardından intravenöz enjeksiyon yoluyla onaylanmış dozda (0.1 mmol / kg vücut ağırlığı) tek bir gadoteridol (ProHance) dozu veya tersi şekilde aldı. Çalışma gadobutrolün güvenliğini ve etkinliğini değerlendirdi. Bu 3. aşama klinik çalışmalardan aşağıdaki sonuçlar çıkarıldı:[9]
- Gadobutrol ile geliştirilmiş ve artırılmamış görüntülere kıyasla birleştirilmemiş görüntüler şunlardır:
- Teşhis performansında üstün
- Lezyon görselleştirme değişkenleri için üstün kontrast arttırma, sınır tanımlaması ve iç morfoloji
- Tespit edilen lezyonların sayısı için daha düşük olmayan
- Gadobutrol'ün, görselleştirme değişkenleri, kontrast artışı, sınır tanımlaması ve iç morfolojinin yanı sıra tespit edilen lezyon sayısı açısından ProHance'ten daha düşük olmadığı gösterilmiştir.
- Gadobutrol, lezyon malignitesinin belirlenmesi için ProHance'ten daha yüksek hassasiyet gösterdi
- Gadobutrol ile geliştirilmiş görüntüler, 3 kör okuyucunun tümü tarafından ProHance ile geliştirilmiş görüntülere göre tutarlı bir şekilde tercih edildi
2015 yılında 2 yaşın altındaki çocuklarda kullanım için onay alınmadan önce, bir faz 1 klinik araştırma yürütüldü. Hem erkek hem de kadın olmak üzere herhangi bir vücut bölgesinin rutin kontrastlı MRI incelemesi için planlanan 2 yaşın altındaki pediyatrik hastalar çalışmaya kaydedilebilir. Açık etiketli, çok merkezli, farmakokinetik ve güvenlik testi gadobutrolün nasıl alındığını, hareket ettirildiğini ve bebeklerin vücudundan çıkarıldığını inceledi. Çalışma ayrıca standart gadobutrol dozunun, 0.1 mmol / kg (0.1 mL / kg) vücut ağırlığının güvenliğini, toleransını ve etkinliğini değerlendirdi. Klinik araştırmanın sponsoru Bayer Healthcare Pharmaceuticals Inc.[13]
2006'nın başlarında manyetik rezonans anjiyografide (MRA) kullanım için onaylanmadan önce, bir faz 3 klinik çalışma yürütüldü. Rutin manyetik rezonans anjiyografi (MRA) için sevk edilen 18 yaşın üzerindeki hem erkek hem de kadın hastalar çalışmaya kaydedilebilir. Açık etiketli, muti merkezli, kör okuma güvenliği ve etkililik çalışması, gadobutrol ile geliştirilmiş MRA görüntülerinin tanısal sonuçlarını kontrastsız MRA görüntüleriyle karşılaştırdı. Hastalar taramadan önce tek bir intravenöz 0.1 mmol / kg gadobutrol enjeksiyonu almıştır. MRA görüntü sonuçları daha sonra kalifiye personel tarafından kör bir şekilde okundu. Klinik araştırmanın sponsoru Bayer Healthcare Pharmaceuticals Inc.[14]
Düzenleyici
Gadobutrol için tek ABD patenti, 9 Kasım 1999'da Schering AG'ye verilen US5980864A'dır.[15] Patent, 10- (1-hidroksimetil-2,3-dihidroksipropil) -1,4,7-triskarboksimetil-1 gadolinyum (III) kompleksini üretmek için 1,4,7,10-tetraazasiklododekan butiltriollerin kullanıldığı işlem içindir, 4,7,10-tetraazasiklododekan (gadobutrol). Patent, bu metal kompleksinin üstün bir teşhis ortamı olarak kullanılmasını savunmaktadır. 2006 yılında Bayer Healthcare Pharmaceuticals Inc., Schering AG'yi bünyesine kattı ve Kasım 2007'de patent Bayer Schering Pharma'ya devredildi. 2011'de FDA onayından sonra, patente 1.470 günlük bir uzatma verildi ve Gadavist ticari adı patentle ilişkilendirildi. Şubat 2016'da patente ikinci dönem uzatma verildi, ancak Kasım 2016'da süresi doldu.[16]
Paketleme ve satın alma
Gadobutrol kontrast maddesi, tek dozluk şişelerde (2 mL, 7,5 mL, 10 mL ve 15 mL), tek dozluk önceden doldurulmuş enjeksiyonlarda (7,5 mL, 10 mL, 15 mL) ve çoklu flakon içeren eczane toplu paketleri (30 mL ve 65 mL).[17] Gadobutrol şu anda ABD'de Gadavist adı altında ve diğer birçok ülkede Gadovist veya Gadovist 1.0 adı altında pazarlanmaktadır.[9]
Gadobutrol reçete için mevcut değildir ve sadece eğitimli personel tarafından uygulanabilir. 2016 yılında Bayer-UK ürün fiyatlarını yayınladı.[18]
Referanslar
- ^ Cheng KT (2007). "Gadobutrol" (PDF). Moleküler Görüntüleme ve Kontrast Ajan Veritabanı (MICAD). Ulusal Biyoteknoloji Bilgi Merkezi (NCBI). PMID 20641787. NBK23589.
- ^ "Radyolojide Bayer - Gadavist® (gadobutrol) enjeksiyonu 1 mmol / mL". bayerimaging.com. Alındı 20 Mayıs 2015.
- ^ "FDA, merkezi sinir sistemi taramaları için görüntüleme ajanını onayladı" (Basın bülteni). ABD Gıda ve İlaç İdaresi (FDA). 15 Mart 2011. Alındı 31 Mart, 2011.
- ^ "ABD FDA, Merkezi Sinir Sisteminin MRI için Bayer'in Gadavist (Gadobutrol) Enjeksiyonunu Onayladı" (Basın bülteni). Bayer HealthCare İlaçları. 14 Mart 2011. Arşivlenen orijinal 2 Mayıs 2011. Alındı 31 Mart, 2011.
- ^ "Kardiyoloji Hastalıkları Uzmanları İçin Eğitim" (PDF). touchcardiology.com. Radcliffekardiyoloji. Alındı 20 Mayıs 2015.
- ^ a b c d e f g h ben j k l m n Ö "Gadavist tam reçete bilgileri" (PDF). Alındı 2011-03-14.
- ^ a b c d e f g h ben "GadovistÜrün Monografisi" (PDF). Bayer Inc. 12 Ağustos 2016. Alındı 11 Kasım, 2016.
- ^ "Gadobutrol". DrugBank. 2016-11-19.
- ^ a b c d e "Gadobutrol Enjeksiyonu için Brifing Dokümanı, NDA 201.277" (PDF). FDA.Gov. Gıda ve İlaç İdaresi. 21 Ocak 2011. Alındı 11 Kasım, 2016.
- ^ a b "Gadavist (gadobutrol) FDA Onay Geçmişi". www.drugs.com. Alındı 2016-11-19.
- ^ Stinson B (6 Mart 2009). "Klinik İnceleme" (PDF). FDA.Gov. FDA. Alındı 11 Kasım, 2016.
- ^ "Merkezi Sinir Sistemi (CNS) Görüntüleme İçin Hastalarda Gadobutrol 1.0 Molar'ın (Gadavist) Güvenliği ve Etkinliği". ClinicalTrials.gov. Alındı 2016-11-19.
- ^ "2 Yaşından Küçük Pediatrik Deneklerde Gadobutrol Farmakokinetik ve Güvenlik Çalışması". ClinicalTrials.gov. Alındı 2016-11-19.
- ^ "Gadobutrol Geliştirilmiş MRA Supra-aortik Damarlar". ClinicalTrials.gov. Alındı 2016-11-19.
- ^ Platzek J, Gries H, Weinmann H, Schuhmann-Giampieri G, Press W (9 Kasım 1999), 1,4,7,10-tetraazasiklododekan butiltrioller, üretim süreçleri ve bunları içeren farmasötik maddeler, alındı 2016-11-19
- ^ "Patent US5980864A". Google Patentleri. Alındı 4 Mart, 2019.
- ^ "Radyolojide Bayer | Gadavist® (gadobutrol) enjeksiyonu 1 mmol / mL". www.radiologysolutions.bayer.com. Alındı 2016-11-20.
- ^ "2016 Fiyat Listesi" (PDF). Bayer-İngiltere. 16 Haziran 2016. Alındı 19 Kasım 2016.
