Galaktoz oksidaz - Galactose oxidase - Wikipedia
| Galaktoz Oksidaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
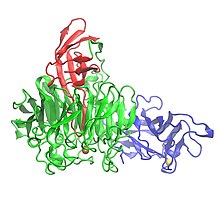 Üç alan gösteren galaktoz oksidazın kristal yapısı: Alan 1 (mavi), Alan 2 (yeşil) ve Alan 3 (kırmızı) | |||||||||
| Tanımlayıcılar | |||||||||
| EC numarası | 1.1.3.9 | ||||||||
| CAS numarası | 9028-79-9 | ||||||||
| Veritabanları | |||||||||
| IntEnz | IntEnz görünümü | ||||||||
| BRENDA | BRENDA girişi | ||||||||
| ExPASy | NiceZyme görünümü | ||||||||
| KEGG | KEGG girişi | ||||||||
| MetaCyc | metabolik yol | ||||||||
| PRIAM | profil | ||||||||
| PDB yapılar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontolojisi | AmiGO / QuickGO | ||||||||
| |||||||||
Galaktoz oksidaz (D-galaktoz: oksijen 6-oksidoredüktaz, D-galaktoz oksidaz, beta-galaktoz oksidaz; kısaltılmış GAO, GAOX, GOase; EC 1.1.3.9 ) bir enzim katalizleyen oksidasyon nın-nin D-galaktoz bazı türlerde mantarlar.[1][2]
Galaktoz oksidaz ailesine aittir. oksidoredüktazlar. Bakır iyonu kofaktör galaktoz oksidaz için. Galaktoz oksidazın dikkate değer bir özelliği, serbest radikal enzim.[3][4] Onun katalitik bölge serbest radikal içerir ligand bakır merkeze koordinasyon.[4] Bu serbest radikal ligand, kovalent olarak çapraz bağlı sistein ve tirozin sırasında oluşan yan zincirler çeviri sonrası değişiklik.[3][4]
Arka fon
Gibi birkaç mantar türünde bulunur Fusarium graminearum NRRL 2903 (önceden yanlış tanımlanmış Dactylium dendroides),[5] ve diğer türler Fusarium ve Aspergillus cins,[1] galaktoz oksidaz ilk olarak 1959'da izole edildi.[6] Bu enzim, mantarlar tarafından hücre dışı boşlukta işlev görmek üzere salgılanır.[1][3][7] D-galaktozun oksidasyon reaksiyonu galaktoz oksidaza adını vermesine rağmen, dioksijen -e hidrojen peroksit mayalarda daha büyük fizyolojik öneme sahip olduğuna inanılmaktadır.[3][4] Mayalar tarafından bu şekilde üretilebilen hidrojen peroksit muhtemelen bakteriyostatik ajan.[3]
Protein yapısı
Galaktoz oksidaz 639 içerir amino asitler.[1] Tek peptid monomer üç β yapısal etki alanları.[1][7] Alan 1 (kalıntı 1-155) bir β-sandviç sekiz antiparalelden oluşur β-iplikçikleri.[3] Na için olası bir bağlanma bölgesi içerir+ veya Ca2+proteinde yapısal rollere hizmet edebilen.[3] Alan 1'in diğer bir özelliği, enzimi hücre dışı karbonhidratlara bağlanmaya yönlendiren bir karbonhidrat bağlanma bölgesinin varlığıdır.[3] Alan 2 (kalıntılar 156-552), bakır bağlanma bölgesini içerir.[1] Alan 2'deki β iplikler yedi katlı bir pervane olarak düzenlenmiştir,[1] ve yedi yapısal birimin her biri, dört antiparalel P-ipliğinden oluşan bir alt alandır.[3] Alan 3 (553-639 kalıntıları), yedi anti-paralel β-sarmalından oluşur ve Alan 2 üzerinde bir "başlık" oluşturur. histidin Alan 3'ün (His581), ligand bakır için, enzimin metal içeren aktif bölgesine katkıda bulunur.[1]
Aktif site

Galaktoz oksidaz bir tip II bakır proteini.[1][8] Kare düzlemsel veya kare tabanlı piramidi benimseyen tek bir bakır merkez içerir. koordinasyon geometrisi.[3][4][9] Bakır merkezin beş koordinasyon ligandı vardır: iki tirozinler (Tyr272 ve Tyr495), iki histidinler (His496 ve His581) ve genellikle su olan bir çözücü molekül.[3][4] Galaktoz oksidazın aktif bölgesindeki bakır, "çarpık kare piramidal" koordinasyon geometrisine sahip olarak tarif edilir.[3][4] Tyr495 eksenel liganddır, diğer dört ligand kabaca bir düzlemde uzanır. Her iki histidin de bakır ile koordine eder 3-nitrojen.[3] Bakır-H2O bağ en uzun koordinat bağı;[3][4] bu kararsız ve bir substrat molekülü ile değiştirilebilir. Tyr272 bir dimer bir orto karbon tirozin yoluyla bir sistein (Cys228) ve sisteinin kükürt atomu ile desteklenen X-ışını kristalografisi çalışmalar.[1][3][4][10] Tyr-Cys çapraz bağlantısı, Tyr272'nin yapısal esnekliğini azaltır.[3] Bu çapraz bağlı tirosinat aynı zamanda bir serbest radikaldir. Tamamen oksitlenmiş galaktoz oksidaz formunda, serbest radikal bakır (II) merkezine bağlanır. antiferromanyetik olarak, Tarafından desteklenen EPR spektroskopik çalışmalar.[4][6] Dahası, çapraz bağlanmanın oluşumu tiyoeter bağı düşürdüğüne inanılıyor oksidasyon potansiyeli Tyr272'nin fenoksit, bu fenoksilin çeviri sonrası modifikasyonda radikal oluşturmak için daha kolay oksitlenmesini sağlar.[1][3][8]
Galaktoz oksidazdaki serbest radikal, diğer birçok serbest protein radikaline kıyasla alışılmadık şekilde stabildir.[2][3] Serbest radikal ligand esas olarak iki şekilde stabilize edilir. İlk olarak, açıkladığı gibi hesaplamalı kimya çalışmalar, eşleşmemiş elektron ile stabilize edilir yerelleştirme tarafından aromatik halka Tirozin ve çapraz bağlı sistein sülfür, Tyr272'nin oksijen atomu yüksek eşlenmemiş elektron yoğunluğu.[1][4][9] Bazı deneysel kanıtlar ayrıca eksenel Tyr495'in eşleştirilmemiş elektron delokalizasyonunda da rol oynadığını göstermektedir.[3] İkincisi, indol bir yüzük triptofan (Trp290), Tirozin-Sisteinin üzerinde ve ona paralel uzanır ve radikali harici çözücü ortamından koruyan bir kalkan gibi davranır.[1][3][4] Destekleyici kanıt bundan gelir mutasyon Bu triptofan kalıntısının, galaktoz oksidazın aktif formunun daha düşük stabilitesine yol açar.[3] Ek olarak, dış küre Aktif sitenin% 'si, aktif bölgeye bir miktar veren birçok aromatik kalıntıdan oluşur. hidrofobik karakter.[3] Ayrıca geniş hidrojen bağı ağlar aktif siteyi çevreler.[3]
Reaksiyon
Mayalarda galaktoz oksidaz aşağıdaki reaksiyonu katalize eder:[1][4]
- D-galaktoz + O2 D-galakto-heksodiyal doz + H2Ö2
Bu reaksiyon, esasen birincil oksidasyondur. alkol kullanma dioksijen karşılık gelen oluşturmak için aldehit ve hidrojen peroksit.[1][4] Galaktoz oksidazın galaktoz dışındaki çeşitli birincil alkolleri de katalize edebildiği gösterilmiştir.[2][3] Aslında, galaktoz oksidaz katalize eder dihidroksiaseton galaktoza göre üç kat daha hızlı.[3] Tepki bölge seçmeli ikincil alkolü oksitleyemez.[3]
Bu iki elektronlu oksidasyon, çift redoks sahası ile elde edilir: bakır (II) metal merkezi ve serbest radikal, her biri substrattan bir elektron kabul edebilir.[4] Bu çift redoks merkezinin üç erişilebilir oksidasyon seviyesi vardır.[4] Galaktoz oksidazın katalitik döngüsünde enzim, tamamen oksitlenmiş form ile tamamen indirgenmiş form arasında hareket eder.[4] Yarı oksitlenmiş form, aktif olmayan formdur.

Katalitik mekanizma
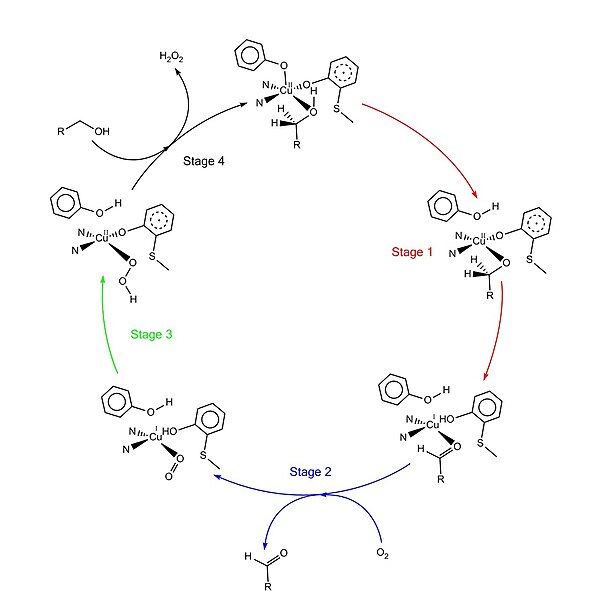
"Ping-pong mekanizması" olarak adlandırılan kabul edilen katalitik mekanizma, dört ana aşamadan oluşur.[1][4][9][11] İlk aşama, substratın çift redoks merkezi tarafından oksidasyonudur. Sonra hidroksil substrat alkol grubu çözücü koordinasyon bölgesini işgal eder, hidroksil grubu Tyr495 tarafından protondan arındırılır, ardından Tyr495 salınır.[12][1] Bu adım, alkolü oksidasyona daha yatkın hale getirir.[4] Hidroksil grubunun eklendiği karbon üzerindeki proton daha sonra substratın oksidasyonu ile birlikte Tyr272'ye (hidrojen alıcısı olarak hizmet eder) aktarılır. Bir elektron radikal liganda gider, diğer elektron bakır (II) merkezine gider ve sonuç olarak bakır (I) 'e indirgenir. Bu arada, Tyr272 radikali de azalır.[4] Proton çıkarma adımı oran belirleme ve stereospesifik beri sadece yanlısı S alkol karbon üzerindeki hidrojen uzaklaştırılır (kinetik izotop etkisi çalışmaları ile desteklenir).[1][3][4] Aşama 1'in genel sonucu, iki hidrojen atomunun uzaklaştırılması ve iki elektronun substrattan uzaklaştırılmasıdır, ancak bunun sırası net değildir.[1][4] İkinci aşama, oksitlenmiş substratın (bu durumda aldehit) salınması ve substrat koordinasyon bölgesinde dioksijen koordinasyonudur. Üçüncü aşamada, dioksijen, bakır (I) tarafından hızla indirgenerek süperoksit. Süperoksit, proton ve bir elektronu Tyr272'den çıkaran ve tirozin radikalini yeniden oluşturan reaktif bir türdür. Dördüncü aşamada, hidroperoksit Tyr496'yı deprotonize eder ve H olarak salınır.2Ö2. Tyr496'nın müteakip eksenel koordinasyonu ve yeni substrat molekülünün bakır merkeze ekvatoral koordinasyonu, enzimin dönüşümünü tamamlar.
Çeviri sonrası değişiklik
Prepro -GAOX (sinyal sekanslı galaktoz oksidaz) iki kez işlenir Proteolitik bölünme içinde lider dizisi olgun GAOX peptidi (pro-GAOX) oluşturmak için.[3] İlk bölünme, 24 amino asitlik bir diziyi şu şekilde kaldırır: sinyal peptidaz.[3] İkinci bölünme, başka bir 17 amino asit dizisini kaldırır.[3]
Tyr272 ve Cys228 arasındaki kovalent bağ, profesyonel -GAOX yapıldı.[4] Bu modifikasyonun meydana gelmesi, başka herhangi bir "yardımcı" protein gerektirmiyor gibi görünüyor.[3][10] Bu kovalent bağlantının oluşumu için mevcut mekanizma, bakır (I) ve dioksijen gereksinimini göstermektedir.[3][4] Bu tirozin-sistein bağlantısının mekanizması tam olarak anlaşılmamıştır, ancak birkaç önemli olay tahmin edilmiştir:[1] Copper (I), (gelecekteki) aktif bölgede Tyr272 ve histidinler ile koordine olur. Dioksijen'in aktif site kompleksi ile reaksiyonu, bir serbest radikal oluşturur orta düzey. Serbest radikalin iki olası şekli, Thiyl ve fenoksil, mümkün;[3] tiil radikalinin fenole eklenmesi veya fenoksil radikalinin tiole eklenmesi, sisteinin kükürt atomu ile tirosinin aromatik halkası arasında kovalent bağ oluşturur;[2] İkinci bir dioksijen molekülü, radikal-bakır kompleksi oluşturmak için çapraz bağlı tirozin-sistein ile koordine edilmiş bakır merkez ile reaksiyona girer.[3][4]
Başvurular
Biyoanaliz
Galaktoz gibi örneklerdeki biyomoleküller, oksijen saptama yöntemi kullanılarak ölçülebilir, çünkü bir eşdeğer oksijen tüketimi, oksitlenmiş bir eşdeğer birincil hidroksil grubuna karşılık gelir.[3] Substrat oksidasyonu sırasında hidrojen peroksit oluşumu için de kullanılabilir kolorimetrik hidrojen peroksit ile oksitlenen boyalar kullanılarak galaktoz tespiti.[3] Karbonhidratlar normalde birincil hidroksil gruplarına sahip olabileceğinden, galaktoz oksidaz hücre yüzeyini değiştirmek için kullanılabilir. glikoproteinler hücre etiketlemesi elde etmek için.[3]
Organik sentez
Galaktoz oksidaz, bir biyokatalizör sentezinde aldehitler ve karboksilik asitler birincil alkollerden.[3]
Biyomimetik bileşikler
Galaktoz oksidaz mekanizmasına ilişkin anlayışımız, araştırmacılara galaktoz oksidazın yapısını ve işlevini taklit eden model bileşikler geliştirmeleri için ilham veriyor.[4] Görünüşe göre bakır ve serbest radikal arasındaki elektron paylaşımı, bu bileşikleri sentezlemenin başarısında çok önemli bir unsurdur.[4] Yapılan ilk GAOX model bileşiği [Cu (II) (dnc)] 'dir, duncamine (dnc) olarak şelatlama ligandı.[3] Diğer model bileşikler literatürde incelenmiş ve rapor edilmiştir.[6][8][9][13][14]
Referanslar
- ^ a b c d e f g h ben j k l m n Ö p q r s t Bertini I, Sigel A, Sigel H, eds. (2001). Metaloproteinler hakkında el kitabı. New York, NY [u.a.]: Dekker. ISBN 978-0824705206.
- ^ a b c d Tkac J, Vostiar I, Gemeiner P, Sturdik E (Mayıs 2002). "Galaktoz oksidazın aktif bölgesi ile bir grafit elektrot arasındaki doğrudan elektron iletişiminin dolaylı kanıtı". Biyoelektrokimya. 56 (1–2): 23–5. doi:10.1016 / s1567-5394 (02) 00043-9. PMID 12009437.
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w x y z aa ab AC reklam ae af ag Ah ai aj ak al am Whittaker JW (2002). "Galaktoz oksidaz". Protein Kimyasındaki Gelişmeler. 60: 1–49. doi:10.1016 / s0065-3233 (02) 60050-6. ISBN 9780120342600. PMID 12418174.
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w x y z aa Bertini I, Grey HB, Stiefel EI, Valentine JS, eds. (2006). Biyolojik inorganik kimya: yapı ve reaktivite. Sausalito, CA: Üniversite Bilim Kitapları. ISBN 978-1891389436.
- ^ Ögel Z (Nisan 1994). "Galaktoz oksidaz üreten mantar Cladobotryum (Dactylium) dendroides NRRL 2903'te selülozla tetiklenen sporülasyon ve bunun bir Fusarium türü olarak yeniden tanımlanması". Mikolojik Araştırma. 98 (4): 474–480. doi:10.1016 / S0953-7562 (09) 81207-0.
- ^ a b c Wang Y, Stack TD (Ocak 1996). "Galaktoz Oksidaz Model Kompleksleri: Katalitik Reaktiviteler". Amerikan Kimya Derneği Dergisi. 118 (51): 13097–13098. doi:10.1021 / ja9621354.
- ^ a b Baron AJ, Stevens C, Wilmot C, Seneviratne KD, Blakeley V, Dooley DM, Phillips SE, Knowles PF, McPherson MJ (Ekim 1994). "Galaktoz oksidazın yapısı ve mekanizması. Serbest radikal bölgesi". Biyolojik Kimya Dergisi. 269 (40): 25095–105. PMID 7929198.
- ^ a b c Wendt F, Rolff M, Thimm W, Näther C, Tuczek F (Kasım 2013). "Galaktoz Oksidazın Küçük Molekül Model Sistemi: Geometri, Reaktivite ve Elektronik Yapı". Zeitschrift für Anorganische und Allgemeine Chemie. 639 (14): 2502–2509. doi:10.1002 / zaac.201300475.
- ^ a b c d Gamez P, Koval IA, Reedijk J (Aralık 2004). "Biyo-taklit eden galaktoz oksidaz ve hemosiyanin, iki dioksijen işleyen bakır proteini". Dalton İşlemleri (24): 4079–88. doi:10.1039 / b413535k. PMID 15573156.
- ^ a b Ito N, Phillips SE, Stevens C, Ogel ZB, McPherson MJ, Keen JN, Yadav KD, Knowles PF (Mart 1991). "Galaktoz oksidazın 1.7 A kristal yapısı ile ortaya çıkan yeni tiyoeter bağı". Doğa. 350 (6313): 87–90. doi:10.1038 / 350087a0. PMID 2002850. S2CID 4345713.
- ^ Himo F, Siegbahn PE (Haziran 2003). "Radikal içeren enzimlerin kuantum kimyasal çalışmaları". Kimyasal İncelemeler. 103 (6): 2421–56. doi:10.1021 / cr020436s. PMID 12797836.
- ^ Whittaker JW (Haziran 2003). "Galaktoz oksidaz ile serbest radikal katalizi". Kimyasal İncelemeler. 103 (6): 2347–63. doi:10.1021 / cr020425z. PMID 12797833.
- ^ Taki M, Kumei H, Nagatomo S, Kitagawa T, Itoh S, Fukuzumi S (Nisan 2000). "İki farklı fenol grubu içeren galaktoz oksidaz için aktif bölge modelleri". İnorganika Chimica Açta. 300-302: 622–632. doi:10.1016 / S0020-1693 (99) 00579-4.
- ^ Wang Y, DuBois JL, Hedman B, Hodgson KO, Stack TD (Ocak 1998). "Katalitik galaktoz oksidaz modelleri: biyomimetik Cu (II) -fenoksil-radikal reaktivitesi". Bilim. 279 (5350): 537–40. Bibcode:1998Sci ... 279..537W. doi:10.1126 / science.279.5350.537. PMID 9438841.

