Lewis asidi katalizi - Lewis acid catalysis
İçinde Lewis asidi katalizi organik reaksiyonlar, metal bazlı Lewis asidi bir substratın reaktivitesini artırmak için bir elektron çifti alıcısı görevi görür. Yaygın Lewis asidi katalizörleri, aşağıdaki gibi ana grup metallerine dayanır alüminyum, bor, silikon, ve teneke hem de birçok erken (titanyum, zirkonyum ) ve geç (Demir, bakır, çinko ) d-blok metaller. Metal atomu, tek bir çift yatağı olan bir eklenti oluşturur elektronegatif substrattaki atom, örneğin oksijen (her ikisi de sp2 veya sp3), azot, kükürt, ve halojenler. Kompleksasyon, kısmi yük transfer karakterine sahiptir ve tek çift vericiyi etkili bir şekilde daha elektronegatif hale getirerek substratı nükleofilik saldırı, heterolitik bağ bölünmesi veya 1,3-dienler ve 1,3-dipollerle siklo-katlama yönünde aktive eder.[1]
Karbon-karbon veya karbon-heteroatom bağ oluşumunu içeren birçok klasik reaksiyon Lewis asitleri tarafından katalize edilebilir. Örnekler şunları içerir: Friedel-Crafts reaksiyonu, aldol reaksiyonu ve oda sıcaklığında yavaş ilerleyen çeşitli perisiklik süreçler, örneğin Diels-Alder reaksiyonu ve ene reaksiyonu. Lewis asidi katalizörleri, reaksiyonları hızlandırmanın yanı sıra, birçok durumda bölgesel seçicilik ve stereoseçicilik uygulayabilir.
Lewis asit reaktiflerindeki erken gelişmeler, aşağıdakiler gibi kolayca bulunabilen bileşiklere odaklanmıştır: TiCl4, BF3, SnCl4, ve AlCl3. Yıllar içinde, özel uygulamalar için tasarlanmış ligandları taşıyan çok yönlü katalizörler, Lewis asidi ile katalize edilmiş reaksiyonların hem reaktivitesinde hem de seçiciliğinde gelişmeyi kolaylaştırmıştır. Daha yakın zamanlarda, kiral ligandlı Lewis asidi katalizörleri, aşağıdakiler için önemli bir araç sınıfı haline gelmiştir: asimetrik kataliz.[2]
Lewis asidi katalizinin geliştirilmesindeki zorluklar arasında, verimsiz katalizör devri (ürün için katalizör afinitesinin neden olduğu) ve çoğu zaman yardımcı grupların kullanımını gerektiren stereoseçicilik için sık sık iki noktalı bağlanma gerekliliği yer alır.
Mekanizma
Polar mekanizmalarla reaksiyonlarda, Lewis asidi katalizi genellikle katalizörün Lewis bazik heteroatomlarına bağlanmasını ve elektron yoğunluğunun geri çekilmesini içerir ve bu da, heterolitik bağ bölünmesi (bu durumuda Friedel-Crafts reaksiyonu ) veya alt tabakayı doğrudan nükleofilik saldırı (durumunda karbonil ekleme reaksiyonları). Dikotomi, Lewis asidi destekli asetal ikame reaksiyonlarında olduğu gibi bazı reaksiyonlarda önemli sonuçlara sahip olabilir. SN1 ve SN2 aşağıda gösterilen mekanizmalar farklı stereokimyasal sonuçlar verebilir. Danimarka ve meslektaşları bisiklik bir sistemde ürün oranını inceleyerek, her iki mekanizmanın da dişilik Lewis asidi ve R 'grubunun kimliği.[3]

İçinde Diels-Alder ve 1,3-çift kutuplu döngü reaksiyonlar, Lewis asitleri LUMO sırasıyla dienofil veya dipolarfilin enerjisi, onu dien veya dipole karşı daha reaktif hale getirir.
Karbonil içeren substratlar ile Lewis asidi katalizi
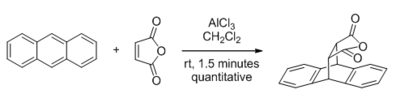
Tarafından katalize edilebilecek reaksiyon türleri arasında Lewis asitleri, olanlar karbonil -içeren alt tabakalar en büyük ilgiyi görmüştür. Bu alandaki ilk büyük keşif, 1960 yılında, Yates ve Eaton'ın Diels-Alder reaksiyonu AlCl tarafından3 ne zaman maleik anhidrit dienofildir.[4] Bağlı olan erken teorik çalışmalar sınır yörüngesi analiz, Lewis asidi katalizinin dienofilin LUMO enerjisini düşürerek çalıştığını tespit etti,[5] bu hala kabul edilen rasyonalizasyondur. Düşük LUMO enerjisi kavramı aynı zamanda karbonil bileşiklerinin (LUMO C-O π * orbitalidir) hafif nükleofilik reaktiflere karşı önemli ölçüde geliştirilmiş elektrofilik reaktivitesini açıklamak için kullanılır. Mukaiyama aldol reaksiyonu ve Sakurai reaksiyonu.
Hız hızlanmasına ek olarak, Lewis asidi ile katalize edilen reaksiyonlar bazen stereo indüksiyon modellerinin gelişimini uyaran gelişmiş stereoselektiflik sergiler. Modellerin kökleri, Lewis asit-karbonil komplekslerinin yapıları hakkında onlarca yıllık araştırma sonucunda teorik hesaplamalar, NMR spektroskopi ve X-ışını kristalografisi 1990'ların başında oldukça sağlam bir şekilde kurulmuştu:[6]
- σ-Kompleksasyon: Lewis asidinin karbonil bileşiği ile oksijen yalnız çifti ile bir σ-bağı yoluyla etkileşime girdiği kompleks hem termodinamik olarak tercih edilir hem de katalitik olarak ilgilidir.[7]
- Bükülmüş geometri: Metal-oksijen-karbon bağ açısı 180 ° 'den azdır ve metal syn daha küçük ikame ediciye, bir şelatlama daha büyük ikame üzerinde grup.
- Bir s-trans α, β-doymamış bileşikler için tercih.
Karbonil bileşiklerine ekleme ve konjugat ekleme
Mukaiyama aldol reaksiyonu ve Sakurai reaksiyonu ekine bakın silil enol eterler ve allilsilanlar sırasıyla karbonil bileşiklerine. Sadece Lewis asidi katalizi altında bu reaksiyonlar sentetik olarak kullanışlı koşullar altında gerçekleşir. Döngüsel olmayan geçiş durumlarının, 1,2- veya 1,4-ekleme için her iki reaksiyonda da işlediğine inanılmaktadır ve sterik faktörler stereoseçiciliği kontrol etmektedir. Bu, katı Zimmerman-Traxler için yaygın olarak kabul edilen döngüsel geçiş durumu aldol reaksiyonu lityum, bor ve titanyum ile enolates. Sonuç olarak, silil enol eter veya alilsilandaki çift bağ geometrisi, ürün stereokimyasına iyi bir şekilde dönüşmez. Kumada tarafından önerilen Sakurai 1,2 ilavesi için bir model aşağıdaki şemada sunulmuştur;[8] syn diastereomer, baskındır (E) silan kullanılır ve ayrıca (Z) silan kullanılır. Heathcock tarafından yapılan benzer bir analiz[9] basit substratlar ile moleküller arası Mukaiyama aldol reaksiyonu için esasen hiçbir diastereo seçicilik olmadığı gerçeğini açıklar.

Lewis asidi katalizörü, aldehit yapabildiğinde stereoseçicilikte bir rol oynar. Kıskaç metal merkez üzerine ve sert bir döngüsel ara madde oluşturur. Stereokimyasal sonuç, daha sonra, nükleofil anti halka üzerindeki daha hacimli ikame ediciye.[10][11]

Diels-Alder reaksiyonu
ZnCl gibi Lewis asitleri2, BF3, SnCl4, AlCl3ve MeAlCl2 hem normal hem de ters elektron talebini katalize edebilir Diels-Alder reaksiyonları. Hızdaki artış genellikle dramatiktir ve orto veya para benzeri ürünlere yönelik bölge seçiciliği, arasındaki reaksiyonda gösterildiği gibi genellikle iyileştirilir. izopren ve metil akrilat.[12]


Katalize edilmiş Diels-Alder reaksiyonunun olduğuna inanılıyor uyumlu. B3LYP / 6-31G (d) seviyesindeki bir hesaplama çalışması, bununla birlikte, geçiş durumu BF'nin3- propenal ve 1,3-butadien arasındaki katalize edilmiş Diels-Alder reaksiyonu, termal reaksiyonunkinden daha asenkrondur - karbonil grubundan daha uzaktaki bağ, diğer bağın önünde oluşur.[13]
Ene reaksiyonu
karbonil-en reaksiyonu sentetik uygulamalarda neredeyse her zaman Lewis asitleri tarafından katalize edilir.[14] Katalize reaksiyon için aşamalı veya büyük ölçüde asenkron mekanizma önerilmiştir. kinetik izotop etkisi çalışmalar.[15] Bununla birlikte, döngüsel geçiş durumları, diastereo seçiciliği yorumlamak için sıklıkla başvurulur. 1990'ların başındaki ufuk açıcı bir incelemede, Mikami ve arkadaşları[16] Diyastero seçicilikte sterik kütlenin rolü de dahil olmak üzere gözlemlenen birçok stereokimyasal sonucu rasyonalize edebilecek geç, sandalye benzeri bir geçiş durumu önerdi:[17]

Ancak daha yakın zamanlarda aynı grup, kalay veya alüminyum Lewis asidi ile katalize edilen ene reaksiyonları üzerinde HF / 6-31G * hesaplamaları gerçekleştirdi. Metil gloksilattan alıntı yaparak şelatlar kalay Lewis asitleri değil, alüminyum olanlar, erken, zarf benzeri bir geçiş durumu başlattılar ve ene reaksiyonunun farklı stereokimyasal sonucunu rasyonelleştirdiler. (E)-2-buten ve metil glioksilat.[18]

Sentezde uygulama
Lewis asidi ile katalize edilmiş karbonil ekleme reaksiyonları, rutin olarak karbon-karbon bağları oluşturmak için kullanılır. doğal ürün sentez. Aşağıda gösterilen ilk iki reaksiyon, (+) - likofleksinin sentezlerindendir.[19] ve zaragozik asit C,[20] Sırasıyla, Sakurai ve Mukaiyama reaksiyonlarının doğrudan uygulamalarıdır. (+) - fawcettimine yolundaki üçüncü reaksiyon, Mukaiyama'ya benzer Lewis asidi ile katalize edilmiş bir siklopropan açıklığıdır.Michael reaksiyonu.[21]

Lewis asitleri tarafından katalize edilen veya teşvik edilen Diels-Alder reaksiyonu, güçlü ve yaygın olarak kullanılan bir yöntemdir. doğal ürün stereokimyasal kontrol ile tek adımda iskele karmaşıklığına ulaşmak için sentez. Aşağıda gösterilen iki reaksiyon, (-) - fusarisetin A'ya yönelik bir molekül içi Diels-Alder reaksiyonudur.[22] ve (-) - epibatidine karşı moleküller arası bir hetero-Diels-Alder reaksiyonu,[23] sırasıyla.

İçinde Friedel – Crafts alkilasyon, bir Lewis asidi - genellikle basit bir metal halojenür tuzu - bir alkil halojenürdeki bir karbon-halojen bağının heterolitik bölünmesini teşvik eder ve bir karbokatyon olan elektrofilik aromatik ikame. Sentezde büyük ölçüde faydalı olmasına rağmen, reaksiyon genellikle aşağıdakilerden kaynaklanan yan reaksiyonlardan muzdariptir. karbokatyon yeniden düzenleme, alkil göçü ve aşırı alkilasyon. Benzer şekilde Friedel-Crafts açilleme, bir Lewis asidi bir asit klorürden (veya bazen asit anhidrürden) bir asilyum iyonunun üretilmesine yardımcı olur. Asilyum iyonunun genellikle aktif ara ürün olduğu varsayılsa da,[24] Protonlanmış asilyum dikasyonunun, müteakip elektrofilik aromatik ikameye maruz kalan aktif elektrofil olduğuna dair kanıtlar vardır.[25]
Friedel-Crafts reaksiyonunun önemli varyantları arasında klorometilasyon (formaldehit ve HCl ile), formilasyon (HCl ve CO veya CN ile−), ve asilasyon Birlikte nitril asil kaynağı olarak. Nitril bazlı asilasyon özellikle faydalıdır çünkü doğrudan orto-asilasyona izin verir. anilin amin grubunu korumadan.[26] Aşağıda gösterilen mekanizma yoluyla reaksiyonun ilerlemesi için zayıf ve güçlü bir Lewis asidinin bir kombinasyonu gereklidir. Bu mekanizma tarafından yönlendirilen ve galyum trihalidlerin en güçlü Lewis asitleri arasında olduğu bilgisiyle donatılmış,[27] Merck'teki proses kimyagerleri, bir ilaç adayına yönelik bu durum için oldukça verimli koşullar geliştirebildiler.[28]

Asimetrik Lewis asidi katalizi
Ortak Kiral Ligandlar
Asimetrik kataliz Lewis asitleri ile katalizörlere güvenir kiral ligandlar metal merkeze koordine edilmiştir. Yıllar geçtikçe, az sayıda kiral ligand iskelesi, çoğu zaman ilgisiz mekanizmalardan oluşan geniş bir uygulama yelpazesi için uygun "ayrıcalıklı" katalitik özelliklere sahip olarak öne çıkmıştır. Asimetrik Lewis asidi katalizindeki mevcut araştırma çabaları, yeni iskeleler oluşturmak yerine çoğunlukla bu ligandları kullanır veya değiştirir. de novo. "Ayrıcalıklı" iskeleler, kimyasal stabilite ve göreceli detaylandırma kolaylığı dahil birkaç ortak özelliği paylaşır. İskelelerin çoğu çok kimlikli. Çoğu ayrıca ligand içinde yüksek iskele sertliğine sahiptir. Birçoğunun oldukça olgun stereoindüksiyon modelleri mevcuttur. Jacobsen tarafından tanımlanan bazı "ayrıcalıklı" iskeleler[29] ve Zhou,[30] aşağıda tanıtılmıştır.
Bisoksazolinler (KUTU)
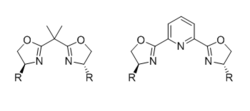
En yaygın kiral bisoksazolin (BOX) ligandları 4-pozisyonlarında hacimli bir grup ile ikame edilmiş, bir bağlayıcı ile birleştirilen iki özdeş kiral oksazolin parçasından oluşur. Ligand iki dişli bağlayıcı tek bir karbon birimi olduğunda, ancak üç dişli (genellikle meridyen) bağlayıcı, PyBOX ligandları durumunda bir piridin nitrojen gibi ek bir koordinasyon atomu taşıdığında. Ligandın etkisi dişilik ve stereokimyasal sonuçla ilgili aktif ara geometri kapsamlı bir şekilde incelenmiştir.[31]
Birçok iki dişli BOX bazlı Lewis asidi ile katalize edilmiş reaksiyon, iki noktalı bağlanma için uygun substratlara sahip bakır (II) katalizörlerine dayanır. Stereokimyasal sonuç, çarpık bir kare düzlemsel ilgili kristal yapılara göre önerilen ara madde.[32][33] Oksazolinin 4-pozisyonundaki ikame maddesi, substratın bir enantiyotopik yüzünü bloke ederek enantiyo seçiciliğe yol açar. Bu, aşağıda gösterilmiştir aldol tip reaksiyon,[34] ancak çok çeşitli reaksiyonlara uygulanabilir Mannich -tip reaksiyonlar,[35] ene reaksiyonu,[36] Michael ilavesi,[37] Nazarov siklizasyonu,[38] ve hetero-Diels-Alder reaksiyonu.[39]

Öte yandan, meridyen tridentat PyBOX ligandını taşıyan bir Lewis asidi üzerindeki iki noktalı bağlanma, kare piramidal karmaşık. Elektrofil olarak (benziloksi) asetaldehit kullanan bir çalışma, stereokimyasal sonucun ekvatoral olarak karbonil oksijen bağlanması ve eksenel olarak eter oksijen bağlanması ile tutarlı olduğunu gösterdi.[40]

BINAP
Noyori tarafından geliştirildi, BINAP (2,2'-difenilfosfino-1,1'-binaftil) bir kiral bir binaftalin omurgası üzerine yerleştirilmiş iki triarilfosfin parçasına sahip difosfin ligandları.[41] BINAP, bir metal (genellikle bir geç geçiş metali) üzerine şelat yaparak bir C2-simetrik kompleks. Aşağıda gösterildiği gibi bir (R)-BINAP rutenyum karmaşık[42] bir üzerinde kalan dört koordinasyon bölgesi arasında sekiz yüzlü metal merkez, iki ekvatoral bölge (mor) ekvator fenil gruplarından güçlü bir şekilde etkilenirken, iki eksenel bölge (yeşil) eksenel fenil gruplarından etkilenir.

Yapıya bağlı olarak, birçok BINAP bazlı Lewis asidi ile katalize edilmiş reaksiyonda gözlemlenen enantiyoseçicilik için modeller önerilmiştir. Örneğin, aşağıda gösterilen paladyumla katalize edilmiş enantiyoselektif Diels-Alder reaksiyonunda, dienofilin ekvatoral bölgelerde metal merkezini koordine ettiği düşünülmektedir. Böylece fosfor üzerindeki ekvatoral fenil grubu, Si-yüz mükemmel enantioseçicilik ile sonuçlanır.[43] Nikel katalizli asimetrik enolat alkilasyon reaksiyonunun sonucunu rasyonelleştirmek için çok benzer bir model kullanıldı, burada substrat aynı zamanda buna izin veren bir yardımcı da taşıyor. Kıskaç metale.[44] Öte yandan, bakır (I) -katalize bir hetero-en reaksiyonunun bir dört yüzlü orta düzey,[45] metal merkezi değiştirerek alternatif bir stereo indüksiyon modu sunar.
BINOL
BINOL (1,1'-binaftil-2,2'-diol) genellikle alüminyum, titanyum, zirkonyum ve çeşitli nadir toprak metalleri gibi oksofilik Lewis asidik metalleri ile birlikte kullanılır. BINOL'un kendisinin ideal enantiyoselektif kontrol sağlamadığı durumlarda, 3,3 'pozisyonlarında ikame ile kolaylıkla detaylandırılabilir (aracılığıyla lithiation ) ve 6,6 'pozisyonları (6,6'-dibromid bileşiği yoluyla) elektrofilik aromatik ikame ) sterik yığın ve elektronik özellikleri modüle etmek için.[46] Örneğin, hacimli 3,3'-disilil ikameli BINOL bazlı alüminyum katalizörler, katalitik asimetrik hetero-Diels-Alder reaksiyonu[47] ve Claisen yeniden düzenleme,[48] 6,6'-pozisyonlarında elektron çeken grupların eklenmesi, zirkonyum (IV) katalizörlerinin Lewis asitliğini ve dolayısıyla katalitik aktivitesini arttırmak için çok önemlidir. Mannich -tip reaksiyon.[49] Ancak bugüne kadar, BINOL'a yönelik stereo indüksiyonu yöneten önemli faktörlere yönelik hiçbir model genel olarak kabul edilmemiştir.

TADDOL
TADDOL tetraaril-1,3-dioksolan-4,5-dimetanol anlamına gelir. Titanyum TADDOLat katalizörlerinin karbonil ilavelerine ve siklokasyonlarına yönelik geniş uygulama alanı Seebach ve çalışma arkadaşları tarafından tanıtıldı ve çok çeşitli reaksiyonlarda gözlemlenen seçicilikle uyuşan çalışan bir stereo indüksiyon modelinin konulduğu ufuk açıcı bir incelemede kapsamlı bir şekilde özetlendi. mekanizmanın net bir resminin olmamasına rağmen.[50]

Başvurular
Lewis asidi katalizi, asimetri belirleme adımında birçok sentez için kullanılmıştır. doğal ürünler. Sentezinden aşağıda gösterilen ilk reaksiyon taksan iskelet, şiral tarafından desteklenen bakır bazlı bir katalizör kullanır fosforamidit bir konjugat karbonil ekleme reaksiyonu için ligand.[51] İkinci reaksiyon, sentezinden ent-Hyperforin, asimetrik için bir demir-PyBOX katalizörü kullanır Diels-Alder reaksiyonu.[52]

Ayrıca bakınız
Referanslar
- ^ Carey, Fransis A .; Sundberg, Richard J. (2007). İleri Organik Kimya: Bölüm A: Yapı ve Mekanizmalar (5. baskı). Berlin: Springer ABD. ISBN 9780387683461.
- ^ Yamamoto, Hisashi (ed.) (2000). Organik sentezde Lewis asitleri. Weinheim: Wiley-VCH. ISBN 978-3527295791.CS1 bakimi: ek metin: yazarlar listesi (bağlantı)
- ^ Danimarka, S.E .; Willson, T.M. içinde Lewis Asidi Destekli Reaksiyonlarda Seçicilikler, Schinzer, D., Ed .; Kluwer Academic Publishers, 1989, s. 247–263.
- ^ Yates, Peter; Eaton, Philip (20 Ağustos 1960). "Alüminyum Klorür ile Diels-Alder Reaksiyonunun Hızlandırılması". Amerikan Kimya Derneği Dergisi. 82 (16): 4436–4437. doi:10.1021 / ja01501a085.
- ^ Houk, K. N .; Strozier, R.W. (1 Haziran 1973). "Diels-Alder reaksiyonlarının Lewis asidi katalizi". Amerikan Kimya Derneği Dergisi. 95 (12): 4094–4096. doi:10.1021 / ja00793a070.
- ^ Shambayati, S .; Schreiber, S.L. Lewis Asit Karbonil Kompleksasyonu, içinde Kapsamlı Organik Sentez, Trost, B.M .; Fleming, I., Eds. Pergamon, Oxford, 1991, cilt. 1, böl. 1.10, s. 283–324.
- ^ Corcoran, Robert C .; Ma, Junning (1 Haziran 1992). "Ketonların Lewis asitleri tarafından aktivasyonunun geometrik yönleri". Amerikan Kimya Derneği Dergisi. 114 (12): 4536–4542. doi:10.1021 / ja00038a014.
- ^ Hayashi, Tamio; Kabeta, Keiji; Hamachi, Itaru; Kumada, Makoto (1 Ocak 1983). "Titanyum klorür varlığında aldehitlere γ-ikameli alilsilanların ilavesi olarak eritroselektiflik". Tetrahedron Mektupları. 24 (28): 2865–2868. doi:10.1016 / S0040-4039 (00) 88045-4.
- ^ Heathcock, Clayton H .; Sarıl, Kathleen T .; Flippin, Lee A. (1 Ocak 1984). "Asiklik stereoseleksiyon. 27. Enolsilanların aldehitlerle lewis asidi aracılı reaksiyonlarında basit diastereoseleksiyon". Tetrahedron Mektupları. 25 (52): 5973–5976. doi:10.1016 / S0040-4039 (01) 81736-6.
- ^ Evans, David A .; Allison, Brett D .; Yang, Michael G .; Masse, Craig E. (1 Kasım 2001). "Dimetilalüminyum Klorür ve Metilaluminyum Diklorürün Olağanüstü Şelatlama Yeteneği. Enolsilan ve Hidrit Nükleofilleri ile Şelat Kontrollü Karbonil Ekleme Reaksiyonlarında α- ve β-Stereo Merkezlerin Birleştirilmiş Stereokimyasal Etkisi". Amerikan Kimya Derneği Dergisi. 123 (44): 10840–10852. doi:10.1021 / ja011337j. PMID 11686685.
- ^ Heathcock, Clayton H .; Kiyooka, Syunichi; Blumenkopf, Todd A. (1 Kasım 1984). "Asiklik stereoseleksiyon. 22. Alilsilanların kiral aldehitler ve enonlarla Lewis asidi aracılı reaksiyonlarında diastereofasiyal seçicilik". Organik Kimya Dergisi. 49 (22): 4214–4223. doi:10.1021 / jo00196a022.
- ^ Inukai, Takashi; Kojima, Takeshi (1 Nisan 1966). "Alüminyum Klorürün İzopren - Metil Akrilat Diels-Alder Reaksiyonu Üzerindeki Katalitik Etkileri". Organik Kimya Dergisi. 31 (4): 1121–1123. doi:10.1021 / jo01342a031.
- ^ Garcia, J. I .; Martínez-Merino, V .; Mayoral, J. A .; Salvatella, L. (1 Mart 1998). "Lewis Asidi Katalizeli Diels − Kızılağaç Reaksiyonunun Yoğunluk Fonksiyonel Teorisi Çalışması. Bütadien + Akrolein Paradigması". Amerikan Kimya Derneği Dergisi. 120 (10): 2415–2420. doi:10.1021 / ja9722279.
- ^ Carey, Francis A .; Sundberg, Richard J. (2007). Reaksiyonlar ve sentez (5. baskı). New York, NY: Springer. s. 871. ISBN 9780387683508.
- ^ Singleton, Daniel A .; Hang, Chao (1 Şubat 2000). "13C ve 2H Kinetik İzotop Etkileri ve Formaldehitin Lewis Asidi ile Katalize Edilmiş Ene Reaksiyonlarının Mekanizması ". Organik Kimya Dergisi. 65 (3): 895–899. doi:10.1021 / jo9917590. PMID 10814025.
- ^ Mikami, Koichi; Shimizu, Masaki (1 Temmuz 1992). "Organik sentezde asimetrik ene reaksiyonları". Kimyasal İncelemeler. 92 (5): 1021–1050. doi:10.1021 / cr00013a014.
- ^ Mikami, Koichi; Loh, Teck Peng; Nakai, Takeshi (1 Ağustos 1990). "Vinilsilanlar ile karbonil-en reaksiyonu: rejyo- ve stereokimya için kontrol elemanı olarak silikon". Amerikan Kimya Derneği Dergisi. 112 (18): 6737–6738. doi:10.1021 / ja00174a058.
- ^ Yamanaka, Masahiro; Mikami, Koichi (1 Aralık 2002). "Lewis Asit Katalizeli Karbonil-Ene Reaksiyonunda Diastereoselektiflik Üzerine Teorik Çalışmalar: Elektrostatik Etkileşimin Temel Rolü". Helvetica Chimica Açta. 85 (12): 4264–4271. doi:10.1002 / hlca.200290011.
- ^ Ramharter, Jürgen; Weinstabl, Harald; Mulzer, Johann (20 Ekim 2010). "Likopodyum Alkaloid (+) - Likofleksinin Sentezi". Amerikan Kimya Derneği Dergisi. 132 (41): 14338–14339. doi:10.1021 / ja107533m. PMID 20866095.
- ^ Evans, David A .; Barrow, James C .; Leighton, James L .; Robichaud, Albert J .; Sefkow, Michael (1 Aralık 1994). "Skualen Sentaz İnhibitörü Zaragozik Asit C'nin Asimetrik Sentezi". Amerikan Kimya Derneği Dergisi. 116 (26): 12111–12112. doi:10.1021 / ja00105a085.
- ^ Jung, Michael E .; Chang, Jonah J. (2 Temmuz 2010). "(+) - Fawcettimine'in Enantiospesifik Biçimsel Toplam Sentezi". Organik Harfler. 12 (13): 2962–2965. doi:10.1021 / ol1009762. PMID 20515058.
- ^ Deng, Jun; Zhu, Bo; Lu, Zhaoyong; Yu, Haixin; Li, Ang (18 Ocak 2012). "(-) - Fusarisetin A'nın Toplam Sentezi ve Doğal Karşıtının Mutlak Yapılandırmasının Yeniden Atanması". Amerikan Kimya Derneği Dergisi. 134 (2): 920–923. doi:10.1021 / ja211444m. PMID 22239597.
- ^ Evans, David A .; Scheidt, Kari A .; Downey, C.Wade (1 Eylül 2001). "(-) - Epibatidin Sentezi". Organik Harfler. 3 (19): 3009–3012. doi:10.1021 / ol016420q. PMID 11554830.
- ^ Olah, G.A. (ed.) Friedel-Crafts ve İlgili Tepkimeler Interscience, New York, 1964
- ^ Sato, Yasuo; Yato, Michihisa; Ohwada, Tomohiko; Saito, Shinichi; Shudo, Koichi (1 Mart 1995). "Gattermann, Houben-Hoesch ve Aktive Edilmemiş Benzenlerin Friedel-Crafts Reaksiyonlarında Reaktif Ara Maddeler Olarak Dikatyonik Türlerin Katılımı". Amerikan Kimya Derneği Dergisi. 117 (11): 3037–3043. doi:10.1021 / ja00116a009.
- ^ Sugasawa, Tsutomu; Toyoda, Tatsuo; Adachi, Makoto; Sasakura, Kazuyuki (1 Temmuz 1978). "Organik sentezde Aminohaloboran. 1. Anilinlerin spesifik orto ikame reaksiyonu". Amerikan Kimya Derneği Dergisi. 100 (15): 4842–4852. doi:10.1021 / ja00483a034.
- ^ Olah, George A .; Kobayashi, Shiro; Tashiro, Masashi (1 Ekim 1972). "Aromatik ikame. XXX. Friedel-Crafts benzen ve toluenin benzil ve ikame edilmiş benzil halojenürlerle benzilasyonu". Amerikan Kimya Derneği Dergisi. 94 (21): 7448–7461. doi:10.1021 / ja00776a030.
- ^ Yasuda, Nobuyoshi (ed.) (2009). Proses Kimyası Sanatı. Weinheim, Bergstr: Wiley-VCH. pp.1 –43. ISBN 9783527324705.CS1 bakimi: ek metin: yazarlar listesi (bağlantı)
- ^ Yoon, T. P .; Jacobsen, Eric N. (14 Mart 2003). "Ayrıcalıklı Kiral Katalizörler". Bilim. 299 (5613): 1691–1693. Bibcode:2003Sci ... 299.1691Y. doi:10.1126 / bilim.1083622. PMID 12637734.
- ^ Zhou, Qi-Lin (ed.) (2011). Ayrıcalıklı kiral ligandlar ve katalizörler. Weinheim, Almanya: Wiley-VCH. ISBN 9783527327041.CS1 bakimi: ek metin: yazarlar listesi (bağlantı)
- ^ Rasappan, Ramesh; Laventine, Dominic; Reiser, Oliver (1 Mart 2008). "Metal-bis (oksazolin) kompleksleri: Koordinasyon kimyasından asimetrik katalize". Koordinasyon Kimyası İncelemeleri. 252 (5–7): 702–714. doi:10.1016 / j.ccr.2007.11.007.
- ^ Evans, David A .; Miller, Scott J .; Lectka, Thomas; von Matt, Peter (1 Ağustos 1999). "Enantioselektif Diels − Alder Reaksiyonu için Lewis Asit Katalizörleri Olarak Kiral Bis (oksazolin) bakır (II) Kompleksleri". Amerikan Kimya Derneği Dergisi. 121 (33): 7559–7573. doi:10.1021 / ja991190k.
- ^ Thorhauge, Jacob; Roberson, Mark; Hazell, Rita G .; Jørgensen, Karl Anker (15 Nisan 2002). "Kiral Bis (oksazolin) bakır (II) -Katalize Enantioselektif Reaksiyonlarda Ara Maddeler Hakkında - Deneysel ve Teorik Araştırmalar". Kimya: Bir Avrupa Dergisi. 8 (8): 1888. doi:10.1002 / 1521-3765 (20020415) 8: 8 <1888 :: AID-CHEM1888> 3.0.CO; 2-9.
- ^ Evans, David A .; Burgey, Christopher S .; Kozlowski, Marisa C .; Tregay, Steven W. (1 Şubat 1999). "Kiral Lewis Asitleri Olarak Simetrik Bakır (II) Kompleksleri. Enolsilanların Piruvat Esterlerine Katalitik Enantiyoselektif Aldol İlavelerinin Kapsamı ve Mekanizması". Amerikan Kimya Derneği Dergisi. 121 (4): 686–699. doi:10.1021 / ja982983u.
- ^ Marigo, Mauro; Kjærsgaard, Anne; Juhl, Karsten; Gathergood, Nicholas; Jørgensen, Karl Anker (23 Mayıs 2003). "Malonatların ve -Keto Esterlerin Doğrudan Katalitik Asimetrik Mannich Reaksiyonları". Kimya: Bir Avrupa Dergisi. 9 (10): 2359–2367. doi:10.1002 / chem.200204679. PMID 12772311.
- ^ Evans, David A .; Burgey, Christopher S .; Paras, Nick A .; Vojkovsky, Tomas; Tregay, Steven W. (1 Haziran 1998). "Kiral Lewis Asitleri Olarak C2-Simetrik Bakır (II) Kompleksleri. Glyoksilat − Ene Reaksiyonunun Enantioselektif Katalizi". Amerikan Kimya Derneği Dergisi. 120 (23): 5824–5825. doi:10.1021 / ja980549m.
- ^ Evans, David A .; Willis, Michael C .; Johnston, Jeffrey N. (1 Eylül 1999). "Kiral Bakır (II) Lewis Asit Kompleksleri Kullanılarak Doymamış Ester Türevlerine Katalitik Enantiyoselektif Michael Eklemeleri". Organik Harfler. 1 (6): 865–868. doi:10.1021 / ol9901570. PMID 10823215.
- ^ Aggarvval, Varinder K .; Belfield, Andrew J. (1 Aralık 2003). "Kiral Lewis Asit Kompleksleri Tarafından Teşvik Edilen Katalitik Asimetrik Nazarov Reaksiyonları". Organik Harfler. 5 (26): 5075–5078. doi:10.1021 / ol036133h. PMID 14682768.
- ^ Yao, Sulan; Johannsen, Mogens; Audrain, Hélène; Hazell, Rita G .; Jørgensen, Karl Anker (1 Eylül 1998). "Katalitik Asimetrik Hetero-Diels − Ketonların Alder Reaksiyonları: Kemzimatik Reaksiyonlar". Amerikan Kimya Derneği Dergisi. 120 (34): 8599–8605. doi:10.1021 / ja981710w.
- ^ Evans, David A .; Kozlowski, Marisa C .; Murry, Jerry A .; Burgey, Christopher S .; Campos, Kevin R .; Connell, Brian T .; Staples, Richard J. (1 Şubat 1999). "C2-Şiral Lewis Asitleri Olarak Simetrik Bakır (II) Kompleksleri. Enolsilanların (Benziloksi) asetaldehide Katalitik Enantiyoselektif Aldol İlavelerinin Kapsamı ve Mekanizması ". Amerikan Kimya Derneği Dergisi. 121 (4): 669–685. doi:10.1021 / ja9829822.
- ^ Miyashita, A .; Takaya, H .; Souchi, T .; Noyori, R. (1 Ocak 1984). "2,2'-bis (difenilfosfino) -1, 1'-binaftil (binap)". Tetrahedron. 40 (8): 1245–1253. doi:10.1016 / S0040-4020 (01) 82411-X.
- ^ Akotsi, Okwado M .; Metera, K; Reid, R.D .; McDonald, R; Bergens, S.H. (19 Mayıs 2000). "Rutenyum-bis (fosfin) hidrojenasyon katalizörlerinin çok yönlü öncüsü". Kiralite. 12 (5–6): 514–522. doi:10.1002 / (SICI) 1520-636X (2000) 12: 5/6 <514 :: AID-CHIR38> 3.0.CO; 2- #.
- ^ Ghosh, Arun K .; Matsuda, Hideho (1 Aralık 1999). "BINAP − Pt (II) ve −Pd (II) Komplekslerinin Karşı iyonları: Yüksek Enantiyoselektif Dieller için Yeni Katalizörler − Kızılağaç Reaksiyonu". Organik Harfler. 1 (13): 2157–2159. doi:10.1021 / ol990346i. PMID 10836069.
- ^ Evans, David A .; Thomson, Regan J. (1 Ağustos 2005). "Ni (II) Tol-BINAP-Katalizeli Enantioselektif Ortoester Alkilasyonları N-Acylthiazolidinethiones ". Amerikan Kimya Derneği Dergisi. 127 (30): 10506–10507. doi:10.1021 / ja053386s. PMID 16045335.
- ^ Yamamoto, Yuhei; Yamamoto, Hisashi (1 Nisan 2004). "Katalitik, Yüksek Enantio ve Diyasteroselektif Nitroso Diels − Alder Reaksiyonu". Amerikan Kimya Derneği Dergisi. 126 (13): 4128–4129. doi:10.1021 / ja049849w. PMID 15053601.
- ^ Chen, Yu; Yekta, Shahla; Yudin, Andrei K. (1 Ağustos 2003). "Asimetrik Katalizde Değiştirilmiş BINOL Ligandları". Kimyasal İncelemeler. 103 (8): 3155–3212. doi:10.1021 / cr020025b. PMID 12914495.
- ^ Maruoka, Keiji .; Itoh, Takayuki .; Shirasaka, Tadashi .; Yamamoto, Hisashi. (1 Ocak 1988). "Bir kiral organoaluminyum reaktifi ile katalize edilen asimetrik hetero-Diels-Alder reaksiyonu". Amerikan Kimya Derneği Dergisi. 110 (1): 310–312. doi:10.1021 / ja00209a061.
- ^ Maruoka, Keiji; Hiroshi Banno; Hisashi Yamamoto (1990). "Şiral organoalüminyum reaktifi ile katalize edilen asimetrik Claisen yeniden düzenlemesi". J. Am. Chem. Soc. 112 (21): 7791–7793. doi:10.1021 / ja00177a047.
- ^ Ishitani, Haruro; Ueno, Masaharu; Kobayashi, Shū (1 Ağustos 2000). "Optik Olarak Aktif β-Amino Asit Türevlerinin Sentezi için Yeni Bir Kiral Zirkonyum Katalizörü Kullanan Enantiyoselektif Mannich Tipi Reaksiyonlar". Amerikan Kimya Derneği Dergisi. 122 (34): 8180–8186. doi:10.1021 / ja001642p.
- ^ Seebach, Dieter; Beck, Albert K .; Heckel, Alexander (5 Ocak 2001). "TADDOL'ler, Türevleri ve TADDOL Analogları: Çok Yönlü Kiral Yardımcıları". Angewandte Chemie Uluslararası Sürümü. 40 (1): 92–138. doi:10.1002 / 1521-3773 (20010105) 40: 1 <92 :: AID-ANIE92> 3.0.CO; 2-K.
- ^ Mendoza, Abraham; Ishihara, Yoshihiro; Baran, Phil S. (6 Kasım 2011). "Ölçeklenebilir enantiyoselektif toplam taksan sentezi". Doğa Kimyası. 4 (1): 21–25. Bibcode:2012 NatCh ... 4 ... 21M. doi:10.1038 / nchem.1196. PMC 3243931. PMID 22169867.
- ^ Shimizu, Yohei; Shi, Shi-Liang; Usuda, Hiroyuki; Kanai, Motomu; Shibasaki, Masakatsu (1 Şubat 2010). "Katalitik Asimetrik Toplam Sentezi ent-Hyperforin ". Angewandte Chemie Uluslararası Sürümü. 49 (6): 1103–1106. doi:10.1002 / anie.200906678. PMID 20063336.
