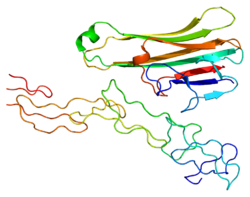
Limfotoksin alfa - Lymphotoxin alpha
Limfotoksin-alfa (LT-α) veya tümör nekroz faktörü-beta (TNF-β) bir protein insanlarda kodlanır LTA gen.[5][6] E ait hematopoietik hücre çizgisi, LT-a, anti-proliferatif aktivite sergiler ve tümör hücre çizgilerinin hücresel yıkımına neden olur.[5] Olarak sitotoksik LT-α, salgılandığı forma bağlı olarak immün regülasyonda çeşitli önemli roller üstlenir. Diğer üyelerin aksine TNF üst ailesi LT-a, yalnızca çözünür bir homotrimer olarak bulunur, hücre yüzeyinde bulunduğunda yalnızca LTp ile bir heterotrimer olarak bulunur.[7]
LT-α, bağışıklık sisteminin sürdürülmesinde önemli bir etkiye sahiptir. ikincil lenfoid organlar.[8][9] LT-α'nın olmaması gastrointestinal gelişimin bozulmasına neden olur, Peyer yaması gelişme ve düzensiz bir dalağa neden olur.[10]
Bir sinyal molekülü olarak LT-α, hücre sağkalımının düzenlenmesinde rol oynar, çoğalma, farklılaşma, ve apoptoz.[11] LT-α önemli bir rol oynar doğuştan gelen bağışıklık düzenleme ve varlığının tümör büyümesini engellediği ve kanserli hücre hatlarını yok ettiği gösterilmiştir.[12] Buna karşılık, LT-α'nın düzensiz ekspresyonu, sürekli aktif bir sinyal yolu ile sonuçlanabilir, bu da kontrolsüz hücresel büyümeye ve tümörler.[11] Bu nedenle, bağlama bağlı olarak, LT-a, kanser hücrelerinin büyümesini önlemek veya tümörlerin gelişimini kolaylaştırmak için işlev görebilir. Ayrıca, LT-a etkileri, etki ettiği organın türüne, kanser hücrelerinin türüne, hücresel ortama, cinsiyete ve bir bağışıklık tepkisi sırasında etki süresine bağlıdır.[13][12]
Gen
LT-a'yı kodlayan insan geni 1985'te klonlandı.[5][14] LT-α'nın geni, kromozom 6 ve gen kodlamasına çok yakın büyük doku uyumluluk kompleksi.[15]
Yapısı
LT-a, 171 amino asit kalıntısı ile 25 kDa'lık bir glikosile polipeptit olarak çevrilir.[6] Ayrıca insan LT-a, proteinin birincil dizisinde fare LT-a ile% 72 özdeştir.[16]
LTa ekspresyonu yüksek oranda indüklenebilir ve salgılandığında çözünür homotrimerik bir molekül oluşturur. LT-α aynı zamanda heterotrimerler oluşturabilir. Lenfotoksin-beta, lenfotoksin-alfa'yı hücre yüzeyine tutturur. LT-α ve arasındaki etkileşim LT-β bir zara bağlı kompleks oluşumuna neden olur (LT-α1-β2).[9]
Fonksiyon
Lymphotoxin alpha, tümör nekroz faktörü üst ailesi tarafından üretilen bir sitokindir lenfositler. LT-α1-β2 gibi reseptörlerle etkileşime girebilir LT-β reseptörleri.[11] Hücre yüzeylerinde LT-β olmaması, LT-α'nın LT-α oluşturma yeteneğini azaltacaktır.1-β2, böylece etkili kabiliyetini bir sitokin.[8][9] LT-α, çok çeşitli iltihaplı, immün sistemi uyarıcı ve antiviral tepkiler. LT-a ayrıca gelişim sırasında ikincil lenfoid organların oluşumunda rol oynar ve apoptozda rol oynar.[17]
LT-α'da Nakavt fareleri, peyerin yamaları ve lenf düğümleri gelişmeyecektir, bu da sitokinin immünolojik gelişimdeki temel rolünü gösterir.[18]
LT-a, sitotoksik bir protein olarak kanserli hücre hatlarının tahrip olmasına neden olur, sinyal yollarını aktive eder ve dönüştürülmüş tümör hücrelerini etkili bir şekilde öldürür.[8][11] Bununla birlikte, aşırı LT-α veya LT-xpress ekspresyonu olan fareler, tümör büyümesinde artış gösterdi ve metastaz çeşitli kanser modellerinde. Diğer çalışmalarda, fareler gen nakavt LT-a, kanserde LT-a'nın muhtemel koruyucu rolünü ima ederek, artmış tümör büyümesi gösterdi. Bununla birlikte, bu çalışmalarda, çözünebilir ve zara bağlı LT'nin etkilerini ayırt etmeye izin vermeyen tam LT-a eksikliği olan fareler kullanılmıştır.[19]
LT-α aracılı sinyal yolu
Üyesi olarak TNF ailesi LT-α, çeşitli reseptörlere bağlanır ve NF-κB yolu, böylece bağışıklık düzenlemesini teşvik eder doğuştan gelen bağışıklık tepki.[11] Aktivasyonun gerçekleşmesi için, LT-α, LT-α'yı oluşturmak üzere LT-β ile bir kompleks oluşturmalıdır.1-β2 karmaşık. LT-α'nın oluşumu1-β2 kompleks, LT-y reseptörlerine bağlanmayı ve ardından sinyal yollarının aktivasyonunu sağlar.[20] NF-κB gibi sinyal yollarının aktivasyonu, sonuçta hücre proliferasyonu ve hücre ölümü dahil olmak üzere çeşitli hücresel kaderlere yol açar. LT-β reseptör aktivasyonundan sonra, IKK-α, β ve γ üretilir ve bu da I-κB, bir NF-kB inhibitörü ve NF-kB1 (p50) ve ReIA (p60) üretir.[20] NF-kB1 ve ReIA üretimi, sitokinlerin ve iltihaplanmaya neden olan moleküllerin gen transkripsiyon oranlarını artırır.[20][21]
Anti-kanserojen özellikler
LT-reseptörlerinin aktivasyonu, kanserli hücrelerin hücre ölümünü indükleyebilir ve tümör büyümesini baskılayabilir.[22][23] Hücre ölümü sürecine IFN-y'nin varlığı aracılık eder ve apoptotik veya nekrotik yolları içerebilir.[22] LT-reseptörlerinin, adezyon moleküllerinin yukarı regülasyonunu kolaylaştırdığı ve tümör büyümesiyle mücadele etmek için lenfositleri tümör hücrelerine topladığı görülmüştür.[5][11] Diğer bir deyişle, LT-a reseptörleri ile LT-a etkileşimleri, tümör hücrelerinin doğrudan yok edilmesi yoluyla anti-tümör etkilerini artırabilir.
Pro-kanserojen özellikler
Bununla birlikte, son çalışmalar, LT-α aracılı sinyallemenin kanser gelişimine katkısını göstermiştir.[8][11][12][13] Daha önce bahsedildiği gibi, LT-a sinyali, enflamatuar tepkileri teşvik edebilir, ancak uzun süreli enflamasyon, ciddi hücresel hasara neden olabilir ve kanser dahil bazı hastalıkların riskini artırabilir.[12] Bu nedenle, LT-a sinyal yolaklarındaki düzenleyici faktörlerdeki mutasyonlar, hücre sinyali bozulmalarını teşvik edebilir ve kanserli hücre çizgilerinin oluşumunu teşvik edebilir. Bu mutasyonlardan biri, LT-α'nın sabit bağlanmasını içerir.1-β2 LT-β reseptörlerine kompleks, bu da NF-κB alternatif yolunun sürekli aktivasyonu ile sonuçlanır.[11][12] Yapısal olarak aktif bir NF-κB yolağının varlığı, multipil myeloma ve kanserle ilgili diğer hastalıklar.[11] LT-β reseptörlerinin uzaklaştırılmasının tümör büyümesini inhibe ettiği ve azaldığı gösterilmiştir. damarlanma.[12] Bu nedenle, lenfotoksin ve bunun NF-κB yolu aracılığıyla aşağı akış sinyali, sitokinin tümör gelişimi ve metastaz üzerindeki etkisini gösterir.
Tamamen insanlaştırılmış bir anti-LT-α antikoru (Pateclizumab veya MLTA3698A) hem LT-a hem de LT-p ile reaksiyona girdiği gösterilmiştir.[8] Bu antikoru içeren klinik deneyler henüz kullanılmamıştır, ancak bu antikorun oluşturulması, NF-kB yolu için alternatif inhibitör yöntemler sunmaktadır.
Gastrointestinal sistem üzerindeki etkiler
Gastrointestinal bağışıklık sistemi, vücudun antikor üreten hücrelerinin% 70-80'ini içerir.[10] Embriyonik gelişim sırasında, LT-a sinyali, gastrointestinal bağışıklık sisteminin oluşumunda aktif bir rol oynar.[10] Özellikle, LT-a aracılı sinyalleme, aşağıdaki gibi bağırsak lenfoid yapılarının gelişiminden sorumludur. Peyerin yamaları.[24][25] Bu bağırsak lenfoid folikülü, sindirim sisteminin bağışıklık sisteminde önemli bir rol oynar.
Peyer'in yamaları, bağırsakta bulunan oldukça özelleşmiş lenfoid nodüllerdir. Folikül ile ilişkili epitel ile çevrilidirler ve diğer bağışıklık hücreleri ile etkileşime girebilirler. Transsitoz yabancı antijenlerin.[26] Bu işleve ek olarak, Peyer’in yamaları üretimi kolaylaştırır Ig-A immünositler üretir, böylece etkinliğini arttırır. adaptif bağışıklık sistemi.[27]
Peyer yamalarının geliştirilmesi, LT-reseptörünün LT-α ile bağlanmasını ve aktivasyonunu gerektirir.1-β2 karmaşık. Transgenik fareleri içeren deneyler, LT-a'nın yokluğunun Peyer yamalarının ve diğer lenf düğümlerinin yokluğuyla sonuçlandığını göstermiştir.[10] Peyer yamalarının ve diğer lenf düğümlerinin eksikliğinin de Ig-A seviyelerini düşürdüğü gösterilmiştir.[10] En çok üretilen immünoglobulin olan Ig-A, mukozaya karşı korur. patojenler bakteri büyümesini düzenleyerek ve antijeni inhibe ederek yapışma normal koşullar altında bağırsağa.[28] Azaltılmış Ig-A seviyeleri, bağırsak immün regülasyonunu büyük ölçüde azaltır ve mikroplara karşı korumayı bozar, böylece Ig-A ekspresyonu için LT aracılı yanıtın önemini vurgular.
İsimlendirme
1960 yılında Granger ve araştırma grubu tarafından keşfedilen LT-alpha, limfotoksin olarak biliniyordu.[29] Yıllar geçtikçe adı tümör nekroz faktörü-beta (TNF-β) olarak değiştirildi.[30] LT-β ve LT-α'nın daha sonra keşfi1-β2 kompleks, TNF-β'nın atılmasına ve LT'nin iki sınıfa ayrılmasına yol açtı: LT-α ve LT-β.[31][32]
Etkileşimler
Limfotoksin alfa'nın etkileşim ile LTB.[33][34][35]
Ayrıca bakınız
Referanslar
- ^ a b c ENSG00000223919, ENSG00000173503, ENSG00000226275, ENSG00000230279, ENSG00000238130, ENSG00000226979 GRCh38: Topluluk sürümü 89: ENSG00000231408, ENSG00000220062799, ENSG00000173000273081, ENSG000002200627975 - Topluluk, Mayıs 2017
- ^ a b c GRCm38: Topluluk sürümü 89: ENSMUSG00000024402 - Topluluk, Mayıs 2017
- ^ "İnsan PubMed Referansı:". Ulusal Biyoteknoloji Bilgi Merkezi, ABD Ulusal Tıp Kütüphanesi.
- ^ "Mouse PubMed Referansı:". Ulusal Biyoteknoloji Bilgi Merkezi, ABD Ulusal Tıp Kütüphanesi.
- ^ a b c d Nedwin GE, Naylor SL, Sakaguchi AY, Smith D, Jarrett-Nedwin J, Pennica D, Goeddel DV, Gray PW (Eylül 1985). "İnsan lenfotoksini ve tümör nekroz faktör genleri: yapı, homoloji ve kromozomal lokalizasyon". Nükleik Asit Araştırması. 13 (17): 6361–73. doi:10.1093 / nar / 13.17.6361. PMC 321958. PMID 2995927.
- ^ a b Aggarwal BB, Eessalu TE, Hass PE (Şubat 1986). "İnsan tümör nekroz faktörü için reseptörlerin karakterizasyonu ve gama-interferon ile regülasyonu". Doğa. 318 (6047): 665–7. doi:10.1038 / 318665a0. PMID 3001529. S2CID 4341571.
- ^ Calmon-Hamaty, Flavia; Combe, Bernard; Hahne, Michael; Morel Jacques (2011). "Lenfotoksin α yeniden ziyaret edildi: romatoid artritte genel özellikler ve etkileri". Artrit Araştırma ve Terapisi. 13 (4): 232. doi:10.1186 / ar3376. ISSN 1478-6354. PMC 3239340. PMID 21861866.
- ^ a b c d e Ruddle NH (Nisan 2014). "Lymphotoxin ve TNF: her şey nasıl başladı - yolculara bir saygı duruşu". Sitokin ve Büyüme Faktörü İncelemeleri. 25 (2): 83–9. doi:10.1016 / j.cytogfr.2014.02.001. PMC 4027955. PMID 24636534.
- ^ a b c Ngo VN, Korner H, Gunn MD, Schmidt KN, Riminton DS, Cooper MD, Browning JL, Sedgwick JD, Cyster JG (Ocak 1999). "Limfotoksin alfa / beta ve tümör nekroz faktörü, dalağın B ve T hücresi alanlarında bulunan kemokinlerin stromal hücre ekspresyonu için gereklidir.". Deneysel Tıp Dergisi. 189 (2): 403–12. doi:10.1084 / jem.189.2.403. PMC 2192983. PMID 9892622.
- ^ a b c d e Gubernatorova EO, Tumanov AV (Kasım 2016). "Tümör Nekroz Faktörü ve Bağırsak Enflamasyonunun Düzenlenmesinde Lenfotoksin". Biyokimya. Biokhimiia. 81 (11): 1309–1325. doi:10.1134 / S0006297916110092. PMID 27914457. S2CID 15764230.
- ^ a b c d e f g h ben Bauer J, Namineni S, Reisinger F, Zöller J, Yuan D, Heikenwälder M (2012-01-01). "Limfotoksin, NF-ĸB ve kanser: sitokinlerin karanlık yüzü". Sindirim Hastalıkları. 30 (5): 453–68. doi:10.1159/000341690. PMID 23108301. S2CID 13165828.
- ^ a b c d e f Fernandes MT, Dejardin E, dos Santos NR (Nisan 2016). "Kanser gelişiminde lenfotoksin-reseptör sinyallemesi için bağlama bağlı roller". Biochimica et Biophysica Açta (BBA) - Kanser Üzerine Değerlendirmeler. 1865 (2): 204–19. doi:10.1016 / j.bbcan.2016.02.005. hdl:10400.1/9527. PMID 26923876.
- ^ a b Wong GH, Kaspar RL, Zweiger G, Carlson C, Fong SE, Ehsani N, Vehar G (Ocak 1996). "Tümör nekroz faktörü ve lenfotoksin ile kanser tedavisi için apoptozu manipüle etme stratejileri". Hücresel Biyokimya Dergisi. 60 (1): 56–60. doi:10.1002 / (SICI) 1097-4644 (19960101) 60: 1 <56 :: AID-JCB9> 3.0.CO; 2-2. PMID 8825416.
- ^ Pokholok DK, Maroulakou IG, Kuprash DV, Alimzhanov MB, Kozlov SV, Novobrantseva TI, Turetskaya RL, Green JE, Nedospasov SA (Ocak 1995). "Murin lenfotoksin beta geninin klonlanması ve ifade analizi". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 92 (3): 674–8. Bibcode:1995PNAS ... 92..674P. doi:10.1073 / pnas.92.3.674. PMC 42682. PMID 7846035.
- ^ Nedospasov SA, Hirt B, Shakhov AN, Dobrynin VN, Kawashima E, Accolla RS, Jongeneel CV (Ekim 1986). "Tümör nekroz faktörü (TNF-alfa) ve lenfotoksin (TNF-beta) genleri, farenin 17. kromozomu üzerinde art arda düzenlenmiştir". Nükleik Asit Araştırması. 14 (19): 7713–25. doi:10.1093 / nar / 14.19.7713. PMC 311791. PMID 3490653.
- ^ Pennica D, Nedwin GE, Hayflick JS, Seeburg PH, Derynck R, Palladino MA, Kohr WJ, Aggarwal BB, Goeddel DV (1984). "İnsan tümör nekroz faktörü: öncü yapı, ekspresyon ve lenfotoksine homoloji". Doğa. 312 (5996): 724–9. Bibcode:1984Natur.312..724P. doi:10.1038 / 312724a0. PMID 6392892. S2CID 4245957.
- ^ "Entrez Geni: LTA limfotoksin alfa (TNF süper ailesi, üye 1)".
- ^ Akirav E, Liao S, Ruddle N (2008). "Bölüm 2: Lenfoid Dokular ve Organlar". Paul W'de (ed.). Temel İmmünoloji (6. baskı). Philadelphia: Lippincott Williams ve Wilkins. pp.27 –55. ISBN 978-0-7817-6519-0.
- ^ Korneev KV, Atretkhany KN, Drutskaya MS, Grivennikov SI, Kuprash DV, Nedospasov SA (Ocak 2017). "Tümörijenezin sürücüleri olarak TLR sinyali ve proinflamatuar sitokinler". Sitokin. 89: 127–135. doi:10.1016 / j.cyto.2016.01.021. PMID 26854213.
- ^ a b c Müller JR, Siebenlist U (Nisan 2003). "Lenfotoksin beta reseptörü, farklı NF-kappa B faktörlerinin ayrı sinyal yolakları aracılığıyla sıralı aktivasyonunu indükler". Biyolojik Kimya Dergisi. 278 (14): 12006–12. doi:10.1074 / jbc.M210768200. PMID 12556537.
- ^ Yılmaz ZB, Weih DS, Sivakumar V, Weih F (Ocak 2003). "Peyer'in yama geliştirmesi için RelB gereklidir: p52-RelB'nin limfotoksin ve TNF ile diferansiyel regülasyonu". EMBO Dergisi. 22 (1): 121–30. doi:10.1093 / emboj / cdg004. PMC 140043. PMID 12505990.
- ^ a b Browning JL, Miatkowski K, Boyutlandırma I, Griffiths D, Zafari M, Benjamin CD, Meier W, Mackay F (Mart 1996). "Limfotoksin beta reseptörü aracılığıyla sinyal verilmesi, bazı adenokarsinom tümör hatlarının ölümüne neden olur". Deneysel Tıp Dergisi. 183 (3): 867–78. doi:10.1084 / jem.183.3.867. PMC 2192357. PMID 8642291.
- ^ Lukashev M, LePage D, Wilson C, Bailly V, Garber E, Lukashin A, vd. (Ekim 2006). "Potansiyel bir kanser tedavisi olarak lenfotoksin-beta reseptörünü agonist antikorlarla hedeflemek". Kanser araştırması. 66 (19): 9617–24. doi:10.1158 / 0008-5472.CAN-06-0217. PMID 17018619.
- ^ Fu YX, Chaplin DD (1999-01-01). "İkincil lenfoid dokuların gelişimi ve olgunlaşması". Yıllık İmmünoloji İncelemesi. 17: 399–433. doi:10.1146 / annurev.immunol.17.1.399. PMID 10358764.
- ^ Randall TD, Carragher DM, Rangel-Moreno J (2008/01/01). "İkincil lenfoid organların gelişimi". Yıllık İmmünoloji İncelemesi. 26: 627–50. doi:10.1146 / annurev.immunol.26.021607.090257. PMC 2590644. PMID 18370924.
- ^ Cornes JS (Haziran 1965). "İnsan ince bağırsağındaki Peyer yamalarının sayısı, boyutu ve dağılımı: Bölüm I Peyer yamalarının gelişimi". Bağırsak. 6 (3): 225–9. doi:10.1136 / gut.6.3.225. PMC 1552287. PMID 18668776.
- ^ Craig SW, Cebra JJ (Temmuz 1971). "Peyer yamaları: tavşanda IgA üreten immünositler için zenginleştirilmiş bir öncü kaynağı". Deneysel Tıp Dergisi. 134 (1): 188–200. doi:10.1084 / jem.134.1.188. PMC 2139023. PMID 4934147.
- ^ Fagarasan S, Honjo T (Ocak 2003). "Bağırsak IgA sentezi: ön hat vücut savunmalarının düzenlenmesi". Doğa Yorumları. İmmünoloji. 3 (1): 63–72. doi:10.1038 / nri982. PMID 12511876. S2CID 2586305.
- ^ Williams TW, Granger GA (Eylül 1968). "Lenfosit in vitro sitotoksisite: çeşitli memeli türlerinin lenfotoksinleri". Doğa. 219 (5158): 1076–7. Bibcode:1968Natur.219.1076W. doi:10.1038 / 2191076a0. PMID 5673378. S2CID 4171855.
- ^ Shalaby MR, Aggarwal BB, Rinderknecht E, Svedersky LP, Finkle BS, Palladino MA (Eylül 1985). "İnsan polimorfonükleer nötrofil fonksiyonlarının interferon-gama ve tümör nekroz faktörleri ile aktivasyonu". Journal of Immunology. 135 (3): 2069–73. PMID 3926894.
- ^ Browning JL, Ngam-ek A, Lawton P, DeMarinis J, Tizard R, Chow EP, Hession C, O'Brine-Greco B, Foley SF, Ware CF (Mart 1993). "Lenfotoksin beta, hücre yüzeyinde lenfotoksin ile heteromerik bir kompleks oluşturan TNF ailesinin yeni bir üyesi". Hücre. 72 (6): 847–56. doi:10.1016 / 0092-8674 (93) 90574-a. PMID 7916655. S2CID 28961163.
- ^ Koni PA, Sacca R, Lawton P, Browning JL, Ruddle NH, Flavell RA (Nisan 1997). "Limfotoksin alfa ve beta için lenfoid organogenezde farklı roller, lenfotoksin beta eksikliği olan farelerde ortaya çıktı". Bağışıklık. 6 (4): 491–500. doi:10.1016 / s1074-7613 (00) 80292-7. PMID 9133428.
- ^ Williams-Abbott L, Walter BN, Cheung TC, Goh CR, Porter AG, Ware CF (Ağustos 1997). "Limfotoksin-alfa (LTalfa) alt birimi, zara sabitlenmiş LTalfa1beta2 heterotrimerik ligandın montajı için gereklidir, ancak reseptör özgüllüğü için gerekli değildir". Biyolojik Kimya Dergisi. 272 (31): 19451–6. doi:10.1074 / jbc.272.31.19451. PMID 9235946.
- ^ Browning JL, Boyutlandırma Kimliği, Lawton P, Bourdon PR, Rennert PD, Majeau GR, Ambrose CM, Hession C, Miatkowski K, Griffiths DA, Ngam-ek A, Meier W, Benjamin CD, Hochman PS (Ekim 1997). "Fare lenfositlerinin yüzeyinde lenfotoksin-alfa beta komplekslerinin karakterizasyonu". Journal of Immunology. 159 (7): 3288–98. PMID 9317127.
- ^ Browning JL, Dougas I, Ngam-ek A, Bourdon PR, Ehrenfels BN, Miatkowski K, Zafari M, Yampaglia AM, Lawton P, Meier W (Ocak 1995). "Yüzey lenfotoksin formlarının karakterizasyonu. Spesifik monoklonal antikorların ve çözünür reseptörlerin kullanımı". Journal of Immunology. 154 (1): 33–46. PMID 7995952.
daha fazla okuma
- Körner H, Sedgwick JD (Ekim 1996). "Tümör nekroz faktörü ve limfotoksin: dokuya özgü otoimmünitede moleküler yönler ve rol". İmmünoloji ve Hücre Biyolojisi. 74 (5): 465–72. doi:10.1038 / icb.1996.77. PMID 8912010. S2CID 22305752.
- Wang Q (Mayıs 2005). "Koroner arter hastalığının moleküler genetiği". Kardiyolojide Güncel Görüş. 20 (3): 182–8. doi:10.1097 / 01.hco.0000160373.77190.f1. PMC 1579824. PMID 15861005.
- Copeland KF (Aralık 2005). "Sitokinler ve kemokinler tarafından HIV-1 transkripsiyonunun modülasyonu". Tıbbi Kimyada Mini Yorumlar. 5 (12): 1093–101. doi:10.2174/138955705774933383. PMID 16375755.
- Elewaut D, Ware CF (Nisan 2007). "LT alfa betanın T hücre farklılaşmasında alışılmadık rolü". İmmünolojide Eğilimler. 28 (4): 169–75. doi:10.1016 / j.it.2007.02.005. PMID 17336158.