Oksokarbon anyon - Oxocarbon anion - Wikipedia

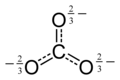
12Ö6−
12, okokarbon anyonlarından biri. Siyah daireler karbon atomları, kırmızı daireler oksijen atomlarıdır. Her mavi hale, negatif yükün yarısını temsil eder.
Kimyada bir okokarbon anyon bir negatif iyon sadece oluşan karbon ve oksijen atomlar ve bu nedenle genel formüle sahip C
xÖn−
y bazı tam sayılar için x, y, ve n.
En yaygın oksokarbon anyonları karbonat, CO2−
3, ve oksalat, C
2Ö2−
4. Bununla birlikte, bu sınıfta, araştırma veya endüstriyel kullanıma sahip birkaç tane dahil olmak üzere çok sayıda kararlı anyon vardır. Ayrıca pek çok kararsız anyon vardır. CO−
2 ve CO−
4, bazı kimyasal reaksiyonlar sırasında geçici bir varlığa sahip olanlar; ve birçok varsayımsal tür CO4−
4 teorik çalışmaların konusu olmuş ancak henüz gözlemlenmemiş.
Kararlı oksokarbon anyonları formu tuzlar çok çeşitli katyonlar. Kararsız anyonlar, çok seyrek gaz halinde kalabilir. yıldızlararası bulutlar. Çoğu okzokarbon anyonu karşılık gelen Parçalar içinde organik Kimya, bileşikleri genellikle esterler. Bu nedenle, örneğin, oksalat kısmı [–O– (C = O)2–O–] esterde oluşur dimetil oksalat H3C – O– (C = O)2-O-CH3.
Karbonat iyonunun elektronik yapısı

Karbonat iyonunun üçgen düzlemsel bir yapısı vardır, nokta grubu D3 sa.. Üç C-O bağının uzunluğu 136 pm ve 3 O-C-O açısı 120 ° dir. Karbon atomunun 4 çift değerlik elektronu vardır, bu da molekülün aşağıdaki özelliklere uyduğunu gösterir. sekizli kuralı. Bu, aşağıdaki gibi kayalarda meydana gelen iyonun yüksek stabilitesine katkıda bulunan bir faktördür. kireçtaşı. Elektronik yapı, 4 elektron çiftinin yalnızca 3 C-O bağına sahip bir molekülde nasıl dağıldığını göstermek için kullanılan iki ana teori ile tanımlanır.
İle değerlik bağ teorisi karbonat iyonunun elektronik yapısı bir rezonans melezi 3 kanonik form.
Her kanonik formda iki tek bağ vardır ve bir çift bağ vardır. Üç kanonik form, rezonans melezine eşit derecede katkıda bulunur, bu nedenle üç bağ C-O bağının uzunluğu aynıdır.

İle moleküler yörünge teorisi 3-kat ekseni, molekülün z ekseni olarak belirlenmiştir. S, p'nin üst üste binen üç σ bağı oluşurx ve Py her oksijen atomunda bir p orbitali olan karbon atomu üzerindeki orbitaller. Ek olarak, yerelleştirilmiş bir π bağı, p'nin üst üste binmesiyle yapılır.z p ile karbon atomu üzerindeki yörüngez molekül düzlemine dik olan her oksijen atomundaki orbital.
Aynı bağlama şemalarının, nitrat iyonu, HAYIR3−, hangisi izoelektronik karbonat iyonu ile.
Benzer şekilde, iki katlı simetrik yapısı karboksilat grupCO–
2, değerlik bağ teorisinde iki kanonik formun bir rezonans melezi olarak veya moleküler orbital teorisinde 2 σ bağ ve bir yer değiştirmiş π bağı ile tanımlanabilir.
Bağıntılı bileşikler
Oksokarbon asitler
Bir okokarbon anyonu C
xÖn−
y tümünü kaldırmanın bir sonucu olarak görülebilir protonlar karşılık gelen asit CxHnÖy. Karbonat CO2−
3örneğin, anyon olarak görülebilir karbonik asit H2CO3. Bazen "asit" aslında bir alkol veya diğer türler; bu, örneğin, asetilendiolat C
2Ö2−
2 bu sonuç verir asetilendiol C2H2Ö2. Bununla birlikte, anyon genellikle asitten daha kararlıdır (karbonat için olduğu gibi);[1] ve bazen asit bilinmemektedir veya son derece kararsız olması beklenmektedir (durum gibi metanetetrakarboksilat C (COO−)4).
Nötrleştirilmiş türler
Her okokarbon anyonu C
xÖn−
y prensipte elektriksel olarak nötr ile eşleştirilebilir (veya oksitlenmiş ) varyant CxÖy, bir okokarbon (oksit karbon) negatif yük haricinde aynı bileşim ve yapıya sahiptir. Bununla birlikte, bir kural olarak, bu nötr oksokarbonlar, karşılık gelen anyonlardan daha az kararlıdır. Bu nedenle, örneğin, kararlı karbonat anyonu, son derece kararsız nötr karbon trioksit CO3;[2] oksalat C
2Ö2−
4 daha az kararlı olana karşılık gelir 1,2-dioxetanedione C2Ö4;[3] ve istikrarlı kıkırdak anyon C
5Ö2−
5 nötr karşılık gelir siklopentanepenton C5Ö5, sadece eser miktarlarda tespit edilmiştir.[4]
Azaltılmış varyantlar
Tersine, bazı okzokarbon anyonları indirgenmiş aynı yapısal formüle ancak daha büyük negatif yüke sahip diğer anyonları elde etmek için. Böylece Rodizonat C
6Ö2−
6 indirgenebilir tetrahidroksibenzokinon (THBQ) anyon C
6Ö4−
6 ve sonra benzenhekzolat C
6Ö6−
6.[5]
Asit anhidritler
Bir okokarbon anyonu C
xÖn−
y ile de ilişkilendirilebilir anhidrit karşılık gelen asit. İkincisi, C formülüne sahip başka bir okzokarbon olacaktır.xÖy−n⁄2; yani asit eksin⁄2 su molekülleri H2O. Standart örnek, karbonat arasındaki bağlantıdır. CO2−
3 ve karbon dioksit CO2. Bu resmi dehidrasyonu gerçekleştirmenin birkaç yolu olabileceğinden, yazışma her zaman iyi tanımlanmamıştır, çünkü bir yapmak için iki veya daha fazla anyonun birleştirilmesi dahil. oligomer veya polimer. Nötralizasyondan farklı olarak, bu biçimsel dehidrasyon bazen oldukça kararlı oksokarbonlar verir. mellitik anhidrit C12Ö9 itibaren mellitat C
12Ö6−
12 üzerinden mellitik asit C12H6Ö12[6][7][8]
Hidrojene anyonlar
Her bir okokarbon anyonu için C
xÖn−
y prensipte var n−1 kısmen hidrojene edilmiş anyonlar formüllerle H
kC
xÖ(n−k)−
y, nerede k 1 ile n−1. Bu anyonlar genellikle "hidrojen" -, "dihidrojen" -, "trihidrojen" - vb. Ön ekleriyle gösterilir. Bununla birlikte, bazılarının özel isimleri vardır: hidrojenkarbonat HCO−
3 genellikle denir bikarbonat ve hidrojenoksalat HC
2Ö−
4 olarak bilinir bioksalat.
Hidrojenlenmiş anyonlar, tamamen protonlanmış asit olmasa bile kararlı olabilir (bikarbonat durumunda olduğu gibi).
Okokarbon anyonlarının listesi
İşte bilinen veya tahmin edilen okzokarbon anyonlarının eksik bir listesi
| Diyagram | Formül | İsim | Asit | Anhidrit | Nötralize |
|---|---|---|---|---|---|
| :CO2− 2 | karbonit | HCO2H | CO | CO2 | |
| CO2− 3 | karbonat | CH2Ö3 | CO2 | CO3 | |
| CO2− 4 | perokokarbonat | CO3 | CO4 | ||
| CO4− 4 | ortokarbonat | C (OH)4 metanetetrol | CO2 | CO4 | |
| C 2Ö2− 2 | asetilendiolat | C2H2Ö2 asetilendiol | C2Ö2 | ||
| C 2Ö2− 4 | oksalat | C2H2Ö4 | C2Ö3, C4Ö6 | C2Ö4 | |
| C 2Ö2− 5 | dikarbonat | C2H2Ö5 | C2Ö4 | ||
| C 2Ö2− 6 | peroksodikarbonat | ||||
| C 3Ö2− 3 | deltate | C3O (OH)2 | C3Ö3 | ||
| C 3Ö2− 5 | mesoksalat | C3H2Ö5 | |||
| C 4Ö2− 4 | asetilendikarboksilat | C4H2Ö4 | |||
| C 4Ö2− 4 | kare şeklinde | C4Ö2(OH)2 | C4Ö4 | ||
| C 4Ö2− 6 | dioksosüksinat | C4H2Ö6 | |||
| C 5Ö2− 5 | kıkırdak | C5Ö3(OH)2 | C5Ö5 | ||
| C 5Ö4− 8 | metanetetrakarboksilat | C5H4Ö8 | |||
| C 6Ö2− 6 | Rodizonat | C4Ö4(COH)2 | C6Ö6 | ||
| C 6Ö4− 6 | benzoquinonetetraolate; THBQ anyon | (CO)2(COH)4 THBQ | C6Ö6 | ||
| C 6Ö6− 6 | benzenhekzolat | C6(OH)6 benzeneheksol | C6Ö6 | ||
| C 6Ö4− 8 | etilenetrakarboksilat | C6H4Ö8 | C6Ö6 | ||
| C 8Ö4− 9 | furantetrakarboksilat | C8H4Ö9 | |||
| C 10Ö4− 10 | benzokuinonetrakarboksilat | C 10H 4Ö 10 | C 10Ö 8 | ||
 | C 12Ö6− 12 | mellitat | C6(COOH)6 | C12Ö9 |
İz miktarlarda birkaç başka okokarbon anyonu tespit edilmiştir. C
6Ö−
6Rodizonatın tek başına iyonize edilmiş bir versiyonu.[9]
Ayrıca bakınız
- Oksokarbon
- Silikat
- Sodyum perkarbonat (aslında bir karbonat perhidrat )
Referanslar
- ^ "Proton ışınlanmış H'nin kızılötesi ve kütle spektral çalışmaları2O + CO2 buz: karbonik asit için kanıt " Moore, M. H .; Khanna, R. K.
- ^ DeMore W. B .; Jacobsen C.W. (1969). "Sıvı karbon dioksit içinde ozonun fotolizinde karbon trioksit oluşumu". Journal of Physical Chemistry. 73 (9): 2935–2938. doi:10.1021 / j100843a026.
- ^ Herman F. Cordes; Herbert P. Richter; Carl A. Heller (1969). "1,2-dioxetanedione (karbon dioksit dimer) varlığının kütle spektrometrik kanıtı. Kemilüminesan ara ürün". J. Am. Chem. Soc. 91 (25): 7209. doi:10.1021 / ja01053a065.
- ^ Schröder, Detlef; Schwarz, Helmut; Dua, Suresh; Blanksby, Stephen J .; Bowie, John H. (Mayıs 1999). "Oksokarbon C'nin kütle spektrometrik çalışmalarınÖn (n = 3–6)". Uluslararası Kütle Spektrometresi Dergisi. 188 (1–2): 17–25. Bibcode:1999IJMSp.188 ... 17S. doi:10.1016 / S1387-3806 (98) 14208-2.
- ^ Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Gray, Franck Dolhem, Jean-Marie Tarascon ve Philippe Poizot (2009), "Tetrahidroksibenzokinonun Lityum Tuzu: Sürdürülebilir Li-İyon Pilinin Geliştirilmesine Doğru" J. Am. Chem. Soc., 131(25), s. 8984–8988 doi:10.1021 / ja9024897
- ^ J. Liebig, F. Wöhler (1830), "Ueber die Zusammensetzung der Honigsteinsäure" Poggendorfs Annalen der Physik und Chemie, cilt. 94, Sayı 2, s.161–164. Çevrimiçi sürüm 2009-07-08 tarihinde erişildi.
- ^ Meyer H, Steiner K (1913). "Über ein neues Kohlenoxyd C12Ö9 (Yeni bir karbon oksit C12Ö9)". Berichte der Deutschen Chemischen Gesellschaft. 46: 813–815. doi:10.1002 / cber.191304601105.
- ^ Hans Meyer; Karl Steiner (1913). "Über ein neues Kohlenoxyd C12Ö9". Berichte der Deutschen Chemischen Gesellschaft. 46: 813–815. doi:10.1002 / cber.191304601105.
- ^ Richard B. Wyrwas ve Caroline Chick Jarrold (2006), "Üretim C
6Ö−
6 CO Oligomerizasyonundan Molibden Anyonları ". J. Am. Chem. Soc. cilt 128 sayı 42, sayfalar 13688–13689. doi:10.1021 / ja0643927